植物转录因子AP2/ERF家族蛋白结构和功能的研究进展
2023-01-05悦曼芳张春吴忠义
悦曼芳 张春 吴忠义
(1.北京市农林科学院生物技术研究所,北京 100097;2.长江大学农学院,荆州 434025)
转录因子又称为反式作用因子,是能够与真核基因启动子区域中顺式作用元件发生特异性结合的蛋白质分子,转录因子和下游靶基因顺式作用元件相互作用,进而调控靶基因的表达[1],对植物生长发育以及响应胁迫具有重要作用。植物中越来越多的转录因子被鉴定出来,例如MYB、NAC、bHLH和AP2/ERF 等。AP2/ERF 家族是植物界中最大的转录因子家族之一,曾经被认为是植物所特有的一类转录因子,但后来在蓝藻、线虫和病毒中也发现了具有AP2 结构域的蛋白[2]。该家族与植物生长发育、生物与非生物胁迫应答以及生物合成等过程密切相关[3]。AP2/ERF 家族已在多种植物中进行了研究。Jofuku 等[4]于1994年首次从模式植物拟南芥中分离出APETALA2(AP2)转录因子,该转录因子参与调控拟南芥花和种子的发育。随后Ohme-Takagi等[5]于1995年从烟草中得到第一个EREBPs(ERF)转录因子,该转录因子具有GCC-box 特异性结合活性。Kagaya 等[6]于1999年首次报道了拟南芥中的RAV 亚家族成员RAV1 和RAV2,该亚家族包含一个B3-like 结构域和一个AP2 DNA 结合结构域。目前,已从多种植物中鉴定出AP2/ERF 转录因子,如玉米(Zea maysL.)、水稻(Oryza sativaL.)和小麦(Triticum aestivumL.)等作物。本文主要对AP2/ERF家族的结构特点、分布、调控植物生长发育、响应胁迫以及生物合成等方面的研究进展进行论述,以期对今后该类家族转录因子研究有所帮助。
1 AP2/ERF 转录因子的结构特征和分类
转录因子一般由DNA 结合域(DNA-bindingdomain,DBD)、转录调控域(transcription-regulationdomain,TRD)、寡聚化位点(oligomerization site,OS)和核定位信号区(nuclear localization signal,NLS)等功能域组成[7]。AP2/ERF 转录因子均含有AP2/ERF 结构域,该结构域含有2 段保守的氨基酸序列,分别命名为YRG 元件和RAYD 元件。YRG元件由19-22 个氨基酸碱性和亲水区域组成,并包含保守的YRG 氨基酸基序,对识别各类顺式作用元件非常重要。RAYD 元件长度为42-43 个氨基酸,包含1 个高度保守的18 个氨基酸核心区域,该区域可形成双亲性α-双螺旋,可能参与介导蛋白质相互作用。在RAYD 元件中,第40 位甘氨酸残基是保守的,对该蛋白质结构和功能有很大作用[8]。
根据AP2/ERF 结构域的数量以及是否含有其他结构域,将其分为AP2、乙烯响应因子(ERF)、脱水响应元件结合蛋白(DREB)、RAV 和Soloist 五个亚家族(图1)[9-10]。其中,AP2 亚家族含有2 个重复的AP2/ERF 结构域;ERF 和DREB 亚家族均只含有1 个AP2/ERF 结构域;RAV 家族除了含有1 个AP2/ERF 结构域以外,还有1 个B3 结构域;Soloist家族也含有1 个AP2/ERF 结构域,但其结构与其他亚家族有很大的差别,且核苷酸序列在多数植物中高度保守[11-12]。所有的AP2/ERF 结构域序列都含有1个α-螺旋和3个β-折叠区域[13]。AP2 亚家族由于2 个AP2 结构域的氨基酸序列和核定位序列的差异,可以再被细分为AP2 和ANT 组[14]。Nole-Wilson 等[15]提出,ANT 第一个结构域与5′端的gCAC(A/G)结合,而第二个结构域则是与偏3′端的cCC(a/g)A结合。AP2家族成员主要参与植物开花、侧根形成等过程的调控。在之前研究中,ERF 与DREB 亚家族统称为ERF 亚家族,后来根据ERF 转录因子结合的顺式作用元件,将它们分为ERF 亚家族和CBF/DREB 亚家族[16]。其中,ERF 亚家族可以与乙烯响应元件GCC-box 结合,参与调控乙烯应答和非生物胁迫响应[17]。CBF/DREB 亚家族可以与干旱、低温响应元件DRE/CRT 结合,进而诱导相关基因的表达,对植物应对非生物胁迫有很大的帮助[18-19]。另外ERF 亚家族和CBF/DREB 亚家族的主要区别是其AP2/ERF 结构域中第14 位和第19 位氨基酸残基不同。ERF 亚家族第14 位和第19 位分别是丙氨酸和天冬氨酸,而DREB 第14 位和第19位氨基酸分别是缬氨酸和谷氨酸[16]。正是这两个氨基酸残基的差异决定这类转录因子与不同的顺式作用元件的特异结合[20]。RAV 家族中的AP2/ERF 结构域位于N 端,可以结合GCC-box 元件,B3 结构域位于C 端,可以特异结合CACCTG 序列[21-22]。
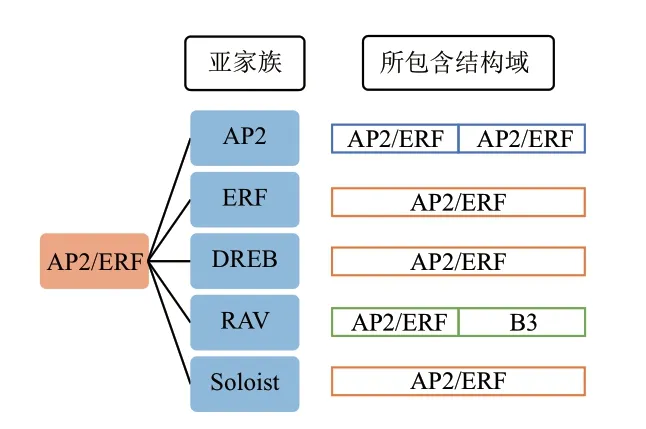
图1 AP2/ERF 蛋白家族分类及结构特征Fig.1 AP2/ERF protein family classification and structural characteristics
2 AP2/ERF 家族蛋白在植物中的分布
AP2/ERF 家族蛋白在植物中的分布非常广泛。2002年,Sakuma[23]等在拟南芥中鉴定出145 个AP2/ERF 转录因子。Nakano 等[24]于2006年通过对拟南芥进行全基因组分析,鉴定出147 个AP2/ERF转录因子,其中,AP2 亚家族基因18 个,DREB 与ERF 亚家族基因122 个,RAV 家族基因6 个。Zhang等[25]于2022年通过全基因组鉴定,鉴定出214 个AP2/ERF 转录因子,其中,AP2 亚家族基因有44 个,ERF 亚家族基因有105 个,DREB 亚家族基因有61个,RAV 亚家族基因有4 个,并通过表达谱分析揭示了其在非生物胁迫耐受性中的重要作用。Rashid等[26]于2012年通过对水稻进行全基因组分析,鉴定出水稻中AP2/ERF 基因共170 个,其中,AP2 亚家族基因有23 个,DREB 与ERF 亚家族基因共141个,RAV 家族基因4 个。Zhao 等[27]于2019年通过对小麦进行全基因组分析,鉴定出565 个AP2/ERF 转录因子,其中,62 个为AP2 亚家族基因。此外,在一些其他植物中,如大豆(Glycine max(Linn.)Merr.)[28]、胡萝卜(Daucus carotaL.var.sativa Hoffm.)[29]、甘蓝(Brassica oleracea)[30]、菠萝(Ananas comosusL.Merr)[31]、烟草(Nicotiana tabacumL.)[32]、玫瑰(Rosa rugosa)[33]、油菜(Brassica napusL.)[34]、毛果杨(Populus trichocarpa)[35]、谷子(Setaria italicaL.)[36]、辣椒(Capsicum annuumL.)[37]、甜橙(Citrus sinensis)[38]、雷蒙德氏棉(G.raimondii(D5)cotton)[39]、茄子(Solanum melongenaL.)[40]、莲花(Nelumbo nucifera Gaertn.)[41]、柳树(Salix matsudana)[42]和油棕(Elaeis guineensisJacq.)[43],分别鉴定出148、267、226、97、375、135、531、200、171、175、108、269、178、121、364 和172个AP2/ERF 转录因子(表1)。
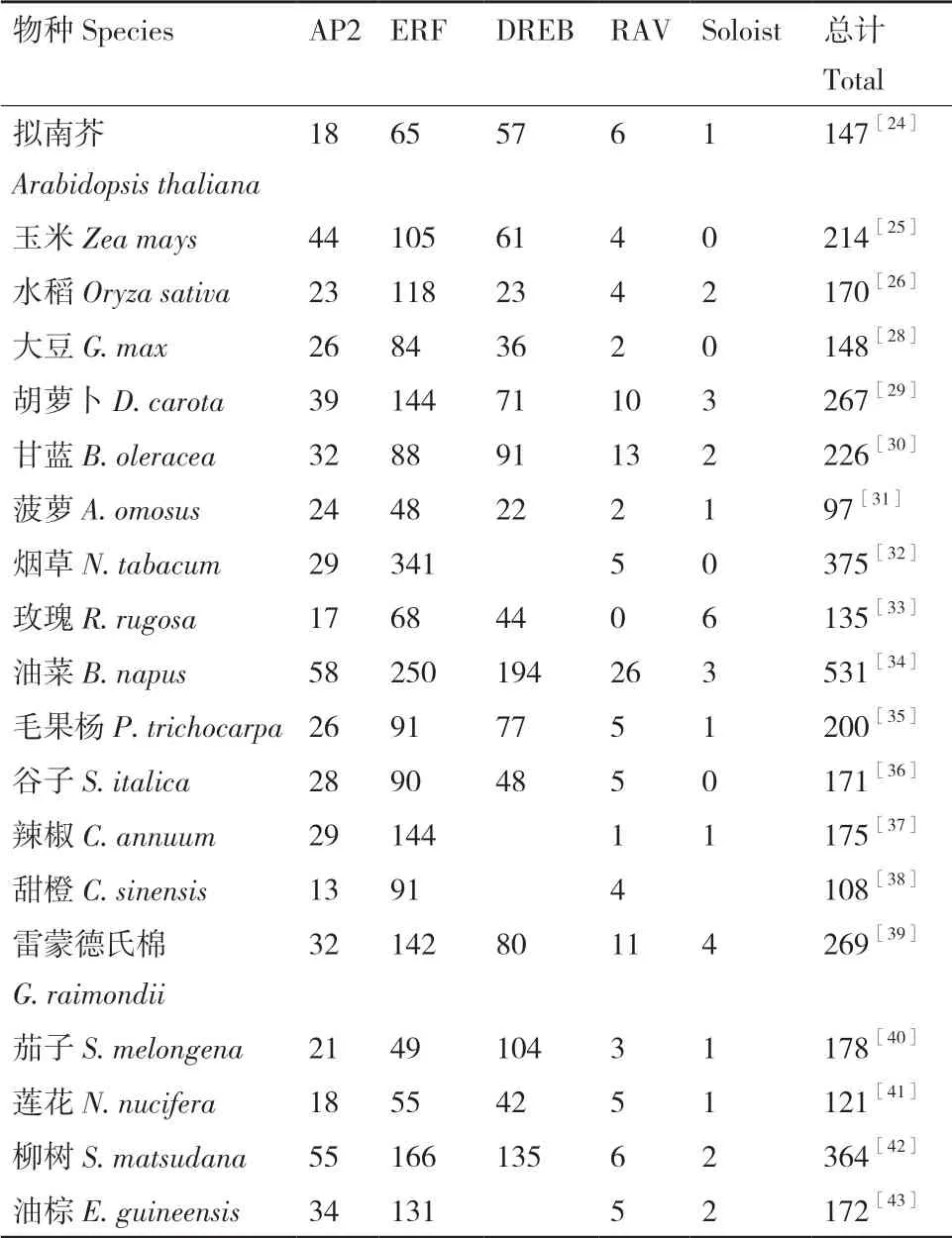
表1 植物AP2/ERF 转录因子的分布Table 1 Distribution of plant AP2/ERF transcription factor
3 AP2/ERF 家族参与植物生长发育中的作用
3.1 AP2/ERF在植物根系生长发育中的作用
CRL5编码一个大的AP2/ERF 转录因子家族蛋白,其在AUX/IAA和ARF介导的生长素信号通路下游发挥作用,通过抑制细胞分裂素信号传导的type-A 型反应调节因子OsRR1而作为冠根形成的正向调节因子[44]。WOX11是生长素和细胞分裂素信号的整合者,是冠根发育的关键调节因子,AP2/ERF 家族转录因子成员OsERF3,可以直接结合WOX11 调控水稻冠根的伸长,并能直接与细胞分裂素应答基因蛋白OsRR2 结合,正向调控OsRR2的表达,控制冠状根的发生[45]。在干旱条件下,过表达OsERF71改变了水稻根的结构,包括更大的通气组织和径向根生长,此外,OsAP2/ERF-40促进水稻不定根发育[46-47]。杨树PtaERF003对不定根和侧根增殖都有积极作用[48]。菊花(Chrysanthemum morifolium)AP2/ERF 转录因子基因CmERF053在调节植物的枝条、侧根和干旱胁迫中起着关键作用。与野生型相比,CmERF053在转基因拟南芥的侧根器官中表现出具有更多的分枝和侧根,并且该基因增强了转基因拟南芥的耐旱性[49]。年龄和创伤是再生的2 个主要决定因素,有研究表明,创伤可以快速诱导ABSCISIC ACID REPRESSOR1 和ERF109充当创伤信号的代理,以诱导生长素生物合成。AP2/ERF 家族是整合根再生的年龄和创伤信号的中枢[50]。JcERF035的表达受磷饥饿胁迫的调节,在缺磷条件下,该基因在根和叶组织中均下调。在低磷胁迫下,JcERF035的下调可能有助于调节植物根系结构[51]。拟南芥ERF109在侧根形成过程中介导茉莉酸和生长素生物合成之间的相互作用[52]。拟南芥ERF13抑制KCS16的表达,KCS16编码一种参与超长脂肪酸(VLCFAs)生物合成的脂肪酸延伸酶,过表达KCS16和外源施加VLCFAs 弥补了ERF过表达株系中侧根出现的缺陷。这表明ERF13在侧根发育中具有负调控作用[53]。生长素调节的AP2/EREBP 基因PUCHI是拟南芥早期侧根原基形态发生所必需的,PUCHI在生长素信号传导的下游发挥作用,并且该基因通过影响原基发育早期的细胞分裂模式进而参与侧根形态发生[54]。拟南芥AP2/ERF转录因子基因ERFII-1和ERFII-2参与植物侧根生长发育,过表达ERFII-1和ERFII-2会使侧根的萌发密度显著减少[55]。异源表达IbRAP2.4显著促进拟南芥侧根的形成,但抑制转基因甘薯贮藏根的形成[56]。
3.2 AP2/ERF在植物其他器官生长发育中的作用
拟南芥AP2 基因决定拟南芥花被器官的特性[57]。Zhang 等[58]报道一个新的油菜雌蕊状花突变体(SCM 突变体)花的4 个萼片被合并成一个心皮,包裹着一些异常的雄蕊和雌蕊,与拟南芥APETALA2 基因同源的油菜BrAP2a与BrAP2b修复了拟南芥ap2-5突变体的花冠缺陷表型,在萼片修饰中起着关键作用。此外,利用CRISPR/Cas9 介导的基因组编辑系统对油菜相应的BnAP2进行敲除,获得类似SCM 的表型。结果表明,BrAP2在花冠修饰中起关键作用。PeERF1只在蝴蝶兰(Phalaenopsis equestris)花朵开放时的第5 阶段表达,这与蝴蝶兰唇瓣角质层增厚和纳米脊状突起的形成相吻合,在蝴蝶兰的唇瓣表皮发育过程中,PeERF1对纳米脊的形成起着重要的作用[59]。过表达AP2/ERF 家族转录因子基因OsRPH1导致水稻株高、节间和叶鞘长度降低,以及其他异常性状,该转录因子通过调控水稻赤霉素代谢基因的表达负调控株高和活性赤霉素含量[60]。另外,OsRPH2通过赤霉素合成代谢相关基因的转录调控,降低水稻内源赤霉素含量(尤其是活性GA4),从而负调控水稻株高,导致矮化[61]。拟南芥AP2/ERF 转录因子基因BOLITA,通过调控细胞大小和数量参与调节拟南芥叶片大小[62]。玉米AP2 基因sid1和ids1可以调控花序分生组织的起始和控制小穗分生组织确定性[63]。乙烯是豆科植物体细胞胚胎发生所必需的,ERF 亚家族的转录因子基因MtSERF1被乙烯诱导,并在胚性愈伤组织中表达。干扰该基因的表达抑制了植物胚胎发生,表明该基因是蒺藜苜蓿体细胞胚胎发生所必需的[64]。敲除CmERF12显著促进胚胎发育,提高杂交结实率。此外,CmERF12 直接与影响花发育和胚胎发生的CmSUF4 相互作用,并显著降低其激活靶基因CmEC1的能力,表明CmERF12负调控菊花胚胎发育[65]。RAV 亚家族转录因子基因TEM1可以与成花素基因(Flowering locus T,FT)5′端非翻译区位点结合,抑制植物开花[66]。PpIAA1和PpERF4通过整合生长素和乙烯信号形成正反馈环路调节桃果实成熟[67]。番茄(Lycopersicon esculentum)转录因子基因LeERF2被乙烯诱导,促进番茄果实成熟,而且LeERF2还能调控异源表达烟草中乙烯的产生[68]。早在2004年就有研究表明,AP2 对控制种子质量有显著作用,AP2 基因突变的功能丧失增加了拟南芥种子质量[69],已有研究表明莴苣LsAP2参与调节莴苣种子形状,与野生型相比,LsAP2突变体植株的种子更长、更窄,并且在种子顶部形成一个延伸的尖端[70]。euAP2最初有助于孢子和孢子囊的发育,随后被募集用于胚珠、果实和花器官的发育[71]。DgERF056属于ERF 亚家族,在花组织中表达量较高,可能参与鸭茅的开花和发育过程[72]。AP2 转录因子还与花芽分化有关[73]。因此,AP2/ERF 转录因子在植物发育过程中发挥巨大的作用(表2)。
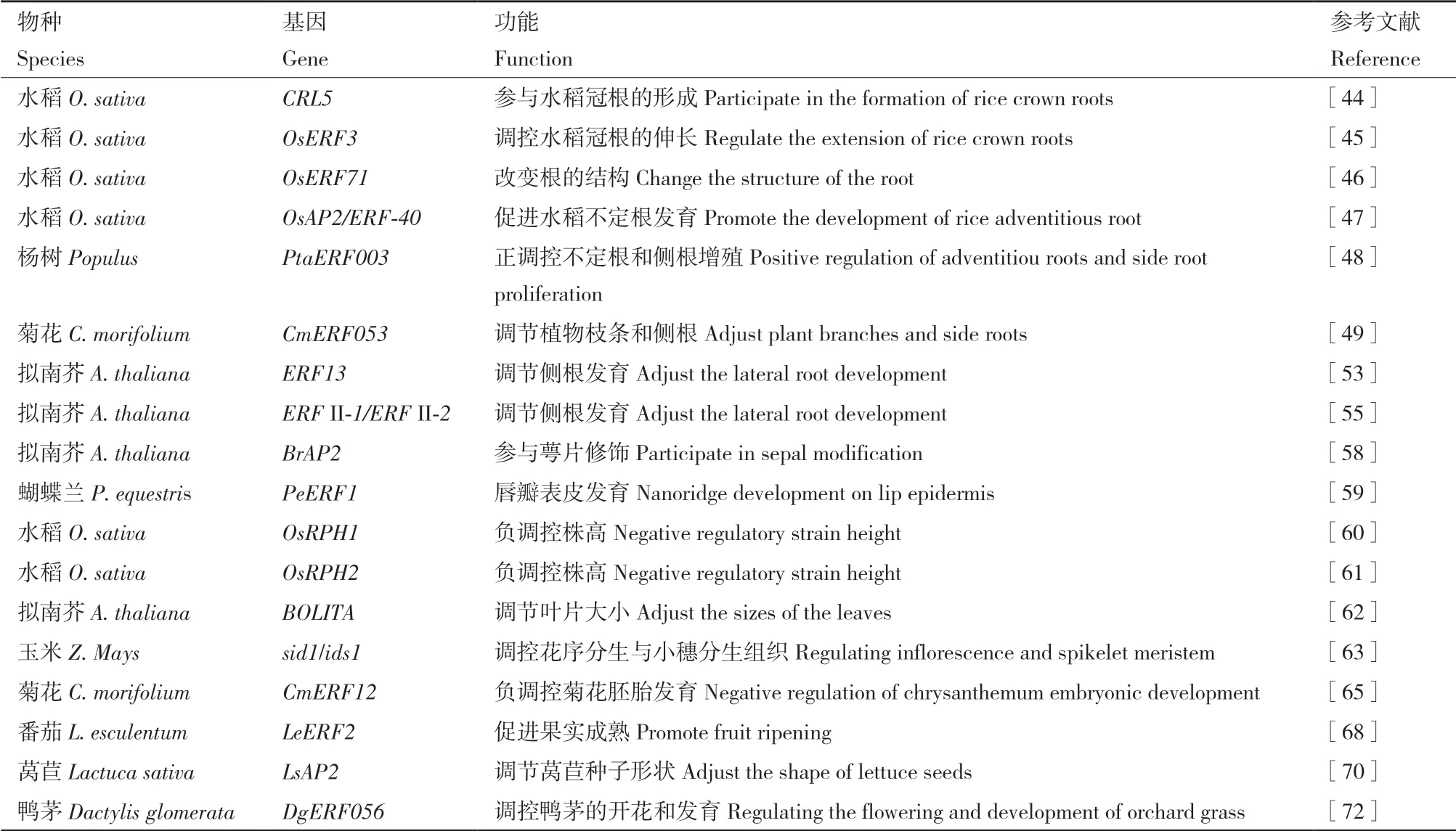
表2 参与生长发育的AP2/ERF 转录因子Table 2 AP2/ERF transcription factor participating in growth and development
4 AP2/ERF 家族响应逆境胁迫的作用
4.1 AP2/ERF家族在生物胁迫中的作用
OsBIERF3抗真菌和细菌病害的免疫具有积极作用,OsBIERF3过表达植物表现出对稻瘟病菌和水稻细菌性条斑病菌的抗性增加,而OsBIERF3抑制植物表现出对稻瘟病菌和水稻细菌性条斑病菌的抗性降低[74]。过表达玉米转录因子基因ZmERF105可以提高玉米对大斑病菌的抗性,而ZmERF105的突变系增加了对大斑病菌的敏感性。过表达ZmERF105株系在感染大斑病菌前后的超氧化物歧化酶和过氧化物酶活性均高于野生型玉米品系。这些均表明ZmERF105正向调节玉米对大斑病菌的抗性[75]。小麦转录因子基因TaAP2-15的沉默增加了小麦条锈菌的易感性,同时促进了病原体的生长[76]。甘蓝AP2/ERF 转录因子通过植物防御途径的错误调节促进了植物对黄单胞菌的易感性[77]。对月季(Rosa chinensis)AP2/ERF 进行全基因分析与基因表达分析发现,有23 个RCERF 基因被真菌灰霉菌诱导,其中,RcERF099参与调控玫瑰花瓣对灰霉病的抗性[78]。ZmEREB58可以调控玉米萜类合成酶基因TPS10的表达,进而增强玉米的抗虫性[79]。拟南芥AT4g13040是AP2/ERF 家族中的一个独特的成员,在病原菌、外源水杨酸(SA)以及在能够激活SA信号的突变体中上调,并且该基因在拟南芥PAD4下游发挥作用,能够促进病原菌诱导的SA 积累,是水杨酸积累和对细菌病原体基础防御的正调控因子,作用于SA 积累的上游[80]。AP2/ERF 家族转录因子APD1功能是光介导的针对细菌病原体的防御和系统获得性抗性所必需的,该基因正向调节SA 的生物合成和对致病细菌的防御[81]。因此,AP2/ERF 转录因子在植物应对生物胁迫方面发挥重要作用(表3)。

表3 参与生物胁迫的AP2/ERF 转录因子Table 3 AP2/ERF transcription factors involved in biological stress
4.2 AP2/ERF家族在非生物胁迫中的作用
非生物胁迫会改变植物激素的产生和分布,进而通过激素信号成分和AP2/ERF 家族应对胁迫反应(图2)[82]。AP2/ERF 转录因子在各种非生物胁迫中均发挥重要作用。
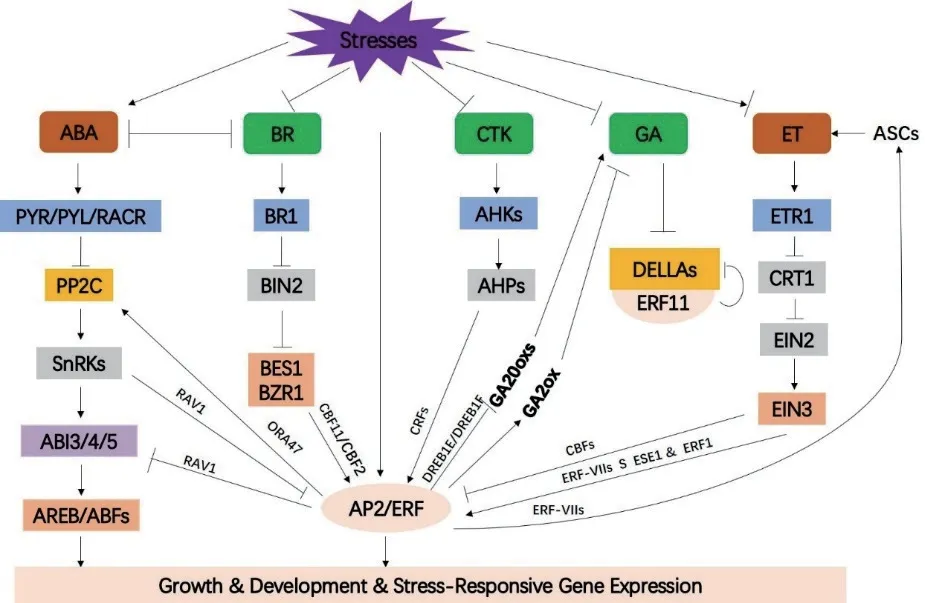
图2 AP2/ERFs 在激素途径中的作用Fig.2 Role of AP2/ERFS in hormone pathway
4.2.1 AP2/ERF 家族在抵抗水分胁迫中的作用 水分胁迫会严重限制植物生长,影响植物产量。AP2/ERF 家族转录因子应对水分胁迫时具有多种调节方式,但主要通过激素调节,如ZmEREB180可以被乙烯诱导表达,通过增强不定根(ARs)的形成和调节抗氧化剂的水平提高长期淹水胁迫玉米的存活率[83]。Submergence-1(Sub1)是影响水稻耐淹水能力的一个主要数量性状位点,包含2 个或3 个ERFlike 基因,其转录物受淹水胁迫调节。水稻耐淹性是由Sub1A的特定等位基因变异体赋予的,该变异体抑制乙烯产生和GA 响应[84]。在深水条件下,乙烯在植物中积累并诱导SNORKEL1和SNORKEL2表达,通过赤霉素引发显著的水稻节间伸长去应对水淹[85]。OeAP2-101、OeAP2-28、OeAP2-42受水胁迫诱导显著上调,推测这些基因对水分胁迫具有重要作用[86]。异源表达中间锦鸡儿(Caragana intermedia)基因CiDREB3改变转基因拟南芥的形态,并提高转基因拟南芥在幼苗发育期间的耐旱性[87]。油菜素类固醇信号负调控拟南芥AP2/ERF 转录因子基因TINY,通过激活干旱反应基因和促进脱落酸介导的气孔关闭正调控干旱反应[88]。OsERF83可以调控干旱相应基因表达,过表达OsERF83显著提高水稻的耐旱性,并具有更高的光化学效率[89]。过表达ZmERF21显著增加叶绿素含量和抗氧化酶的活性,并调节激素信号和胁迫应答基因的表达,从而增强玉米幼苗的耐旱性[90]。胁迫诱导转录因子基因TaERF-6-3A的表达,该转录因子增加了转基因拟南芥对干旱胁迫的敏感性[91]。ERF 家族转录因子基因OsERF101调节水稻生殖组织的干旱应激反应[92]。ZmDREB2A的组成型表达或胁迫诱导表达提高植物的抗旱性[93]。在水稻中异源表达番茄TSRF1,诱导水稻脱落酸(ABA)合成相关基因SDR以及脯氨酸合成和光合作用相关基因的表达,从而增强转基因水稻对渗透胁迫和干旱胁迫的抗性[94]。小麦TaERF1受干旱诱导,该基因在拟南芥中异源表达能够提高转基因拟南芥的抗旱性[95]。在干旱处理后,与野生型相比,过表达AtRAP2.4 拟南芥叶片的角质层蒸腾和叶绿素流失较慢,该基因通过激活拟南芥表皮蜡质的生物合成来应对干旱胁迫[96]。
4.2.2 AP2/ERF 家族在抵抗温度胁迫中的作用 高低温对植物的生长发育有很大的不利影响,限制了植物的生物量和产量,高等植物发展出各种复杂而独特的防御机制来响应外界的逆境胁迫。PtrERF9作用于乙烯信号的下游,该基因通过调节PtrGSTU17的转录维持植物体内ROS 平衡进而在植物耐寒性中发挥积极作用[97]。AP2/ERF 转录因子HcTOE3正调控拟南芥的抗冻性,转基因株系表现出较低的丙二醛含量、电解质外渗量和较少的活性氧积累,并且存活率、抗氧化酶活性和渗透调节物质脯氨酸的含量都有所提高[98]。对籼稻(Oryza sativaL.ssp.indica)的AP2 转录因子进行全基因组研究和表达分析,揭示了AP2 转录因子可以应对热胁迫[99]。OsERF115/AP2EREBP110受高温和干旱胁迫强烈诱导,过表达OsERF115/AP2EREBP110提高种子和营养生长期植株的耐热性[100]。CaERF109受低温诱导,不受高温和植物外源激素生长素、赤霉素和茉莉酸甲酯诱导,该基因可能参与辣椒低温胁迫应答[101]。DREB 是AP2/ERF 家族中的一类重要的与非生物胁迫密切相关的转录因子,DREB 能够特异性结合DRE/CRT 顺式作用元件,激活下游多种抗逆功能基因的表达,且不依赖ABA 信号转导途径,从而提高植株对非生物胁迫的抗性[102-103]。过表达CmDREB6激活热相关基因的转录,从而提高菊花对热应激的耐受性[104]。Chen 等[105]克隆了一个AP2/EREBP 基因OsDREBL,其可以被冷应激快速诱导。杨雪[106]研究表明AP2/ERF 转录因子基因OsSub1C可能通过抑制冷敏感基因的表达来响应低温胁迫。结缕草DREB 亚家族基因ZjDREB1.4在不抑制生长的情况下,提高转基因拟南芥对高温和冷冻胁迫的耐受性[107]。利用酵母单杂交技术,从拟南芥中克隆DREB1A和DREB2A,其中,DREB1A受低温诱导,而DREB2A受干旱、高盐和高温诱导[108]。Dubouzet 等[109]从水稻中分离了5 个DREB 同源基因,OsDREB1A、OsDREB1B、OsDREB1C、OsDREB1D和OsDREB2A,其中,OsDREB1A和OsDREB1B被寒冷诱导表达,而OsDREB2A的表达受干旱和高盐的诱导,过表达OsDREB1A提高转基因植物对干旱、高盐和冷冻胁迫更高的耐受性。枸橘PI-B05和PIC10是被冷胁迫诱导的2 个AP2/ERF 家族转录因子,对冷胁迫具有重要作用[110]。
4.2.3 AP2/ERF 家族在抵抗盐胁迫中的作用 盐分会对植物造成离子渗透,AP2/ERF 是盐胁迫信号响应通路中的一个重要调节因子[111]。异源表达GhERF13.12拟南芥表现出更高的盐胁迫耐受性。该基因参与ABA 信号转导、并使脯氨酸生物合成和ROS 清除基因的表达增强,此外,沉默GhERF13.12导致棉花对盐胁迫的敏感性增加[112]。在拟南芥中,异源表达一个含有AP2 结构域的大豆转录因子基因GmSGR发现,在较高的ABA 和葡萄糖浓度下,转基因拟南芥种子的发芽率明显高于野生型种子。在盐胁迫下,转基因拟南芥种子的发芽率低于对照。而且转基因拟南芥的幼苗中,AtEm6和AtRD29B的表达高于野生型幼苗,表明GmSGR可通过调节AtEm6和AtRD29B的表达而降低转基因种子的ABA敏感性,并增强盐敏感性[113]。JcERF被盐分、干旱、乙烯和机械伤害处理诱导,但不被ABA 胁迫诱导,拟南芥中异源表达JcERF增强了植物对盐和寒冷的耐受性[114]。在逆境胁迫条件下,羊草(Leymus chinensis)LcDREB3a参与ABA 和非ABA 依赖的信号转导途径,拟南芥中异源表达该基因可以提高转基因拟南芥的抗旱和抗盐能力[115]。Zhang 等[116]研究表明烟草中异源表达GmERF3可以提高植物对高盐和干旱的耐受性。GmERF4和GmERF7受到盐、干旱和茉莉酸等多种胁迫处理的诱导,异源表达GmERF4或GmERF7转基因烟草也表现出对盐胁迫更高的耐受性[117-118]。GmDREB1可以通过与ERFlike 转录因子形成异二聚体来调节下游胁迫相关基因的表达,从而提高转基因大豆的抗旱性[119]。火龙果(Hylocereus undatus)HuERF1被乙烯和高盐诱导,在拟南芥中,异源表达HuERF1增强转基因拟南芥对盐胁迫的耐受性,减少超氧化物和过氧化氢的积累,并且提高抗氧化酶的活性。表明HuERF1参与调控乙烯介导的盐胁迫耐受性[120]。水稻盐敏感性ERF 基因SERF1在盐胁迫的初始阶段放大了活性氧激活的MAPK 级联信号,并将盐诱导的信号转化为适当的表达反应,从而产生耐盐性[121]。大麦HvDREB1在转基因拟南芥中的异源表达增强了转基因拟南芥对高盐胁迫的耐受性[122]。IbRAP2-12是从甘薯的耐盐品种中克隆出来的一个AP2/ERF 转录因子,Li 等[123]研究表明IbRAP2-12赋予转基因植物对盐胁迫更高的耐受性。ZmEREB102参与了玉米抗旱耐盐的响应,并且通过参与ABA 生物合成途径负调节植物在胁迫下的萌发[124]。JcDREB2主要在叶片中表达,可被脱落酸诱导,但被赤霉素(GA)和盐胁迫抑制。异源表达JcDREB2的水稻植株表现出矮化和GA 缺乏表型,转基因水稻中GA 生物合成基因的表达水平也显著降低,此外,异源表达JcDREB2增加水稻对盐胁迫的敏感性[125]。在水稻中,异源表达JcERF011增加了其对盐胁迫的敏感性[126]。在拟南芥中,异源表达LcERF054增强了转基因拟南芥对盐胁迫的耐受性,转基因拟南芥表现出更高的种子萌发率,并且在胁迫条件下具有更高水平的相对含水量、可溶性糖含量、脯氨酸含量和更低水平的丙二醛[127]。在拟南芥中,异源表达甜橙CsERF36可以提高拟南芥的耐盐性,在盐胁迫下,异源表达CsERF36的拟南芥表现出比野生型更强的生命力[128]。
4.2.4 AP2/ERF 家族在抵抗其他非生物胁迫中的作用 拟南芥RAP2.2是一个对缺氧存活至关重要的乙烯反应转录因子基因,过表达RAP2.2在低氧胁迫下提高了植物的存活率,而含有该基因T-DNA 敲除株系的存活率低于野生型[129]。2 个拟南芥缺氧响应基因HRE1和HRE2对拟南芥缺氧反应具有重要作用,过表达HRE1的转基因拟南芥植株表现出更好的耐缺氧性,且单基因敲除突变体与野生型无显著差异,而双敲除突变体hre1hre2比野生型更易受影响[130](表4)。
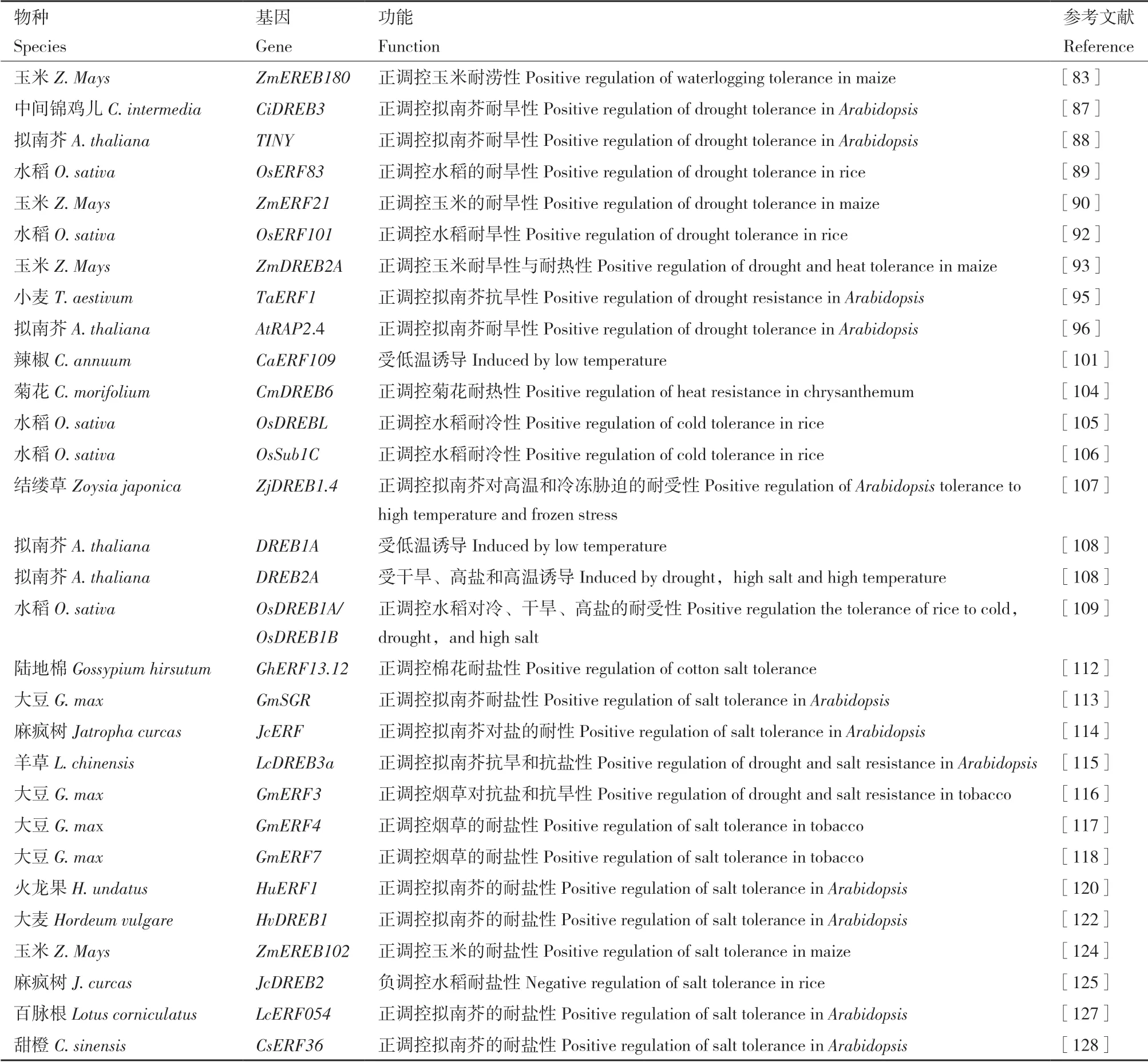
表4 参与非生物胁迫的AP2/ERF 转录因子Table 4 AP2/ERF transcription factors involved in abiotic stress
4.3 AP2/ERF家族在生物合成中的作用
AP2/ERF 转录因子在生物合成方面也发挥着重要作用。丹参(Salvia miltiorrhiza)是一种中药材,对治疗心血管、肿瘤等疾病具有很高的药用价值。有研究表明丹参的2 个AP2/ERF 转录因子基因Smoo8和Sm082对丹酚酸及丹参酮生物合成具有调控作用。过表达Smoo8和Sm082株系中丹酚酸B、二氢丹参酮Ⅰ和隐丹参酮的含量明显上升,抑制表达Smoo8和Sm082株系中二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA、丹酚酸B 等含量明显下降[131]。2021年,Yu 等[132]研究表明SmAP1、SmAP2和SmERF2对盐胁迫下丹参根部丹参酮的生物合成具有正向调节作用,其相对表达水平的升高与丹参酮含量呈正相关。Zheng 等[133]研究表明SmERF73调节丹参酮生物合成基因的表达。该基因在丹参中的过表达协同上调了7 个丹参酮生物合成基因的转录,其中4 个位于丹参酮基因簇中,从而增加了丹参酮的积累,而SmERF73的沉默降低了相应基因的转录和丹参酮的积累。呋喃酮是草莓果实香气的主要贡献者,其生物合成的最后一步由草莓醌氧化还原酶(FaQR)催化,FaERF#9-FaMYB98转录复合物通过激活醌氧化还原酶在草莓中的表达来调节呋喃酮的生物合成,乙烯反应因子FaERF#9是FaQR 启动子的正调节因子[134]。双吲哚生物碱长春花碱和长春新碱是公认的具有抗肿瘤作用的生物碱,有研究表明AP2/ERF 转录因子CrERF5正调控长春花双吲哚生物碱及其前体的生物合成,在过表达CrERF5花瓣中,双吲哚生物碱、长春花碱以及单吲哚生物碱等含量显著增加,而在沉默CrERF5植物中,它们的含量下降[135]。Xu 等[136]通过转录组分析与qPCR 鉴定出2 个GpAP2/ERF与绞股蓝皂苷生物合成基因表达水平以及对茉莉酸响应模式一致,推测它们是中草药绞股蓝皂甙生物合成的潜在调控基因。通过差异转录组分析等方法挖掘与三七皂苷生物合成相关的基因发现,PnERF2和PnERF3的表达模式与三七皂苷生物合成的关键基因表达模式呈正相关,证明这两个转录因子可能参与了三七皂苷的生物合成[137](表5)。

表5 参与生物合成的AP2/ERF 转录因子Table 5 AP2/ERF transcription factors involved in biosynthesis
5 展望
植物容易受到外界环境的干扰,为了应对这些干扰,植物已经进化出多种复杂的信号网络,转录因子在植物生长发育和适应环境胁迫的信号通路以及网络调节中起着至关重要的作用。AP2/ERF 转录因子是最重要的植物转录因子家族之一,AP2/ERF家族蛋白在植物生长发育、生物与非生物胁迫以及生物合成方面均有重要作用。AP2/ERF 家族转录因子功能复杂,能够参与多种通路、调控多个基因,但目前研究大多只是功能验证以及下游调控相关研究,对其被调控的内在机制了解不够深入。因此,有必要对该家族转录因子进行更深入的研究,将该家族转录因子应用起来,为今后培育优良的作物品种奠定基础,并加强其在实际生产中的应用研究。