植物类黄酮UDP-糖基转移酶研究进展
2023-01-05姚宇顾佳珺孙超申国安郭宝林
姚宇 顾佳珺 孙超 申国安 郭宝林
(中国医学科学院药用植物研究所 北京协和医学院,北京 100193)
类黄酮以C6-C3-C6 为基本碳架,是广泛存在于自然界的次生代谢物,目前已有~9 000 个已鉴定的化合物[1-2]。根据化学结构,类黄酮可分为几大类:黄酮、黄酮醇、黄烷酮(二氢黄酮)、黄烷醇、查耳酮、异黄酮和花青素。药理研究证明,许多类黄酮成分具有抗炎、抗菌、抗氧化、抗肿瘤等多种生物活性[3-4],是一些重要中药的主要有效成分。类黄酮通常以α 或β 糖苷形式存在,糖基化是带来黄酮结构多样化的主要因素之一,会对类黄酮在人体内的药理活性以及药代动力学行为有一定的影响[5]。催化植物类黄酮糖基化的酶是尿苷二磷酸糖基转移酶(UDP-glycosyltransferase,UGT),即以尿苷二磷酸(uridine diphosphate,UDP)活化的糖分子作为糖基供体的糖基转移酶,是植物中最大的糖基转移酶超家族[6],很多与植物激素和次生代谢产物糖基化有关的糖基转移酶属于该超家族[7-8]。
本文在综述植物UGT 的结构特征和家族分类的基础上,进一步总结了植物类黄酮UGT 的功能特征,以及各个家族在不同植物科属中的分布特点,以期为植物类黄酮UGT 基因的发掘与鉴定,及序列结构与催化功能研究提供指导,进而推动类黄酮糖苷药用植物的分子育种,促进类黄酮苷类药物的合成生物学研究。
1 植物UDP-糖基转移酶(UGT)
1.1 植物UDP-糖基转移酶(UGT)的结构特征
植物UGT 的C 末端通常含有一个由大约40 个氨基酸组成的保守序列,名为植物次生代谢糖基转移酶保守区(plant secondary product glycosyltransferase box,PSPG box),该序列在不同植物UGT 中具有60%-80%的序列相似性(图1),具有PSPG box的UGT 与植物次生代谢产物的合成有关[8]。该序列被认为是与UDP-糖供体结合的区域[6],其中至少10 个高度保守氨基酸可与UDP-糖供体直接发生相互作用,如与糖供体形成氢键[9]。
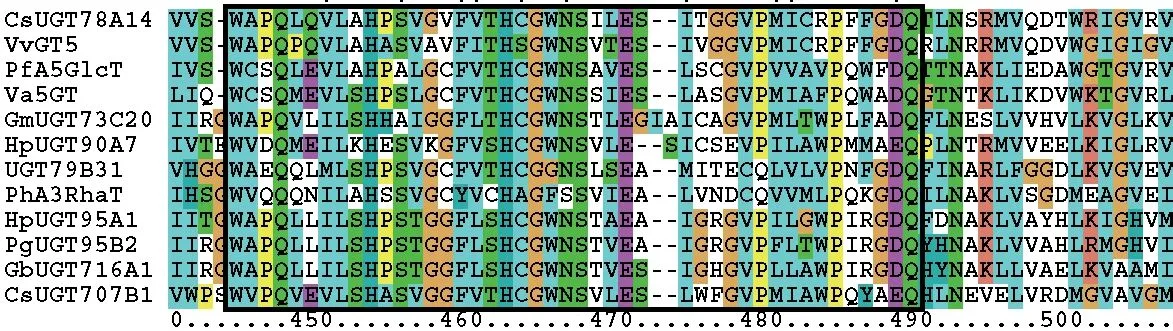
图1 PSPG 保守区Fig.1 Conserved box of plant secondary product glycosyltransferase(PSPG)
植物UGT 之间的氨基酸序列相似性相对较低(~20%-30%),但它们的3D 结构相对保守。目前有超过10 个植物UGT 的晶体结构被报道,包括识别类黄酮O-和C-位的UGT[10-14]。根据已报道UGT 三维结构的折叠特征,所有UGT 都属于β/α/β Rossmann 折叠域组成的GT-B 结构类型,拥有GT-B 类蛋白的结构特点[15],即拥有两个β/α/β 类Rossmann 结构域,这两个结构域结合不紧密,它们的位置左右相对,两个结构域中间为N 末端和C 末端形成的一个裂缝,构成了底物结合口袋。糖供体位于该裂缝中,主要与酶的C 末端结构域相互作用,而受体主要与N 末端的结构域结合[16-17]。
1.2 植物UDP-糖基转移酶(UGT)家族分类
植物UGT 基因数量有随着植物进化而逐渐增加的趋势。从藻类基因组平均有1.5 个UGT 到苔藓植物约有38 个UGT,而在维管植物中,石松类植物中平均有137 个UGT,真叶植物(蕨类植物和种子植物)中平均有152 个UGT[18]。被子植物进化过程中,UGT 超家族通过全基因组复制事件(WGDs)在整个植物谱系内扩张,随后串联重复事件(LTD)和假基因化的发生造成了不同植物谱系之间UGT 数量的显著差异[19]。随着植物的进化,植物中的糖基化代谢产物种类和数量更加丰富,UGT 的数量和功能多样性也因为串联重复的发生而不断变化[18]。
UGT 超家族进一步可分为家族和亚家族,其区分依据为氨基酸的序列相似性,相似性≥40%为同一个家族,相似性≥60%为同一个亚家族[6]。在植物中,不同家族的UGT 又聚类为不同的组(Group),迄今为止,植物的UGT 家族可被分为18个组(A-R),处于同一组内的UGT 通常功能相似(表1[6-7,15,18,20])。在高等植物的进化中,A、D、E、G 和L 组扩张较多,特别是E 组和L 组[20]。

表1 植物UGT 的底物识别特异性Table 1 Substrate specificity of plant UGT
E 组是被子植物中扩张最大的组,占整个UGT超家族的20%-25%[18]。E 组成员包括UGT71、72和88 家族,以及UGT706 和707 两个只在单子叶植物中发现的家族。其中部分基因的功能已经被验证,比如水稻(Oryza sativa)的糖基转移酶OsUGT706C2能够催化芹菜素、木樨草素和山奈酚等多种类黄酮的7-OH 糖基化[21],藏红花(Crocus sativus)的UGT707B1,是以黄酮醇3-O-葡萄糖苷为底物的2′′-O-葡萄糖苷转移酶[22]。L 组是被子植物中扩张第二大的组,在早期被子植物无油樟目和樟目中所占比例较高[18]。L 组成员包括UGT74、75 和84 家族。E 组和L 组包括的UGT 家族较多,其中不同成员对底物类型的识别差异较大。A 组也是被子植物中扩张较大的组,A 组成员在菊分支(asterids)和真双子叶植物基部类群中数目较多,但在单子叶植物和蔷薇分支(rosids)中较少[18]。A 组UGT 主要包括UGT79、91 和94 三个家族,此外还包括仅在单子叶植物中出现的UGT721 家族[18]。UGT79 家族主要识别类黄酮化合物[23-24],91 和94 家族识别类黄酮化合物和萜类化合物[25-26]。
G 组UGT 只包括UGT85 家族,该组基因在几个亲缘关系较远的被子植物中数目较多,包括毛茛目、泽泻目、壳斗目和樟目等[18],尤其在蔷薇科的多种植物中有明显的扩张[27]。部分UGT85 家族基因可以识别萜类化合物、香兰素、氰醇、细胞分裂素等化合物。推测G 组UGT 在植物中独立扩张成为UGT85 家族,其扩张与植物中挥发性成分的合成有一定关系[27]。
D 组在单子叶植物中比例较高,尤其是天门冬目[18]。D 组主要包括UGT73 家族,可以催化类黄酮等多种化合物的糖基化修饰。还包含6 个迄今为止仅在单子叶植物中鉴定的UGT 家族(UGT98、UGT99、UGT702、UGT703、UGT704、UGT705 和UGT729),其中观赏植物montbretia(Crocosmia crocosmiiflora)的CcUGT4(UGT703H1)被鉴定为黄酮醇糖苷的4′-O-木糖基转移酶,CcUGT5(UGT729A2)是黄酮醇糖苷1,4-鼠李糖基转移酶,在4′-O-木糖上添加鼠李糖,最终合成montbretin A[28]。
除了上述UGT 数目极多的组,还有一些组中UGT 数目极少。N 组UGT 是被子植物中数目最少的组,只包含UGT82 家族。多数植物中N 组仅含有1-2个成员[20,27]。Q 组和R 组是最新发现的组,以石榴(Punica granatum)中的PgUGT95B2 为代表,该酶对黄酮和黄酮醇具有一定的底物偏好,但是该组基因在十字花科(以拟南芥为代表)和禾本科中尚未发现,可能是趋同进化或基因丢失的结果[29]。R组UGT 以荞麦(F.esculentum)中的UGT708C1 为代表,可识别并催化三羟基苯乙酮结构类型化合物的C-糖基化反应[18,30]。
2 植物类黄酮UDP-糖基转移酶(UGT)
类黄酮UGT 具有糖受体和糖供体的多样性和特异性[31]。根据糖基化反应中修饰位点的不同,类黄酮UGT 可分为类黄酮的3-O-糖基转移酶、5-O-糖基转移酶、7-O-糖基转移酶和GGT(催化生成二糖苷甚至多糖苷的糖基转移酶),以及C-糖基转移酶[30,32]。类黄酮UGT 的糖受体包括黄酮醇、花色素、黄烷酮、黄酮、异黄酮和黄烷醇等(图2)。UDP-葡萄糖是最常见的活化的糖供体,还有UDP-半乳糖、UDP-鼠李糖、UDP-阿拉伯糖和UDP-葡萄糖醛酸等[15],GGT 催化合成的双糖主要包括芸香糖(6-O-α-L-鼠李糖-D-葡萄糖)、槐糖(2-O-β-D-葡萄糖-D-葡萄糖)、新橙皮糖(2-O-α-L-鼠李糖-D-葡萄糖)等,较少有3 个以上的糖连接,糖的连接形式包括1 →2 连接、1 →4 连接和1 →6 连接等连接方式[5]。此外,植物基因组中存在不同的UGT 可以催化相同的反应,即存在功能冗余和共同催化的情况,而某些UGT 可以同时识别多个底物[15]。迄今为止,在UGT 的16 个组中,以类黄酮为底物的UGT 主要分布在A-F 以及L 这几个组中。在I、J、K、N、O 和P 组中,还没有关于催化类黄酮的UGT报道[29]。本文收集了多种验证功能为糖基化类黄酮OH 的UGT 序列,与拟南芥的UGT 基因家族共同绘制了系统进化树(图2),并从中总结了识别类黄酮O-位的UGT 在不同分组中的分布规律(表2)。由于Q 组基因在进化树上与A 组聚在了一簇,在后续分析中归为“A 组”进行总结。
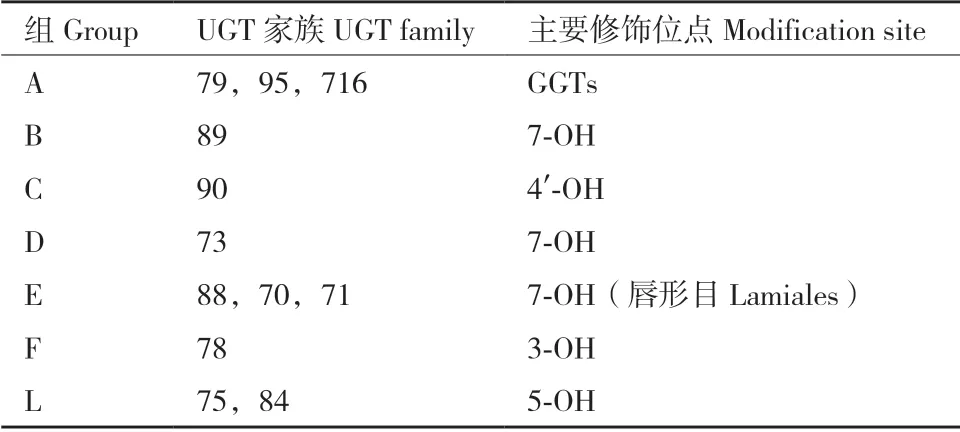
表2 识别植物类黄酮O-位的UGT 对底物修饰位点的选择性Table 2 Specificity of UGT identifying flavonoid O-site to the modification sites of substrates in plants

图2 植物类黄酮UGT 和拟南芥UGT 系统进化树Fig.2 Phylogenetic analysis of Arabidopsis UGT family and plant flavonoid UGT
2.1 植物A组中的类黄酮UGT
A 组中与类黄酮相关的UGT 主要为UGT79 家族,其成员功能主要是转移糖基到类黄酮糖苷的糖基上,即GGT(glycoside glycosyltransferases),为催化生成二糖苷甚至多糖苷的糖基转移酶。A 组的GGT 可以识别黄酮醇糖苷、花青素糖苷、查耳酮糖苷等类黄酮糖苷,对于糖苷底物上的糖基位置和类型具有一定的选择性,并且不同GGT 催化添加糖基时,糖基之间有不同的连接方式。
对于催化黄酮醇糖链延伸的GGT,大豆(G.max) 中Fg1、Fg2和Fg3基因属于UGT79 家族[33-35],分别编码GmF3G6′′RT、GmF3G6′′GT 和GmF3G2′′GT,各自能够催化黄酮醇3-O-葡萄糖苷的1,6-鼠李糖基化、1,6-半乳糖基化和1,2-葡萄糖基化。其中GmF3G6′′GT 与GmF3G6′′RT 具有82%的氨基酸相似性,表明这两个基因可能具有共同祖先,后来分化为识别不同糖基的GGT。GmF3G6′′RT是首个发现催化修饰黄酮醇糖苷6′′-O 位置的GGT基因。长春花的葡萄糖基转移酶(CaUGT3)催化槲皮素3-O-葡萄糖苷的1,6-葡萄糖基化反应。CaUGT3 具有独特的葡萄糖基链延伸活性,不仅形成龙胆苷,而且可以连续对糖基产物进行糖基化修饰,最终形成龙胆二糖苷、龙胆三糖苷甚至龙胆四糖苷[36]。
上述基因主要为修饰黄酮醇糖苷6′′-O 位置的GGT 基因,也有报道修饰黄酮醇糖苷2′′-O 位置的GGT 基因。拟南芥(A.thaliana)的UGT79B6 是花粉中黄酮醇的关键修饰酶,可以将山奈酚3-O-葡萄糖苷转化为山奈酚3-O-葡萄糖苷-(1 →2)-葡萄糖苷[37]。矮牵牛(Petunia hybrid)的特异性黄酮糖基转移酶UGT79B31 负责花粉中黄酮醇的末端糖基修饰,可将山奈酚3-O-半乳糖苷/葡萄糖苷转化为山奈酚3-O-葡萄糖基(1 →2)半乳糖苷/葡萄糖苷。UGT79B31 更偏好黄酮醇3-O-半乳糖苷而不是3-O-葡萄糖苷,很少接受3-O-二糖苷作为糖受体。UDP-葡萄糖是UGT79B31 的首选糖供体[23]。
对于花青素糖苷的糖链延伸,日本牵牛花(Ipomoea nil)的UGT79G16 基因编码花青素3-O-葡萄糖苷-2′′-O-葡萄糖苷转移酶,催化花青素3-O-葡萄糖苷的葡萄糖基化反应生成花青素3-O-槐糖苷。牵牛花的花瓣中由于含有花青素3-O-槐苷,呈现亮蓝色或红色,而UGT79G16 突变体由于缺少UGT79G16,花青素3-O-葡萄糖苷不能转化为花青素3-O-槐苷,花瓣表现为红棕色或紫灰色[38]。
除了上述均能催化类黄酮3-O-糖苷发生糖基化的GGTs,另外还有催化类黄酮7-O-糖苷添加糖基的GGTs 也属于A 家族。柑橘属植物中,7-O-新橙皮苷是其苦味的来源,柚子(Citrus maxima)中的Cm1,2RhaT 是一种1,2-鼠李糖基转移酶,它可以将新橙皮苷转化为7-O-新橙皮苷[39]。
A 组中除了GGT,也有少数UGT 催化其他位点的糖基化,比如矮牵牛(P.hybrida)的PhA3RhaT催化花青素的3-O 位鼠李糖糖基化[40]。拟南芥(A.thaliana)中的AtUGT79B2 和AtUGT79B3 催化花青素3-O 位添加鼠李糖基,其可被寒冷、盐碱和干旱等多种非生物胁迫强烈诱导,说明其在拟南芥中通过调控花青素的积累,赋予植物对非生物胁迫的耐受性[24]。进化树聚类分析的结果表明,上述3 个催化花青素3-O 位糖基化的UGT 都聚类在UGT79 家族(图2)。
A 组的UGT95 家族成员也能识别类黄酮,但其成员糖基化的修饰位点较多样。绿毛山柳菊(Hieracium pilosella)中的HpUGT95A1 偏好木犀草素作为底物,催化其3′-O位的糖基化[41]。石榴(Punica granatum)的PgUGT95B2,对B 环有3 个羟基的黄酮类化合物五羟黄酮的活性最强,催化其B 环的4′-O位[29]。特别的是,UGT95 家族存在除了识别类黄酮以外,还能识别其他化合物的UGT。裸子植物银杏(Ginkgo biloba)的GbUGT716A1 被聚类在A 组的UGT95 家族中,可对黄酮、黄酮醇、异黄酮、没食子酸、没食子酸黄烷醇等多种底物的3-O、7-OH、3′-OH、4′-OH 等多个位点进行修饰,产生多种糖基化产物[42]。GbUGT716A1 具有如此广泛的底物选择性,可能是因为银杏作为裸子植物,少量的UGT 家族成员承担了较多功能。通常来说,高等植物UGT对底物的识别具有较高选择性,可能其在祖先UGT的基础上发生了亚功能化和新功能化,产生了具有底物选择特异性的UGT[42]。
2.2 植物B、C和D组中的类黄酮UGT
B、C 和D 组中涉及类黄酮UGT 分别为UGT89、90 和73 家族,因其序列和功能较为相似,聚成一个大的分支。这3 个组的成员识别底物多数为黄酮醇,也有黄酮、异黄酮等,都具有催化7-O 位糖基化的功能,部分基因对于其底物的3-O 位是否有糖基修饰有一定选择性。
B 组中,拟南芥(A.thaliana)的UGT89C1 将山奈酚3-O-葡萄糖苷转化为山奈酚3-O-葡萄糖苷7-O-鼠李糖苷,该酶识别3-O-糖基化黄酮醇和UDP-鼠李糖,但不识别黄酮醇苷元、3-O-糖基化花青素或其它UDP-糖[43]。C 组中,绿毛山柳菊(Hieracium pilosella)的HpUGT90A7 偏好木犀草素作为底物,主要催化4′-O 位的糖基化,也能催化7-O 位的糖基化[41]。D 组中,拟南芥(A.thaliana)的UGT73C6 催化UDP-葡萄糖向山奈酚-3-O-鼠李糖苷和槲皮素-3-O-鼠李糖苷的7-OH 转移[44]。金鱼草(Antirrhinum majus) 的UGT73A9、UGT73E2和UGT73N1 均能催化修饰芹菜素的7-O 位添加葡萄糖基[45]。对于异黄酮的糖基化,目前为止报道均为7-O 位的葡萄糖转移酶,包括大豆(G.max)的GmUGT73C20 催化大豆苷元形成7-O-葡萄糖苷[46]。
草莓(Fragaria x ananassa)的FaGT7 虽然聚类在D 组,但不同于D 组中主要催化修饰7-O 位UGT的功能,其重组酶将槲皮素转化为3-O-葡萄糖苷和4′-O-葡萄糖苷,也能得到少量的7-O-葡萄糖苷和3′-O-葡萄糖苷,但不形成二葡萄糖苷。FaGT7 可接受多种类黄酮、羟基香豆素和萘酚作为底物[47],它的底物选择性相对广泛。
2.3 植物E组中的类黄酮UGT
E 组中涉及到类黄酮的主要为UGT88 家族,为唇形目特有的UGT 家族[45],其修饰位点类似于上述的B、C 和D 三组,也是4′-O 位或7-O 位的糖基化,个别酶兼具同时催化修饰两个位点的功能。但不同于B、C 和D 三组的是,UGT88 家族成员主要催化修饰的底物多为黄酮、黄烷醇、查耳酮、异黄酮等。
对于UGT88 家族,在唇形科植物中,金鱼草(A.majus)的UGT88D4、芝麻(Sesamum indicum)的UGT88D5 和UGT88D6、紫苏(Perilla frutescens)的UGT88D7 皆能催化芹菜素7-O 葡萄糖醛酸化[45]。豆科植物中,大豆(G.max)的GmUGT88E19 能够催化大豆苷元形成7-O-葡萄糖苷,还可催化(-)-表儿茶素的3′-O-葡萄糖基化[46]。比较特别的是UGT88 家族中,粉蝶花(Nemophila menziesii)中分离得到了NmF4′GT,催化芹菜素的4′-OH 糖基化[48]。柳穿鱼(Linaria vulgaris)的UGT88D2(LvC4′GlcT)和金鱼草(A.majus)的UGT88D3(AmC4′GlcT)都能催化查尔酮的4′-OH 发生葡萄糖基化,随后合成下游的花色苷[49-50]。系统进化树的结果(图2)表明,葛根(Pueraria lobata)的PlUGT1 和PlUGT2 两个酶也聚类在E 组,PlUGT1 能够催化大豆苷元、染料木素、刺芒柄花素形成7-O-葡萄糖苷,PlUGT2催化多种异黄酮4′-O 和7-O 发生连续的二糖基化,对染料木素(豆科植物常见的异黄酮)的催化活性最高[51]。
E 组UGT70 和71 家族中也有少量识别类黄酮的UGT。UGT71 家族中,草莓(F.x ananassa)的FaGT6(其家族分类来自系统进化树分析结果,如图2)催化以槲皮素为代表的黄酮醇形成3-O-葡萄糖苷和少量的7-O-、4′-O-、3′-O-单葡萄糖苷和二葡萄糖苷,也可接受多种类黄酮、羟基香豆素和萘酚作为底物。FaGT6 和属于D 组的FaGT7 功能较为相似,二者都在瘦果中有较强的表达,而在花托中表达水平普遍较低[47]。尽管它们的功能和表达模式都比较相似,但其序列的相似度较低,进化树上聚类在两个不同的组。
UGT70 家族中,藏红花(C.sativus) 的UGT707B1,是以黄酮醇3-O-葡萄糖苷为底物的2′′-O-葡萄糖苷转移酶,在拟南芥中过表达该基因导致茎和花中山奈酚3-O-槐糖苷含量显著增加,转基因植株茎秆变粗,开花延迟[22]。该基因是极少数不属于A 家族的GGT 基因。
2.4 植物F组中的类黄酮UGT
F 组只有UGT78 家族,该家族成员均为类黄酮3-O-糖基转移酶,对于修饰位点的选择较专一,其底物多数为黄酮醇,并且同一个基因通常能催化修饰几种不同黄酮醇的3-O 位。
拟南芥(A.thaliana)中,UGT78D1、UGT78D2和UGT78D3 都是以槲皮素和山奈酚为底物的3-O-糖基转移酶,只是对糖供体的选择有所不同[44,52-53]。UGT78D1 催化UDP-鼠李糖向槲皮素和山奈酚的3-OH 转移,UGT78D2 将UDP-葡萄糖转移到山奈酚和槲皮素上[39]。UGT78D3 能将槲皮素转化为槲皮素3-O-阿拉伯糖。UGT78D3 对黄酮醇苷元和UDP-阿拉伯糖具有严格的底物特异性。拟南芥ugt78d1/ugt78d2 双突变体中黄酮醇含量仅为野生型植株的1/3,说明黄酮醇苷元的糖基化对苯丙烷代谢途径上游基因表达存在反馈抑制调控[54]。
矮牵牛(P.hybrida)的黄酮醇3-O-半乳糖基转移酶F3GalTase(Ph3GalT),只在雄配子体中表达,体外功能验证表明它以山奈酚和槲皮素为底物,仅识别UDP-半乳糖作为供体[55]。葡萄柚(Citrus paradisi)的Cp3GT 可特异地催化槲皮素、山奈酚和杨梅素的3-O 位葡萄糖基化[56-57]。黄酮醇3-O-糖苷是茶树(Camellia sinensis)中特有的涩味化合物,CsUGT78A14 和CsUGT78A15 分别催化合成黄酮醇3-O-葡萄糖苷和黄酮醇3-O-半乳糖苷,底物同样为山奈酚、槲皮素和杨梅素[58-59]。
上文所述拟南芥(A.thaliana)的UGT78D1、UGT78D2 和UGT78D3 彼此之间序列相似度非常高,其糖基化位点和催化底物完全相同,区别只在于识别的糖基不同。这样相似的一对或几对UGT 在植物中经常存在。如葡萄(V.vinifera)中VvGT5 和VvGT6,分别是黄酮醇-3-O-葡萄糖醛酸转移酶和双功能的黄酮醇-3-葡萄糖醛酸转移酶/半乳糖基转移酶。VvGT5和VvGT6基因具有很高的序列相似性(91%),它们在11 号染色体上是串联的,这表明其中一个基因是由另一个基因复制而来。这两个基因的表达与黄酮醇合成酶基因的表达以及黄酮醇类化合物在该植物中的分布模式一致[60]。
2.5 植物L组中的类黄酮UGT
L 组中催化修饰类黄酮主要为UGT75 家族,其成员为类黄酮-5-O-糖基转移酶,识别的底物多数为3-O 位已有糖基的花青素糖苷。葡萄(V.amurensis)的Va5GT 以锦葵色素3-O-葡萄糖苷为底物,催化形成锦葵色素3,5-O-二葡萄糖苷[61]。紫苏(P.frutescens)的PfA5GlcT 以UDP-葡萄糖为供体,催化花青素3-O-葡萄糖苷在O-5 位置的糖基化,形成花青素3,5-O-二葡萄糖苷,但对于没有3-O-葡萄糖苷的花青素没有活性[45]。
进化树的分析结果表明,UGT84 家族也有一个酶对类黄酮有活性。粉蝶花(N.menziesii)的NmF4′G7GT 聚类在UGT84 家族,既可以催化修饰芹菜素的4′-OH,又可以催化7-OH 的糖基化,与上文中E 组已经介绍的NmF4′GT 先后修饰芹菜素,最终得到芹菜素7,4′-O-二葡萄糖苷[48]。
2.6 植物类黄酮C-UGT
C-糖基类黄酮化合物广泛分布于植物界,含有一个或多个通过C-C 糖苷键与类黄酮苷元连接的糖基,例如葛根素(大豆苷元8-C-葡萄糖苷)、白藜芦素(根皮素3-C-葡萄糖苷)、根皮素3、5-二-C-葡萄糖苷、牡荆素(芹菜素8-C-葡萄糖苷)、异牡荆素(芹菜素6-C-葡萄糖苷)和野芹菜素-2(芹菜素6,8-二-C-葡萄糖苷)等[62-63]。修饰类黄酮C-糖基化的UGT(CGT)通常催化糖基转移到类黄酮C6 和/或C8 位[64]。修饰类黄酮C-糖基化的UGT主要为R 组的UGT708 家族,单子叶植物和双子叶植物都有存在[64-65],能够识别催化闭环或开环2-羟基黄烷酮互变异构体、查耳酮或其他具有2′,4′,6′-三羟基苯乙酮骨架的化合物[62]。此外,金莲花(Trollius chinensis)的TcCGT1[66]和葛根(P.lobata)的PIUGT43[67-68]不属于UGT708 家族,TcCGT1 催化36 种黄酮类化合物和其他黄酮类化合物的8-C 糖基化反应,也能催化多种酚类化合物的O-糖基化反应。PIUGT43者直接催化黄酮或异黄酮的8-C糖基化。
3 总结与展望
综上所述,同组的类黄酮UGT 相对偏好相同的修饰位点,但也可以修饰多种类黄酮底物。F 组的类黄酮UGT 对于修饰位点的选择较为专一,该组基因只催化3-OH 的糖基化。而除F 组以外,多个组的UGT 都存在部分修饰位点“特殊”的UGT 序列,难以严格按照位点选择性分类(表3)。A 组的类黄酮UGT 主要为GGTs,但存在部分UGT 催化修饰3-OH,乃至同时催化修饰3′-OH 或4′-OH 等多个位点。B、C 和D 组基因主要催化修饰7-OH,也有部分UGT 修饰4′-OH 的基因。L 组的类黄酮UGT 催化修饰5-OH 以及少量7-OH 的糖基化。可以看出,催化修饰7-OH 的UGT 没有特异地聚集在某个组,而是在B、C、D、E 和L 组均有分布,而修饰3′-OH和4′-OH 的UGT 分布更加广泛,在除了F 组以外的所有类黄酮相关的组中都有发现。说明这些功能可能是在基因分化之后以植物谱系特有的方式扩增得到的。E 组成员除了UGT88 家族为唇形目植物特异性修饰7-OH 的UGT,多数能同时催化多个位点,且具有较为多样的位点选择性。存在多个E 组UGT按照修饰位点分类本该归属其它组的情况,比如红花(C.sativus)的CsUGT707B1 是少数没有归属在A 组的GGT[22],而草莓(F.×ananassa)的FaGT6按其催化3-O 位似乎应该归为F 组[47]。这种UGT具有相似功能但归属于不同组的现象可能是趋同进化的结果[18]。

表3 修饰位点选择不符合所在组规律的植物类黄酮UGT Table 3 Plant flavonoids UGT with special modified site
植物类黄酮苷是一些重要中药的主要有效成分,糖基化通常是类黄酮苷合成的最后一步,不仅可以改变类黄酮化合物的极性,也对类黄酮的药效活性和药代动力学产生一定影响。UGT 是植物最大的超基因家族之一,从数百个UGT 基因中筛选和鉴定负责糖基化类黄酮的UGT 是一个巨大的挑战。本文通过梳理不同家族中类黄酮UGT 的修饰位点特异性、糖供体和糖受体的特异性,以期为类黄酮UGT 的筛选和鉴定提供指导。随着更多类黄酮UGT 的鉴定,将进一步推动UGT 结构与功能研究,有助于发现影响修饰位点特异性、糖供体和糖受体的特异性的关键位点,这将为通过酶工程改良类黄酮UGT 的催化特性奠定基础。