miRNA的非经典作用机制研究进展
2023-01-05李潇凡耿丹丹毕瑜林江勇王志秀常国斌陈国宏白皓
李潇凡 耿丹丹 毕瑜林 江勇 王志秀 常国斌 陈国宏 白皓
(1.扬州大学农业科技发展研究院 教育部农业与农产品安全国际合作联合实验室,扬州 225009;2.扬州大学动物科学与技术学院,扬州 225009)
microRNA(miRNA)是一类在进化上较为保守的内源性非编码单链RNA 分子,包含大约20-22个核苷酸,是基因表达的重要调控因子[1-2]。自发现以来,人们对其生物学功能进行了大量的研究,截至2021年12月,miRNA 数据库(miRBase,http://mirbase.org/)的最新版本包含了近300 个物种中超过38 000 个潜在miRNA 的信息。随着人们对miRNAs 的结构特征和成熟机制认识逐渐深入,它们在细胞中的主要功能和相关蛋白因子的范围被确定。目前,科学界公认其功能是在细胞质中负调控基因表达[1],即编码miRNA 的基因通过细胞核中的RNA 聚合酶Ⅱ或Ⅲ转录为包含5′帽子结构和3′端polyA 尾的miRNA 的前体(pri-miRNA)[3],随后pri-miRNA 由RNAse III 酶Drosha 和辅助因子DGCR8 共同组成的复合体进一步加工以形成茎环或发夹结构前体miRNA(pre-miRNA)[4-5],并通过exportin-5[6]从细胞核运输到细胞质,后通过Dicer酶和RNA 结合蛋白TRBP 进一步加工成miRNA 双链。miRNA 双链解开后,引导链与Argonaute(AGO)蛋白形成RNA 诱导沉默复合体(RNA-induced silencing complex,RISC),其中成熟的miRNA 通过靠近5′端的种子区与同源mRNA 3′端的碱基配对结合,进而抑制靶标mRNA 翻译或者影响mRNA稳定性,对转录后基因表达水平进行负调控,该过程主要由AGO 的合作伙伴-功能蛋白GW182 介导完成[7],而双链的另一条链则立即降解,这就是miRNA 在生物体内的经典作用机制。
如今越来越多的证据阐明了miRNA 在细胞核中的亚细胞定位[8],并研究了其在细胞稳态中的各种新功能是通过非经典作用机制进行调控[9],主要包括miRNA 前体可编码多肽、miRNA 可与其他功能蛋白相结合、miRNA 可直接激活TLR 受体蛋白、miRNA 可提高蛋白表达水平、miRNA 靶向调控线粒体相关基因mRNA 以及miRNA 可直接调控基因转录过程等6 种非经典作用机制。本文针对近年来miRNA 的6 种非经典作用机制进行总结,旨在能够更加深入和系统地理解miRNA 的非经典作用模式,为解析miRNA 在生物体内复杂的分子调控机制提供新的思路和方法。
1 miRNA 前体pri-miRNA 编码调节肽miPEPs
成熟的miRNA 是由编码基因(MR 基因)转录后经过一系列加工后所得。在转录过程中,primiRNA 易被剪切为pre-miRNA,且存在时间较短,因此有关于miRNA 的机制研究主要集中于miRNA成熟体方向。近期研究表明,miRNA 的前体primiRNA 可能具有潜在的编码功能。pri-miRNA 序列的5′UTR 包含短的开放阅读框架(small open reading frames,smORFs),能被翻译成大小4-60 个氨基酸的功能短肽(microRNA-encoded peptides,miPEP),过表达或外用miPEP 可通过增强其相关MR 基因的转录,影响相应miRNA 的转录水平,对成熟miRNA 进行正向调控[10-11]。一般情况下miPEP 通过被动扩散和胞吞作用相关过程进入细胞进行调控,合成的miPEP(无额外的修饰和加工)也能产生相同的自动调节效果,这与通常作为配体被相关受体识别的前体衍生肽不同[12-14]。
2015年,Lauresergues 等[15]首次发现蒺藜苜蓿(Medicago truncatula)的pri-miR176 和拟南芥的primiR165a 能分别编码短肽miPEP176 和miPEP165a,这两个短肽增加了相应miRNA 的积累和靶基因的下调,导致侧根发育迟缓并能刺激主根生长。目前通过人工合成miPEP,在大豆、葡萄等农业作物上miPEP 的调节功能都得到了验证[11,16]。由于在人类、动物和植物中miRNA 序列都很保守,因此研究pri-miRNAs 在哺乳动物细胞中是否编码miPEP具有重要的价值。目前已证明在人类细胞中可以编码miPEP-200a 和miPEP-200b[17-18]。2020年,Niu等[19]研究报道人树突状细胞(dendritic cells,DCs)中miR-155 可以编码多肽miPEP-155,其可以特异性地与DC 细胞的互作蛋白HSC70 的ATPase 功能域绑定,降低炎症环境中DC 细胞MHC-Ⅱ的表达和转运水平,调控其抗原提呈功能。
如今多项研究表明动植物细胞中的pri-miRNA具有潜在的编码功能,能编码出具有调控功能的短肽miPEP,miPEP 其能影响相应的miRNA 的转录水平,可通过增强其相关MR 基因的转录,对成熟miRNA 进行正向调控。
2 miRNA 可与多种功能蛋白相结合
几十年来,RNA 互作结合蛋白(RBPs)在前体mRNA(pre-mRNA)剪接、mRNA 移动、mRNA分解和翻译中的作用均被广泛研究[20-22]。一般认为,成熟的miRNA 与AGO 蛋白复合体组成一个RISC 复合物,结合并调节含有相关顺式调控元件的靶标mRNA 的表达[23]。在此过程中,AGO2 蛋白及其家族蛋白(AGO1、AGO3 和AGO4)被认为是专门处理和装载具有独特结构特征的miRNA 的RBP[24]。近期研究表明,有少数功能蛋白(miRBPs)与AGO2 蛋白功能相似,也可以与成熟的miRNA结合[25-26]。
2012年有研究报道,在HeLa 细胞中miRNA的表达量是AGO 家族蛋白的13 倍,而miRNA 与mRNA 的结合量是AGO 家族蛋白的7 倍[27],这种“过量”miRNA 分子在细胞中的作用仍不清楚,而维持miRNA 的浓度和稳定性已被证明涉及许多RNA结合蛋白,例如HuR 和AUF1[28]。这些研究结果表明除AGO 蛋白家族外,miRNA 还可与其他功能蛋白结合发挥非经典调控途径。Mukherjee 等[29]研究发现,HuR 可以从AGO2 中竞争性结合mir-122,并在自身泛素化作用下从结合状态中脱离,来调节mir-122 的胞外输出。Eiring 等[30]研究发现,mir-328 除了发挥正常负调控功能,还可以竞争性结合hnRNP E2 蛋白来阻碍其与CEBPA 蛋白的mRNA 结合,导致了CEBPA 核转录因子表达量上升。除了竞争性结合,也有一些研究支持miRNA 与AGO 和miRBPs三者之间存在合作性结合:如UF1 与let-7 的直接结合有助于其在体外以单分子水平转移至AGO2[31-32],HuR 可以增加let-7 与AGO2 的结合量[31]。Song等[33]研究发现mir-346 的中间序列基序(CCGCAU)可以与GRSF1 相结合,再与hTERT 3′UTR 结合时形成“鼓包环”,促进hTERT mRNA 向核糖体的聚集从而上调hTERT 的表达,以独立于AGO2 调节的方式促进翻译。另外,除了成熟的miRNA,premiRNA 也可以与功能蛋白相结合[34]。
可以看出,成熟miRNA 和pri-miRNA、premiRNA 能与多种功能蛋白相结合,并存在多种结合方式,如可逆性结合、竞争性结合和合作性结合等,发挥非经典调控途径,展现出miRNA 调控细胞命运的双重控制能力。
3 miRNA 可作为信号分子直接激活TLR 受体蛋白
如今普遍认为,miRNA 能够感知Toll 样受体(Toll-like receptor,TLR),特别是核内受体TLR7 可以被大脑中存在的miRNA 直接激活,miRNA 作为信号分子在不影响受体蛋白量的情况下发挥作用。早期研究报道,细胞外的let-7 能激活TLR7,并通过神经元TLR7 诱导神经变性[35]。游离的细胞外miRNA let-7b 可以激活小鼠巨噬细胞和小胶质细胞中的TLR7 信号,诱导肿瘤坏死因子-α(tumor necrosis factor,TNF-α)的产生导致神经元死亡,这种效应在TLR7 缺乏的细胞中并不存在[35]。
目前研究表明,游离miRNA 进入细胞并到达核内体诱导信号传导主要受两方面因素影响:一方面是miRNA 需要被包裹在某些类型的载体里以保护它们在到达核内体的过程中免受降解,有研究发现,猿猴免疫缺陷病毒诱导的脑炎模型脑中的细胞外囊泡(EVs)中miR-21 水平升高,并且miR-21可以通过TLR7 发出信号诱导神经毒性[35]。通过将miRNAs 与阳离子脂质体如1,2-二油酰-3-三甲基铵- 丙烷(DOTAP)、lipofectamine 或LyoVec 相络合来模拟EVs 的作用,将细胞暴露于这些络合物中,能发现miRNAs 位于TLR7/8 附近的核内体中。研究表明在巨噬细胞中,与DOTAP 复合的miR-21和miR-29a 通过小鼠TLR7 和人TLR8 发出信号,诱导TNF-α 和IL-6 的产生[28],而未与DOTAP 结合的游离miRNA 在体外不会诱导TNF-α 的产生。另一方面研究发现,miRNA 序列特定位置的某些核苷酸会影响TLR 的激活[28]。Wu 等[36]认为具有特定序列基序和长度的细胞外miRNA 是有效的TLR7 激活剂,可以触发先天免疫反应。其中U 和C 对TLR7 活化起到关键作用,并鉴定出两个由10 个核苷酸组成的miRNA 序列UGCUUAUAGU 和GUGCUUAUAG,可以刺激TNF-α 的产生,这是已知激活TLR7 的最短ssRNA 序列。
TLR7 是导致中枢神经系统损害扩散的途径中的一个基本要素,miRNA 的这种作用机制与肿瘤—免疫系统的通讯有关,在肿瘤生长和扩散中起到关键作用,具有重要的研究意义。
4 miRNA 可上调蛋白表达水平
基因表达调控是一个复杂而有序的过程,包括有多种水平的调控,其中转录后水平的调控起着不可忽视的作用。在该过程中,miRNA 主要作为抑制剂来影响mRNA 稳定性及翻译效率,下调蛋白表达水平。但最近的一些研究揭示了miRNA 在翻译过程中对mRNA 稳定性及翻译效率起到积极作用,达到上调蛋白表达水平的效果[37-38]。
研究发现,位于一些mRNA 3′UTR AU 富含元件(AU-rich element,ARE)是能在转录后水平调节mRNA 稳定性的元素之一,它兼具介导相关因子mRNA 衰变及增强某些mRNA 稳定性的作用。Vasudevan 等[39]首先发现在细胞周期停滞时,miRNAs 可以通过招募AGO 和FXR1 到靶标mRNAs的ARE 区域来激活翻译。而let-7 可以和人工合成的mircxcr 4 在细胞周期阻滞中协同促进靶标mRNA的翻译上调,但在细胞增殖过程中抑制翻译,即其翻译调控随细胞周期的变化在抑制和激活之间波动。与此相似,AGO2-miR369-3p 复合物可以结合TNF-α ARE 招募FXR1,从而刺激TNF-α 的翻译[39],而miR-125b 可以通过防止ARE 降解来增强κB-Ras2 mRNA 的稳定性和表达[40]。除了与3′UTR 的ARE的结合之外,miRNA 还可以通过与mRNA 的5′UTRs相互作用来促进mRNA 翻译。如miR-10a 通过与核糖体蛋白mRNA 的5′UTRs 相互作用来增强mRNA的翻译[41];miR-346 除了与3′UTR 结合激活翻译之外[42],还可以通过靶向RIP140 mRNA 的5′UTR 来提高RIP140 蛋白水平[43];miR-483-5p 也被证明可以通过与IGF2mRNA 的5′UTR 结合来促进IGF2 转录[44]。此外,在实际生产中有研究结论表明miRNA可能在mRNA 转录后调节过程中起到作用,如ggamiR-222a 能上调两个蛋氨酸合酶基因Odosp_3416 和BF9343_2953 的表达,增加蛋氨酸浓度[45],在植物中,干旱胁迫条件下miRNA-156能上调花青素基因表达,形成多酶复合物,该复合物将在粗面的内质网(RER)的胞质面合成更高水平的花青素,从而提高抗干旱胁迫能力[46]。
miRNA 在发挥抑制剂作用的同时,也能够在翻译过程中起到上调靶向mRNA 表达作用,其可以通过招募功能蛋白到靶标mRNAs 3′UTR 的ARE 区域或5′UTRs 来激活翻译,上调蛋白表达水平。
5 miRNA 靶向调控线粒体相关基因mRNA
Mitochondrial microRNA(mitomiRs)指位于线粒体内部的miRNA,它们绝大部分由核基因组编码并转移至线粒体的miRNA,在线粒体内转录并调节线粒体基因表达。还存在少部分由线粒体基因组直接编码合成的miRNA[47-48],这些mitomiRs 的功能与细胞质定位的miRNA 存在差异。
对于核来源mitomiRs,普遍认为核编码的miRNA 成熟后进入线粒体抑制线粒体转录物的翻译[47,49]。研究发现,miR-181c 作为核来源miRNA定位于新生大鼠心室肌细胞线粒体中,可以与来自线粒体基因组的细胞色素c 氧化酶亚基1(mt-COX1)mRNA 的3′UTR 相结合,过表达miR-181c 可以显著降低mt-COX1 蛋白水平[50]。Fan 等[51]研究发现,核来源的miR-2392 可以穿梭到线粒体中并与mtDNA杂交,下调调控癌症中氧化磷酸化、代谢重编程和化学抗性的基因。此外,有研究发现在肌肉分化过程中,miR-1 可以通过与特异性mRNA 碱基互补配对来促进线粒体基因组转录物的翻译,在该过程中miR-1 只需要与AGO2 结合,功能蛋白GW182并没有参与[52]。随着研究进一步深入,发现这些mitomiRs 在缺乏线粒体DNA 的细胞中不表达,如在针对人正常前列腺上皮细胞(PNT1A)的野生型(WT)和mtDNA 缺失型(Rho0)细胞中mitomiRs 的表达水平研究发现,mitomiRs 在Rho0 型PNT1A 细胞中的表达水平显著低于其在WT 型PNT1A 细胞中的表达水平[53]。对于线粒体来源的miRNA 研究相对较少,目前在人类和哺乳动物中已检测到线粒体来源miRNA[53-54],在人类和小鼠的线粒体基因组也存在编码类似miRNAs 的mitomiRs[55]。尚未检测到线粒体内存在由miRNAs 介导的翻译抑制过程中必须的功能蛋白GW182,这与前文中的研究结果相照应[52-53],miRNA 加工蛋白Drosha 和DGCR8 也未检测出;Dicer 酶同样被证实不存在于线粒体中[53],该结论在小鼠心肌细胞也被证实[56]。但Vargas等[57]研究报道pre-miR-338 和Dicer 酶可以在SCG神经元轴突线粒体中共定位。
多项研究表明线粒体功能障碍与心脑血管疾病及癌症等有关,miRNA 在细胞特异性表达表明他们有可能参与线粒体相关疾病,这无疑为线粒体ncRNA 调控网络的研究指明了方向,有助于更全面的理解线粒体生物学,未来对mitomiRs 分布和功能的具体机制的研究可以确定新的药物递送途径和线粒体生物标志物,有助于更好地理解线粒体功能障碍相关疾病的诊疗和治疗方法。
6 miRNA 可直接调控基因转录过程
在miRNA 经典调控途径中,成熟的miRNA 通常在细胞质中形成RISC,与靶标mRNA 的3′UTR碱基配对,靶点选择主要由miRNA 5′UTR 序列决定,对细胞质中的蛋白质合成进行抑制[58-59]。有不同研究表明,miRNA 包含的额外序列元素可以改变它们的亚细胞定位进而调控它们的转录后行为,即miRNA 也可以在细胞核中发挥作用,来自高通量测序的数据甚至预测了核miRNA 的基因组DNA 结合位点,这可能在miRNA 转录调控研究中发挥作用[60]。
在细胞核中已证实存在miRNA 作用机制所需的成分,比如AGO2 和Dicer 酶,但在细胞核和细胞质之间的机制不同。其中,核RISC 蛋白分子量158 kD,相较于核RISC 平均3 MD 的分子量要小很多,成分有所缺失,仅由AGO2 和一个短RNA 形成[61]。因此普遍认为AGO2/miRNA 复合物可以在细胞核外构成,形成的RISC 复合物可进入细胞核内[62]。核-细胞质运输也由Exportin-1 介导[63],由miRNA 序列中特定核定位信号(AGUGUU基序、5′-UUGCAUGU-3′和5′-AGGUUGKSUG-3′基序等)指导富集[64-65],再由核孔蛋白泵入到细胞核内进行修饰[66],与靶基因启动子区域相互作用直接激活转录过程,如在AGO2 和GW182 作为支架参与的情况下,miR-589可结合环氧化酶-2(COX-2)启动子并激活基因转录[67];miR-744 和miR-1186 通过靶向cyclinB1 基因启动子上调Ccnb1 基因的表达[68],这种小RNA 参与的通过结合启动子区域在转录水平激活基因的现象被称为RNA 激活(RNAa)。此外miRNA 也可以靶向负调控其他非编码RNA 的前体RNA,如miR-709 可以与pri-miR-15a 和pri-miR-16-1 结合,阻止它们的进一步加工以调节小鼠细胞的凋亡[69]。miR-122 可以通过与核蛋白结合来阻止pri-miR-21 的成熟[70],近年来有研究发现,NamiRNAs(核激活miRNAs)能够激活增强子,如miR-24 可以改变增强子位点的染色质状态,使组蛋白修饰H3K27ac 富集在miR-24 靶向的增强子区域,该过程依赖增强子的完整性;miR-26a-1 在400 kb 的窗口中被蛋白质编码基因ITGA9 和VILL 包围,过表达的情况下能激活其转录[71]。综上可以看出miRNA 与增强子相互作用能调节基因表达和细胞稳态,然而miRNA 增强子相互作用机理和功能的分子机制仍有待进一步挖掘。
除却自细胞核转移至细胞质发挥作用的经典调控途径,部分miRNA 还可以依照自身额外的序列改变亚细胞定位从而调控自身的转录后行为,即在细胞核内调控基因转录过程,发挥非经典调控作用。
7 问题与展望
本文重点阐述了6 种miRNA 非经典作用机制及其研究进展,在实际研究中仍有其他的非经典调控途径被科学家们所关注,如miRNA 可以与细胞核中的pri-miRNA 结合来阻止它们的进一步加工[69,72],但其作用机制仍需深入研究,是今后miRNA 研究的一个重要方向;还有研究发现在细胞内同一条信号转导通路上,miRNA 可以同时通过其种子区序列和非种子区序列与靶基因/转录因子的3′端结合[73-74],这种功能机制可以达到更加有效且稳定的基因调控作用,对以miRNA 为靶点的多种疾病治疗提供了新的思路和方法。另外,通过对miRNA 的亚细胞定位,在内质网[75]和无细胞质膜的小室(如SGs)[76]中都检测到了miRNA,这些miRNA 可能是调节特定生物过程和肿瘤发生所必需的,对研究细胞适应性具有重要意义。然而,由于相关研究较少,位于不同亚细胞区室的miRNA 的组织、运输和功能在很大程度上是未知的,在本文中并未详细阐述。
近年来,miRNA 在许多重要生物过程中得到了研究者的广泛关注。miRNA 的结构、基因组编码、表达和成熟方式等方面的许多具体特征已被阐明,参与的事件范围在经典调控途径的基础上逐步扩大,这为我们揭示了一片新的图景(图1)。可以看出多数非经典调控机制都涉及到miRNA 的亚细胞定位,其中miRNA 前体可编码多肽、miRNA 可直接激活TLR 受体蛋白、miRNA 靶向调控线粒体相关基因mRNA 以及miRNA 可直接调控基因转录过程都与miRNA的亚细胞定位有关。自从发现miRNA以来,由于技术限制,它们的亚细胞定位在很大程度上被忽视。尽管在分离纯亚细胞组分和基于免疫荧光的精确定位分析方面仍存在一些技术困难,但积累的研究为miRNA 的亚细胞定位和新的miRNA 调控机制提供了广阔的视野,测序技术的进步已经确定大量miRNA 富集于细胞核和多种细胞器中,他们的高丰度表明了miRNA 在转录和转录后调节中存在重要功能作用。
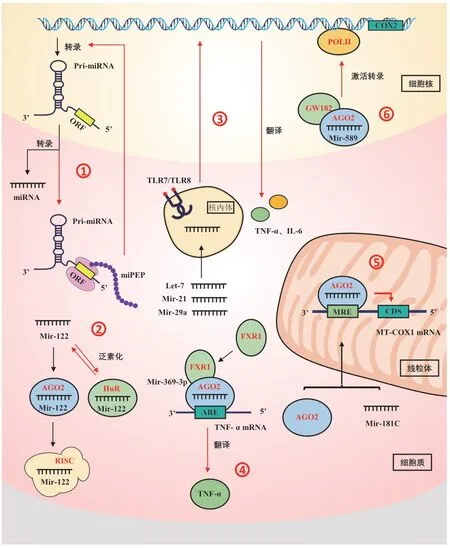
图1 miRNA 非经典作用机制Fig.1 Unconventional miRNA functions
但受制于目前多数动植物基因组、转录组、蛋白质等信息的匮乏以及技术手段的限制,调控机制的某些关键节点和细节仍没有得到答案,比如在primiRNA 编码调节肽miPEPs 中,miPEP 如何执行他们的生物学功能,与其对应的pri-miRNAs 的上调是否有特异性;pri-miRNA 的细胞质翻译和miRNA 的核成熟能否同时发生,pri-miRNA 如何协调其编码和非编码过程;在miRNA 作为信号分子进入细胞并到达内体诱导信号传导的机制并不清楚,诱导miRNA激活TLR7 激活的基序尚未确定;mitomiRs 易位进入线粒体调控的具体机制还存在争议,mtDNA 编码的miRNAs 是否存在非典型的生物发生机制依然存疑,无法证明这些miRNA 是否来自mtDNA 编码,还是污染副产物,或是线粒体中存在另一套RNA 干扰机制。另外,大多数调控机制仅停留在研发阶段,植物研究多集中在拟兰芥和苜蓿等模式植物上,其他植物上少见报道,而动物上使用人类和小鼠细胞系进行研究,未进行到临床试验阶段(表1)。相信实验技术的精进和研究的深入,miRNA 及其他小RNA 分子参与的表达调控机制的网络会逐步明晰,这将有利于我们进一步了解生物体内部的运作机制,为研究miRNA 在调控基因表达和功能中的作用及其机制打开了新的窗口,释放其在人类和动植物上重大的应用潜能。