稀有糖类益生元研究进展
2023-01-03张子龙黄小玉徐海芳师晓敏张冰玉杨家乐吕玉红岳昌武
张子龙,赵 雯,黄小玉,徐海芳,师晓敏,刘 晨,张冰玉,杨家乐,吕玉红, ,岳昌武,
(1.延安大学医学院,延安市微生物药物创新与转化重点实验室,陕西延安 716000;2.河南省驻马店市农科院,河南驻马店 463001)
稀有糖是被定义为“自然界中数量有限的单糖及其衍生物”的一类单糖或糖醇,稀有糖主要存在于天然植物中,与自然界中大量存在的葡萄糖和果糖相比存量非常稀少[1]。目前已报道发现约50种,已被广泛应用于保健食品、婴幼儿配方食品、乳制品、饮料等食品生产和医疗临床产品生产[2]。稀有糖类作为益生元的重要来源,一般不能为动物直接消化吸收利用,但可被肠道内双歧杆菌、乳杆菌等益生菌分解吸收,促进有益细菌生长繁殖,对维持肠道菌群平衡具有重要意义[3]。目前,常见的有开发价值的活性稀有糖类主要有塔格糖、阿洛酮糖、异麦芽酮糖(帕拉金糖)、L-阿拉伯糖和海藻糖等,也因其具有降血糖、降血脂、提高免疫力等重要的生物活性[4]而备受食品、化工和医药等领域关注。随着人们对稀有糖产品功能认可度不断提高,中国食糖结构的日益优化,国内稀有糖的需求日益增长,将为功能性稀有糖的开发、生成及推广带来良好的机遇[5]。然而,由于稀有糖研发基础薄弱、生产工艺落后、自主知识产权欠缺等因素,国内稀有糖生产还有较大提升空间。本文将从稀有糖的结构、生物活性及生物转化合成等方面,对近年来稀有活性糖的研究进展进行回顾,并对其应用和工业化发展趋势进行展望,为国内活性稀有糖的研究开发以及产业化利用提供理论依据。
1 主要活性稀有糖类的结构
从化学结构上可以将稀有糖类分为稀有糖和稀有糖醇两种主要结构类型,二者化学结构的差别导致了其生物活性有较大差异。大量的研究表明,活性稀有糖类的基本构成单糖单元组成、特殊基团及构象等结构的差异决定了其生物活性的多样性[6]。无论是稀有糖或是稀有糖醇,往往都有D-型构象也有L-型构象,而食品工业中利用价值较高的稀有糖往往是D-糖或D-糖醇,提示人们在食品加工添加稀有糖时需要关注稀有糖的构象差异,才能确保产品的生物功能。
1.1 主要活性稀有糖及其结构
稀有糖具有糖类共有的多羟基醛类或者酮类化学结构特征(图1),目前研究较多的稀有糖有塔格糖(Tagatose)、D-阿洛酮糖(D-Psicose)和D-甘露糖(DMannose)、D-核酮糖(D-Ribulose)、D-鼠李糖(DRhamnose)、D-山梨糖(D-Sorbose)和D-木酮糖(DXylulose)。稀有二糖主要异麦芽酮糖/帕拉金糖(Isomaltulose/Palatinose)、L-阿拉伯糖(L-Arabinose)、乳果糖(Lactulose)和海藻糖(Trehalose)等为主,这些活性糖大多是由乳糖、果糖、蔗糖和海藻多糖等生物质经生物转化或化学转化而来,因而具有不同于常见天然单糖的化学结构[7]。其中塔格糖为果糖的 “差向异构体”,是以乳糖为原料,经水解获得半乳糖后经异构化酶处理转化生成的含酮基的六碳己酮糖[7]。阿洛酮糖则是由D-果糖经D-阿洛酮糖3-差向异构酶经生物转化而得到的D-果糖C3所对应的差向异构体[8]。异麦芽酮糖又叫帕拉金糖,是由葡萄糖和果糖以α-1,6糖苷键连接形成的还原性二糖,为蔗糖的1种异构体[9]。L-阿拉伯糖是一种戊醛糖,又称树胶醛糖、果胶糖,常与其他单糖结合,以杂多糖的形式存在于胶质、半纤维素、果胶酸、细菌多糖及某些糖苷中,可经酸、碱水解或生物酶解而获得[10]。乳果糖(4-O-β-D-吡喃半乳糖基-D-果糖),是由果糖和半乳糖组成的乳糖的同分异构体,该糖在自然界中并不存在[11]。作为自然界中最稳定的一类天然双糖,海藻糖是由两个葡萄糖分子组成的一个非还原性双糖,按照海藻糖的构象又可以将其分为α,β-海藻糖(Neotrehalose,新海藻糖)、α,α-海藻糖(Mushroom sugar,蘑菇糖)、和β,β-海藻糖(Isotrehalose,异海藻糖)。其中只有α,α-海藻糖在自然界中以游离状态存在,即为通常所说的海藻糖,而α,β-型海藻糖和β,β-型海藻糖在自然界中很少见,可由化学合成途径获得[12]。

图 1 几种重要生物活性稀有糖的结构Fig.1 Structure of important bioactive rare sugars
1.2 主要活性稀有糖醇及其结构
稀有糖醇是相应稀有糖的酮基经催化氢化还原而被相应的羟基等取代生成的多元醇(图2),因其多由相应的稀有糖类衍生而来,因此还具有某些糖的化学和生物属性。在食品工业有较大利用价值的稀有糖醇主要包括:麦芽糖醇(Maltitol)及其同分异构体异麦芽糖醇(Isomaltitol)、山梨醇(Sorbitol)及其同分异构体异山梨糖醇(Isosorbide)、岩藻糖醇(Fucitol)、苏糖醇(Threitol)、艾杜糖醇(Iditol)、甘露醇(Mannitol)、塔罗糖醇(Talitol)以及阿拉伯糖醇(Arabinitol)等,这些活性糖醇大多数既有D-糖醇构象也有L-糖醇构象,且两种构象的生物活性差别较大。

图 2 几种重要生物活性稀有糖醇的结构Fig.2 Structure of important bioactive rare sugar alcohols
2 稀有糖的生物活性
图3总结了稀有糖类主要影响肠道菌群-肠脑轴而发挥生物活性的机制[13],食物中稀有糖类往往不能被胃和小肠直接消化吸收,进入大肠后可被肠道菌利用转化成短链脂肪酸(Short chain fatty acids,SCFA)或维生素等代谢产物,激活机体免疫系统或是刺激机体白介素等合成,增加机体免疫力等多种途径发挥益生作用;或是抑制肠道有害菌异常发酵,减少了肠道内各种毒素产生;或是通过影响人胰高血糖素样肽-1(GLP-1)等的合成与分泌,发挥降血糖、血脂的作用。

图 3 稀有糖主要生物活性机制Fig.3 Main bioactivites mechanism of rare sugars
2.1 经肠道菌转化成可被机体吸收的SCFA或维生素
稀有糖类不能被人体直接吸收利用,当它们进入肠道后可作为养分直接为双歧杆菌、乳酸菌或枯草芽孢杆菌等益生菌所利用提供能量或合成菌体成分,促进益生菌增殖同时被益生菌转化而产生多种乙酸、丙酸、丁酸和乳酸等多种SCFA[14]。稀有糖转化的有机酸一方面可降低肠道pH值促使肠道益生菌的大量增殖进而竞争性抑制有害菌的生长及其有害产物的产生,一方面还可以刺激肠道蠕动、润湿粪便从而有效预防便秘[15]。此外,SCFA被肠道上皮细胞吸收入血,进而通过肠脑轴调节机体的免疫力等增强机体机能。稀有糖类也是维生素合成的重要前体物质,可以在体外由特定酶催化合成维生素,为实现维生素工业化量产提供物质基础。
2.2 病原微生物的抑制作用
稀有糖类除了通过对益生菌的益生作用抑制有害菌异常发酵,直接减少了肠道内各种毒素产生外,其刺激增殖的双歧杆菌、乳酸菌、枯草芽孢杆菌等菌体的细胞壁成分和胞外分泌物,可刺激机体免疫系统抑制病原微生物活性[16]。稀有糖不被口腔微生物利用,可抑制口腔病原菌的生长,进而抑制牙齿龋变,有报道称D-塔格糖可通过抑制变形链球菌在牙齿形成生物膜而发挥抗龋齿作用[17]。
2.3 其他作用
稀有糖具有对细胞活性酸素的抑制作用,抑制收缩期、扩张期血压的上升,对脏器贫血障碍的保护作用,抑制破骨细胞的分化,抑制癌细胞的增殖等作用[18]。稀有糖也可通过影响人胰高血糖素样肽-1(GLP-1)等的合成与分泌,通过影响体内相关信号途径进而发挥降血糖、血脂的作用[4,19]。同时,有大量研究表明稀有糖对神经性病变、脑梗塞、心肌梗塞、高血压等疾病的具有抑制效果[20]。最新研究表明,稀有糖对肝脏细胞能量产生、肝脂肪积累和基因表达具有结构特异性影响,具有保肝药物应用潜力[21]。
总之,稀有糖表现出抗肿瘤、免疫调节、抗氧化、降血糖、降血脂、防腹泻、抗炎症以及抗衰老等多种生物活性,可适合于肠胃功能失调、糖尿病、高血压、肥胖症、动脉硬化、龋齿患者以及免疫力低下的慢性病和老年病患者,更可作为日常饮食中添加成分用于人体营养与保健[22-24]。此外,稀有糖和合成化学药品相比,无不良反应,因而必将在制造康养食品和医药品以及医疗制品方面具有非常大的应用前景。
3 稀有糖的制备方法
稀有糖作为极具市场开发潜力和大量使用的益生元,传统的生产工艺已不能满足市场和环境保护的需要,研究开发其高效、低耗、绿色的生产工艺尤为重要,目前稀有糖的主要制造方法大致可分为天然原料酸/碱水解及提取、化学合成、天然多糖生物转化、糖基生物质转化、单糖酶学转化等(图4)[25-26],由于近年来从天然原料中提取稀有糖以及天然多糖的酸/碱水解以及化学合成的相关研究进展不大,本文主要就后3种方法展开介绍,包括基于糖基生物质的转化生产稀有糖;以单糖、寡糖为原料的稀有糖生物合成;己糖Izumoring策略的稀有糖生物合成。

图 4 稀有糖的主要生物制备途径Fig.4 Biological production methods of rare sugars
3.1 基于糖基生物质的转化生产稀有糖
得益于现代微生物组学、酶工程和基因工程技术的巨大进步,使得在工厂里以糖基生物质为原料通过生物合成方法生产稀有糖成为了可能[27-30]。糖基生物质水解法作为比较传统生产方法,生产工艺较为成熟、近年来鲜有重大突破[31]。例如乳果糖是由半乳糖与果糖组成的二糖,在自然界中并不存在,可通过化学法或生物酶法生产。化学法主要有碱单一催化法、铝酸钠催化法和酸碱协同催化法,后者是目前工业上的主要生产乳果糖的方法[32]。L-阿拉伯糖广泛存在于水果、粗粮皮壳中,早期主要是通过碱水解、酸中和获得阿拉伯聚糖,也可通过化学合成法,利用鼠李糖等为原料,在过氧化氢和乙酸催化下制备L-阿拉伯糖,现已开发出生物转化法生产L-阿拉伯糖[33]。塔格糖(Tagatose)是以乳糖为原料,经水解获得半乳糖,然后在碱性条件下,以碱金属或碱土金属盐为催化剂,催化D-半乳糖与金属氢氧化物发生异构化反应,生成金属氢氧化物+D-塔格糖复合物沉淀,然后酸中和分离沉淀而得[34]。尽管化学家通过两种不同催化剂介导的受氢和供氢的连续步骤、通过位点选择性差向异构化反应直接以D-葡萄糖为原料经一系列催化合成中间体,最终成功制备出D-阿洛糖,实现了稀有糖化学合成的重大突破[35],是迄今为止产率和选择性最好的方法,为合成高价值的稀有糖提供了一条简洁且广泛的方法,但由于其复杂的化学工艺、转化成本高昂,目前尚不能应用于实际生产。
纤维素、半纤维素为代表的陆生植物糖基生物质以及褐藻多糖、红藻多糖、绿藻多糖和蓝藻多糖等为代表的海藻多糖是地球糖基生物质的主要来源。其中占植物界碳含量的50%以上的纤维素是自然界中分布最广、含量最多的一种多糖,是通过生物转化获得优质稀有糖的重要原料[36]。已有大量的研究通过将分解纤维素、半纤维素产生葡萄糖、纤维二糖、木糖的纤维素酶(Cellulase)、木聚糖酶(Xylanase)和下游能将后二者进行转化的合成稀有糖的相关酶类通过代谢工程等方法构建全细胞级联反应体系或体外转化体系,成功实现以直接以纤维素、半纤维素为原料的稀有糖的生物转化[37]。
以淀粉为原料的稀有糖生产技术经过这些年的探索,已经取得了较大进展,可用于稀有糖的低成本绿色生物制造,如游淳课题组基于“热力学驱动策略”构建了一个以淀粉为原料的体外稀有糖的合成酶生物体系(图5),通过多种酶的级联反应,最终实现了合成多种稀有糖生物合成[38]。甘油是生物体内通过糖异生途径合成多种糖的重要原料,科学家们已经实现了体内外的甘油为原料的多种稀有酮糖的生物催化合成,李子杰等成功构建了一锅多酶系统(Onepot multienzyme system)策略(图6)。该策略以甘油为唯一碳源,将多种来自不同微生物的甘油糖异生和稀有糖合成相关的酶在大肠杆菌基因工程菌体内过表达,最终获得14.8 g/L的D-山梨糖和D-阿洛酮糖产量,该策略也可用于其他稀有糖高效、低成本的合成,该团队还利用该策略实现多种稀有糖的体内酶促催化合成[39]。
3.2 以单糖、寡糖为原料的稀有糖生物合成
将葡萄糖、果糖等单糖或寡糖转化成稀有糖的方法除了已经介绍的化学法外,利用自然界已发现的具有转化合成稀有糖酶活性的菌株或酶类的发现、定向突变和酶工程一直是科学家们研究的热点。科学家通过突变获得了耐热型β-半乳糖苷酶,该酶以乳糖和果糖为底物、可高效的将乳糖水解成半乳糖并后者转移给果糖而合成乳果糖,其转化效率较传统补料法提高了10.6倍,极大提高了乳果糖产率和转化率[40]。目前海藻糖生产主要利用酶转化法,该法是以麦芽糖为原料,利用麦芽磷酸化酶、海藻糖磷酸酶共同催化麦芽糖或单独使用海藻糖合成酶将麦芽糖产生海藻糖[41-42]。生产上利用枯草芽孢杆菌、金黄色节杆菌或酵母菌的培养物酶解阿拉伯聚糖是获得L-阿拉伯糖重要途径[43]。塔格糖则是采取化学法和生物法结合的生产方式,先通过水解乳糖获得半乳糖,再通过脱氢酶催化氧化半乳糖醇得到D-塔格糖,或者通过L-阿拉伯糖异构酶催化D-半乳糖异构化生成D-塔格糖[44-45]。利用微生物来源的酮糖3-差向异构酶催化D-果糖与D-阿洛酮糖转化,是目前D-阿洛酮糖生产的主要途径[46]。利用沙雷氏杆菌、大肠杆菌等微生物的α-葡萄糖基转移酶转化蔗糖或是利用酶法转化葡萄糖和果糖是目前生产异麦芽酮糖重要方法[47-49]。
图7总结了以葡萄糖为原料,通过不同来源的已糖异构酶等生物酶类组合催化,实现多种稀有糖的生物合成技术路线。目前基于基因工程的组合酶催化生物合成已经在 L-己糖、D-塔格糖、D-阿洛糖等多种稀有糖生物合成中取得成功[50-51]。生产中可以此为借鉴,根据目标产物的生物合成进展,采取固定化菌株或固定化酶的技术,将来自不同微生物的催化稀有糖合成的高活性酶类基因进行克隆并将相应的催化单元按照一定的顺序进行模块化组合,就可完成特定的稀有糖的高效生物转化[52]。

图 5 淀粉为原料的体外多种酶组合合成稀有酮糖体系Fig.5 In vitro strategy for the synthesis of rare ketose from starch
3.3 稀有糖合成的己糖Izumoring策略
受益于稀有糖酶工程模块化技术进步,Ken Izumori提出了一套完整的适用于所有稀有糖的生物制备Izumoring策略,该策略利用基于各种稀有糖化学结构、生物活性和酶促催化的相关性,利用AIase(Aldose isomerase,醛糖异构酶)催化醛糖-酮糖异构化,KEase(Ketose 3-epimerase,酮糖3-差向异构酶)催化酮糖C-3异构化,Arase(Aldose reductase,醛糖还原酶)和PDH(Polyol dehydrogenase,多元醇脱氢酶)分别催化醛糖和酮糖还原为相应的多元醇的四个基本酶促反应实现各种稀有糖的转化[53]。以己糖Izumoring策略为例(图8),只经过6步反应,即可将L-葡萄糖依次经L-葡萄糖醇、D-山梨糖、D-塔格糖、D塔洛糖醇/D-阿卓糖醇、D-阿洛酮糖、D-果糖等中间体,最终得到D-葡萄糖[54]。Izumoring策略为工厂化生产稀有糖提供了一条简便、高效且灵活的生产策略,人们可以将各种来源的AIase、KEase、Arase、和PDH固定化,根据生产目的进行有机的组合,可以实现从L-葡萄糖等糖基生物质原料到己糖稀有糖目标高效生产。

图 6 甘油全细胞合成D-山梨糖和D-阿洛酮糖的策略Fig.6 Strategy for the whole-cell synthesis of D-sorbose and D-allulose from glycerol

图 7 基于单糖异构化的稀有糖生物转化策略Fig.7 Strategy for the rare sugars biotransformated by isomerase
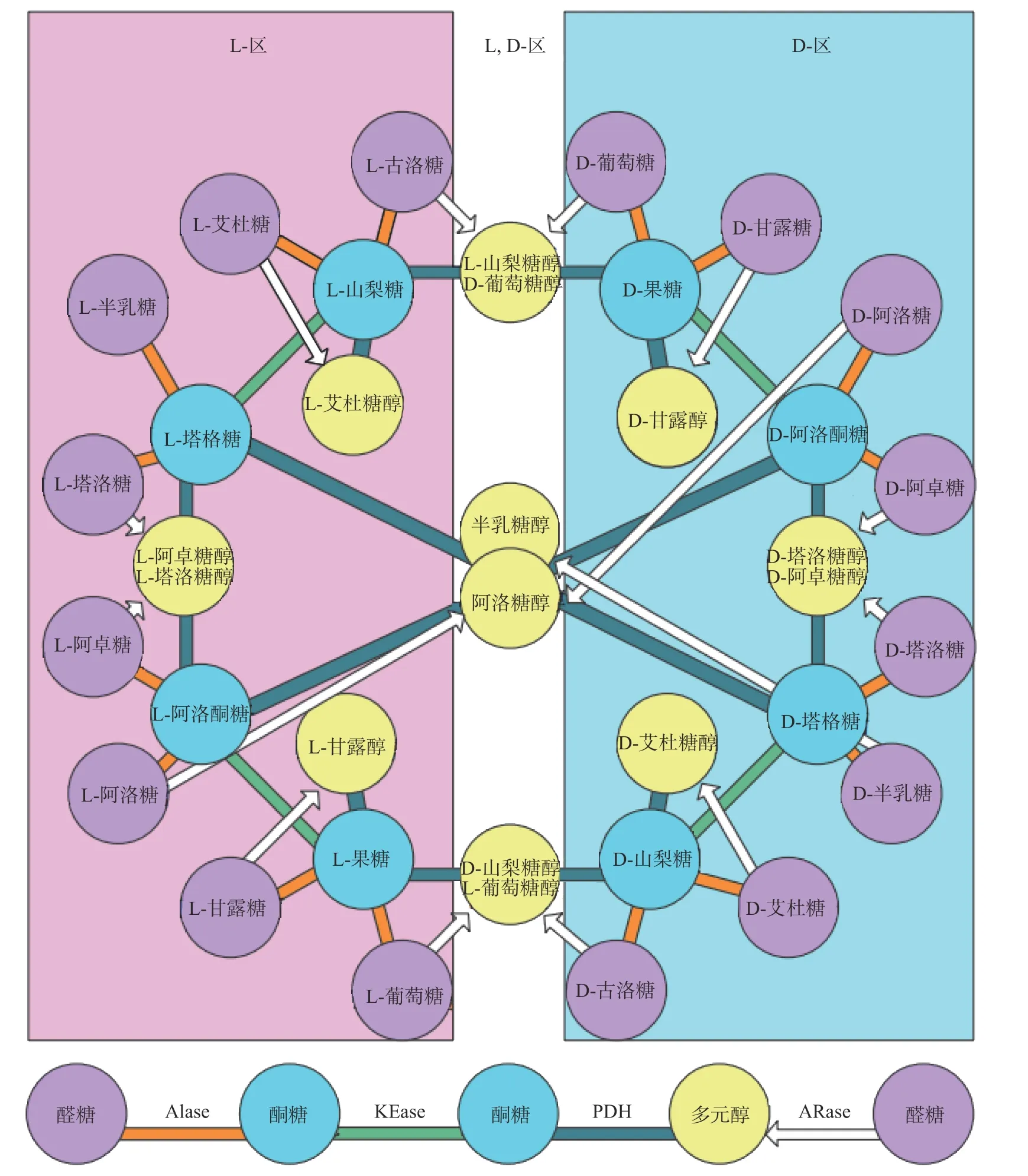
图 8 稀有糖的己糖Izumoring策略Fig.8 Strategy of hexose Izumoring for rare sugars
4 结论与展望
本文对近年来稀有糖类的结构、活性及制备方法等研究进展进行较为系统的回顾,尽管目前稀有糖的工厂化生产还是主要从糖基生物质植物中通过理化工艺提取,但以位点选择性差向异构化反应为代表的从葡萄糖为原料生产稀有糖的化学法的巨大突破为工厂化大规模化学合成稀有糖提供了新的技术,今后如能再进一步提高转化效率、简化生产工艺,必将成为稀有糖的生产一种重要工艺。绿色生物合成是今后稀有糖生产的发展方向,今后的生产中可以尝试基于代谢工程的原理、通过基因编辑技术将不同来源高活性纤维素酶、淀粉酶和下游的己糖激酶、磷酸己糖异构酶、醛缩酶、醛(酮)糖醇氧化酶、己糖异构酶、多元醇脱氢酶等进行有机组合,构建出可以分别以纤维素、淀粉等多糖类糖基生物质为原料的高效稀有糖生产工艺。以葡萄糖等己糖为原料生产稀有糖的Izumoring策略可根据生产目的进行有机的组合,可以实现从L-葡萄糖等己糖原料到多种己糖稀有糖或糖醇自由切换,极大方便了生产者根据市场行情随时调整相应的生产工艺和产品类型,具有很高的生产应用价值。基于甘油等糖异生中间分子的稀有糖生物合成技术则可以将稀有糖生产的原料突破了糖基生物质的范围,衍生到可代谢产生这类小分子中间产物的脂肪、蛋白类原料,为稀有糖生产提供更大原料和代谢途径改造选择空间。今后应重点考虑将目前这些研究进展如何优化成适应工厂生产模式,可重点考虑解决上述相关酶的催化效率、催化活性稳定性、多酶体系组合优化、超级菌株构建及其稳定性、稀有糖分离纯化工艺优化(去蔗糖、葡萄糖残留)方面存在的问题,以提高稀有活性糖的转化效率、简化生产工艺、降低生产成本,满足人们日益增长的对稀有糖的需求。
