MiR-20a靶向调控MICA对乳腺癌细胞恶性生物学行为及IFN-γ和TNF-α的影响
2022-12-28白国栋王凯斌付泽华刘娟妮廖和和
白国栋,颜 谭,王凯斌,付泽华,刘娟妮,廖和和
(陕西省核工业二一五医院肿瘤外科,陕西 咸阳 712000)
全球每年新增乳腺癌患者约200万例,占所有新增肿瘤患者的11.6%,排名第一;每年死于乳腺癌的患者约60万例,占所有肿瘤死亡患者的18.4%,排名第四[1]。免疫抑制在肿瘤的发生和进展中发挥着重要的作用,Th1型免疫细胞可促进干扰素-γ(interferon-γ,IFN-γ)表达,以抑制乳腺癌细胞增殖[2]。自然杀伤(natural killer,NK)细胞可以靶向识别和清除肿瘤细胞。研究发现,活化的NK细胞可分泌大量IFN-γ和肺癌坏死因子-α(tumor necrosis factor-α,TNF-α),从而抑制乳腺癌进展[3]。
肿瘤细胞表面主要组织相容性复合体Ⅰ类链相关分子A(major histocompatibility complexclass I-chain related A,MICA)蛋白具有免疫调节的作用,MICA蛋白表达降低与乳腺癌细胞恶性生物学行为有关,而MICA蛋白表达升高可激活NK细胞和Th1细胞,清除肿瘤细胞[4]。微小RNA(microRNA,miRNA)不具备编码能力,但可以与信使RNA(message RNA,mRNA)靶向结合,并使其降解[5]。研究发现,miR-20a与肿瘤的发生密切相关,其可以增加乳腺癌的恶性程度及骨转移的风险[6]。此外,miR-20a也可以调控机体对乳腺癌细胞的免疫应答,但其相关机制仍不清楚。因此,本研究旨在分析miR-20a靶向调控MICA对乳腺癌细胞恶性生物学行为及IFN-γ和TNF-α的影响。
1 材料与方法
1.1 试剂和仪器
人乳腺癌细胞MCF-7(批号:AC-2338H)购自美国ATCC公司,DMEM培养基(批号:11965092)、胎牛血清(批号:10100147)和LipofectamineTM2000(批号:12566014)购自美国Invitrogen公司,miR-20a mimics(批号:C09001-20a)、miR-20a inhibitor(批号:C09004-20a)和阴性对照(批号:C06027)购自上海吉玛公司,miRNeasy Mini试剂盒(批号:217004)购自美国GE Healthcare公司,TaqMan miRNA试剂盒(批号:4427014)购自美国Thermo Fisher公司,MICA(批号:ab62540-MICA)和β-actin(批号:ab179467)抗体购自美国Abcam公司,基质胶(批号:356234)和Transwell小室(批号:338123)购自美国Corning公司,快速定点诱变试剂盒(批号:D0208S)、Renilla荧光素酶质粒(批号:RG062S)购自上海碧云天公司,荧光素酶报告试剂盒(批号:E1500)和1000 System检测仪购自美国Promega公司,Annexin V-FITC/PI细胞凋亡检测试剂盒(批号:E606336)购自上海生工公司,酶标仪购自美国Biotek公司,显微镜购自日本Olympus公司,FACSCalibur流式细胞仪购自美国BD公司,Odyssey曝光仪购自美国奥德赛公司。TNF-α(批号:EK-H12145)、IFN-γ(批号:EK-H12415)ELISA试剂盒均购自上海酶研生物科技有限公司。
1.2 细胞转染
将MCF-7细胞分为对照组、miR-20a mimics组、miR-20a inhibitor组。根据组别,采用LipofectamineTM2000将miR-20a mimics、miR-20a inhibitor和阴性对照质粒转入MCF-7细胞,具体方法如下:将MCF-7细胞种植于6孔板,当细胞密度达60%时,将LipofectamineTM2000和目的质粒加入培养基,转染16 h后,撤去含有质粒的培养基,并采用PBS清洗,然后收集目的细胞。
1.3 检测方法
1.3.1 RT-qPCR检测miR-20a表达 提取细胞总RNA,根据miRNeasy Mini试剂盒操作说明反转录生成cDNA,37 ℃ 15 min;85 ℃ 5 s。采用TaqMan miRNA试剂盒进行RT-qPCR,95 ℃预变性2 min,94 ℃变性20 s,58 ℃退火20 s,72 ℃延伸20 s,共40个循环。以U6作为内参,通过2-ΔΔCt法计算miR-20a相对表达水平。
1.3.2 CCK-8检测细胞增殖能力 转染细胞达到80%融合后,取各组细胞制备细胞悬液,每孔100 μL接种于96孔板中(细胞浓度为2×103个/孔),随后将96孔板置于细胞培养箱预培养24 h,至细胞融合为60%左右后,每孔加入10 μL CCK-8溶液,之后分别在细胞培养箱中孵育24 h、48 h。随后用酶标仪检测细胞 450 nm波长处光密度(optical density,OD)值。
1.3.3 Transwell实验检测细胞侵袭能力 细胞在无血清培养基中饥饿处理,随后向预先铺好基质胶(1∶8稀释)的Transwell上室中加入100 μL密度为5×105/mL的细胞溶液,24孔板Transwell小室下室加入600 μL完全培养基。24 h后,细胞用95%乙醇固定,0.1%结晶紫染色20 min。随后在显微镜下(×400倍)随机选取5个视野并计数。
1.3.4 ELISA检测IFN-γ和TNF-α水平 弃细胞培养基,使用蛋白裂解液吹打处理后的细胞,收集至1.5 mL无酶EP管,12 000 r/min离心20 min,收集细胞上清,按照检测试剂盒说明书进行操作,随后用酶标仪检测450 nm波长处的OD值。根据标准曲线计算细胞培养基中IFN-γ和TNF-α的浓度。
1.3.5 双荧光素酶报告检测miR-20a和MICA的靶向结合 在Starbase网站(http://starbase.sysu.edu.cn/index.php)获取MICA和miR-20a的碱基结合位点。野生型MICA(Wt-MICA)序列扩增到pGL4荧光素酶载体后,通过快速定点诱变试剂盒生成突变型MICA(Mut-MICA)。24孔板中每孔接种3×104个细胞,培养24 h。将1 μg Wt-MICA/Mut-MICA荧光素酶质粒通过LipofectamineTM2000转染细胞后,分别转染miR-20a mimics或阴性质粒。37 ℃孵育36 h,然后通过荧光素酶报告试剂盒检测荧光素酶活性,即相对光单位(relative light unit,RLU),将Renilla荧光素酶活性作为标准。
1.3.6 流式细胞仪检测细胞凋亡情况 收集1×106个细胞并用100 μL PBS重悬,根据Annexin V-FITC/PI细胞凋亡检测试剂盒说明书双染色15 min。使用FACSCalibur流式细胞仪评估细胞凋亡水平。
1.3.7 Western blot检测MICA蛋白表达 收集5×106个乳腺癌细胞,经裂解后提取总蛋白并检测浓度。加入SDS蛋白上样缓冲液,煮沸变性后,取20 μg蛋白样品加入12%预制胶,电泳,转膜。经5%脱脂奶粉封闭2 h,随后加入一抗MICA抗体(1∶500)或β-actin抗体(1∶2 000),4 ℃过夜。TBST洗涤3次,加入免疫荧光二抗(1∶5 000),室温孵育1 h。TBST洗涤后用Odyssey曝光仪检测,以β-actin做标准化处理,用Image J分析灰度值。
1.4 统计学处理
2 结果
2.1 MiR-20a的相对表达水平
MiR-20a mimics组的miR-20a相对表达水平显著高于对照组,miR-20a inhibitor组的miR-20a相对表达水平显著低于对照组(P<0.05),提示转染实验成功,见图1。
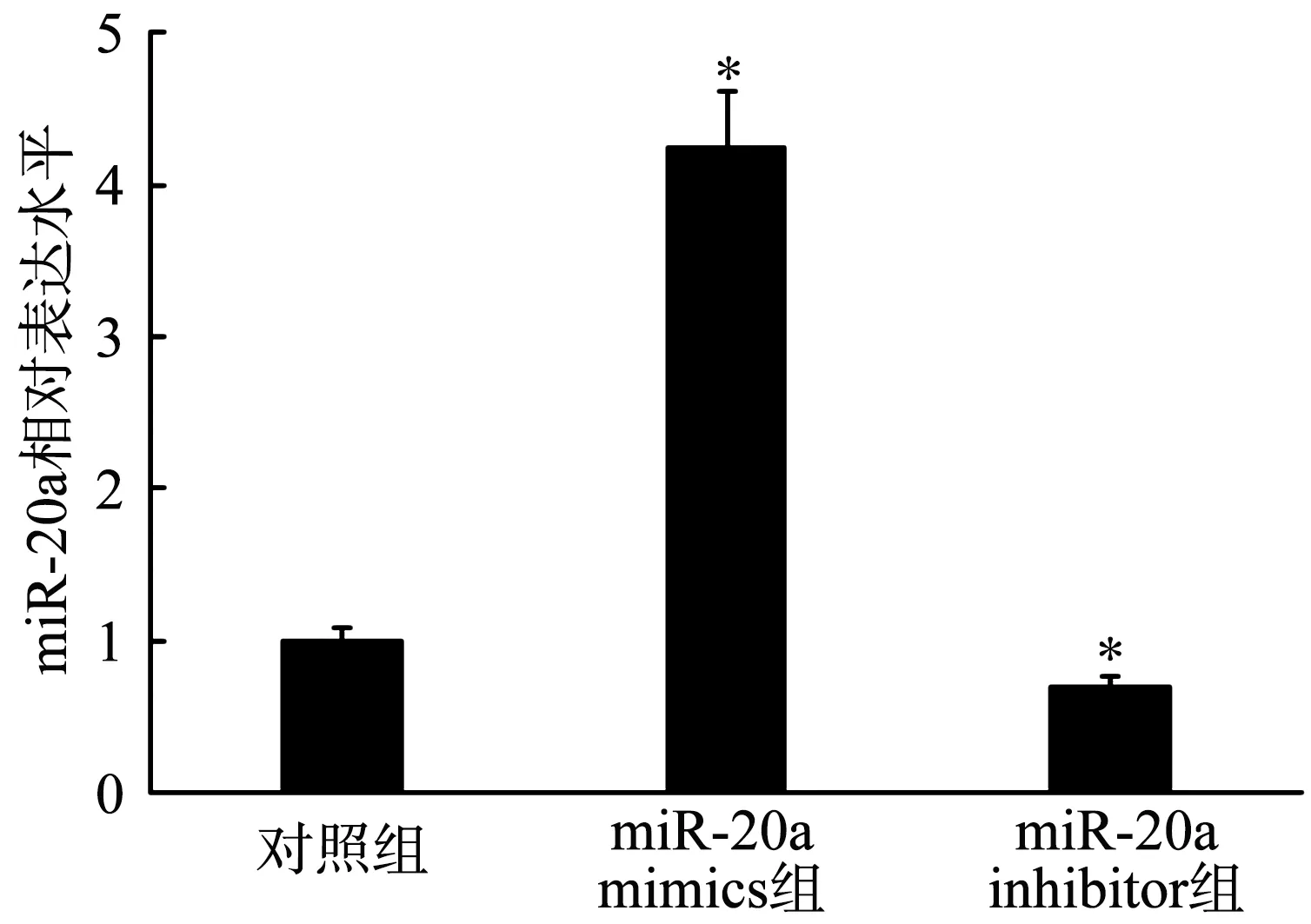
*:与对照组比较,P<0.05
2.2 MiR-20a对乳腺癌细胞增殖能力的影响
转染miR-20a mimics 24 h和48 h时MCF-7细胞的OD值均高于对照组(P<0.05),表明细胞增殖能力增强;而转染miR-20a inhibitor 24 h和48 h时其OD值则均低于对照组(P<0.05),表明细胞增殖能力减弱,见图2。此外,与对照组比较,miR-20a mimics组细胞数目显著增加(P<0.05),而miR-20a inhibitor组细胞数目显著减少(P<0.05),见图3。
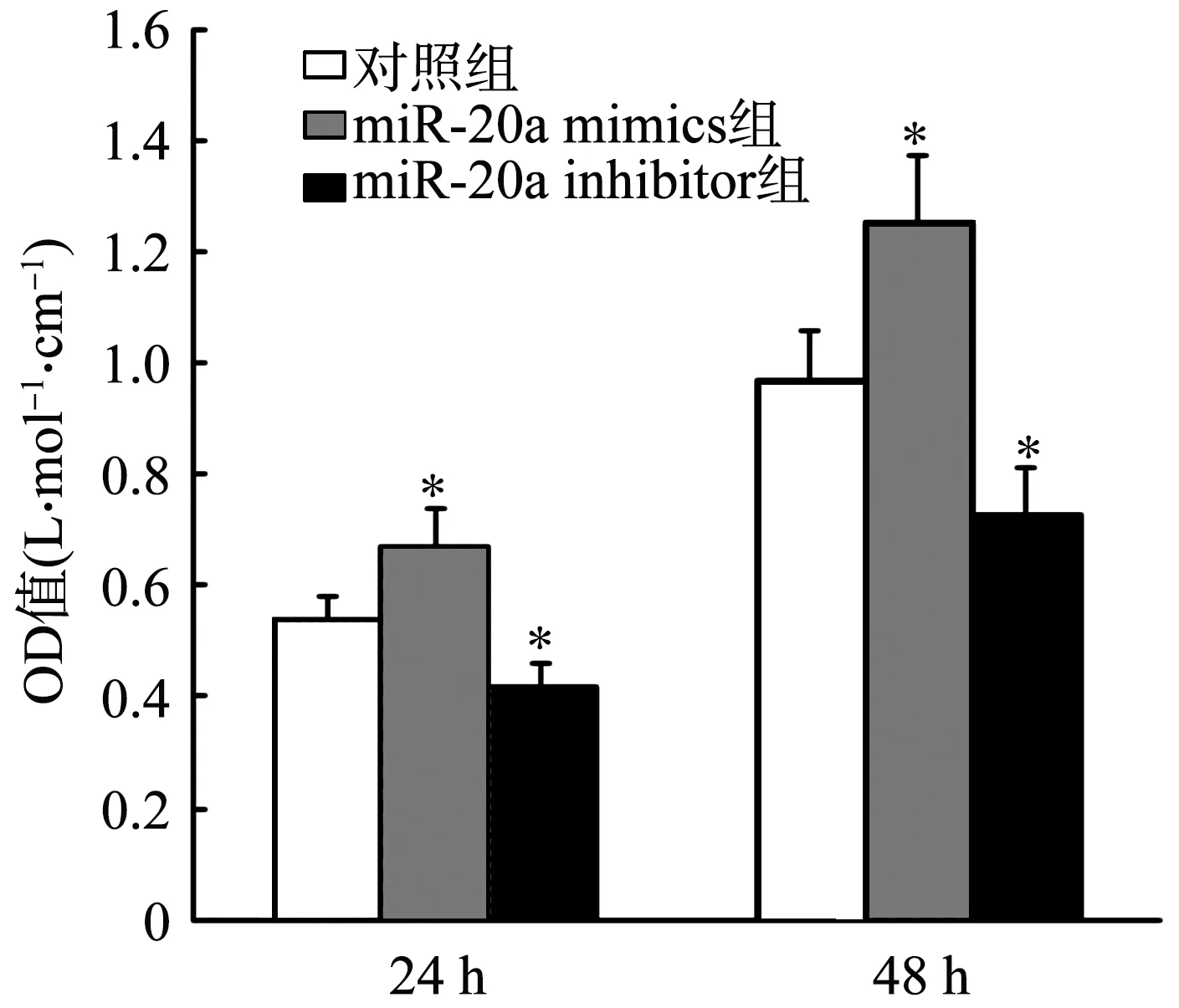
*:与对照组比较,P<0.05
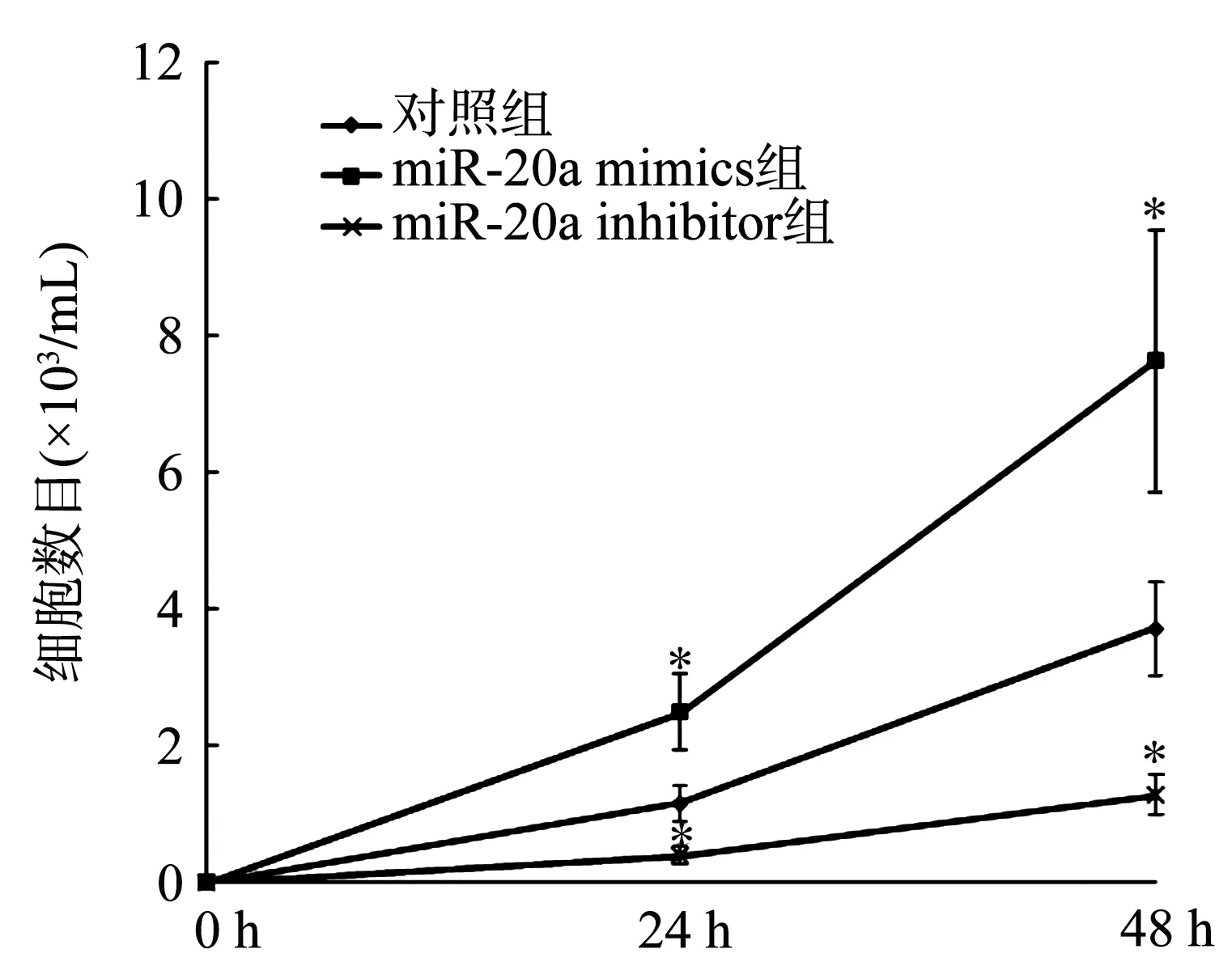
*:与对照组比较,P<0.05
2.3 MiR-20a对乳腺癌细胞侵袭能力的影响
与对照组比较,miR-20a mimics组侵袭细胞数目显著增加,miR-20a inhibitor组的侵袭细胞数目显著减少(P<0.05),见图4。
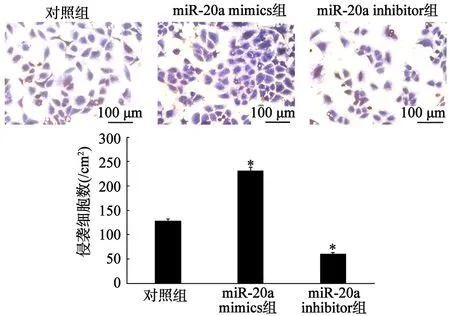
*:与对照组比较,P<0.05
2.4 MiR-20a对乳腺癌细胞IFN-γ和TNF-α表达水平的影响
MiR-20a mimics组的IFN-γ和TNF-α蛋白表达水平均显著低于对照组(P<0.05),miR-20a inhibitor组的IFN-γ和TNF-α蛋白表达水平均显著高于对照组(P<0.05),见图5。
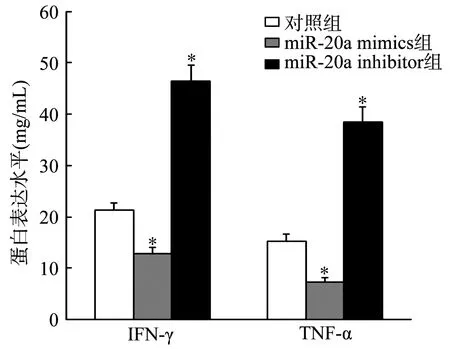
*:与对照组比较,P<0.05
2.5 MiR-20a对乳腺癌细胞MICA蛋白表达水平的影响
MiR-20a mimics组的MICA蛋白表达水平显著低于对照组(P<0.05),miR-20a inhibitor组的MICA蛋白表达水平显著高于对照组(P<0.05),见图6。
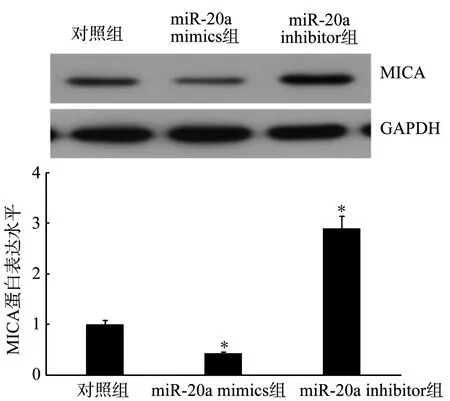
*:与对照组比较,P<0.05
2.6 双荧光素酶报告验证miR-20a与MICA的靶向关系
MiR-20a与MICA的靶向结合位点见图7。双荧光素酶报告结果显示,Wt-MICA和miR-20a mimics共同转染后,荧光素酶活性显著降低(P<0.05),见图8。提示miR-20a与MICA靶向结合。
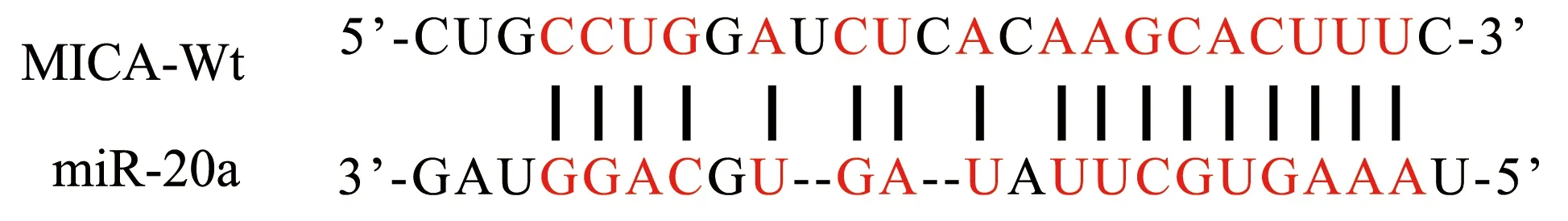
图7 MiR-20a与MICA基因的结合位点
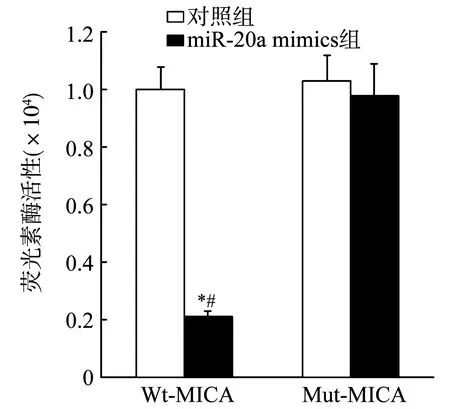
*:与Mut-MICA比较,P<0.05;#:与对照组比较,P<0.05
2.7 MiR-20a对乳腺癌细胞凋亡的影响
与对照组相比,miR-20a mimics组细胞凋亡率明显较低,miR-20a inhibitor组细胞凋亡率明显较高,差异均有统计学意义(P<0.05),见图9。

*:与对照组比较,P<0.05
3 讨论
乳腺癌是引起全球女性癌症死亡的首要原因之一,据统计,死于恶性肿瘤的女性中约有15%的病例死于乳腺癌[7]。化学疗法作为现阶段治疗晚期乳腺癌的主要方法之一,应用最为广泛,但是仍有部分患者对化学疗法不敏感。更重要的是,尽管化学疗法和激素疗法可取得令人满意的短期效果,但仍有20%的患者会在治疗后10年内出现肿瘤复发或转移[8]。因此,探究乳腺癌发生发展的机制对其治疗具有重要意义。
MiRNA可通过碱基配对识别并结合mRNA,进而诱导mRNA降解,或抑制mRNA翻译[9]。研究显示,miR-20a作为新发现的肿瘤相关miRNA,其在膀胱癌[10]、前列腺癌[11]、结直肠癌[12]等中均发挥着促癌作用。另有研究发现,miR-20a可促进乳腺癌细胞增殖和侵袭[13]。此外,miR-20a还具有促进免疫抑制的作用,其通过下调RUNX1蛋白的表达抑制NK细胞对宫颈癌细胞的杀伤作用,并抑制TNF-α和IFN-γ的表达[14]。本研究发现,过表达miR-20a可显著促进乳腺癌细胞的增殖、侵袭并抑制TNF-α和IFN-γ的分泌,而抑制miR-20a则会抑制乳腺癌细胞的增殖、侵袭,并促进TNF-α和IFN-γ的分泌,提示miR-20a参与乳腺癌细胞的恶性生物学行为并调控TNF-α和IFN-γ的分泌。
本研究还检测了MICA蛋白的表达水平,以探究miR-20a对乳腺癌细胞生物学行为的调控机制。MICA主要表达于胃上皮细胞、内皮细胞和成纤维细胞的表面以及单核细胞的细胞质中[15]。MICA可作为NK细胞活化性受体NKG2D的配体,能通过NKG2D途径调控免疫细胞的杀伤力,解除免疫抑制,从而发挥抗肿瘤作用[16]。研究显示,提高MICA的表达能够提高免疫细胞对乳腺癌细胞的杀伤力[17]。IFN-γ和TNF-α均是抑癌细胞因子,其在正常细胞中低表达,而上调IFN-γ和TNF-α的表达则对乳腺癌细胞具有抗增殖效应[18-19]。本研究结果显示,miR-20a高表达不但会促进乳腺癌的恶性生物学行为、诱导免疫抑制,还会显著抑制MICA蛋白的表达。而研究也表明,MICA高表达会通过促进IFN-γ和TNF-α的表达来解除免疫抑制,从而发挥抑癌作用[20-21]。本研究还通过双荧光素酶报告证实了miR-20a与MICA的靶向结合,这提示miR-20a可通过靶向抑制MICA蛋白的表达水平,从而促进免疫抑制水平,诱导乳腺癌细胞的恶性生物学行为。
综上所述,miR-20a可能通过靶向MICA蛋白促进乳腺癌细胞的增殖和侵袭,并抑制免疫促进因子IFN-γ和TNF-α的表达,这提示miR-20a可能成为乳腺癌的治疗靶点。然而,本研究也有一些不足之处,关于miR-20a靶向抑制MICA蛋白对乳腺癌的影响仍需要体内研究证实,miR-20a和MICA在乳腺癌患者中的临床意义也需要进一步分析。
