甘草对大鲵抗嗜水气单胞菌感染的作用
2022-12-21王文博李春颖孙盛雁黄雨莹刘屹楠鲁义善
王文博 曹 娟 李春颖 孙盛雁 黄雨莹 刘屹楠 鲁义善
(1.咸阳师范学院生命科学系, 咸阳 712000; 2.中国科学院水生生物研究所农业农村部淡水养殖病害防治重点实验室,武汉 430072; 3.中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072;4.广东海洋大学水产学院, 湛江 524088)
中国大鲵(Andrias davidianus)是国家二级重点保护物种, 野生大鲵多栖息在山区溪流里, 喜穴居,怕光怕声, 以鱼蟹等水生动物为食, 在陕西秦岭山区分布较多[1]。现存于世的大鲵有3个种, 分别是中国大鲵(A.davidianus)、美国大鲵(Cryptobranchus alleganiensis)和日本大鲵(A.japonicus)[2]。后两者在当地无论野生种还是养殖种均不能买卖, 只能进行保护, 因此没有形成人工养殖产业, 而中国大鲵允许人工繁殖的子二代进行交易, 已具备一定的产业规模。然而, 在养殖过程中由于病害的发生, 给养殖者带来了惨重的经济损失, 其中, 由嗜水气单胞菌引发的大鲵败血症是常见病害之一[3,4]。嗜水气单胞菌是常见的水生细菌, 自然水体中多有存在,但通常情况下并不会引起疾病, 只有当水生动物免疫力下降, 其才有可能通过消化道或者皮肤伤口感染机体, 引发败血症[4]。
因此, 如果能增强大鲵免疫细胞及免疫分子的活性, 提高其自身免疫力, 就可有效阻断嗜水气单胞菌的感染途径, 降低败血症的发病概率。中草药在我国资源丰富, 成本低廉, 且比较环保, 在水产养殖中得到了越来越多的应用[5]。除了亚洲国家, 欧美国家也有用草药成功控制鱼虾病害的报道[6,7]。然而, 在以上研究中, 中草药在水产养殖中的使用方法多为生药直接投喂, 没有对免疫活性成分进行提取、浓缩。来自家禽养殖业的报道认为, 甘草对机体具有免疫调节作用[8], 但尚未发现甘草对两栖动物大鲵抗败血症能力影响的报道。本研究对甘草有效成分进行针对性提取后开展了这方面探索。
1 材料与方法
1.1 实验材料
甘草(Glycyrrhiza uralensisFiseh)购自甘肃省武威市, 采用其根部切成圆片后提取有效成分。大鲵(Andrias davidianus)购自陕西省汉中市大鲵人工养殖场, 平均体重为(248.05±3.07)g。实验前在持续流动的山泉水养殖池中驯养1周, 投喂杂鱼及配合饲料。溶壁微球菌(Micrococcus lysodeikticus)和嗜水气单胞菌(Aeromonas hydrophila)购自道生试剂公司(陕西西安)。
1.2 药饵的制备
采用水提醇沉法提取工艺对甘草多糖及甙类化合物进行粗提[9]。甘草切片置10倍量95%酒精中, 60℃回流醇洗, 除杂。酒精废液60℃旋转蒸发,回收。药渣经蒸馏水浸提, 过虑, 弃药渣。水提液加乙醇以4000 r/min离心沉淀20min, 弃上清, 将离心所得浸膏蒸干, 研磨成粉, 4℃备存。将甘草粗提粉按0.5%和2%的质量分数与基础粉料混和, 制成颗粒饵料。其中, 基础粉料配比(占干物质%)为鱼粉30%、鱼油10%、豆粕20%、淀粉20%、麸皮15%、无机盐预混料4.5%和维生素预混料0.5%。
1.3 分组及采样
同源同批大鲵被随机分配到3个水泥池(每个容积约300 L)中, 分别为对照组、低剂量组和高剂量组。每个池50尾大鲵, 中间用隔板隔开, 用于平行实验, 均避光处理。对照组投喂无药饵料, 低剂量组投喂0.5%甘草饵料, 高剂量组投喂2%甘草饵料。
分别在投喂后第14、第28、第35、第42和第56天采样, 每次每池取10尾。对照组在实验之前(0d)采样。采样时, 先称量体重, 之后用一次性医用注射器于尾静脉抽血, 最后取脾脏称重。
1.4 免疫学检测
血清溶菌酶活性按Parry所述方法[10]进行。5 μL新鲜血清加入3 mL菌液中, 测定波长为540 nm。以1min内吸光值下降0.001为一个活性单位(U)。
肾脏巨噬细胞的吞噬活性肾脏巨噬细胞悬液按Secombes方法制备[11]。菌悬液按Thompson方法制备[12], 所不同的是菌株为嗜水气单胞菌, 而非A.salmonicidaMT004。操作方法按Rafiq等[13]所述。显微镜下观察计数200个巨噬细胞中吞噬嗜水气单胞菌的细胞数, 按下式求出吞噬百分率:
吞噬百分率(Phagocytic Percent, %)=(吞噬细菌的巨噬细胞数/200)×100%
白细胞比容将采集的血液样本装于肝素化的医用白细胞压积管中, 22℃ 2000 r/min 离心30min, 小心将压积管取出, 用游标卡尺测量白细胞压积的高度占全长的百分比, 即为白细胞比容(Leucocrit)。
脾脏脏器系数先对大鲵称量体重, 摘取脾脏, 用生理盐水稍加冲洗, 吸水纸吸干表面水分, 立即在电子称上秤重。脾脏重量与体重之比即为脾脏脏器系数(Spleen weight index)。
人工感染实验将两次活化后的嗜水气单胞菌用0.5%的生理盐水洗脱菌苔, 先进行倍比稀释进行预实验, 选择能显示出组间差异的浓度, 用分光光度计精确调配, 确定终浓度为3×106CFUs/mL。在最后一次采样后, 每尾腹腔注射5 mL, 观察1周,统计死亡率和免疫保护率。死亡率(Mortality rate)=(死亡尾数/受试尾数)×100%; 免疫保护率(Relative percent survival, %)=(1–免疫组死亡率/对照组死亡率)×100%。
1.5 统计方法
实验数据表示为平均值±标准差(X±SD), 学生t检验(Student’st-test)对结果进行分析, 当P<0.05时认为有显著差异, 当P<0.01时认为有极显著差异。
2 结果
2.1 血清溶菌酶活性测定结果
如图1所示, 从28d开始, 药物组先升后降, 呈抛物线趋势, 低剂量组在42d出现最大值(158.4±34.7)U/mL, 高剂量组在35d出现最大值(178.3±28.8)U/mL,两者都显著高于同期对照组(P<0.05)。
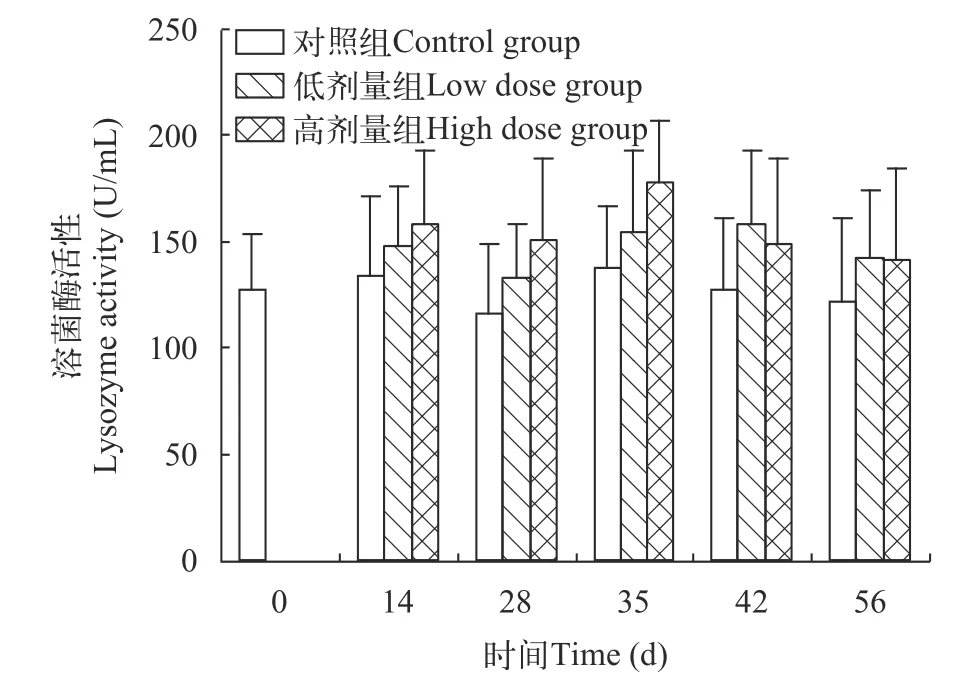
图1 投喂甘草提取物对大鲵血清溶菌酶活性的影响Fig.1 Effect of feeding of G.uralensis Fiseh extract on lysozyme activity in A.davidianus serum
2.2 吞噬实验结果
如表1所示, 药物组在最后两次采样期, 即42d和56d时, 吞噬活性显著高于对照组(P<0.05)。低剂量组和高剂量组最大值均出现在42d, 分别为(59.4±8.5)%和(58.4±5.2)%。
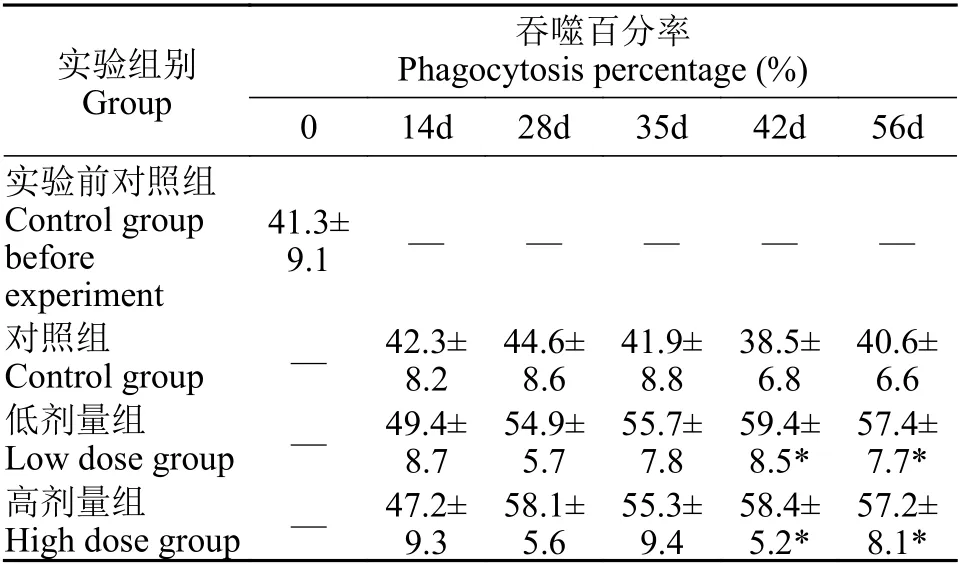
表1 投喂甘草提取物对大鲵肾脏巨噬细胞吞噬活性的影响Tab.1 Effect of feeding of G.uralensis Fiseh extract on phagocytic activity of macrophages in A.davidianus kidney
2.3 压积实验结果
与同期相比, 药物组白细胞比容值均高于对照组(表2)。其中, 高剂量组在28d时白细胞比容值为(5.8±1.7)%, 低剂量组在56d时为(5.5±0.8)%, 高剂量组在56d时为(5.9±1.7)%, 三者都显著高于同期对照组(P<0.05)。
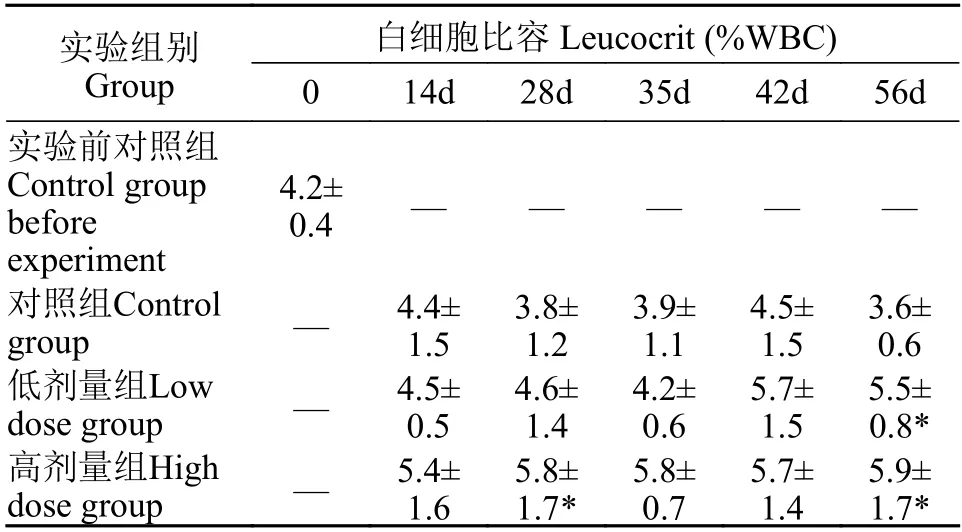
表2 投喂甘草提取物对大鲵白细胞比容的影响Tab.2 Effect of feeding of G.uralensis Fiseh extract on leucocrit value of A.davidianus
2.4 脾脏脏器系数测定结果
如表3所示, 药物组和对照组的脾脏脏器系数之间没有显示出显著差异。

表3 投喂甘草提取物对大鲵脾脏脏器系数的影响Tab.3 Effect of feeding of G.uralensis Fiseh extract on spleen weight index of A.davidianus
2.5 攻毒实验结果
如表4所示, 最后一次采样(56d)后人工感染嗜水气单胞菌, 对照组死亡率为90%, 低剂量组和高剂量组都为60%, 均低于对照组, 而药物组免疫保护率为33.3%, 也都高于对照组。

表4 投喂甘草提取物对大鲵感染嗜水气单胞菌后死亡率的影响Tab.4 Effect of feeding of G.uralensis Fiseh extract on mortality rate of A.davidianus induced by A.hydrophila infection
3 讨论
大鲵病害病原主要有病毒、细菌和寄生虫, 如虹彩病毒(A.davidianus iridovirus)可致大鲵大脚病,嗜水气单胞菌(A.hydrophila)可致大鲵败血症, 复口吸虫(Diplostomulum hupehensis)可致大鲵白内障[14]。其中, 嗜水气单胞菌是最为常见的水生机会致病菌,具有普遍性, 因此本研究用它进行攻毒试验。嗜水气单胞菌属弧菌科(Vibrionaceae)、气单胞菌属(Aeromonas), 是一类能运动的气单胞菌[15], 能引起多种水生动物的败血症, 其中也包括大鲵[16]。嗜水气单胞菌可通过皮肤和肠道入侵机体, 定植于皮肤及肠道细胞, 然后大量繁殖, 吸取宿主营养, 致使机体抵抗力下降。嗜水气单胞菌的致病性和它的毒力基因密切相关。研究表明, 嗜水气单胞菌的溶血素、外膜蛋白及丝氨酸蛋白酶等都是重要的毒力基因[17]。嗜水气单胞菌一经进入机体, 就会在不同的组织细胞内定植、增殖后产生外毒素, 在各种毒力因子的作用下, 对大鲵机体造成损伤。受感染的病鲵通常表现为体表黏液增多, 肝脏、肾脏、胰脏和肺出现肿大, 肌肉、肠道和胃等均出现不同程度的充血和出血, 腹部胀大且有积水, 并伴随溶血[18],严重影响大鲵的能量代谢, 破坏内环境稳态, 降低大鲵的免疫能力, 最终造成其死亡。因此, 嗜水气单胞菌是大鲵养殖过程中重要的致病菌, 危害极大,急需找到有效的防治手段。
非特异性免疫反应也称为先天性免疫反应, 是机体抵抗病原体攻击的第一道防线, 在预防感染和激活特异性免疫反应方面起着至关重要的作用。当病原体入侵机体时, 它们将面对一系列免疫细胞和免疫分子, 这些细胞和分子相互作用并启动炎症反应。其中, 免疫细胞包括单核细胞、巨噬细胞、中性粒细胞、非特异性细胞毒性细胞、自然杀伤细胞和肥大细胞等。免疫分子包括溶菌酶、补体、转铁蛋白、干扰素、抗蛋白酶和C反应蛋白等[19]。血清溶菌酶活性、巨噬细胞吞噬活性、白细胞比容、脾脏脏器系数等指标是检测机体免疫机能, 尤其是非特异性免疫机能较为典型的指标[9], 涉及免疫因子、免疫细胞和免疫器官三个层面, 人工感染实验是对最终免疫保护效果的验证, 因此本研究所选指标具有代表性。溶菌酶大量存在于鱼类的血清和黏液中, 通过破坏革兰氏阳性和阴性菌的细胞壁, 导致其溶解从而发挥杀菌作用。血清溶菌酶活性被认为是评估各种免疫增强剂的免疫效果的重要标志之一[20]。有研究表明[21], 在中华鳖(Peiodiscus sinesis)稚鳖饲料中添加甘草素, 不仅提高了中华鳖血液溶菌酶活性和白细胞吞噬活性, 从而促进了其免疫应答水平, 还改善了肝功能, 增强了抗嗜水气单胞菌感染的能力, 对生长也有一定的促进作用。这与本实验中甘草对大鲵的作用结果大致相同。在本实验中, 甘草在一定程度上提高了大鲵血清溶菌酶活性、白细胞数量及对嗜水气单胞菌的免疫保护率, 但是对免疫器官脾脏没有显示出明显的促进作用。类似的报道还有, 中药醇提液通过调节 S1、ATPase-β、isocitrate lyase 和 NSE 这 4 种代谢酶的表达而抑制了嗜水气单胞菌的生长, 为中药作为饲料添加剂应用于水产养殖提供了理论依据[22]。同样, 甘草作为饲料添加剂也提高了罗非鱼(Oreochromis niloticus)溶菌酶活性和抗体水平, 提高了对嗜水气单胞菌感染的抗性, 使其致死率降低,表明甘草对提高鱼的免疫应答有一定作用[23]。此外, 甘草可与包括单核细胞、中性粒细胞、巨噬细胞和淋巴细胞在内的免疫细胞相互作用, 以增强机体的先天免疫, 并可通过增加白细胞计数来增强非特异性免疫力[23], 这些都与本实验结果相吻合。然而, 需要指出的是, 和其他中药材一样, 甘草在水产实践上的应用也存在一些问题, 比如药材质量不稳定、使用方法粗放、规范化药方少及命名和描述不准确等, 因此, 应当尽早健全和规范其质量标准,使用方法精细化, 加强精方和专方的研制, 规范水产应用术语[5]。
蛋白质是构成生命的物质基础, 参与几乎所有的生命活动。而蛋白质的产生是由遗传物质DNA或RNA指导的, 它们具有一定的稳定性, 通过控制蛋白质的合成来控制机体的生命代谢活动, 包括生长、发育、遗传与变异等生命过程。因此, 中草药可通过影响菌体DNA的自我复制, 来间接影响着蛋白质的合成, 最终使菌体生长受到抑制[24]。另一方面, 在机体的非特异性免疫防御功能方面, 溶菌酶、白细胞和巨噬细胞都是极其重要的免疫分子和免疫细胞, 它们都可通过溶解或者吞噬外来病原菌, 从而起到杀伤作用, 有效保护机体。那么, 在本实验中, 甘草提高了大鲵受嗜水气单胞菌感染后的存活率, 同时, 大鲵血清溶菌酶活性、白细胞数量和巨噬细胞吞噬活性都有所升高, 它们之间是否存在关联? 大鲵存活率的提高是由于这几项指标的提高造成的还是由于前面所说, 中草药影响了菌体的DNA的合成从而影响了菌体蛋白的合成而造成的? 这些问题还有待进一步研究。
