桑蚕丝胶/柞蚕丝素/明胶基共混抗菌膜的制备及表征
2022-12-16陈文凯冼俊思钟杨生陈芳艳
陈文凯, 王 新, 冼俊思, 钟杨生, 陈芳艳
(华南农业大学 动物科学学院,广州 510642)
感染是导致伤口修复效率较低甚至失败的主要原因[1-2],因此,开发具有抗菌、抗感染的多功能生物材料是生物医学研究的持续目标。临床上常利用胶原蛋白、丝素蛋白、壳聚糖等医用生物材料作为基料,这些基料能够在分子、细胞和个体水平上加速伤口的愈合,其降解产物为安全无毒的氨基酸、糖类等物质[3-5]。柞蚕丝素、桑蚕丝胶和明胶三种材料均具有良好的生物相容性、可降解性和成膜性,有利于细胞的黏附和增殖,安全无毒而且来源广泛。三种材料各有独特的优势,明胶(GEL)是胶原蛋白水解产物,含有亚氨基、醛基等活性极强的基团,易发生交联,成膜性好,但其力学强度低,需与其他材料复合使用[6-8]。柞蚕丝素蛋白由于富含天然的精氨酸-甘氨酸-天门冬氨酸(RGD)三肽序列,特别有利于动物细胞的黏附和生长[9-11]。与丝素蛋白相比,丝胶蛋白含亲水性氨基酸较多,具有较强的吸水能力,可防止水分流失,具有促进胶原增殖和迁移的能力,并且对革兰氏阳性菌和阴性菌均有较理想的抑菌效果[12-14]。由于丝素、丝胶中丝氨酸的醇羟基、酪氨酸的酚羟基、赖氨酸的氨基、组氨酸的咪唑基等都具有活泼H的基团,可通过与聚乙二醇、戊二醛等交联剂交联成具有一定力学性能的生物材料[15-17]。虽然戊二醛交联效果好,但是它有基因毒性和诱变的潜在危害[18],相比之下,聚乙二醇在安全性方面更有优势[19]。
抗菌性能对生物基材料的应用十分重要。然而,大多数的生物基材料本身不具备抗菌性能或抗菌能力较弱,因此,通过不同的抗菌剂修饰,可以有效提高生物材料的抗菌性能。目前用于制备抗菌生物材料的抗菌剂主要有黄酮类、多酚类、蒽醌类、季铵盐类、抗生素类及溶菌酶等有机抗菌剂[20-23]和Ag、Zn、TiO2、石墨烯等无机抗菌剂[24-27]。医药领域的生物抗菌材料更趋向于选择具有优异抗菌杀菌能力、不产生耐药性、进而能够广谱抗菌、生物低毒/无毒的抗菌剂[28]。抗菌肽(Antimicrobial peptides,AMPs)是一类相对分子质量小的多肽,作为天然高效抗菌剂,是替代传统抗生素最有潜力的新型药物[29-30]。它具有抗菌谱广、特异性高、耐药性极低的特点,对多种耐药菌具有杀伤作用,而且热稳定性和水溶性好,对高等动物的正常细胞几乎无毒害作用,在生物医药领域具有一定的优势[31]。
因此,本研究选用柞蚕丝素蛋白、明胶和桑蚕丝胶蛋白作为生物膜的基材,以聚乙二醇为交联剂,首先探讨桑蚕丝胶/柞蚕丝素/明胶基共混膜的制备方法,并通过单因素和正交试验优化配方,在此基础上,通过吸附的方式载入AMPs,获得抗菌生物膜。本研究拓宽了蚕丝的应用领域,可为蚕丝蛋白在生物敷料等医用抗菌生物材料研制和开发提供新的途径。
1 试 验
1.1 材料及仪器
材料:柞蚕茧壳(辽宁省蚕业科学研究所),桑蚕茧壳(华南农业大学蚕丝科学系),抗菌肽(Mw=2 512 Da)(华南农业大学蚕丝科学系蚕桑资源利用实验室),活性检测指示菌希埃氏大肠杆菌(K12D31)、金黄色葡萄球菌(SA)(华南农业大学蚕丝科学系蚕桑资源利用实验室)。
试剂:硝酸钙和明胶(广州化学试剂厂),碳酸钠(天津大茂化学试剂厂),聚乙二醇200(PEG 200)(广州金华大化学试剂有限公司),无水乙醇(乙醇含量≥99.7%)(上海凌峰化学试剂有限公司),均为分析纯;透析袋(Mw=8~10 kDa)(上海源叶生物科技有限公司)。
仪器:AGS-X型万能机械测试机(日本Shimadzu公司),VERTEX型傅里叶变换红外光谱仪(德国BRUKER公司),XRD-6100型X-射线衍射仪(日本Shimadzu公司),XL-30-ESEM型扫描电子显微镜(荷兰FEI公司),UV-1800型紫外分光光度计(日本Shimadzu公司)。
1.2 方 法
1.2.1 桑蚕丝胶溶液的制备
称取桑蚕茧壳10 g,置于500 mL圆底烧瓶中,然后加入120 mL蒸馏水,于100 ℃冷凝回流提取30 min后过滤,收集滤液,得到质量浓度为4.50 μg/mL丝胶溶液,4 ℃下保存备用。
1.2.2 柞蚕丝素溶液的制备
称取柞蚕茧壳10 g,置于含500 mL 1% Na2CO3的烧杯中,于100 ℃的条件下搅拌15 min;脱胶结束后,用60 ℃蒸馏水冲洗干净,以上过程重复3次,得到脱胶柞蚕丝素;最后将其在75 ℃条件下干燥2.5 h,扯松,获得网状丝素纤维。然后,参照肖露等[33]的方法制备柞蚕丝素溶液。首先称取180 g的硝酸钙于烧杯中,80 ℃下搅拌30 min后,得到熔融的硝酸钙,用量筒量取100 mL熔融的硝酸钙,置于圆底烧瓶中;然后加入10 g剪碎的柞蚕丝素纤维,放置于油浴锅中,加热到120 ℃并搅拌2 h,得到柞蚕丝素溶液,待其冷却后,装入截留相对分子质量为8~10 kDa的透析袋中,透析除盐,得到质量浓度为27.5 mg/mL柞蚕丝素溶液,置于4 ℃下储藏备用。
1.2.3 蛋白质含量的测定
按Bradford法测定丝胶蛋白和丝素蛋白的含量[33],并以牛血清白蛋白为标准蛋白质。
1.2.4 桑蚕丝胶/柞蚕丝素/明胶基(BS-TSF-GEL)共混膜制备单因素试验
称取3.6 g明胶粉末,加入到6.4 mL蒸馏水中,磁力搅拌至完全溶解,配制温度为60 ℃,静置除去气泡,制得质量浓度为360 mg/mL的明胶溶液。量取一定体积的桑蚕丝胶(4.50 μg/mL)、柞蚕丝素(27.5 mg/mL)、明胶(360 mg/mL)溶液和聚乙二醇200(质量分数100%)交联剂,室温下混合均匀后,取5 mL混合液倒入直径6 cm的培养皿中,在温度为30 ℃的条件下,放置48 h,成膜后浸泡于一定质量分数的乙醇中处理24 h,在通风橱中自然干燥即可得到BS-TSF-GEL共混膜。设置单因素试验考察丝胶、丝素、聚乙二醇、明胶溶液的添加量对共混膜溶失率的影响。
1)桑蚕丝胶与柞蚕丝素体积比对BS-TSF-GEL共混膜溶失率的影响。将丝胶与丝素溶液分别按体积比3︰0、2.5︰0.5、2︰1、1.5︰1.5、1︰2、0.5︰2.5、0︰3的比例混合,得到体积比不同的丝胶/丝素混合液,分别取3 mL不同体积比的丝胶/丝素混合液于烧杯中,再依次加入3 mL聚乙二醇200和1.5 mL明胶溶液,固定丝胶/丝素混合液占整个体系的比例为40%。成膜后测定不同丝胶、丝素体积比对共混膜溶失率的影响。
2)聚乙二醇200添加量对BS-TSF-GEL共混膜溶失率的影响。依次吸取0.000、0.500、1.125、1.930、3.000、4.500、6.750 mL的聚乙二醇200于烧杯中,然后加入3 mL体积比为2︰1的丝胶/丝素混合液,1.5 mL明胶溶液,使聚乙二醇200占整个体系的比例分别为0、10%、20%、30%、40%、50%、60%。成膜后测定聚乙二醇200添加量对共混膜溶失率的影响。
3)明胶添加量对BS-TSF-GEL共混膜溶失率的影响。依次吸取0.00、0.32、0.67、1.06、1.50、2.00、2.57 mL明胶溶液于烧杯中,再依次加入3 mL体积比为2︰1的丝胶/丝素混合液,3 mL聚乙二醇200,使明胶溶液占整个体系的比例为0、5%、10%、15%、20%、25%、30%。成膜后测定明胶添加量对共混膜溶失率的影响。
1.2.5 BS-TSF-GEL共混膜制备的正交试验
根据上述单因素试验结果,综合考察丝胶与丝素体积比、聚乙二醇200和明胶添加量三因素对BS-TSF-GEL共混膜溶失率的影响,设计L9(33)正交试验,如表1所示。

表1 正交试验因素与水平Tab.1 Orthogonal test factors and levels
1.2.6 乙醇质量分数对BS-TSF-GEL共混膜溶失率的影响
取6块上述最优配方条件下制备的BS-TSF-GEL膜,分别置于质量分数为60%、70%、80%、90%、100%的乙醇中浸泡24 h后取出,待乙醇挥发后,测定共混膜的溶失率。
1.2.7 BS-TSF-GEL共混膜溶失率测试方法
溶失率的测定参考谢瑞娟等[34]的方法,并作适当改进。将采用同一方法制备的膜平分为质量相同的两份,一份在100 ℃的烘箱中烘至恒重后,在50%相对湿度下平衡48 h,称取质量(Wi);另一份在37 ℃的PBS中以1 (g)︰30 (mL)的浴比振荡1 h,收集余膜,置于100 ℃烘箱中烘至恒重,50%相对湿度下平衡48 h后,称取质量(Wt)。溶失率测试重复3次,溶失率(R)计算公式如下:
(1)
式中:Wi为初始样品的干重,g;Wt为样品溶失率测试结束后的干重,g。
1.2.8 扫描电子显微镜(SEM)分析
将BS-TSF-GEL膜切割成5 mm×5 mm大小,临界点干燥,放置在导电胶上,然后覆盖金薄层。使用扫描电子显微镜对BS-TSF-GEL膜的微观形貌进行分析。
1.2.9 拉伸性能测试
将BS-TSF-GEL共混膜切割成20 mm×10 mm大小,厚度为3.2 mm的标准长条形试样,在50%的相对湿度下平衡48 h,按照GB/T 1040—2006《塑料 拉伸性能的测定》标准,使用万能材料试验机以10 mm/min的恒定速率进行拉伸测试。
1.2.10 傅里叶变换红外光谱(FTIR)测试
利用傅里叶变换红外光谱仪的ATR附件,以空气为背景测定BS-TSF-GEL膜的红外光谱。扫描范围400~4 000 cm-1,分辨率为4 cm-1,扫描次数16次。用OPUS软件对波数在1 600~1 700 cm-1内的图谱进行剪切,之后进行二阶求导,作为分峰位置的参照;再退卷积处理,各子峰的峰位由二阶导数图谱确定;再对图谱进行谱线拟合,得到曲线拟合数值,统计α螺旋、无规卷曲、β折叠和β转角结构含量。
1.2.11 X-射线衍射分析(XRD)
利用日本岛津XRD-6100型射线衍射仪测定BS-TSF-GEL共混膜的X射线衍射谱。参数设定:管电流40 mA,管电压40 kV,铜靶,λ=15.406 nm,扫描范围2θ=5°~45°,扫描速度3 (°)/min。
1.2.12 BS-TSF-GEL共混抗菌膜的制备
将BS-TSF-GEL共混膜分别浸泡于质量分数为0.062 5%、0.125 0%、0.250 0%、0.500 0%、1.000 0%的抗菌肽溶液中,30 min后取出,用蒸馏水将吸附在膜表面的抗菌肽冲洗干净,风干后获得抗菌膜。
1.2.13 抗菌性能测试
采用Kirby-Bauer扩散法[35]对载有抗菌肽的BS-TSF-GEL共混膜进行抗菌能力评价。以革兰氏阳性菌(金黄色葡萄球菌SA)和革兰氏阴性菌(希埃氏大肠杆菌K12D31)为指示菌。
将灭菌后的LB培养基置于室温,待其冷却至48~50 ℃时,向100 μL无菌LB培养基中加入8 μL浊度为1×108cfu/mL的菌液(金黄色葡萄球菌SA或希埃氏大肠杆菌K12D31),摇匀。吸取含菌LB培养基15 mL,均匀摊平在60 mm培养皿底部,放置在超净工作台的台面上使其冷却凝固后,将直径为2.5 mm的抗菌膜铺在LB培养基表面,静置30 min后,于37 ℃恒温培养箱中,倒置培养过夜,观察并用游标卡尺测量抑菌圈直径,记录数据。
1.2.14 数据处理与统计分析
试验数据经Excel 2007整理后,用SPSS 24.0软件完成统计,得到平均数±标准差(X±S)。
2 结果与分析
2.1 BS-TSF-GEL共混膜制备
2.1.1 BS-TSF-GEL共混膜制备的单因素条件优化
溶失率通常用来评价生物医学材料在体内和体外的稳定性[36-37]。本试验首先设置了7个体积比不同的丝胶/丝素混合液制备共混膜,探究丝胶/丝素溶液体积比对共混膜溶失率的影响,结果如图1所示。
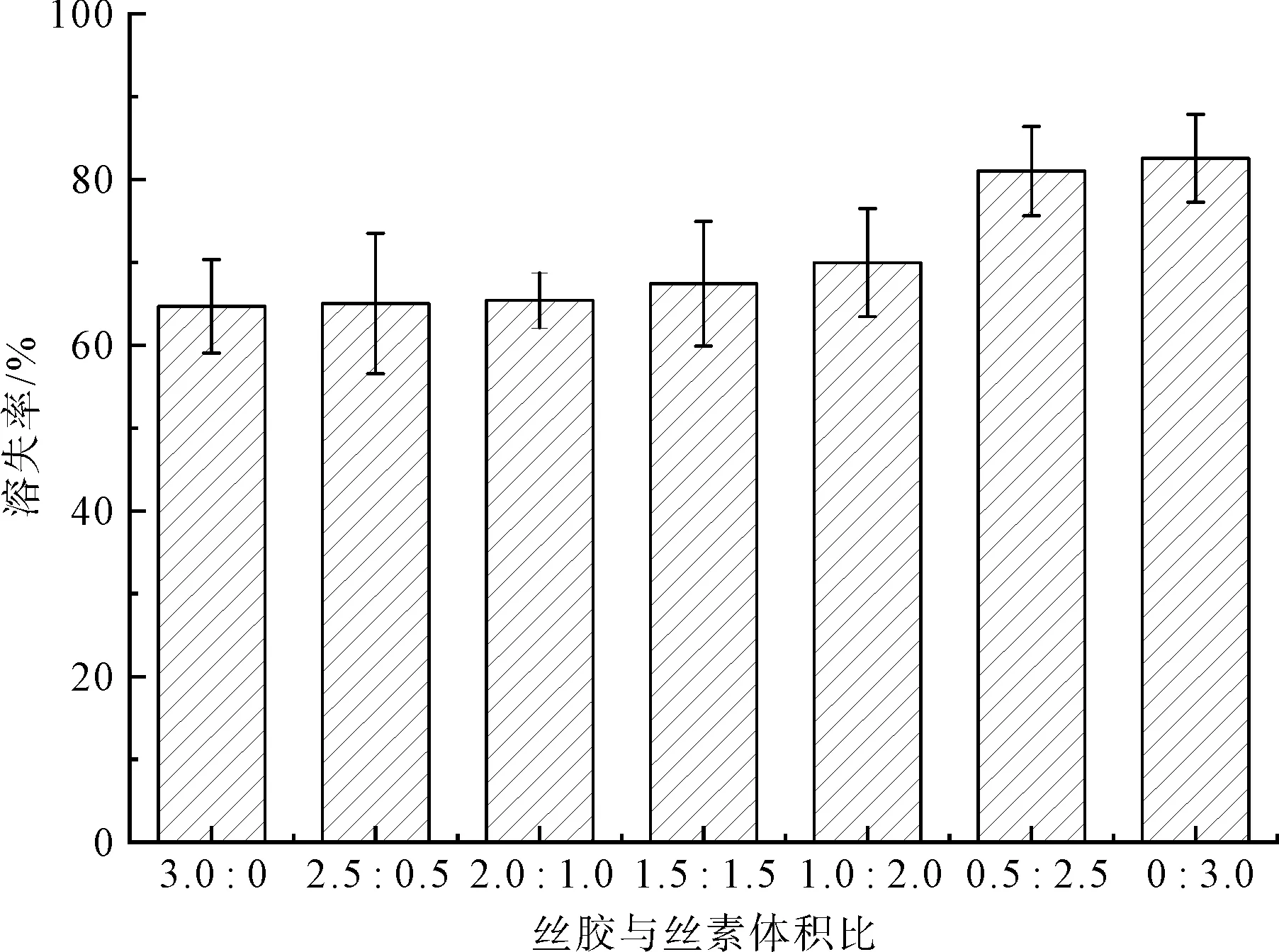
图1 桑蚕丝胶/柞蚕丝素体积比对BS-TSF-GE共混膜溶失率的影响Fig.1 Effect of volume ratio of bombyx mori sericin and tussah silkfibroin on the dissolution rate of BS-TSF-GE blended films
当丝胶与丝素体积比低于2︰1时,膜的溶失率保持在65%左右,变化不大;当丝胶与丝素体积比达到2︰1后,继续增加柞蚕丝素溶液比例,共混膜的溶解率开始随着丝素含量的增加而提高,这一变化趋势与马芳等[15]研究结果一致。这是因为丝素分子之间主要以氢键结合,在水溶液中丝素大分子之间的氢键易被水与丝素大分子形成的氢键取代,所以容易溶解[36]。因此,考虑柞蚕丝素在细胞促生长方面优异的生物学特性,本研究将丝胶与丝素体积比确定为2︰1。
在确定丝胶与丝素体积比后,考察聚乙二醇200添加量对共混膜溶失率的影响,结果如图2所示。由图2可知,随着聚乙二醇200添加量的增加,共混膜的溶失率呈现先下降后上升的趋势。当聚乙二醇200添加量为40%时,共混膜的溶失率最低(63.44%)。聚乙二醇的两个活泼羟基容易与丝素、丝胶的氨基酸残基中的活泼基团发生交联反应,从而增加共混膜的稳定性[36]。但聚乙二醇200添加到一定量后,膜的溶失率上升,这可能是由于聚乙二醇较强的亲水性所致。因此,聚乙二醇200添加40%较为适宜。

图2 聚乙二醇200添加量对BS-TSF-GE共混膜溶失率的影响Fig.2 Effect of polyethylene glycol 200 concentration on thedissolution rate of BS-TSF-GE blended films
探究明胶添加量对共混膜溶失率的影响,结果如图3所示。共混膜的溶失率随着明胶添加量的增大呈现显著降低,最后趋于稳定。当明胶溶液添加量为20%时,溶失率为61.74%。由于丝素和丝胶的等电点低于7.0,而明胶等电点大于7.0,在pH 7.0的环境中,丝胶、丝素和明胶带相反的电荷,正负电荷相互作用,有利于交联[38]。

图3 明胶添加量对BS-TSF-GE共混膜溶失率的影响Fig.3 Effect of gelatin concentration on the dissolutionrate of BS-TSF-GE blended films
2.1.2 BS-TSF-GEL共混膜制备的正交试验条件优化
通过设置正交试验进一步优化BS-TSF-GEL共混膜各组分间的配比,正交试验结果如表2所示。从表3的极差分析可知,3个因素影响BS-TSF-GEL共混膜溶失率的主次为:桑蚕丝胶与柞蚕丝素体积比(A)>PEG 200质量分数(B)>明胶质量分数(C)。对应的最优配方是A2B3C2,即体积比为2︰1的丝胶/丝素溶液、聚乙二醇200、明胶溶液,它们分别占总体系的35%、40%和25%。为了进一步验证最佳组合A2B3C2的真实性,进行了3次重复表征试验,BS-TSF-GEL共混膜的平均溶失率为(59.19±1.23)%。

表2 正交试验结果Tab.2 Orthogonal test results

表3 极差分析结果Tab.3 Range analysis results
2.2 BS-TSF-GEL共混膜稳定性及拉伸性能优化
现有的研究表明,乙醇处理可有效改善丝素蛋白结构和功能特性,同时,乙醇是对丝素蛋白材料水不溶性处理的有效手段[15,39]。为进一步提高BS-TSF-GEL共混膜的稳定性,本研究将膜浸入不同质量分数乙醇中浸泡处理,对膜的性能进行优化,检测膜的溶失率,结果如图4所示。

图4 不同质量分数乙醇处理对BS-TSF-GEL膜溶失率的影响Fig.4 Effect of different concentrations of ethanol treatment onthe dissolution rate of BS-TSF-GEL blended films
由图4可知,随着乙醇质量分数升高,溶失率呈现下降趋势;但溶失率下降的幅度随着乙醇质量分数的增加而变小,当乙醇质量分数达到90%时,继续增加乙醇质量分数膜的溶失率下降不显著。这可能是因为经过一定质量分数的乙醇处理后共混膜中蛋白大分子的结构趋向稳定,此后膜的溶失率随乙醇质量分数变化很小。乙醇质量分数为100%时,溶失率为34.62%,与未经乙醇处理的共混膜相比,膜溶失率降低了24.57%。
测定60%~100%乙醇处理后的BS-TSF-GEL共混膜的力学性能,结果如图5所示。随着乙醇质量分数的升高,膜的断裂伸长率逐渐减小,断裂强度逐渐增加。乙醇质量分数为100%时,膜的断裂强度最高,为578.8 kPa,此时断裂伸长率可达到34.15%,优于桑蚕丝的平均断裂伸长率(15%~25%)。因此,选择100%为最优处理质量分数,由于乙醇可以增强蛋白大分子多肽链之间的部分氢键和范德华力,诱导蛋白质从α螺旋和无规则卷曲向β折叠构象的转变[39],从而使共混膜的断裂强度得到提高。

图5 乙醇质量分数对BS-TSF-GEL共混膜的拉伸性能Fig.5 Effect of ethanol mass fraction on the tensile propertiesof BS-TSF-GEL blended films
2.3 BS-TSF-GEL共混膜的形貌及结构
BS-TSF-GEL共混膜外观形貌如图6(a)所示,可见共混膜外观均匀,呈淡黄色,无相分离现象,手感顺滑柔软,富有弹性。BS-TSF-GEL共混膜的微观形貌如图6(b~c)所示,可见共混膜表面存在微小的孔隙。有研究认为,膜的表面孔隙可以增大吸附的比表面积,提高载药量,吸收伤口渗出液,促进伤口愈合[17]。孔隙大小、分布、孔隙率的多少,以及添加PEG和乙醇处理对孔隙的影响有待于今后开展深入的研究。

图6 BS-TSF-GEL共混膜的形貌Fig.6 Morphology of BS-TSF-GEL blended films
进一步地,采用傅里叶红外光谱(FTIR)法分析共混膜的二级结构。FTIR光谱法可量化蛋白质的二级结构,酰胺Ⅰ带对研究蛋白质的二级结构最有价值[40]。酰胺Ⅰ带中1 610~1 640 cm-1谱峰属于β折叠,1 640~1 650 cm-1谱峰属于无规卷曲,1 650~1 660 cm-1谱峰属于α螺旋,1 660~1 700 cm-1谱峰属于β转角[41]。BS-TSF-GEL共混膜的傅里叶红外光谱如图7(a)所示。BS-TSF-GEL共混膜在1 630 cm-1处有很强的吸收峰,这是β折叠结构的特征吸收峰膜;1 647 cm-1有一个较弱的吸收峰,这是无规卷曲的特征吸收峰;1 662、1 678 cm-1和1 692 cm-1处的吸收峰归属于β转角结构。
将傅里叶自去卷积应用于共混膜的酰胺Ⅰ带,以确定其二级结构的含量[41],自去卷积结果如图7(b)所示。BS-TSF-GEL共混膜主要以β折叠为主,其相对含量高达37.29%,α螺旋/无规卷曲的相对含量为14.67%,β转角的相对含量为27.77%。FTIR结果表明,BS-TSF-GEL共混膜由β折叠、α螺旋/无规卷曲、β转角结构组成,且以β折叠为主,属于Silk Ⅱ结晶构型。通常纯丝素膜的构象主要以α螺旋和无规卷曲结构为主,是典型的Silk Ⅰ结晶构型[41]。因此,可以推断,PEG 200与蛋白大分子发生了相互作用,加之乙醇的后处理进一步促进了共混膜内分子链之间形成了β折叠结构。乙醇浸入共混膜内,破坏了共混膜中原有的氢键,分子链段发生重排形成了更加稳定的蛋白质氢键,从而诱导β折叠分子构象的形成[39]。

图7 BS-TSF-GEL膜的二级结构Fig.7 Secondary structure of BS-TSF-GEL blended films
为验证BS-TSF-GEL共混膜的构象,对共混膜做了X-射线衍射分析,BS-TSF-GEL共混膜的XRD图谱如图8所示。Silk Ⅰ(α螺旋和β转角)的衍射主要出现在12.2°、19.7°、24.7°、28.2°、32.3°、36.8°和40.1°;Silk Ⅱ(β折叠)的衍射主要出现在9.10°、18.9°、20.7°、24.3°和39.7°[42]。BS-TSF-GEL共混膜在2θ=24.49°附近出现了很强的衍射峰,表明BS-TSF-GEL共混膜以β折叠结构为主,结晶结构为Silk Ⅱ型。而在2θ=40.97°附近出现了一个弱而宽的“馒头峰”,说明BS-TSF-GEL膜有少量的Silk Ⅰ结构存在。XRD测试结果表明,BS-TSF-GEL共混膜以Silk Ⅱ为主,并有少量的Silk Ⅰ结构存在,该结果与FTIR结果一致。相对于Silk Ⅰ和无定型结构,Silk Ⅱ结构更加稳定,BS-TSF-GEL共混膜的这种结构使其在溶失率较低的同时机械性能也较好。
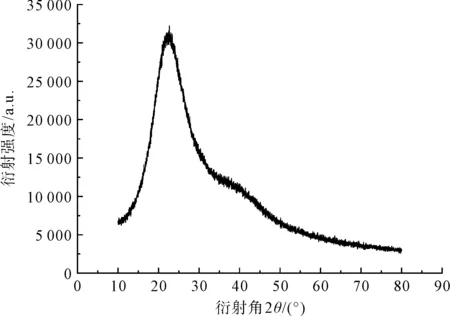
图8 BS-TSF-GEL共混膜的X-射线衍射图谱Fig.8 X-ray diffraction pattern of BS-TSF-GEL blended films
2.4 负载抗菌肽BS-TSF-GEL共混膜的抗菌性能
用抑菌圈大小评价BS-TSF-GEL共混膜的抑菌效果和负载能力,BS-TSF-GEL共混膜抑菌性能如图9和表4所示。

图9 载有抗菌肽的BS-TSF-GEL共混膜平板抑菌圈Fig.9 Plate inhibition zone of BS-TSF-GEL blended films loaded with antimicrobial peptides

表4 BS-TSF-GEL共混抗菌膜的抑菌圈直径Tab.4 Diameter of inhibition zone of BS-TSF-GELblended antibacterial biofilms
由图9可见,在共混膜的周围会形成透明的抑菌圈,随着抗菌肽质量分数的增加,抑菌圈增大,当抗菌肽质量分数达到1.0%时,对金黄葡萄球菌(革兰氏阳性菌)的抑菌圈直径为3.93 mm,对大肠杆菌(革兰氏阴性菌)的抑菌圈直径为3.55 mm(表4),说明BS-TSF-GEL共混膜对革兰氏阳性菌和革兰氏阴性菌均有较好的抑菌效果,同时也表明共混膜对抗菌肽有较强的负载能力。这主要是因为抗菌肽(正电荷)能够以静电吸附的方式,负载到带有负电荷的丝素和丝胶共混膜中[28,38]。
此外,作为对照,没有负载抗菌肽的BS-TSF-GEL共混膜周围也观察到一点点的透明圈,说明未负载抗菌肽的共混膜也有微弱的抑菌作用,这是由于共混膜中丝胶蛋白本身具有良好的抗菌性能。研究表明丝胶蛋白可以改变细菌形状,破坏细菌细胞膜,导致细胞内容物外泄而发挥抑菌作用[12]。共混膜负载抗菌肽后,其抗菌效果增强。
3 结 论
采用柞蚕丝素蛋白、明胶和桑蚕丝胶蛋白作为生物膜的基材,以聚乙二醇200作为交联剂成功制备共混膜;利用乙醇对共混膜进行改性,提高其强度和结晶度;通过负载抗菌肽获得抗菌效果。制备的共混抗菌膜稳定性好,溶失率34.62%,断裂伸长率34.15%,断裂强度578.8 kPa,对大肠杆菌和金黄色葡萄球菌均具有良好的抑菌效果。BS-TSF-GEL共混抗菌膜在生物医用材料领域具有明显的优势,本研究为蚕丝蛋白的应用探索了新的途径。

《丝绸》官网下载

中国知网下载
