程氏蠲痹汤通过抑制PI3K/Akt/mTOR 信号轴促进类风湿关节炎滑膜成纤维细胞的自噬
2022-12-05孙广瀚南淑玲王玉凤方妍妍
孙广瀚,许 霞,万 磊,南淑玲,王玉凤,赵 黎,程 卉,王 坤,刘 莹,方妍妍,孙 朗,朱 俊
安徽中医药大学1中医学院,3科研技术中心,安徽 合肥 230012;2安徽中医药大学第一附属医院,安徽 合肥 230031
程氏蠲痹汤(JBT)出自新安医家程国彭《医学心悟》,主治因风、寒、湿三气合而成痹[1]。现代多应用于治疗神经根型颈椎病[2]、急性期臂丛神经炎[3]、肩周炎[4]、坐骨神经痛[5]等,其中在类风湿关节炎动物实验中论证最多[6,7],具有较好的抗炎镇痛作用[8]。本课题组前期研究中选择的是佐剂关节炎大鼠FLS[9],故本文选择人关节FLS希望能进一步发现JBT作用机制。
类风湿关节炎(RA)是一种炎症性关节病,可导致多脏器病变,其主要特征包括滑膜炎和骨关节破坏。失调细胞稳态是引发RA的主要因素,但其中的精细分子机制仍不清楚。自噬在维持细胞稳态从而使细胞适应外界环境中的作用日益凸显[10]。RA-FLS的自噬增加,以抵抗细胞凋亡,改善RA的症状,而RA-FLS自噬功能紊乱将导致滑膜组织增生[11,12]。本团队在前期研究中发现滑膜成纤维细胞(FLS)中Beclin-1、LC3B mRNA及蛋白表达水平,提高细胞自噬水平有关[9]。细胞自噬信号通路可被多种途径激活,在这些途径中,PI3K/Akt/mTOR 通路是调节自噬功能的经典上游信号通路。PI3K可被激素、生长因子等刺激激活。激活的PI3K产生信使PIP3,使非活性Akt 发生构象转变。然后Ser124/Thr450和Thr308/Ser473位点相继磷酸化,导致Akt信号被激活。活化的Akt进一步触发mTOR的磷酸化激活,mTOR激酶直接作用于Atg等蛋白来调节自噬体的形成。RA模型中PI3K/Akt/mTOR通路研究,大多集中在细胞增殖、迁移、侵袭、凋亡、自噬等方面[13],而且中医药在此基础上有一定的研究成果[14,15],但是JBT在PI3K/Akt/m TOR信号通路中扮演的角色,目前尚无相关报道。
本实验从自噬依赖的PI3K/Akt/mTOR信号通路探讨了JBT 治疗RA 的机制,观察JBT 是否通过PI3K/Akt/mTOR信号轴调控RA-FLS自噬,为RA的临床用药提供理论。
1 材料和方法
1.1 细胞及药物来源
类风湿关节滑膜成纤维细胞(HUM-iCell-s010)购自上海赛百慷生物技术股份有限公司,纤维连接蛋白或波形蛋白免疫荧光染色为阳性,经上海赛百慷生物技术股份有限公司鉴定细胞纯度高于90%。结合《医学心悟》原方和临床中的药物用量比例,本研究中选用的程氏蠲痹汤(JBT)剂量为羌活10 g,独活10 g,桂枝9 g,当归9 g,秦艽10 g,海风藤20 g,川芎10 g,桑枝30 g,乳香9 g,木香6 g,炙甘草5 g。药物由安徽中医药大学第一附属医院制剂中心提供并制成药液。
1.2 冻干粉制备
将所得药液3000×g离心30 min 祛除杂质,放置于-80 ℃冷冻过夜。用冷冻干燥机将冷冻过夜的药液进行冷冻干燥,得冻干粉,放置于-20 ℃保存备用。
1.3 CCK8法检测细胞抑制率
胰酶消化对数期细胞,离心收集制成细胞悬液,细胞计数调整其浓度至5~10×104/mL。接种至96孔培养板,每孔100 μL,边缘孔用无菌PBS填充。将接种好的细胞培养板放入培养箱中培养,5%CO2,37 ℃孵育过夜,倒置显微镜下观察。培养不同时间后,每孔加入10 μL CCK8,继续培养1~4 h。酶联免疫检测仪A450nm处测量各孔的吸光值。同时设置空白孔(培养基、CCK8)。抑制率=[(对照孔A值-实验孔A值)/(对照孔A值-空白孔A值)]×100%,实验组为含待测物,对照孔为不含待测物,空白孔为仅有培养基。
1.4 电镜下观察细胞形态学变化
收集的细胞团块采用2.5%戊二醛固定24 h。吸除培养液,经消化、离心收集细胞。加入预冷的PBS,置于离心机离心5 min,弃去上清液,加入固定液(2.5%戊二醛)固定细胞,低温保存,委托安徽中抗生物技术有限公司进行后续处理并通过透射电镜观察、拍照记录细胞亚显微结构。
1.5 自噬双标腺病毒实验观察细胞内自噬流
将细胞接种于共聚焦培养皿中,待细胞铺满50%时采用自噬双标腺病毒转染细胞,按照说明书观察细胞转染情况并对细胞进行换液。36~48 h后按照上述分组进行干预,在共聚焦显微镜下观察。每孔取5个视野观察并拍照。mRFP-GFP-LC3串联荧光蛋白腺病毒中表达的GFP和mRFP用于标记及追踪LC3,最后将处理好的标本在共聚焦显微镜下在显微镜成像后红绿荧光merge后通过merge后出现的黄色斑点即是自噬小体,红色的斑点即是自噬溶酶体。
1.6 RT-qPCR检测细胞对PI3K、Akt和mTOR的mRNA表达水平
根据制造商的方案使用1 mL TRIzol 试剂从培养的细胞中提取总RNA。使用PrimeScript™RT reagent Kit with gDNA Eraser进行RT-qPCR。使用Ct(2-△△C)t方法计算相对基因表达水平,并将PI3K、Akt和mTOR的mRNA 标准化为mRNA 的β-actin 量。物合成由Sangon Biotech公司设计,引物的序列见表1。
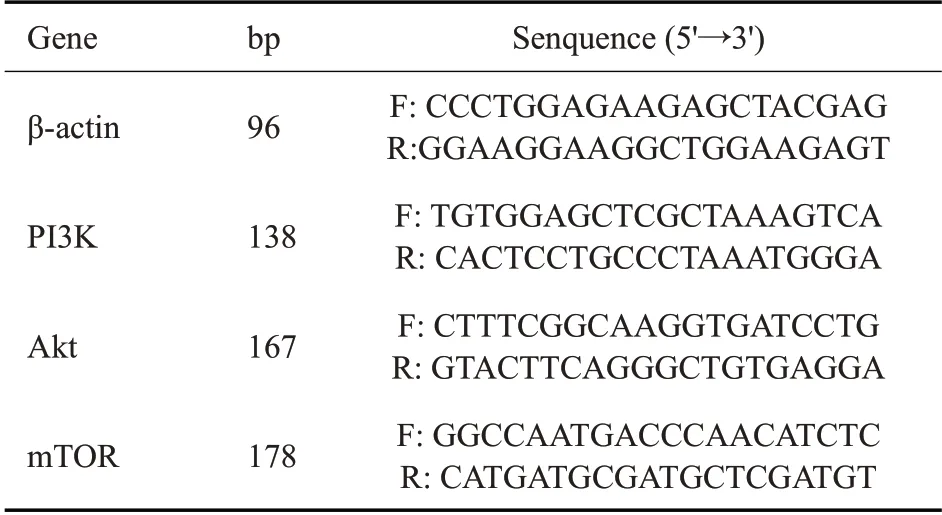
表1 PI3K、Akt和mTOR的mRNA的引物Tab.1 Primers used for RT-qPCR
1.7 Western blot分析细胞自噬相关蛋白及PI3K/Akt/mTOR信号转导通路相关蛋白表达
各组细胞采用RIPA裂解液1 mL(内含1 mmol/L PMSF)裂解。使用SDS-PAGE 电泳后采用湿转转膜,NLRP3转膜时间为90 min;Caspase-1转膜时间为40 min;IL-1β转膜时间为35 min;IL-18 转膜时间为25 min。PI3K、Akt、mTOR、p-mTOR、p-PI3K、P62、Beclin-1、LC3B一抗稀释比例为1∶1000,p-Akt稀释比例为1∶2000,于4度冰箱孵育过夜后PBST 洗涤NC膜3次,10 min/次。二抗孵育(稀释比例:10 000),PBST洗涤10 min,共3次。使用增强型化学发光试剂盒在化学发光成像仪上对条带进行可视化,并通过Image J软件分析。
1.8 统计学分析
数据用SPSS 21.0 统计软件进行统计学处理,采用GraphPad Prism 9.0软件作图,多组间均值的比较采用单因素方差分析,组内两两比较采用LSD检验。P<0.05为差异有统计学意义。
2 结果
2.1 CCK8检测JBT对RA-FLS细胞抑制作用
以25%为倍数筛选0.1、0.25、0.5、0.75、1 mg/mL JBT冻干粉培养液,FLS组未加药物。加入JBT组与RAFLS组相比,细胞抑制率增加(P<0.05);与加入0.1 mg/mL JBT相比,加入0.25、0.5、0.75 mg/mL JBT后细胞抑制率增加(P<0.05),加入1 mg/mL JBT后细胞抑制率降低(P<0.05),而且加入0.5 mg/mL JBT细胞抑制率最高,因此JBT最佳作用浓度为0.5 mg/mL;与0 h和12 h相比,24 h、48 h及72 h细胞抑制率增加(P<0.05),且24 h、48 h及72 h细胞活力无明显差异(P>0.05),因此JBT最佳作用时间为12 h(图1)。
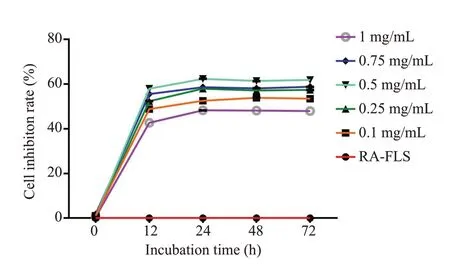
图1 以25%为倍数筛选JBT最佳剂量Fig.1 Determination of the optimal JBT concentration for cell treatment.
2.2 电镜观察JBT对细胞自噬的影响
FLS组线粒体模糊不清,粗面内质网断裂增多、糖原颗粒明显减少,自噬体少量存在。FLS+JBT组中能看到线粒体明显皱缩,线粒体膜模糊不清,内质网减少,自噬体大量存在。FLS+RAPA组中线粒体明显减少,线粒体空泡变性严重,粗面内质网轻微扩张,自噬体较多。FLS+RAPA+JBT组中线粒体、粗面内质网等细胞器丰富,糖原颗粒密集,线粒体有轻微损伤,嵴清晰可见,自噬体较多(图2)。
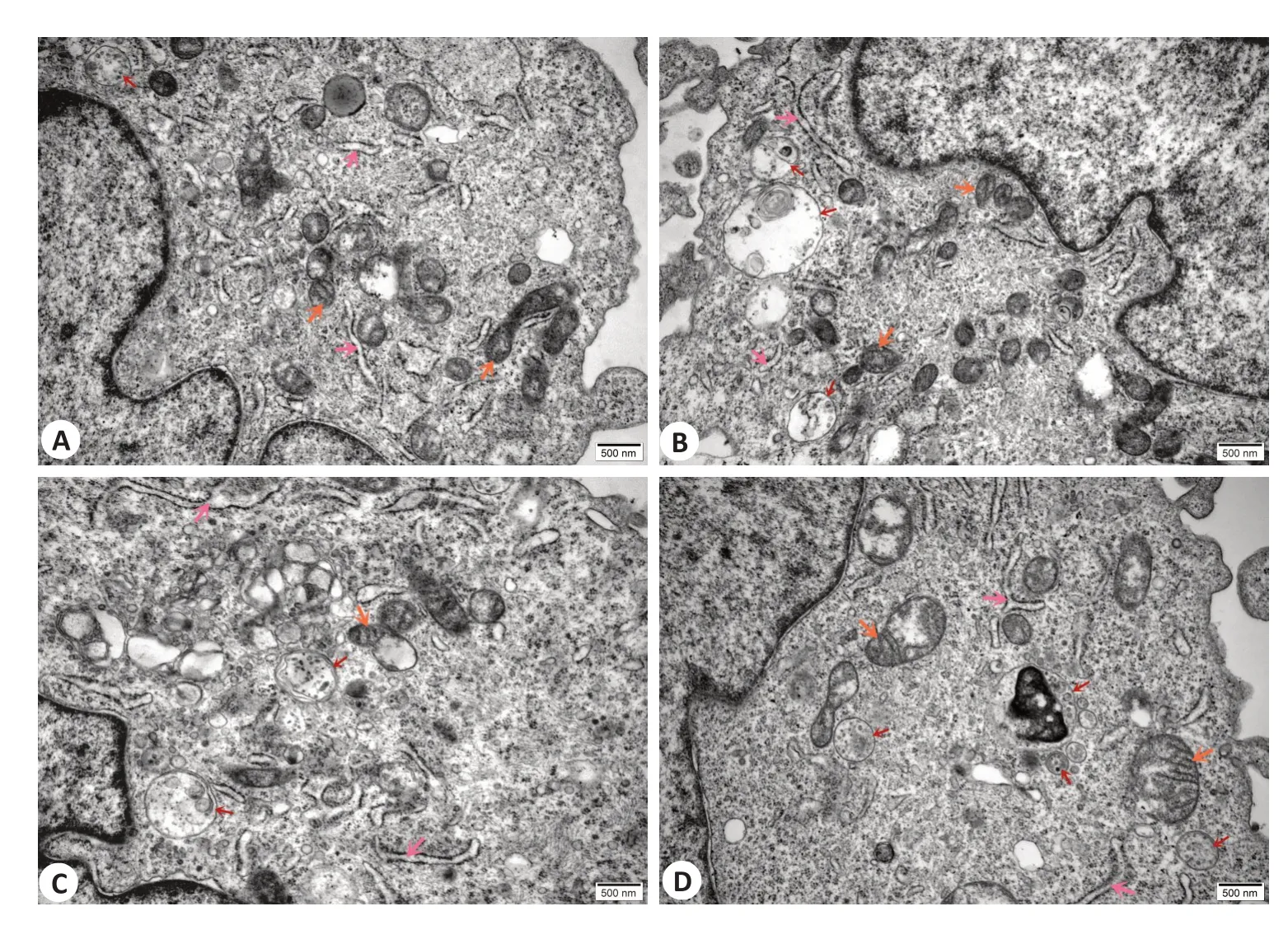
图2 电镜观察自噬体变化Fig.2 Transmission electron microscopy for observing autophagosome changes in RA-FLS with different treatment.indicates the autophagosomes,the mitochondria,and the rough endoplasmic reticulum.A:FLS group.B:FLS+JBT group.C:FLS+RAPAgroup.D:FLS+RAPA+JBT group.
2.3 细胞自噬流的变化
自噬双标腺病毒实验结果显示,FLS+RAPA+JBT组较FLS组、FLS+JBT组、FLS+RAPA组相比,黄色斑点明显增多,且黄色斑点多于红色斑点,即自噬小体显著增多,且自噬溶酶体较少;FLS 组较FLS+JBT 组、FLS+RAPA组、FLS+RAPA+JBT组相比,红色斑点增多、黄色斑点减少,即自噬溶酶体增多自噬小体减少(图3)。
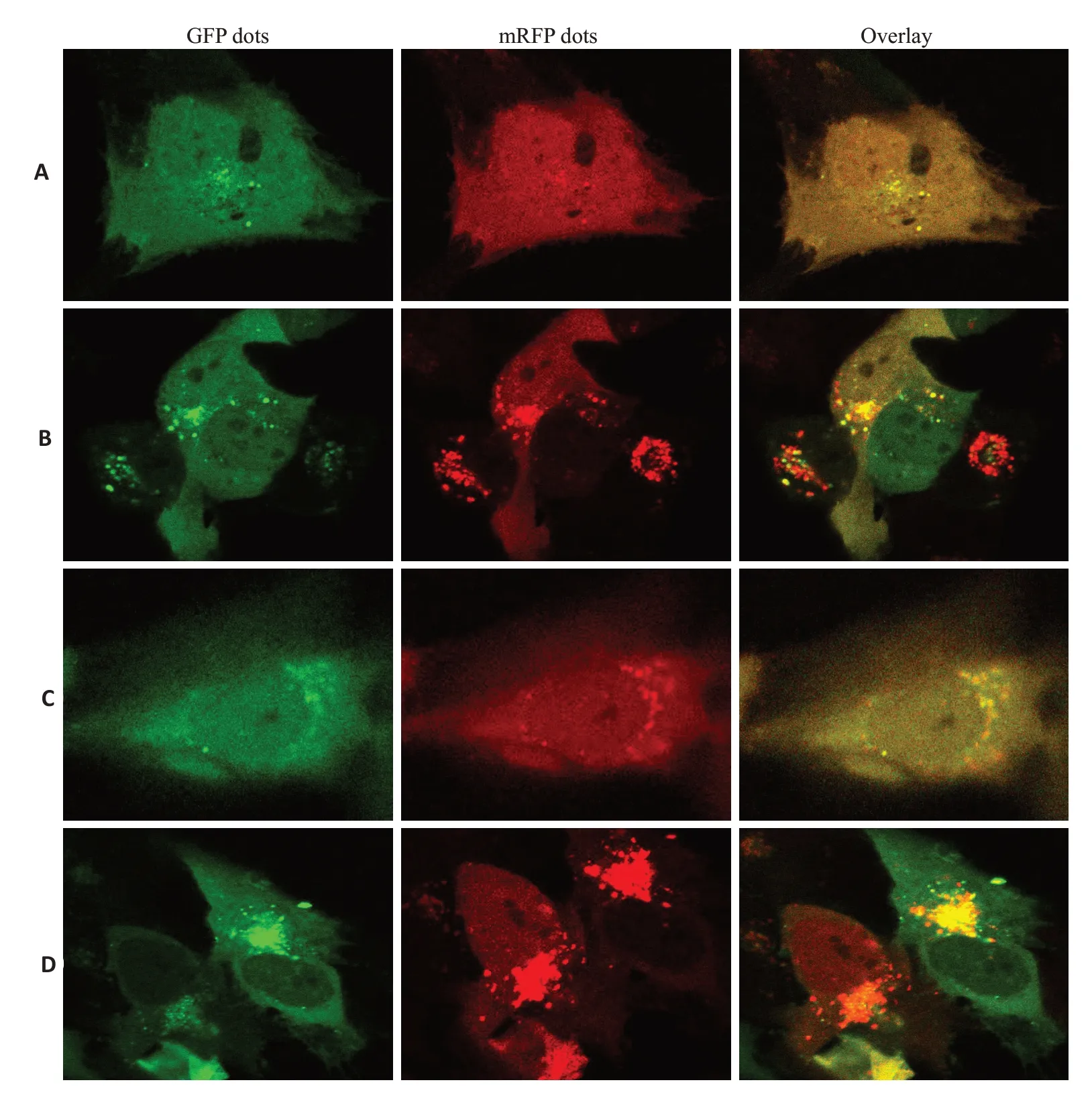
图3 mRFP-GFP-LC3腺病毒检测自噬流情况Fig.3 mRFP-GFP-LC3 adenovirus for detecting autophagic flow(Original magnification: ×600).The yellow dots indicate autophagosomes,and the red dots indicate autophagolysosomes in the merged images.A:FLS group.B:FLS+JBT group.C:FLS+RAPAgroup.D:FLS+RAPA+JBT group.
2.4 JBT对PI3K/Akt/mTOR 信号转导通路的影响
RT-qPCR结果显示,FLS+JBT组、FLS+RAPA组、FLS+RAPA+JBT组较FLS组相比,PI3K、Akt和mTOR的mRNA的水平明显降低(P<0.01)。FLS+RAPA+JBT组较FLS组、FLS+JBT组、FLS+RAPA组相比,PI3K、Akt 和mTOR 的mRNA 的水平降低更明显(P<0.01,图4)。Western blotting分析显示,FLS+JBT组、FLS+RAPA 组、FLS+RAPA+JBT 组与FLS 组相比,FLS+RAPA+JBT组较FLS组、FLS+JBT组、FLS+RAPA组相比,PI3K、Akt、mTOR蛋白的水平无明显差异(P>0.05)。FLS+JBT 组、FLS+RAPA 组、FLS+RAPA+JBT 组较FLS组相比,p-Akt、p-mTOR、p-PI3K蛋白水平明显降低(P<0.05),FLS+RAPA+JBT组较FLS组、FLS+JBT组、FLS+RAPA组相比,p-Akt、p-mTOR、p-PI3K蛋白水平降低更明显(P<0.05,图4、5)。
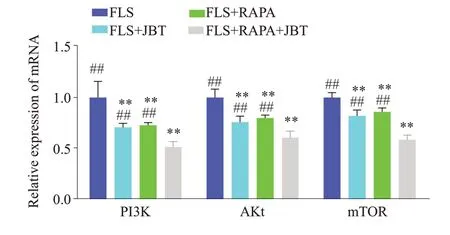
图4 PI3K/Akt/mTOR相关基因的表达Fig.4 Expression of mRNAs of PI3K/Akt/mTOR-related genes.*P<0.05,**P<0.01 vs FLS group.##P<0.01 vs FLS+RAPA+JBT group.
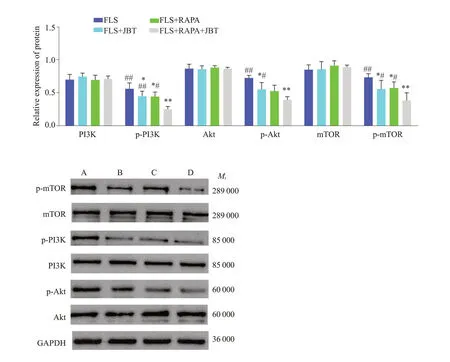
图5 PI3K/Akt/mTOR通路相关蛋白表达水平Fig.5 PI3K/Akt/mTOR pathway-related protein expression levels detected by Western blotting.A:FLS group.B:FLS+JBT group.C:FLS+RAPA group.D:FLS+RAPA+JBT group.*P<0.05,**P<0.01 vs FLS group.#P<0.05,##P<0.01 vs FLS+RAPA+JBT group.
2.5 细胞自噬相关蛋白表达的影响
FLS+RAPA+JBT组较FLS组、FLS+JBT组、FLS+RAPA 组相比,P62 蛋白表达量明显下降,Beclin-1、LC3B蛋白表达量明显上升(P<0.05);FLS组较FLS+JBT组、FLS+RAPA组、FLS+RAPA+JBT组相比,P62蛋白表达量高,Beclin-1、LC3B 蛋白表达量明显较低(P<0.05,图6)。

图6 P62、Beclin-1、LC3B蛋白表达水平Fig.6 Expression levels of P62,Beclin-1,and LC3B proteins in the FLS.A:FLS group.B:FLS+JBT group.C:FLS+RAPA group.D:FLS+RAPA+JBT group.*P<0.05,**P<0.01 vs FLS group;#P<0.05,##P<0.01 vs FLS+RAPA+JBT group.
3 讨论
近年来围绕着自噬如何影响RA发病的研究逐年增加,但具体机制尚不明确。本文研究程氏蠲痹汤通过PI3K/Akt/mTOR信号轴调控RA-FLS自噬的影响及相关机制,研究结果表明JBT可抑制RA-FLS的存活率,并可提高细胞自噬水平,其机制可能与下调PI3K/Akt/mTOR信号通路有关。
同属温性药物为主的五味温通除痹胶囊[16]、具有温通作用的艾灸[17]也能促进细胞自噬,缓解炎症。电镜是检测自噬的金标准,自噬体的特征是双层膜状的包裹着胞浆和线粒体等细胞器的空泡结构,当自噬体与溶酶体融合形成自噬溶酶体后,空泡内的细胞器会被溶酶体降解,形成黑色颗粒状物质的单层膜状空泡结构[18]。电镜及自噬双标腺病毒实验结果显示,JBT加入后自噬小体显著增多,且自噬溶酶体较少,CCK8结果显示JBT能够抑制RA-FLS增殖,并且具有浓度依赖性。说明JBT提高保护细胞的功能,对于各种应激导致的细胞损伤能有效应对。
研究证实,PI3K/Akt/mTOR信号通路是调节自噬的主要信号通路[19,20]。PI3K激活后,将其底物3,4 二磷酸磷脂酰肌醇磷酸化为3,4,5 三磷酸磷脂酰肌醇,与Akt结合,使其活化,活化的Akt进一步与TSC1/2复合物结合,激活下游分子mTOR。mTOR是自噬启动阶段的关键调节因子,活化后可抑制自噬发生[21]。启动阶段的靶点主要为mTOR相关靶点,包括TOR复合体1(TORC1)和Ⅰ型PI3K。Beclin-1、p62、LC3B 是细胞自噬的标志性蛋白[22]。Beclin-1在自噬起始阶段发挥重要作用,是形成自噬体的必需分子之一。Beclin-1蛋白表达水平与自噬成正相关[23],本研究表明,JBT 能提高Beclin-1蛋白表达水平,增强细胞自噬。最经典的自噬相关药物,雷帕霉素(RAPA)的作用靶点即为TORC1[24],TORC1可以影响mTOR的活性,进而调节细胞自噬的活性。有研究表明,加入RAPA后巨噬细胞中的自噬明显增强[25]。本研究结果显示JBT能够使细胞中PI3K、Akt和mTOR的mRNA的水平降低,PI3K、p-Akt及pmTOR蛋白的表达下调,提示其促进结RA-FLS自噬,抑制细胞增殖,与抑制PI3K/Akt/mTOR信号转导通路的活性密切相关。
综上所述,本研究首先通过CCK8选取JBT抑制RA-FLS增殖的最佳浓度,JBT干预后明显增强了RAFLS 细胞的自噬水平,进一步应用RAPA 阻断PI3K/Akt/mTOR 信号,发现JBT 可能是通过PI3K/Akt/mTOR 信号增强自噬,并与RAPA起协同作用,进一步增强自噬作用,更为深入的机制还有待进一步的研究。
