过表达miR-607通过下调TRPC5表达抑制肝细胞癌的生长和转移
2022-12-05陈双江姜业臻
李 超,陈双江,姜业臻
1清华大学附属北京清华长庚医院肝胆胰外科,北京 102218;2安康市人民医院普通外科,陕西 安康 725000;3西安交通大学第一附属医院肝胆外科,陕西 西安 710061;4通用环球西安北环医院普通外科,陕西 西安 710032
肝细胞癌(HCC)具有生长速度快、易发生脉管侵犯和肝内外转移的特点,目前已成为我国致死率最高的恶性肿瘤[1]。MicroRNA(miRNA,miR)是一种长度小于22个碱基的单链非编码RNA,miRNAs的异常表达在HCC发生发展中发挥关键作用[2]。MiR-607位于人类10号染色体,最早在抗埃博拉病毒相关miRNA中[3]被发现,随后miR-607被发现与神经精神疾病[4,5]及多种癌症[6,7]的进展密切相关。胰腺癌中,血清miR-607低表达患者出现淋巴结转移、肝脏转移和周围神经侵犯比例更高、预后更差[8],体外过表达miR-607能够抑制胰腺癌细胞增殖和迁移[9],提示miR-607在胰腺癌中具备液体活检标志物价值并能发挥抗癌作用。目前,仅通过测序发现HCC患者血清外泌体miR-607表达水平降低[10],但HCC组织中miR-607的表达和具体生物学功能尚缺乏研究。因此,本研究拟通过探讨miR-607在HCC中异常表达的临床意义和调节HCC生长转移的功能机制,以期明确miR-607在HCC疾病进展中的作用。
1 资料和方法
1.1 资料
收集2019年1月1日~2021年1月1日于安康市人民医院普通外科行手术切除的HCC组织及对应癌旁组织标本45例,包括男性29例,女性16例,年龄50~77岁,中位年龄63岁。所有患者术前均未接受过靶向、介入、放化疗等辅助治疗并且均签署知情同意书,实验方案由西安交通大学第一附属医院伦理委员会审核批准(批号:2021 伦审科字第347 号)。MicroRNA 模拟物(mimics,miR-607及阴性对照)、microRNA PCR扩增引物试剂盒(miR-607及U6)、野生型及突变型TRPC5 mRNA 3'-非翻译区(3'-UTR)双荧光素酶报告基因系统由广州锐博生物科技有限公司提供。LO2、HepG2、Hep3B、Huh-7及HCCLM3细胞由西安交通大学第一附属医院肝胆外科实验室保存。DMEM液体培养基及胎牛血清(Gibco)。RNA 提取试剂Trizol、转染试剂LipofectamineTM3000 及RT-PCR 试剂盒(Invitrogen)。SYBR Green实时荧光定量PCR试剂盒(BIO-RAD)。TRPC5、Akt、Ser473 磷酸化Akt、CCND1、MMP2 及GAPDH一抗(proteintech)。CCK-8试剂盒、流式细胞仪凋亡检测试剂盒(上海生工生物有限公司)。TRPC5引物(上游5'-GTTCTAGGTTTCATTTGGGGTGAGA-3';下游5'-ACATTTCCCATTCCTCCCTTGG-3')、GA PDH引物(上游5'-CCAGGGCTGCTTTTAACTCT-3';下游5'-GGACTCCACGACGTACTCA-3')购自上海生工生物有限公司。Transwell小室(CORNING),人工基质胶(B&D)。
1.2 方法
1.2.1 细胞培养与传代 正常人永生化肝细胞LO2及肝癌细胞HepG2、Hep3B、Huh-7及HCCLM3细胞株培养于含10%胎牛血清的DMEM培养基中,置于细胞培养箱中,在37 ℃、5%CO2及饱和湿度环境下进行培养传代。稳定传代2~3代后,取对数生长期细胞进行后续实验。
1.2.2 qRT-PCR 检 测miR-607 及TRPC5 mRNA 表 达使用Trizol试剂按操作指南提取临床标本组织或体外培养细胞中的总RNA。定量后,每份组织样品或细胞样品取等量RNA 配制20 μL 的逆转录反应体系合成cDNA。cDNA稀释10倍后取5 μL配制实时荧光定量PCR体系,按如下条件进行PCR反应:95 ℃预变性30 s,1循环;95 ℃变性5 s,60 ℃退火延伸30 s,40循环。以U6 RNA 为miR-607 内参,以GAPDH 为TRPC5 的内参,采用2-△△Ct法计算miR-607及TRPC5 mRNA的相对表达量。
1.2.3 miR-607 mimics细胞转染 HCC细胞以过夜培养达50%~70%之密度接种于6孔板中。miR-607 mimics转染分组:阴性对照组(miR-ctrl)加入100 pmoL/孔的阴性对照mimics及5 μL转染试剂,miR-607组(miR-607)加入100 pmoL/孔的miR-607 mimics及5 μL转染试剂;以无血清DMEM培养基调整终体积为2 mL/孔。按后续实验要求确认转染时间。
1.2.4 CCK-8检测细胞增殖 分别收集转染24、48 h及72 h 后的HCC细胞,制备密度为1×105/mL 的无血清DMEM基细胞悬液,以200 μL/孔接种于96孔板。加入10 μL/孔CCK-8 solution试剂后放置于细胞培养箱内避光培养2 h。于酶标仪上测定各孔450 nm的吸光度A450nm。每个样本独立重复实验3次。
1.2.5 流式细胞仪检测凋亡 取转染72 h后的HCC细胞,用1×Binding Buffer制备密度为1×106/mL的细胞悬液,每管加入500 μL细胞悬液、5 μLAnnexin Ⅴ-FITC和10μLPropidiumIodide。混匀后,室温下避光反应10min,进行流式细胞仪检测。每组样本独立重复实验3次。
1.2.6 划痕愈合实验检测细胞迁移 取转染24 h后的HCC细胞,以过夜培养达80%~90%之密度接种于6孔板中。过夜培养后用无菌200 μL移液器枪头沿培养孔中线划过制作初始划痕。以无血清DMEM培养基清洗培养孔以洗净悬浮细胞。每孔再次加入无血清DMEM培养基2 mL,将6孔板置于培养箱中继续培养48 h。在显微镜下拍照记录划痕剩余距离,计算细胞迁移情况。
1.2.7 Transwell 小室模型检测细胞侵袭 用无血清DMEM 培养基按1∶8 比例稀释50 mg/L 的基质胶100 μL/孔覆盖transwell小室上室面,于37 ℃细胞培养箱内风干1 h 制成侵袭小室模型。取转染48 h 后的HCC细胞用无血清DMEM培养基重悬,以2×105/mL的密度加入100 μL/孔的细胞悬液。24孔细胞培养板内加入750 μL/孔含10%胎牛血清的DMEM培养基,建立细胞侵袭检测模型。培养完成后,PBS清洗小室、4%多聚甲醛固定,并用0.1%的结晶紫染色10 min。擦除上室面未成功穿过小室膜的细胞,显微镜下观察并计数下室面细胞数目。
1.2.8 生物信息学分析 使用Targetscan 网站(https://www.targetscan.org/)确定miR-607 与潜在靶基因TRPC5 mRNA3'-UTR区的结合位点。
1.2.9 双荧光素酶报告基因系统 Huh-7及HCCLM3细胞分别以1×105/孔种于24孔板中过夜培养,每种细胞均 设置4 个分组Wt-TRPC5 质粒+miR-ctrl mimics;Mut-TRPC5 质粒+miR-ctrl mimics;Wt-TRPC5 质粒+miR-607 mimics;Mut-TRPC5质粒+miR-607 mimics。采用LipofectamineTM3000将混合物转染入特定细胞中培养48 h后,按双荧光素酶检测试剂说明书进行荧光强度测定。
1.2.10 Western blot 提取转染48 h后的HCC细胞总蛋白并调齐所有样品的蛋白浓度。采用垂直电泳法,利用4%~10%SDS-PAGE 凝胶按相对分子质量分离总蛋白。采用湿转法,按100 Ⅴ转印2 h之条件将分离后的蛋白转移至NC膜上,5%BSA室温封闭NC膜1 h。裁取目的蛋白所在的位置条带,按1∶1000 比例配制TRPC5、Akt、Ser473 磷酸化Akt、CCND1、MMP2 及GAPDH一抗,4 ℃孵育过夜。PBS洗去未结合一抗后采用1∶5000稀释的HRP标记山羊抗兔二抗室温孵育NC膜1 h。于暗室内,ECL法曝光目的蛋白,以条带灰度强度计算蛋白相对表达量。
1.3 统计学分析
采用SPSS22.0统计软件进行分析,连续性资料以均数±标准差表示,两组间比较采用两独立样本t检验。非连续性资料结果采用Pearson卡方检验,以P<0.05表示差异具有统计学意义。
2 结果
2.1 miR-607在肝细胞癌中表达及临床意义
分析45对HCC及癌旁组织的miR-607表达,HCC组织中miR-607 的平均表达水平低于对应癌旁组织(t=2.214,P=0.029,图1A)。以HCC组织中miR-607平均表达量为截断值,将45例肝细胞癌患者分为miR-607高表达组(n=16)和miR-607低表达组(n=29)。miR-607低表达与肿瘤直径>5 cm(χ2=4.640,P=0.031)、血管侵犯(χ2=4.865,P=0.027)及较晚的TNM 分期(III+IⅤ,χ2=5.940,P=0.015)密切相关(表1)。在体外培养细胞中,与正常人永生化肝细胞LO2相比,所检测HCC细胞系中miR-607 的表达 水平均降低(HepG2:P=0.044,Hep3B:P=0.041,Huh-7:P=0.037,HCCLM3:P=0.031;图1B)。选择Huh-7及HCCLM3细胞进行mimics转染以开展下一步实验,结果显示,与miR-ctrl组相比,转染miR-607 mimics 提高了两种HCC 细胞内miR-607 的表达水平(Huh-7:P<0.001,图1C;HCCLM3:P=0.003,图1D)。
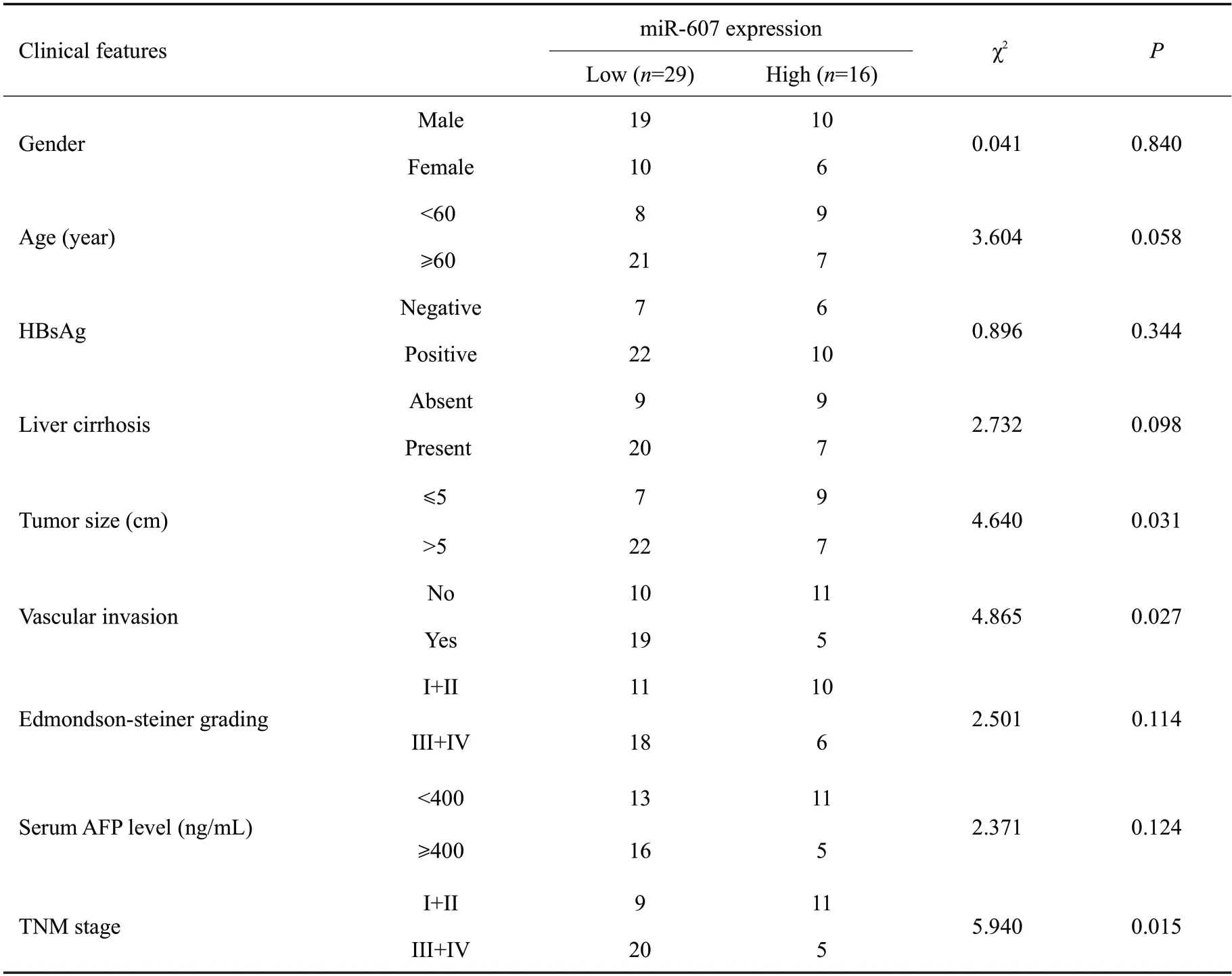
表1 miR-607异常表达在肝细胞癌中的临床意义Tab.1 Correlation between miR-607 expression and clinicopathological features of HCC patients
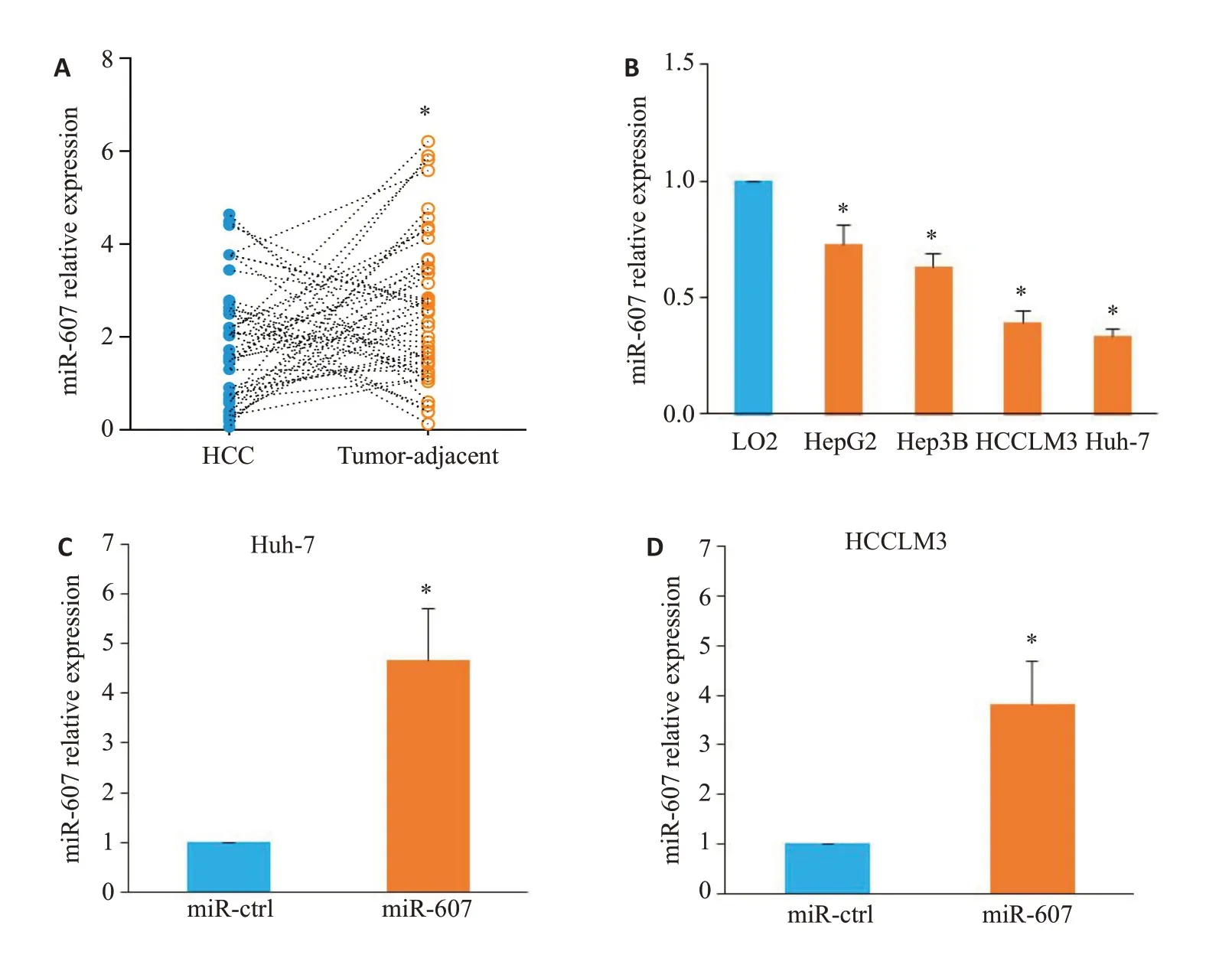
图1 miR-607在HCC中的表达以及在Huh-7和HCCLM3细胞中过表达miR-607Fig.1 Expression of miR-607 in HCC and overexpression of miR-607 in Huh-7 and HCCLM3 cells.A: Down-regulated expression of miR-607 in HCC tissues (*P<0.05 vs tumor-adjacent tissues).B:miR-607 expression is lower in the 4 HCC cell lines(HepG2,Hep3B,Huh-7,and HCCLM3)than in LO2 cells(*P<0.05 vs LO2).C,D:Transfection of miR-607 mimics increases miR-607 expression in Huh-7(C)and HCCLM3(D)cells(*P<0.05 vs miR-ctrl group).
2.2 过表达miR-607抑制HCC细胞增殖并诱导凋亡
与miR-ctrl组相比,miR-607组Huh-7细胞的增殖活力在转染48 h 后明显下降(P=0.037),并且在转染72 h后仍可检测出差异(P=0.023,图2A)。同时,转染72 h后通过流式细胞仪分析发现,miR-607组细胞凋亡比例高于转染miR-ctrl 组(P=0.005,图2B)。过表达miR-607可抑制HCCLM3的增殖活力(48 h:P=0.045,72 h:P=0.025;图2C)并促进细胞凋亡发生(P=0.004,图2D)。
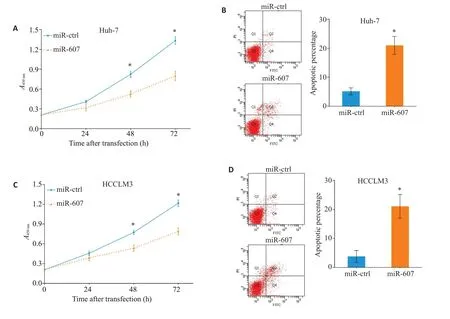
图2 过表达miR-607抑制HCC细胞增殖并促进凋亡Fig.2 Overexpression of miR-607 inhibits proliferation and promotes apoptosis in HCC cells.A,C:Overexpression of miR-607 inhibits proliferation of Huh-7(A)and HCCLM3(C)cells.B,D:Overexpression of miR-607 promotes apoptosis of Huh-7(B)and HCCLM3(D)cells.*P<0.05 vs miR-ctrl group.
2.3 过表达miR-607抑制HCC细胞迁移和侵袭
细胞划痕愈合试验发现,与miR-ctrl组相较,miR-607组中Huh-7细胞的迁移距离缩短(P=0.011,图3A)。Transwell侵袭小室结果显示,miR-ctrl组Huh-7细胞穿膜数量少于miR-607组Huh-7细胞穿膜数量(P=0.005,图3B)。过表达miR-607具有抑制HCCLM3细胞迁移(P=0.023,图3C)和侵袭(P=0.003,图3D)的效应。
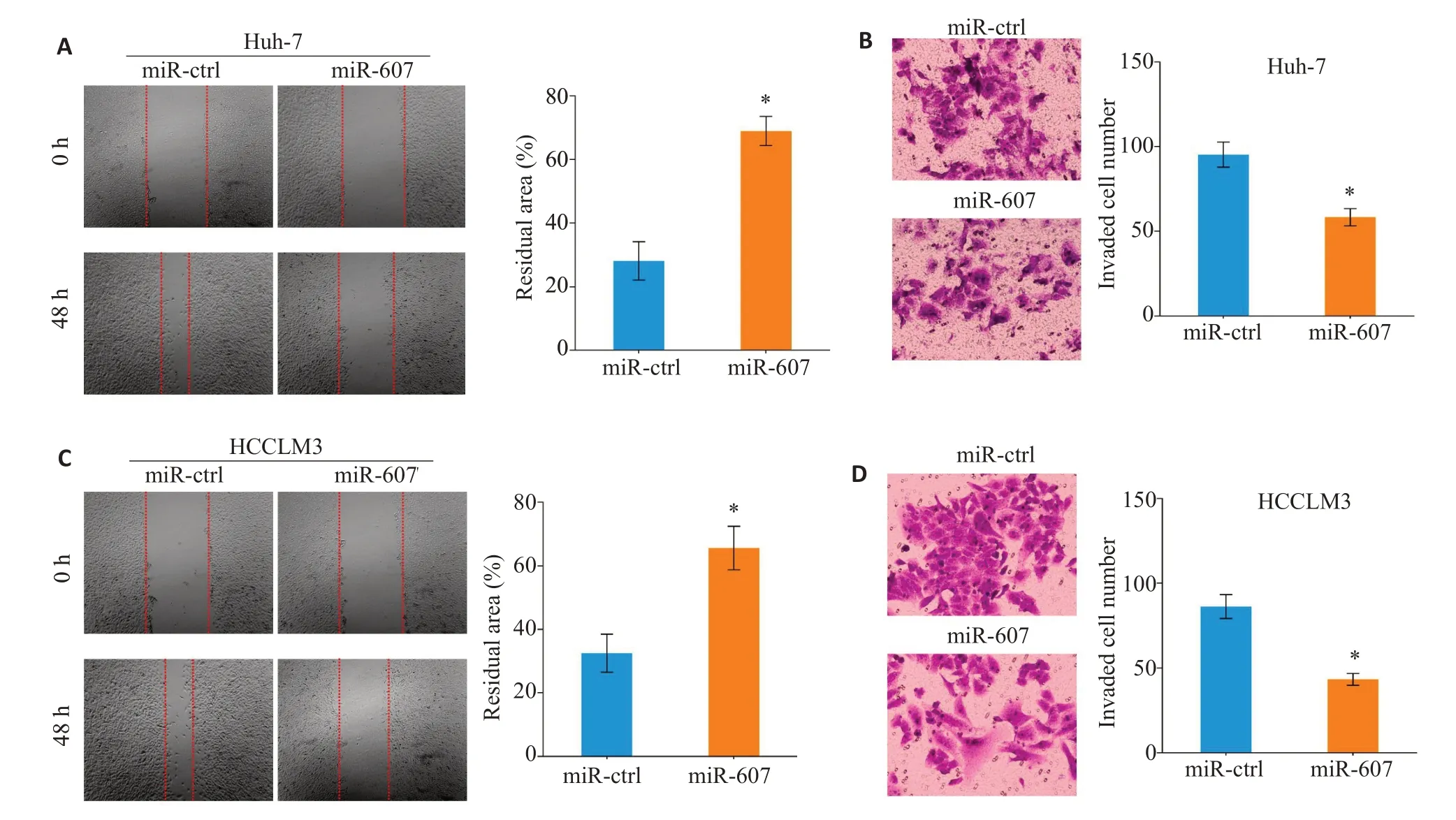
图3 过表达miR-607抑制HCC细胞迁移和侵袭Fig.3 Overexpression of miR-607 inhibits migration and invasion of HCC cells.A,C:Overexpression of miR-607 inhibits migration of Huh-7(A)and HCCLM3(C)cells.B,D:Overexpression of miR-607 inhibits invasion of Huh-7(B)and HCCLM3(D)cells.*P<0.05 vs miR-ctrl group.
2.4 miR-607靶向TRPC5抑制Akt通路激活
在Starbase、miRDB、TargetScan 数据库进行生物信息学检索发现,经典瞬时受体电位通道5(TRPC5)可能是miR-607的潜在靶点之一(图4A)。采用双荧光素酶报告基因系统检测证实,miR-607能够与HCC细胞内TRPC5 mRNA的野生型3'-UTR区直接结合(Huh-7:P=0.004,HCCLM3:P=0.011;图4B)。PCR及Western blot 检测显示,过表达miR-607 下调HCC 细胞内TRPC5 mRNA(Huh-7:P<0.001,HCCLM3:P=0.002;图4C)及蛋白质(Huh-7:P=0.001,HCCLM3:P=0.013;图4D)的表达水平。
与miR-ctrl组相比,过表达miR-607的HCC细胞内Akt的磷酸化水平下调(Huh-7:P=0.034,HCCLM3:P=0.041);同时,增殖相关分子CCND1(Huh-7:P=0.026,HCCLM3:P=0.029)及侵袭相关分子MMP2(Huh-7:P=0.004,HCCLM3:P=0.001)的表达水平降低(图4D、E)。
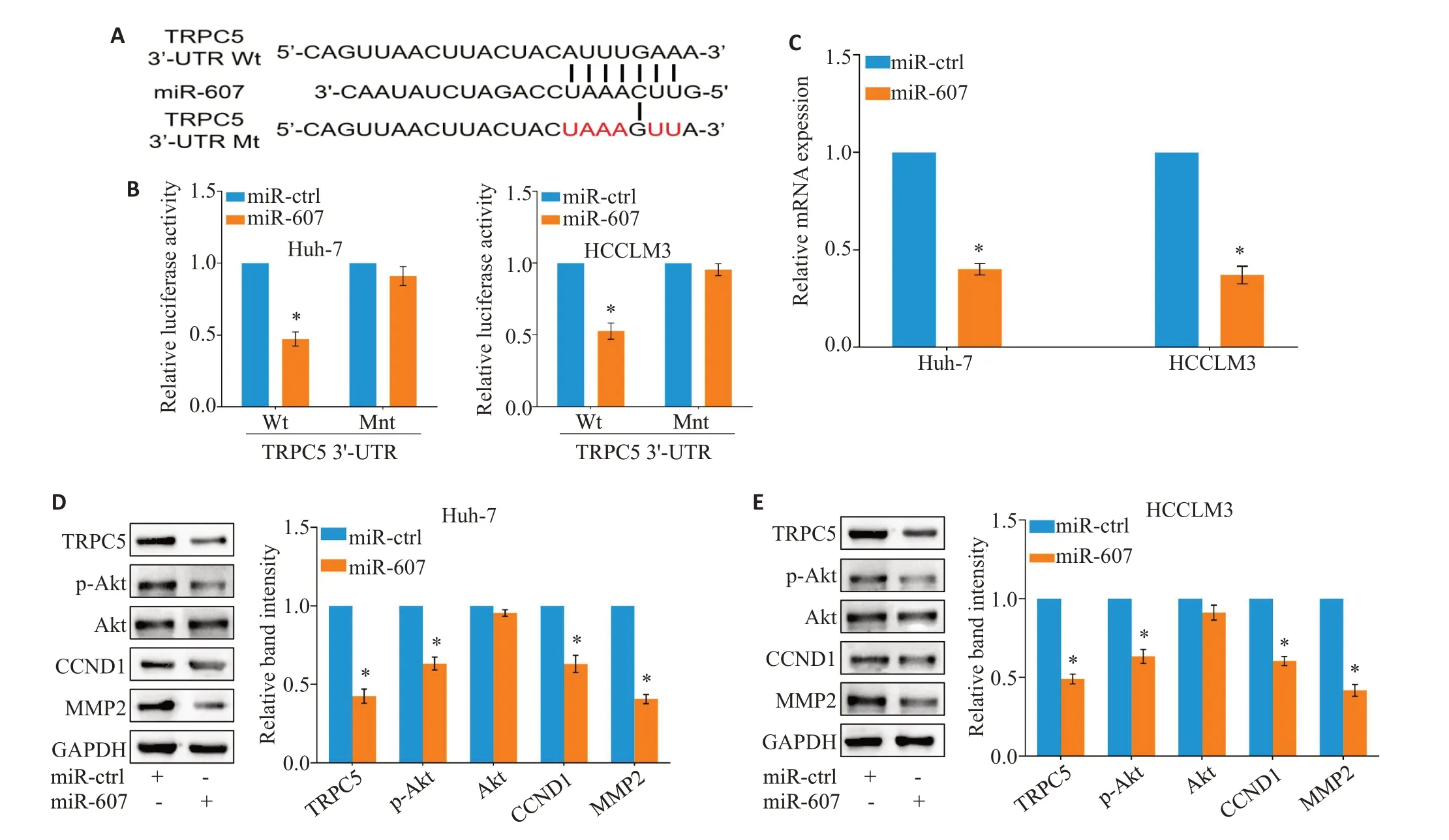
图4 miR-607靶向TRPC5抑制Akt通路激活Fig.4 miR-607 inhibits Akt pathway activation through targeting TRPC5.A:miR-607 was predicted to bind to TRPC5 mRNA3'-UTR region by bioinformatics analysis.B:Overexpression of miR-607 inhibits luciferase activity of wild-type(Wt)but not mutant-type(Mut)3'-UTR vectors of TRPC5 in HCC cells.C:Overexpression of miR-607 decreases TRPC5 mRNA expression in HCC cells.D,E:Total expressions of TRPC5,CCND1,MMP2 and phosphorylated Akt are decreased in Huh7(D)and HCCLM3(E)cells.*P<0.05 vs miR-ctrl group.
3 讨论
MicroRNA异常表达与肿瘤生长转移[11,12]和患者预后[13]密切相关,其中miR-607在非小细胞肺癌中表达下调并提示预后不良[14];慢性淋巴细胞白血病中miR-607通过下调WNT信号通路受体FZD3表达发挥细胞周期阻滞和凋亡诱导作用[15]。本研究发现,miR-607在HCC组织中的表达水平显著下调,miR-607低表达与肿瘤体积增大、血管侵犯和较晚的临床分期等肿瘤生长转移特征密切相关;体外实验表明miR-607 可以显著抑制HCC 细胞的增殖、迁移、侵袭,并诱导细胞凋亡的发生。肿瘤中MicroRNA的表达下调大多与长链非编码RNA、环状RNA等其他内源性RNA的分子海绵的吸附效应有关[16]。宫颈癌中miR-607被lncRNATP73-AS1吸附降解,导致其对下游靶点CCND2的抑制作用减弱,引起肿瘤发生凋亡抵抗和侵袭转移[17]。在HCC中发现lncRNATP73-AS1表达显著升高[18],并促进HCC增殖侵袭[19]和放疗抵抗[20],上述结果从侧面揭示了本研究所发现的miR-607低表达原因。
TRPC5是一种以同源四聚体形式锚定于细胞膜上的Ca2+离子通道[21],开放后可介导细胞Ca2+内流[22]。据报道,TRPC5作为促癌因子在肺癌[23]、胃癌[24]中表达升高并与肿瘤生长转移和患者不良预后相关。生物信息学分析推断TRPC5可能是miR-607的潜在靶点之一。我们的研究通过双荧光素酶报告基因证实miR-607可 与TRPC5 的mRNA 3'-UTR 区直接结合,PCR 及Western blot结果也表明miR-607能下调TRPC5表达,说明TRPC5是miR-607的靶基因之一。
在肺鳞癌中,miR-607通过下调钙激活核苷酸酶1表达抑制肺癌细胞增殖侵袭[25],提示Ca2+信号参与了miR-607的抑癌过程。研究证实,Ca2+信号异常活动是TRPC5发挥促癌作用的主要机制。结肠癌中TRPC5介导的Ca2+内流可激活HIF-1α/Twist轴促进上皮间质转化发生[26]。乳腺癌细胞中TRPC5的通过Ca2+依赖转录因子NFATC3诱导多药耐药蛋白1表达将细胞内阿霉素泵至胞外,诱导原发性耐药形成[27]。在HCC中,通道受体异常表达引起的Ca2+内流能激活PI3K/Akt通路来促进HCC生长和转移[28]。据此线索,本研究发现过表达miR-607 能够削弱Akt 的磷酸化并下调CCND1、MMP2等Akt通路下游效应分子的表达,初步揭示了miR-607抗肿瘤的潜在生物学机制。由于目前尚未能在裸鼠荷瘤模型中进一步验证miR-607的抗癌活性及体内作用机制,因此尽管本研究在体外分子过程方面进行了较为深入的探索,但其结果仍有一定的局限性,需要在未来的工作中进一步完善。
综上所述,HCC中低表达miR-607与肿瘤恶性临床特征密切相关。MiR-607通过下调TRPC5表达进而抑制Akt通路激活来发挥抗HCC生长转移作用。调控miR-607表达具有靶向治疗肝细胞癌潜力。
