Aumolertinib可体内外抑制人脉络膜黑色素瘤MUM-2B细胞的增殖
2022-12-05王爱莲祝英泽高自清
李 娟,王爱莲,李 宁,祝英泽,李 坤,刘 浩,高自清
1蚌埠医学院第一附属医院眼科,安徽 蚌埠 233000;2蚌埠医学院药学院//安徽省生化药物工程技术研究中心,安徽 蚌埠 233030;3安徽科技学院生命与健康科学学院生物医药与健康研究院,安徽 凤阳 233100
葡萄膜黑色素瘤是成年人眼内最常见的恶性肿瘤,可发生于虹膜、睫状体和脉络膜,脉络膜是最常见的发生部位。脉络膜黑色素瘤恶性程度很高,50%的患者在治疗早期即发生远处转移,一旦发生转移,患者中位生存率仅有6月[1-3]。现行治疗方案虽对早期患者具有较好的疗效,但对于晚期转移病例或者早期治疗后复发病例,仍然缺少有效的治疗方式延长生存期。因此,探寻安全有效的新型药物及治疗靶点是近年来科学家们研究的热点[4-6]。
表皮生长因子受体(EGFR)在癌症发生、发展中起着重要的作用,在多种人类肿瘤中表现异常,包括基因扩增、基因突变和高表达[7-9]。EGFR抑制剂已成为抗肿瘤新药设计的热点[10,11]。Aumolertinib是我国(江苏豪森药业集团有限公司)自主研发的一种副作用更小的第3代小分子EGFR抑制剂。Aumolertinib对EGFR敏感突变和T790M耐药突变的抑制作用强于对EGFR野生型的抑制,该药物通过选择性抑制突变型EGFR从而降低毒副作用,而且该药物具有更高的血脑屏障穿透率[12-16]。目前Aumolertinib于2021年在我国获批用于EGFR T790M阳性非小细胞肺癌患者的治疗。
最近有研究发现EGFR在脉络膜和脉络膜黑色素瘤细胞上有表达,并且在脉络膜黑色素瘤细胞中表达量的多少与发生肝脏转移的早晚和患者生存期长短密切相关[17,18]。Amaro A对48例脉络膜黑色素瘤组织病理标本和14个脉络膜黑色素瘤细胞系进行研究,发现均高表达EGFR,并且表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs)对其有明显的抑制作用,提出EGFR可能是治疗脉络膜黑色素瘤的一个新的药物靶点[19]。目前Aumolertinib对脉络膜黑色素瘤体内外生长的影响以及具体的抗肿瘤机制尚无报道。本研究在体外考察Aumolertinib对人脉络膜黑色素瘤MUM-2B细胞增殖的影响,然后通过流式细胞仪研究Aumolertinib 对MUM-2B细胞凋亡坏死、线粒体膜电位、细胞内ROS和细胞周期分布的影响,最后构建MUM-2B 细胞裸鼠模型来评估Aumolertinib体内抗肿瘤作用,旨在评价Aumolertinib治疗脉络膜黑色素瘤的临床应用可行性,并提供相应的理论和实验依据。
1 材料和方法
1.1 材料
人脉络膜黑色素瘤细胞株MUM-2B(ATCC)。Aumolertinib(江苏豪森药业有限公司赠送),DMEM高糖培养基(中桥新舟),胎牛血清(四季青),CCK-8、Annexin Ⅴ-FITC细胞凋亡检测试剂盒、活性氧检测试剂盒(线粒体膜电位检测试剂盒(JC-1)、细胞周期与细胞凋亡检测试剂盒、0.25%胰酶消化液(含EDTA/不含EDTA)(碧云天)。
1.2 方法
1.2.1 细胞培养 MUM-2B细胞培养于含10%胎牛血清和双抗的DMEM高糖培养基中,培养箱条件为5%CO2,温度37 ℃。
1.2.2 CCK-8检测细胞存活率 制备MUM-2B细胞悬液,以5×103/孔的密度接种于96孔板,置于5%CO2,温度37 ℃培养箱培养过夜后,细胞贴壁,然后对细胞进行加药处理,根据设置的不同加入不同浓度的Aumolertinib溶液(0、2、4、6、8、10 μmol/L)100 μL,每组设置6个复孔,在培养箱继续培养36 h、72 h后,每孔加入20 μL的CCK-8溶液,培养箱继续培养2 h后,酶标仪设置450 nm,检测此波长下各个孔的吸光度值A450nm,重复实验3次。计算公式:细胞存活率(%)=(实验组A/对照组A)×100%。
1.2.3 倒置显微镜观察细胞形态 将对数生长期的MUM-2B细胞制成单细胞悬液,以1.5×105/孔的密度接种于6孔板中。将细胞放在5%CO2,温度37 ℃培养箱中培养24 h,加入不同浓度梯度的Aumolertinib 溶液(0、2、4、6、8、10 μmol/L),作用24 h后倒置显微镜观察MUM-2B细胞形态及密度。
1.2.4 细胞集落克隆形成抑制实验 将MUM-2B单细胞悬液以5×103/孔的密度接种于6孔板中,继续培养24 h,待细胞贴壁,根据设置的不同加入不同浓度的Aumolertinib 溶液(0、0.4、0.6、0.8μmol/L),继续培养7天,随后使用PBS洗涤细胞2次,然后使用4%的多聚甲醛固定15 min,然后使用PBS洗涤3次,加入结晶紫染液染色15 min,结束后使用水洗3次,自然晾干,对6孔板进行拍照处理,同时使用倒置显微镜计数,细胞个数超过50的单克隆作为计数条件。
1.2.5 凋亡坏死情况 将制备好的MUM-2B单细胞悬液以1×105/孔的密度铺板于6孔板中,将细胞放置于5%CO2,温度37 ℃培养箱中培养24 h,然后对细胞进行加药处理,根据设置不同加入不同浓度的Aumolertinib 溶液(0、2、4、6、8、10 μmol/L),继续培养24 h,观察各组细胞的生长状态,按浓度收集上清备用,PBS 洗涤细胞两次,0.25%胰酶消化液(不含EDTA)消化细胞,按照Annexin Ⅴ-FITC细胞凋亡试剂盒使用说明,对细胞进行Annexin Ⅴ和PI 双染,之后使用流式细胞仪进行分析。
1.2.6 线粒体膜电位变化 将制备好的MUM-2B单细胞悬液以1×105/孔的密度铺板于6孔板中,将细胞放在5%CO2,温度37 ℃培养箱中培养24 h,然后对细胞进行加药处理,根据设置的不同加入不同浓度的Aumolertinib溶液(0、2、4、6、8、10 μmol/L),上清去除,PBS洗涤细胞两次,每孔加入0.25%的胰酶溶液(不含EDTA)0.7 mL,消化收集细胞,之后按照线粒体膜电位检测试剂盒步骤处理进行染色,最后使用流式细胞仪进行分析。
1.2.7 活性氧(ROS)变化 将制备好的MUM-2B单细胞悬液以1×105/孔的密度铺板于6孔板中,将细胞放置于5%CO2,温度37 ℃培养箱中培养24 h,然后对细胞进行加药处理,根据设置的不同加入不同浓度的Aumolertinib 溶液(0、2、4、6、8、10 μmol/L),上清去除,PBS洗涤细胞两次,每孔加入0.25%胰酶溶液(不含EDTA)0.7 mL,消化收集细胞,重悬于1 mL 含有10 μmol/L 2′,7′-二氯二氢荧光素(DCF-DA)的无血清培养基中,在37 ℃培养箱中孵育20 min,期间每隔3~5 min上下颠倒1次,然后使用无血清培养基洗涤细胞3次,200 μL PBS重悬之后使用流式细胞仪进行分析,激发光488 nm 发射光525 nm。
1.2.8 细胞周期阻滞情况 将制备好的MUM-2B单细胞悬液以1×105/孔的密度铺板于6孔板中,将细胞放置于5%CO2,温度37 ℃培养箱中培养24 h,然后对细胞进行加药处理,根据设置的不同加入不同浓度的Aumolertinib溶液(0、2、4、6、8、10 μmol/L),收集上清,PBS 洗涤细胞两次,每孔加入0.25%胰酶溶液(不含EDTA)0.7 mL,消化收集细胞,之后按照细胞周期与细胞凋亡检测试剂盒处理,然后使用流式细胞仪进行分析。
1.2.9 考察Aumolertinib 体内抗肿瘤活性 选择雌性nu/nu小鼠作为实验鼠,取生长状况良好的MUM-2B细胞,用无菌PBS重悬配置成密度为5×107/mL的悬液,放在4 ℃冰上保存,接种于裸鼠的右背部,使用皮下注射的方式进行种瘤,每只裸鼠注射100 μL细胞悬液。待接种成功,肿瘤体积达到100 mm3左右时,将裸鼠随机分为2组,HS-10296实验组(40 mg/kg)和对照组,每组6只裸鼠。通过腹腔注射的方式进行给药,每3 d给药1次,并测量裸鼠体质量及肿瘤大小,计算瘤体积,瘤体积=1/2(L×W2)。给药8次后,将裸鼠进行脊椎脱臼处死,把瘤体从裸鼠体内剥出,拍照并称量瘤组织的质量,同时测量肿瘤的长度和宽度,计算肿瘤体积。
1.3 统计分析方法
采用GraphPad PrismⅤersion7 软件对实验结果进行分析,数据以均数±标准差表示,采用单因素方差分析和LSD检验比较组间差异,P<0.05为差异具有统计学意义。
2 结果
2.1 Aumolertinib对MUM-2B细胞的增殖抑制作用
Aumolertinib对MUM-2B细胞增殖的影响(图1A),随着Aumolertinib浓度增加,细胞形态逐渐变圆,漂浮细胞增多,细胞密度显著下降,细胞折光增加,细胞内可见强光点。CCK-8结果显示,随着给药浓度的增加,Aumolertinib对MUM-2B细胞的增殖抑制作用明显增加,呈现浓度和时间依赖性,36 h、72 h 的IC50值分别为7.684、6.871µmol/L(P<0.05,图1B)。根据CCK-8的实验结果,我们选用低浓度的的Aumolertinib(0.4、0.6、0.8 μmol/L)作用于Mum-2B 细胞,观察Aumolertinib 对MUM-2B细胞集落形成的影响,随着药物浓度的增加,细胞集落形成明显减少(P<0.05,图1C),当给药浓度为0.6148 μmol/L时,集落形成抑制率为50%(图1D)。
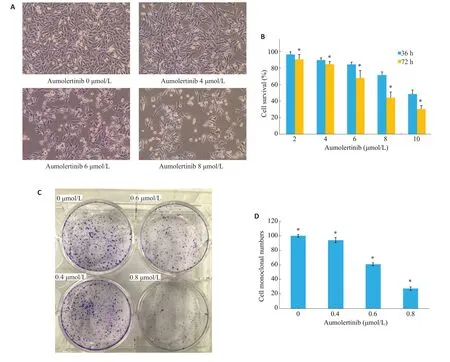
图1 Aumolertinib对MUM-2B增殖的影响Fig.1 Inhibitory effect of aumolertinib on proliferation of MUM-2B cells in vitro.A:MUM-2B cells treated with different concentrations of aumolertinib for 24 h(inverted microscopy,orignal magnification:×100).B:Viability of MUM-2B cells treated with different concentrations of aumolertinib for 36 h or 72 h detected by CCK-8 assay.*P<0.05 vs 36 h.C,D:Colony formation of MUM-2B cells treated with aumolertinib(0,0.4,0.6,or 0.8 μmol/L)for 7 days.*P<0.05 vs 0 μmol/L.
2.2 Aumolertinib诱导MUM-2B细胞发生凋亡
Annexin Ⅴ-FITC/PI实验结果显示,与对照组相比,随着Aumolertinib浓度的增加(4、6、8 μmol/L),MUM-2B 细胞凋亡率逐渐提高,分别为45.2%、54.15%及76.65%,差异均具有统计学意义(P<0.01,图2)。
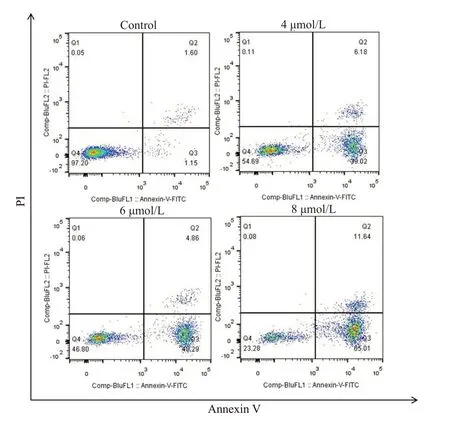
图2 Aumolertinib对MUM-2B细胞凋亡的影响Fig.2 Effect of different concentrations of aumolertinib for 24 h on apoptosis and necrosis of MUM-2B cells analyzed by flow cytometry.
2.3 Aumolertinib降低MUM-2B细胞线粒体膜电位
与对照组相比,随着Aumolertinib浓度的增加(4、6和8 μmol/L),MUM-2B细胞的线粒体膜电位逐渐降低,分别是11.08%,22.76%,67.42%,差异均具有统计学意义(P<0.01,图3)。
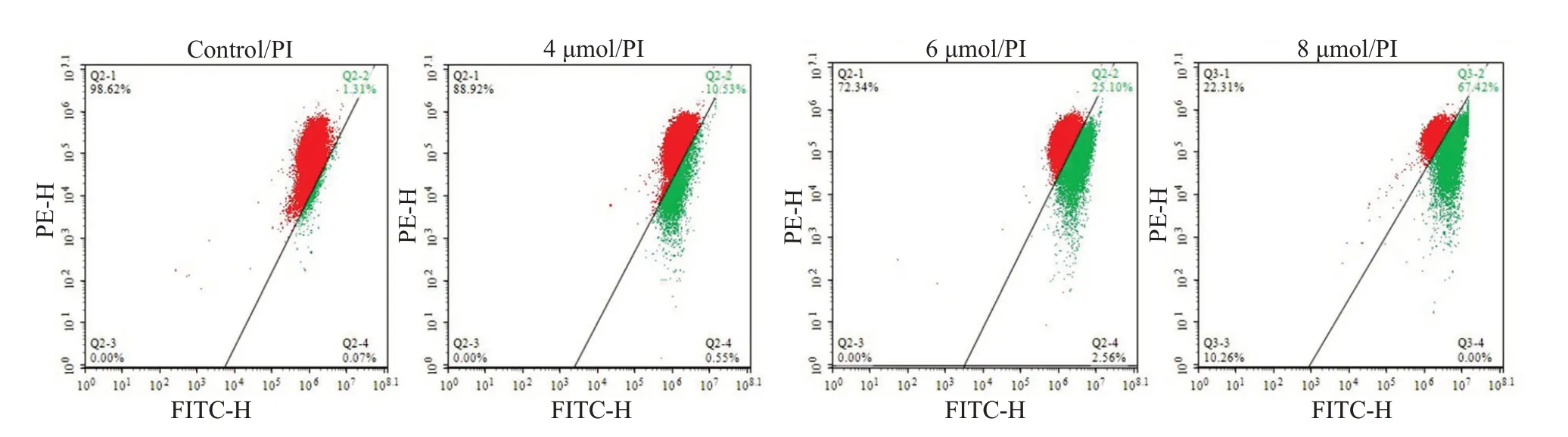
图3 Aumolertinib对MUM-2B细胞线粒体膜电位的影响Fig.3 Effect of different concentrations of aumolertinib for 24 h on the mitochondrial membrane potential (Δψm) of MUM-2B cells analyzed using flow cytometry.
2.4 Aumolertinib诱导MUM-2B细胞发生细胞周期阻滞
细胞周期与细胞凋亡实验结果显示,与对照组相比,不同浓度的Aumolertinib明显影响MUM-2B细胞的周期分布,随着药物浓度的增加(4、6、8 μmol/L),显著降低了处于S和G2期的细胞比例,而使处于G1期的细胞比例大量增加。
2.5 Aumolertinib增加MUM-2B细胞内活性氧水平
活性氧检测实验结果显示(图5),与对照组相比,随着Aumolertinib浓度的增加(4、6和8 μmol/L),MUM-2B细胞内的活性氧水平逐渐增加。
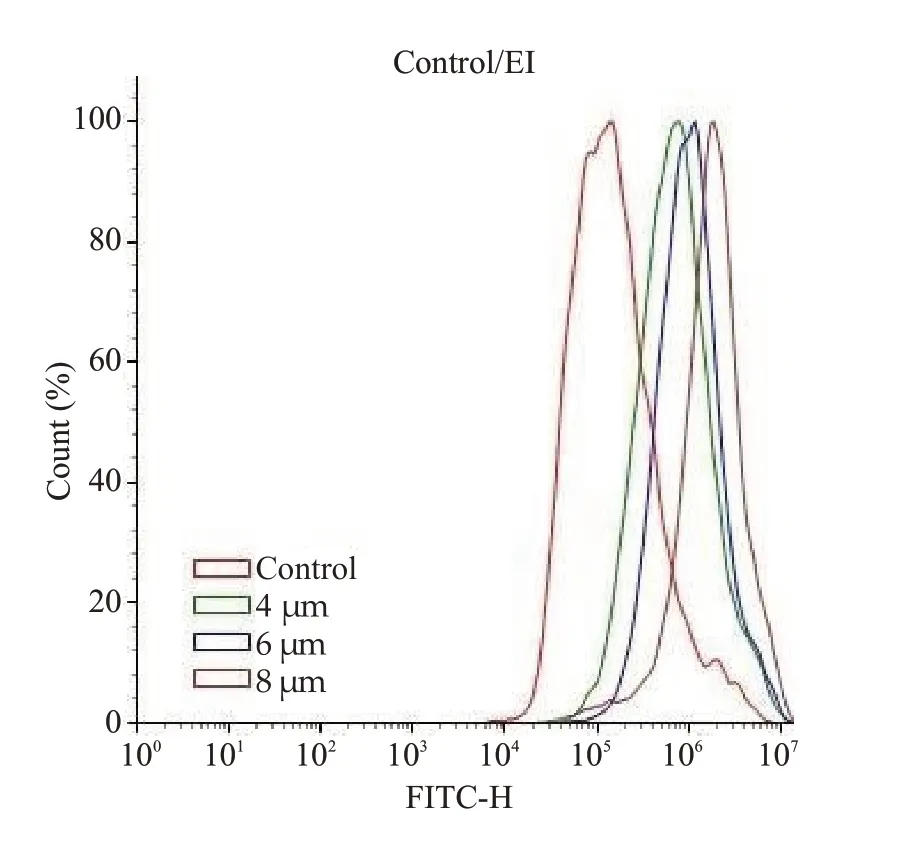
图5 Aumolertinib对MUM-2B细胞内活性氧的影响Fig.5 Effect of different concentrations of aumolertinib for 24 h on ROS production in MUM-2B cells.
2.6 Aumolertinib体内抗肿瘤活性
Aumolertinib实验组的瘤体大小、体积均明显小于对照组,25 d 的给药组和对照组的瘤体积分别为178.6 mm3和567.8 mm3(图6A、B,P<0.05)。两组小鼠体质量变化曲线结果显示,Aumolertinib实验组小鼠体质量小于对照组(图6C,P<0.05)。
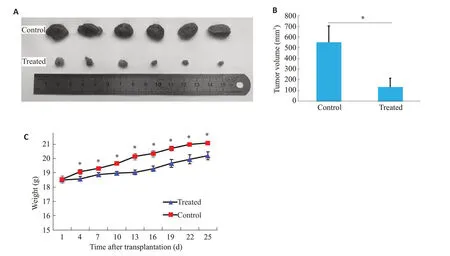
图6 Aumolertinib在体内的抗肿瘤作用Fig.6 Antitumor effect of aumolertinib on MUM-2B cell xenograft in nude mice.A:Representative images of tumors from the control group and experimental group.B:Tumor volume in the two groups.C:Body weight of the mice.*P<0.05 vs the treated group.
3 讨论
脉络膜黑色素瘤的发病机制复杂,多条信号通路被激活,其中包括MAPK通路和PI3K/AKT通路等,目前临床已经采用的系统治疗方法包括全身化疗、免疫治疗、针对MAPK通路的靶向药物和肝靶向治疗,但反应率一般低于10%,均不能有效改善患者中期生存率[6]。Aumolertinib属于小分子靶向抗肿瘤药物,其作用机制是通过靶向EGFR的ATP结合域,与多种致癌酪氨酸激酶催化域的ATP位点结合,减弱参与癌症增殖、侵袭、转移和血管生成的下游信号通路,抑制其磷酸化而阻断信号向下游传导至MAP-MEK和PI3K-AKT信号通路,从而抑制细胞增殖和凋亡[12]。最近有研究发现,Aumolertinib在其他肿瘤上也显现出显著的抑制作用,葛贤明等[13]研究发现Aumolertinib 可通过抑制EGFR/PI3K/AKT信号通路,抑制MDA-MB-231细胞增殖,诱导细胞发生自噬和凋亡。另外还有研究发现Aumolertinib可以使过表达ABCB1的多药耐药癌细胞对化疗药物重新敏感起来[14]。本研究结果显示Aumolertinib作为一种EGFR-TKI,在对人脉络膜黑色素瘤体外和体内试验中均具有显著的抑制作用,可有效抑MUM-2B细胞的生长增殖及诱导细胞凋亡坏死。不同浓度Aumolertinib作用MUM-2B细胞后,经CCK-8试验、细胞集落克隆检测分析,Aumolertinib 能够有效抑制细胞的存活和增殖,并呈浓度、时间依赖性;接下来我们采用Annexin Ⅴ/PI双染试剂盒和流式细胞仪深入考察其死亡机制,实验结果说明Aumolertinib对MUM-2B细胞的作用是通过有效诱导细胞凋亡和坏死实现的。细胞凋亡是细胞在受到病理或生理性刺激下,为维持内环境稳定,出现的一种自发性程序性死亡过程,在肿瘤的发生、发展过程中起着重要作用[20-24]。因此,诱导细胞凋亡可能是Aumolertinib 抑制MUM-2B 细胞增殖的主要机制。
线粒体膜电位降低是细胞凋亡早期标志性事件[25-28]。为了进一步考察Aumolertinib的抗肿瘤机制,本研究采用JC-1探针检测MUM-2B线粒体膜电位的变化,当线粒体膜电位降低时,JC-1探针的荧光将会由红色向绿色转变[29],试验结果表明,与对照组相比,随着Aumolertinib浓度的增加MUM-2B细胞的线粒体膜电位显著降低,意味着线粒体膜受到损伤而崩解,同时释放与细胞凋亡相关的细胞信号分子,进而启动细胞凋亡途径。
细胞在正常生理条件下可以产生ROS,但是当细胞受缺氧、缺血再灌注、线粒体呼吸抑制等情况下,ROS的产生会显著增加,这是细胞应对外界刺激的一种自我防御机制[30-32]。本研究利用DCF-DA探针标记MUM-2B细胞内的ROS水平,结果表明随着Aumolertinib浓度增加,细胞内的ROS明显增加。根据实验结果我们推断,Aumolertinib损伤MUM-2B细胞内的生物分子或者亚细胞结构,造成细胞产生氧化压力而产生ROS作为信号分子,启动细胞凋亡信号途径,最终导致细胞死亡。
为了深入探讨其死亡机制,我们利用细胞凋亡和细胞周期试剂盒标记并利用流式细胞仪进行分析MUM-2B细胞的周期分布,试验结果表明Aumolertinib可引起MUM-2B细胞阻滞于G1/M期,阻止细胞进入细胞分裂期(M期),最终诱导细胞启动细胞凋亡信号途径。Aumolertinib在体外实验中表现出具有较好的抗肿瘤效果,为验证其体内抗肿瘤活性,本研究采用了裸鼠荷瘤模型,Aumolertinib能够明显抑制肿瘤细胞生长且不会引起小鼠体质量明显减轻。
综上所述,Aumolertinib在体外、体内均具有显著的抗人脉络膜黑色素瘤的作用,其机制可能是通过降低细胞线粒体膜电位、细胞内ROS增多、诱导细胞发生G1期阻滞等多种途径最终导致细胞凋亡坏死。这项研究为Aumolertinib在脉络膜黑色素瘤中的应用提供了可能性,但是仍需要更多的工作来研究药代动力学,药效学等方面的相关机制。
