Fkbp38 基因缺失导致小鼠早发性卵巢功能不全:基于激活mTOR通路并诱导细胞凋亡
2022-12-05周玉霞赵茴茴佘加杰刁瑞英汪丽萍
周玉霞,赵茴茴,帅 领,佘加杰,刁瑞英,汪丽萍,
1南方医科大学南方医院妇产科,广东 广州 510515;2深圳市第二人民医院生殖医学科,广东 深圳 518035
早发性卵巢功能不全(POI)是指女性在40岁之前发现卵巢排卵功能障碍及性激素水平紊乱的一种临床综合征[1]。据流行病学统计,40岁以下女性POI发病率为1%,且呈现年轻化发展趋势[2]。POI的病因包括遗传因素(染色体异常和基因变异)、医源性因素(卵巢手术或细胞毒性癌症治疗)、免疫因素(自身免疫性甲状腺疾病、Addison病)、环境因素等[3-5]。POI无特效疗法,主要采用雌孕激素序贯疗法和生育力保存[6],激素治疗副作用大,而生育力保存疗法成本高,无疑给患者带来巨大的身体、精神和经济负担。因此,阐明POI的发病机制显得尤为重要。
雷帕霉素靶蛋白(mTOR)信号通路在哺乳动物生命活动中起着中心枢纽作用,细胞内外多种信号通路上的生长因子、激素、应激和能量转化代谢等相关因素通过激活mTOR信号通路,从而调控细胞生长、增殖、自噬与凋亡等生理过程[7,8]。FKBP38 是mTOR 复合物1(mTORC1)组份之一。研究发现mTORC1调节卵泡发育,激活mTORC1会导致原始卵泡池过度活化,从而导致卵巢早衰和不孕症[9]。FKBP38是mTOR信号通路的内源性抑制剂[10]。mTOR通过调节哺乳动物甾醇调节元件结合蛋白(SREBPs)促进脂肪生成,FKBP38可通过抑制mTOR/SREBPs 通路在体外和体内降低脂质含量[11]。研究表明FKBP38可以招募B细胞淋巴瘤/白血病-2(BCL-2)蛋白到线粒体膜上,从而抑制细胞凋亡[12,13]。mTORC1调节卵泡发育及Fkbp38抑制细胞凋亡作用已被证实,但尚未有Fkbp38 在卵泡发育中及POI发生发展中的任何研究。
目前关于POI病因研究中基因变异研究最多,主要是选择在卵泡形成中起作用的基因作为候选基因,通过构建细胞特异性敲除转基因小鼠模型研究POI病因[14]。POI的确切病因研究仍具有挑战性,对某些基因和基因产物的评估可能有助于产生提高生育能力的药物。因此,本研究拟构建卵母细胞特异性敲除Fkbp38转基因小鼠,通过探索Fkbp38基因在卵泡发育中的作用及在POI疾病发生发展中可能的作用机制,为临床POI防治提供新的思路。
1 材料和方法
1.1 实验动物
Gdf9cre+小鼠[011062-STOCKTg(Gdf9-icre)5092Coo/J,Jackson实验室]。Fkbp38flox/flox小鼠(南京医科大学赵子健教授实验室赠送)。相关实验已通过动物伦理审核。
1.2 试剂及耗材
鼠尾基因组裂解液(南方医科大学细胞生物学实验室配制);ELISA检测试剂盒(Elabscience);FKBP38一抗(Sigma);PS6 一抗(Cell Signaling Technology);BCL-2一抗(ImmunoWay);BAX一抗(Abclonal);激光共聚焦显微镜FluoⅤiew FⅤ1000(Olympus)。
1.3 构建转基因小鼠及PCR鉴定基因型
将F0代Gdf9cre+小鼠和Fkbp38loxp/loxp小鼠交配得到F1代,选基因型为Fkbp38loxp/+Gdf9cre+雄性小鼠与纯合的Fkbp38loxp/loxp雌性小鼠回交,获得F2 代Fkbp38loxp/loxpGdf9cre+雌性小鼠即为卵母细胞特异性敲除Fkbp38转基因小鼠(敲除鼠,即cKO鼠)。获得的基因型Fkbp38loxp/+Gdf9cre-、Fkbp38loxp/loxpGdf9cre-同窝雌性小鼠作为对照小鼠(对照鼠,即Ctrl鼠)。使用PCR方法鉴定小鼠基因型,根据成像条带大小判断鉴定结果。相关基因型鉴定的引物序列见:Gdf9-F: 5'-TCTGATGAAGTCAGG AAGAACC-3';Gdf9-R: 5'-GAGATGTCCTTCACTCT GATTC-3';Fkbp38-F: 5'-TCATGCAGGCAGAGTGC ACATAG-3';Fkbp38-R: 5'-CTGGAACTGGAGACTG GCTCCA-3'。
1.4 HE染色及卵泡计数
分别选cKO鼠和Ctrl鼠(4月龄、6月龄和8月龄)卵巢组织固定、脱水、包埋后行连续切片(6 μm/张),间隔5张取片,脱蜡水化,苏木素染液1 min,伊红染液2 min;封片后,在Nikon光学显微镜下拍照及计数,观察到卵母细胞核时计为一个卵泡,按照此方法对整个卵巢各阶段卵泡进行计数,镜下计数原始卵泡和初级卵泡数乘以系数5计为卵泡总数。
1.5 免疫荧光染色(IF)
卵巢石蜡切片脱蜡水化后,高温加热抗原修复5 min,5%山羊血清室温下封闭1 h,一抗稀释液4 ℃孵育过夜,37 ℃孵育对应的二抗1 h,DAPI染液封片;图像采集软件为FluoⅤiew FⅤ1000共聚焦显微镜(Olympus)。所用一抗:抗FKBP38 羊多克隆抗体(1∶100);抗PS6兔多克隆抗体(1∶100)、抗BCL-2 小鼠多克隆抗体(1∶100)、抗BAX兔多克隆抗体(1∶200)(×200,镜下5个视野)。
1.6 免疫组织化学染色(IHC)
脱蜡、水化、抗原修复处理步骤如免疫荧光染色;加3%过氧化氢室温10 min,以降低非特异性背景染色;5%山羊血清室温下封闭1 h;FKBP38抗体4 ℃孵育过夜;37 ℃孵育对应的二抗1 h;DAB显色剂镜下显色;复染、氨水返蓝、酒精梯度脱水、二甲苯透明处理后,中性树脂封片,正置光学显微镜观察和拍照。
1.7 末端脱氧核苷酸转移酶介导的dUTP原位切口末端标记(TUNEL)
取cKO鼠和Ctrl鼠卵巢切片,脱蜡水化后,在室温下蛋白酶K(10 mg/mL)透化10 min;接下来步骤按照TUNEL试剂说明进行操作,DAPI染液封片剂封片;使用FluoⅤiew FⅤ1000共聚焦显微镜(Olympus)采集图像;整个卵巢连续切片均等取5张切片,对TUNEL阳性信号即凋亡的颗粒细胞进行计数统计。
1.8 酶联免疫吸附实验(ELISA)
选取6月龄cKO鼠和Ctrl鼠,麻醉后,心脏采血,上清检测。ELISA方法检测血清卵泡刺激素(FSH)、雌激素(E2)、黄体生成素(LH)、抗苗勒管激素(AMH)、抑制素B(INHB)激素水平,所有激素检测按照试剂盒说明书进行。设置酶标仪测量各孔的吸光度A450nm。并使用origin2019计算标准曲线并进行浓度换算。
1.9 统计学方法
所有实验都经过3次或者3次以上的重复实验。数据表示为均数±标准差。使用SPSS 20.0软件进行数据统计学分析:两组之间的差异用独立样本t检验进行检验。P<0.05为差异具有统计学意义。使用GraphPad Prism 8及PS软件进行统计图的制作。
2 结果
2.1 成功构建卵母细胞特异性敲除Fkbp38转基因小鼠
生长分化因子9(GDF9)特异性表达于卵母细胞中,通过PCR程序扩增鉴定基因型发现:Gdf9Cre+产物大小为600 bp,Fkbp38loxp/loxp产物大小为272 bp,Fkbp38+/+大小为217 bp(图1A)。IF及IHC结果均显示,cKO鼠卵巢中卵母细胞FKBP38蛋白低表达或不表达,而Ctrl鼠卵母细胞FKBP38蛋白高表达(图1B)。
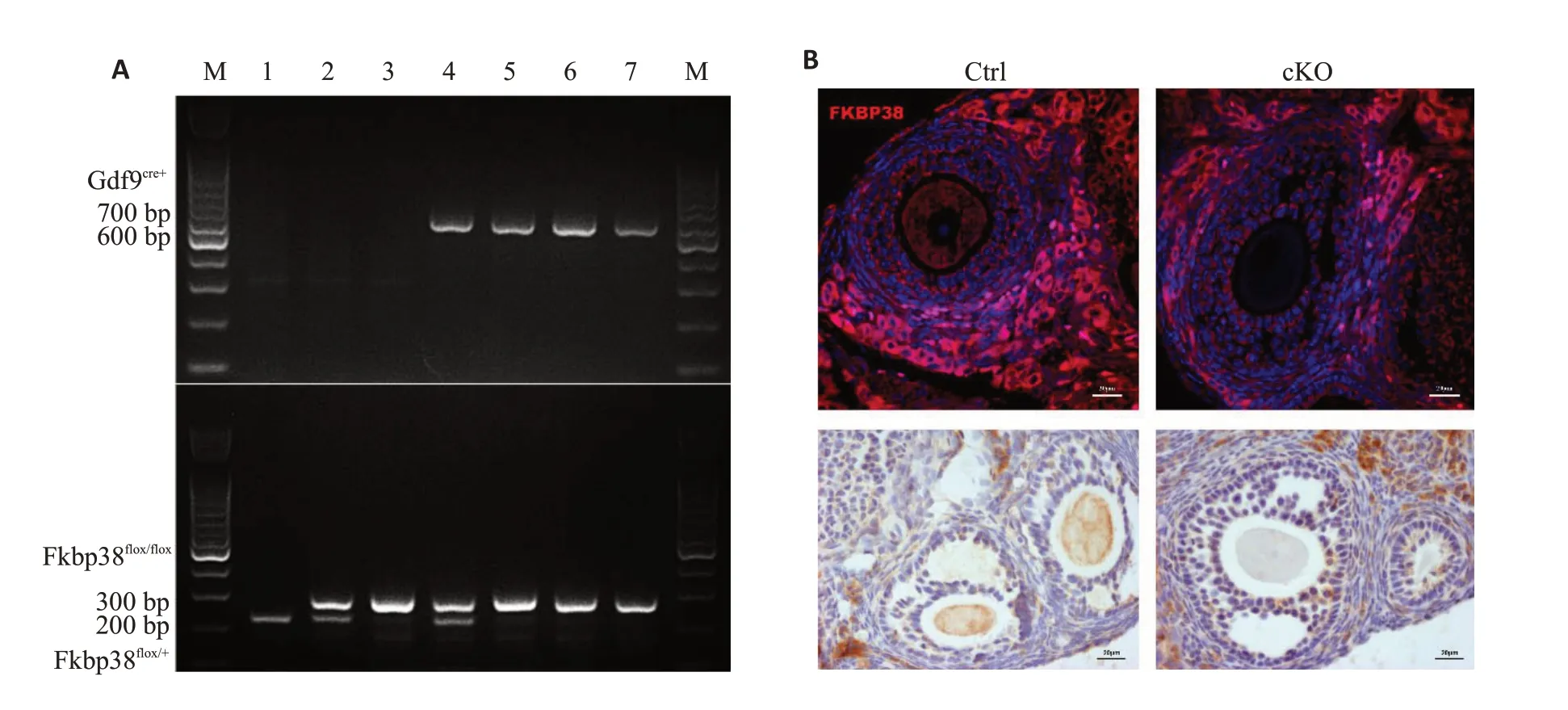
图1 成功构建卵母细胞特异性敲除Fkbp38转基因小鼠Fig.1 Construction of oocyte-specific Fkbp38 knockout transgenic mice.A:Genotyping of the offspring mice using PCR.B: Immunohistochemistry and immunofluorescence assay for detecting ovarian FKBP38 expression in the transgenic mice(Original magnification:×400).
2.2 卵母细胞缺失Fkbp38基因对卵巢卵泡发育的影响
Fkbp38敲除鼠成功构建后,我们需确定敲除鼠是否存在POI相关表型。选取4、6、8月龄cKO鼠与Ctrl鼠,两组不同年龄段cKO鼠较Ctrl鼠卵巢大体观无明显改变(图2A);不同年龄段小鼠体质量无明显差异(P>0.05,图2B);卵巢重量与体质量比值也未见明显差异(P>0.05,图2C)。进行cKO鼠与Ctrl鼠卵巢卵泡计数结果发现:4月龄时,cKO鼠较Ctrl鼠卵巢卵泡结构及各级卵泡计数无明显改变(P>0.05,图2D)。6月龄开始,cKO鼠较Ctrl 鼠原始卵泡显著下降(P<0.05,图2E);8 月龄时,cKO鼠原始卵泡、初级卵泡和次级卵泡均显著性下降(P<0.05,图2F)。
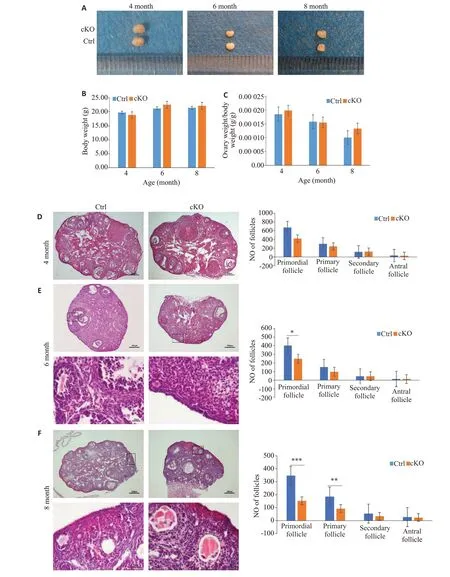
图2 卵母细胞特异性敲除Fkbp38转基因小鼠表现为卵泡发育障碍Fig.2 Follicular developmental disorders in oocyte-specific Fkbp38 knockout transgenic mice.Ovary size (A),ovarian weight(B)and ovarian-to-body weight ratio(C)were measured in 4,6 and 8 months old transgenic mice.DF:HE staining for assessing ovarian follicular development(×50).Ovarian follicle counting included the primordial,primary,secondary and antral follicles in 4,6 and 8 month old transgenic mice.In E and F,the lower panel shows the enlarged view(×400)of the boxed area in the upper panel.*P<0.05,**P<0.01,***P<0.001.
2.3 卵母细胞特异性敲除Fkbp38转基因小鼠生育力下降、性激素紊乱
繁殖实验结果显示cKO鼠较Ctrl鼠自连续合笼2个月开始产仔数减少,连续合笼至6个月时产仔数显著下降(P<0.05,图3A);cKO鼠较Ctrl鼠6个月的产仔总数也明显减少(P<0.05,图3B);cKO鼠妊娠周期延长,妊娠周期定义为自合笼日至产仔日之间的天数(图3C)。在血清性激素(E2、FSH、INHB、LH、AMH)水平上,cKO鼠血清中E2和INHB激素水平显著性下降(P<0.05,图3D、F);FSH激素水平显著性升高(P<0.05,图3E);LH水平未见明显差异(P>0.05,图3G);AMH激素水平下降(P>0.05,图3H),但差异不具有统计学意义。
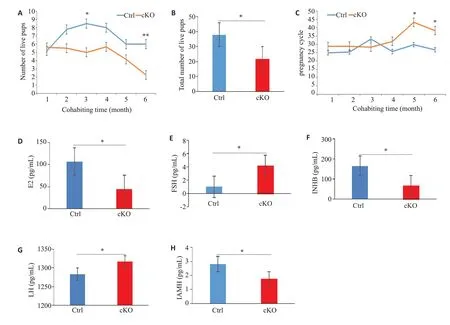
图3 卵母细胞缺失Fkbp38基因导致小鼠生育力下降及性激素紊乱Fig.3 Deletion of FKBP38 gene in oocytes leads to reduced fertility and sex hormone disorders in mice.A:Litters per month.B:Total litter size at 6 months.C:Pregnancy cycle.D:Serum sex hormone levels of E2(D),FSH(E),INHB(F),LH(G)andAMH(H)tested by ELISA.*P<0.05,**P<0.01 vs control.
2.4 卵母细胞缺失Fkbp38基因激活mTOR信号通路,颗粒细胞凋亡增加和卵母细胞内凋亡相关蛋白(BAX/BCL-2)比值升高
IF结果显示,cKO鼠较Ctrl鼠卵巢中PS6表达明显增强(图4A)。TUNEL检测发现,cKO鼠较Ctrl鼠卵巢颗粒细胞凋亡显著增加(图4B);cKO 鼠卵母细胞中BAX表达显著增强,BCL-2表达减弱,cKO鼠卵母细胞BAX/BCL-2比值升高(图4C)。
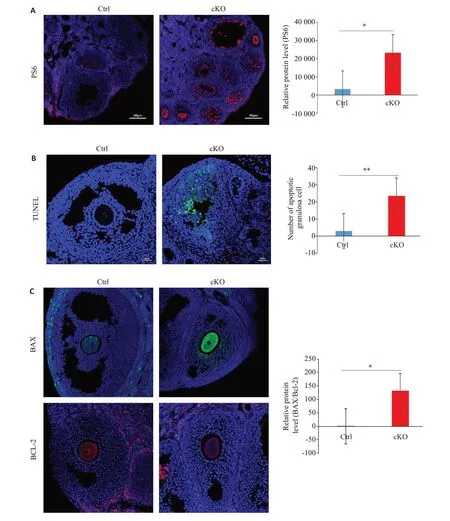
图4 卵母细胞缺失Fkbp38基因激活了mTOR信号通路,使卵母细胞抗凋亡能力下降、颗粒细胞凋亡增加Fig.4 Deletion of Fkbp38 gene in oocytes leads to activation of the mTOR signaling pathway,reduced antiapoptotic ability of the oocytes and apoptosis of granulosa cells.The expression of PS6(A),apoptotic granulosa cells (B),and expressions of BCL-2 and BAX (C) in the ovaries of Fkbp38 knockout mice are visualized using immunofluorescence assay(×200).*P<0.05,**P<0.01.
3 讨论
雌性生育能力取决于多个器官系统高度协调和精细控制,当精细控制网络出现中断时,可能导致POI发生[15]。卵巢中卵母细胞、颗粒细胞及卵泡膜细胞对卵泡发育成熟至关重要,原始卵泡过度活化、卵泡凋亡或卵泡闭锁加速,将导致POI[16]。本课题组前期研究发现对雷帕霉素不敏感的结构(RICTOR)/mTORC2在卵子发生、卵泡细胞存活中起重要作用[17]。mTOR信号通路在卵子发生中起重要调节作用。鉴于目前国内外尚未见Fkbp38基因在POI疾病发生发展的相关报道,于是我们构建了卵母细胞特异性敲除Fkbp38转基因小鼠模型,通过繁殖实验发现敲除鼠较对照鼠表现出生育力下降,进一步研究发现敲除鼠较对照鼠卵巢外观及质量无明显变化,但敲除鼠表现出卵巢原始卵泡、初级卵泡和次级卵泡均大量减少,表明Fkbp38在卵泡发育过程中起着重要作用。
众所周知,性激素水平在卵泡发育过程中起着关键性作用。抑制素B与生长中的卵泡直接相关,其可抑制卵母细胞的自发成熟,并且受卵巢衰老和整个月经周期中卵巢功能减退的影响[18]。在具有不同程度的促性腺激素亢进(即将发展为POI)的女性中,指标抗苗勒管激素(AMH)似乎是评估卵巢卵泡耗竭程度的更好参数,并且可能成为诊断POI更好的指标[19]。我们通过检测血清性激素水平,发现卵母细胞缺失Fkbp38基因会导致小鼠血清性激素水平发生紊乱,说明卵母细胞特异性敲除Fkbp38转基因小鼠模型能模拟POI疾病模型。
磷酸酯酶与张力蛋白同源物(PTEN)是mTOR的上游活化信号磷脂酰肌醇3 激酶(PI3K)的抑制分子,当在卵母细胞中敲除PTEN基因使PI3K通路过度激活后,会导致卵巢早衰[20]。同样,卵母细胞特异性敲除mTORC1上游抑制因子结节性硬化症基因1(TSC1)或结节性硬化症基因2(TSC2),激活mTORC1导致卵泡过度活化,发展为卵巢早衰[21,22]。有研究发现端粒酶缺陷小鼠肝脏、骨骼肌和心脏中,mTORC1的靶蛋白磷酸化核糖体S6(PS6)水平升高,从而激活mTOR 信号通路[23]。那么,通过检测mTOR信号通路下游靶蛋白PS6表达情况,确定卵母细胞特异性敲除Fkbp38是否会激活mTOR信号通路。本研究中敲除鼠卵母细胞中PS6蛋白表达增加,表明卵母细胞缺乏Fkbp38基因会激活mTOR信号通路。进而,激活mTOR信号通路使得卵巢原始卵泡过度被激活,而激活后的卵泡拥有更多的颗粒细胞,使不断增长的卵泡对mTOR信号通路的敏感性增加,导致卵泡储备的过早耗尽,最终导致POI。
FKBP38调节细胞存活、细胞凋亡、增殖和转移信号传导途径[24]。FKBP38作为抗凋亡蛋白BCL-2的分子伴侣,敲低Fkbp38可改变BCL-2定位并增加细胞凋亡,而过表达FKBP38能保护BCL-2免受半胱天冬酶依赖的降解从而抑制细胞凋亡[12]。有研究表明过表达FKBP38导致细胞内BCL-2蛋白的积累并降低BCL-2降解速率,siRNA干扰Fkbp38会降低BCL-2蛋白的细胞水平[25]。体内研究表明,人卵巢上皮性癌发生过程中FKBP38蛋白表达下调,提示FKBP38在肿瘤中起到抑癌基因的作用[26]。在小鼠胚胎敲除Fkbp38转基因模型研究中,发现敲除鼠出现脊髓和神经管严重缺陷,推测Fkbp38在脊髓形成期间具有抗凋亡作用。本研究中TUNEL实验结果表明卵母细胞缺失Fkbp38基因会导致颗粒细胞凋亡增加。BAX/BCL-2两蛋白表达的比例关系对抑制细胞凋亡作用起着重要作用,BAX/BCL-2蛋白表达比例越小,抑制细胞凋亡作用越强[28]。于是,我们通过检测BAX及BCL-2蛋白在卵母细胞中表达情况,发现敲除鼠较对照鼠卵母细胞中BAX/BCL-2两蛋白之间的比值增大,表明卵母细胞敲除Fkbp38基因会导致卵母细胞凋亡,最终导致POI发生。
因此,我们的研究揭示了Fkbp38基因在卵泡发育成熟中发挥重要作用;卵母细胞内Fkbp38基因缺失可能通过激活mTOR信号通路,从而调控凋亡相关信号通路使颗粒细胞及卵母细胞凋亡增加,导致各阶段卵泡数减少,使POI发生。本研究对细胞缺失Fkbp38基因在POI中的作用机制进行了初步探索,同时构建的转基因小鼠模型可用于卵巢卵泡领域的研究,为POI的防治提供了重要支撑。
