类黑色素纳米颗粒联合近红外光照射具有良好的抗卵巢癌作用
2022-12-05杨洁容陈小平
杨洁容,陈小平
广东省第二中医院妇科,广东 广州 510095
卵巢癌是女性生殖器官常见的肿瘤之一,发病率仅次于子宫颈癌和子宫体癌而列居第3位[1]。但因卵巢癌致死者占各类妇科肿瘤的首位,是严重威胁妇女生命的恶性肿瘤。因卵巢位于盆腔深处,难以扪及或筛查,卵巢癌早期又多无症状,70%的卵巢癌在诊断时就已扩散到子宫,双侧附件,大网膜及盆腔各器官,而且卵巢癌组织类型复杂,所以卵巢癌无论在诊断和治疗上都是目前研究的热点[2,3]。由于卵巢生长在女性盆腔的深部,位置隐蔽,无法直接看到或者触摸到,并且患者常常无明显的临床症状,导致80%以上的患者就诊时已为晚期,错过了治疗的最佳时期[4]。目前晚期卵巢癌患者的5年生存率仅为20%~40%,而早期患者却可以达到70%~90%[5]。
目前纳米载体介导的肿瘤光治疗,特别是具有代表性的光热治疗(PTT)和光动力治疗(PDT)已取得了很大进展[6]。光热治疗(PTT)是近年来被广泛研究的一种新型肿瘤治疗方法,利用具有较高光热转换效率的材料靶向肿瘤,并在近红外光(NIR)的照射下将光能转化为热能,利用癌细胞不耐热的特性来杀死癌细胞,具有副作用小、操作简单、治疗精准等优点[7,8]。PDT是基于光敏剂在肿瘤内的局部激活,以诱导化学损伤,从而导致肿瘤细胞死亡[9];这种方法在临床上已经应用了40多年,用于治疗各种癌症,包括浅表皮肤癌、食道癌和肺癌[10,11]。光热治疗肿瘤短期效果好,光动力治疗持续时间较长[12]。但无论是PTT或者PDT都有其不可避免的缺陷,单模式治疗难以彻底根除肿瘤,这仍然是一个尚未解决的重大问题,阻碍了PTT和PDT在临床上的广泛应用[13]。而PTT和PDT协同治疗的方法既继承了光治疗毒性低、副作用小的优点,又能使两种治疗方式取长补短,是提高疗效和减少毒副作用的有效策略。因此,构建一种新型PTT/PDT 协同治疗纳米药物体系,对肿瘤后期研究和临床治疗具有重要意义。黑色素及其类似物分布在许多生物中,由于其光吸收特性、光转化和亲和性,被广泛用作无处不在的生物材料。它们是应用于生物成像、光疗、抗氧化治疗和药物递送系统领域的极好的纳米载体。此外,值得注意的是,类黑色素(PDA)纳米颗粒可以调节免疫反应,正如乌贼墨中的纳米颗粒介导了M2-TAM 到M1 的复极。因此,黑色素和PDA纳米粒子是药物装载、光疗和免疫激活的合适纳米平台,而PDA纳米在卵巢癌肿瘤中的应用尚罕见报道。
在本研究中,我们制备了PDA纳米,采用透射电镜,水合粒径分析,Zeta电位分析及NIR照射分析其理化表征,同时验证了其在不同功率NIR照射下诱导卵巢癌细胞氧化应激、增殖转移能力的变化,为PDA纳米在卵巢癌中的转化与应用奠定基础。
1 材料和方法
1.1 主要试剂和仪器
盐酸多巴胺(98%)、水合钠(99%)和聚乙二醇(NH2mPEG-NH2 MW 2000,98%)从广州淡水有限公司(中国广州)获得。去离子(DI)水(18.2 MQcm),从水净化系统(Synergy,Millipore,MA)获得,用于所有制备过程。Zeta 电位和流体动力学直径测量由Zetasizer Nano ZS(Malvern)进行。
1.2 方法
1.2.1 类黑色素纳米的制备 将300 mg 盐酸多巴胺(1.95 mmol,阿拉丁)溶解在216 mL去离子水中。在50 ℃温度下,在剧烈搅拌下,向盐酸多巴胺溶液中加入1700 μL 的NaOH溶液(1 mol/L)。当溶液颜色变为淡黄色时,向溶液中加入NaOH,并逐渐变为深棕色。搅拌6 h 后,用离心过滤器(Amicon 离心过滤装置,MWCO=10 000 Da)进一步离心溶液,并用去离子水涤,重复3次。向5 mL类黑色素水溶液(5 mg/mL水)中加入1 mol/L NaOH 溶液,将溶液的pH调节至9。将该混合溶液滴加到25 mg pH=9的NH2-PEG2000-NH2水溶液中。剧烈搅拌8 h后,通过离心过滤器(Amicon 离心过滤器装置,MWCO=10 000 Da)离心回收PEG修饰的PDA NPs,然后用去离子水洗涤数次以除去未反应的NH2-PEG2000-NH2。最后,通过冷冻干燥除去水性溶剂,得到聚乙二醇修饰的PDA纳米粉末。
1.2.2 PDA纳米光热光动力性能评估 用808 nm波长的激光照射(0.7 W/cm2或1.0 W/cm2,5 min)处理PDA,作为热探针检测不同时间点的温度变化,同时选择等量的PBS进行相同激光照射作为阴性对照。温度变化的图像由红外成像设(ThermaCAMSC3000,Flir system Incorporation)在0.5 min内记录,共5 min。为了进一步验证PDT电位,通过DPBF定量分析PDA NPs 在NIR(0.7 W/cm2或1.0 W/cm2,5 min)下产生的活性氧(ROS)产量。
1.2.3 细胞培养 购买小鼠卵巢癌细胞(ID8,美国型培养物保藏中心),用杜尔贝科改良的Eagle 培养基(DMEM,Gibco)培养,并在37 ℃下添加10%胎牛血清(FBS,Gibco)和抗生素(100 U/mL),在5%CO2中培养。为了准备实验,将细胞分别接种到6孔板或96孔板中,并与添加有10%FBS的适当DMEM孵育。将制备的细胞暴露于具有10%FBS(Control对照组)、PDA组和PDA加NIR(0.7 W/cm2或1.0 W/cm2,5 min)。
1.2.4 细胞活性氧生成实验 将ID8细胞接种到6孔板中,培养24 h(37 ℃,5%CO2)。然后,将细胞分别进行Control、PDA、PDA联合NIR(0.7 W/cm2或1.0 W/cm2,5 min)处理后,再次孵育24 h。最后,将细胞与ROS测定试剂盒(中国南京凯根)孵育。
1.2.5 细胞线粒体膜电位实验 将ID8细胞接种到6孔板中,培养24 h(37 ℃,5%CO2)。然后,将细胞分别进行Control、PDA、PDA联合NIR(0.7 W/cm2或1.0W/cm2,5 min)处理后。再次孵育24 h后,用JC-1检测试剂盒(中国南京凯根)孵育细胞,JC-1探针孵育后会变成单体JC-1(绿色荧光)跟聚集体JC-1(红色荧光),而绿色荧光与红色荧光的比值即可代表线粒体膜电位状态。
1.2.6 CCK-8细胞毒性实验 将ID8细胞接种到96个平板中,在补充有10%FBS的DMEM中培养24 h。随后,将ID8 分别进行Control、PDA、PDA 联合NIR(0.7W/cm2或1.0 W/cm2,5 min)处理后,再次孵育24 h后,用CCK-8测定分析细胞存活率。
1.2.7 Transwell 实验 将ID8 分别进行Control、PDA、PDA联合NIR(0.7W/cm2或1.0 W/cm2,5 min)处理后,重新消化悬浮ID8细胞(2×105)并种植在直径8.0 μm的聚碳酸酯Costar®Transwell®两室移行板(康宁)的上室中。将介质(600 μL)加入6孔板的下层隔间。孵育24 h后,对下室细胞进行计数,评价细胞的侵袭和迁移能力。
1.2.8 类黑色素纳米颗粒的体内抗肿瘤效应 将ID8卵巢癌细胞注射于构建小鼠皮下单侧构建荷瘤模型,予尾静脉注射类黑色素纳米颗粒24 h后用NIR(0.7 W/cm2)照射单侧皮下肿瘤,连续记录小鼠瘤体体积并绘制生长曲线;2周后,用戊巴比妥对小鼠实施安乐死,对肿瘤组织进行称重及体积测量。
1.2.9 统计学分析 所有数据均采用IBM SPSS 20.0处理。计数资料组间比较则采用卡方检验。采用Kaplan-Meier法进行生存分析,并用Log-rank检验比较组间差异。以α=0.05为检验标准,对以上结果均进行双侧检验,P<0.05为差异具有统计学意义。
2 结果
2.1 类黑色素纳米颗粒的理化表征
本实验成功制备PDA-PEG纳米颗粒。透射电镜图所示:PDA-PEG纳米为约100 nm大小的圆球颗粒(图1A)。经由马尔文粒径仪数据所示:PDA-PEG纳米复合物粒径为100±5 nm,其平均Zeta电位分别为-20±2.1 mⅤ(图1B、C)。
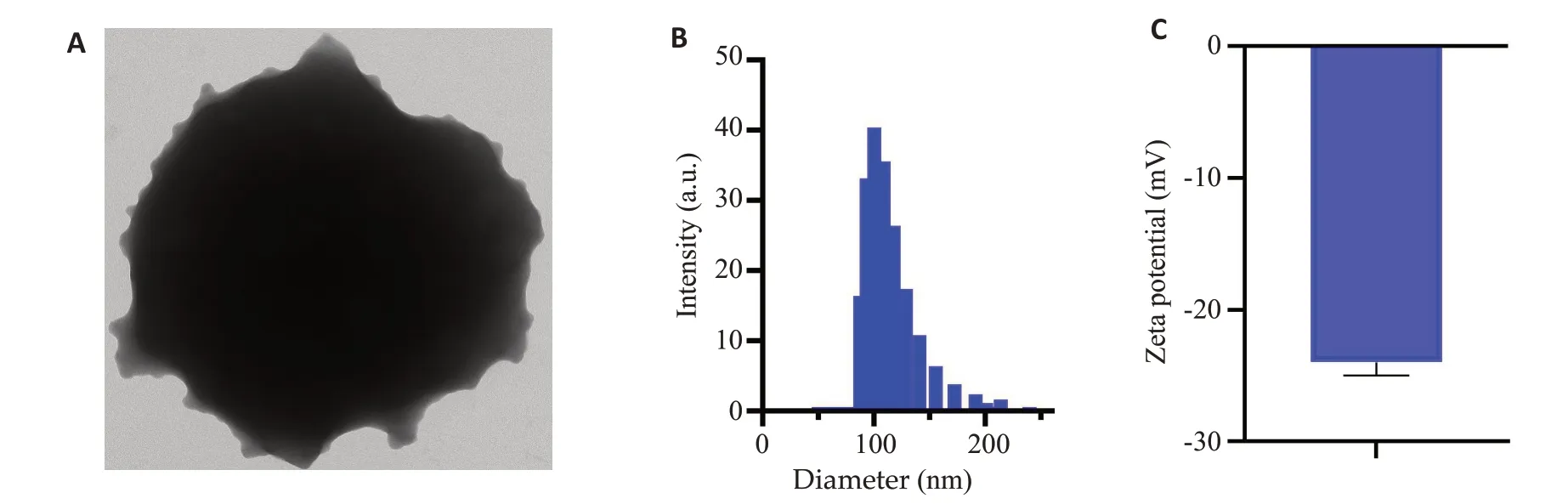
图1 PDA-PEG纳米的理化表征Fig.1 Characterization of PDA-PEG nanoparticles.A: Transmission electron microscopic images of PDA-PEG nanoparticles (Scale bar=50 nm).B: Particle size of PDA-PEG nanoparticles.C: Surface charge of PDA-PEG nanoparticles.Data are shown as Mean±SD(n=3).
2.2 类黑色素纳米颗粒的光热光动力性能
本研究利用近红外激发光(808 nm)对PDA-PEG纳米溶液进行激发,通过对温度曲线分析发现:相比于磷酸盐缓冲液(PBS,空白对照组),PDA-PEG纳米复合物在0.7 W/cm2以及1.0 W/cm2功率下的溶液温度呈先快速增高,后续缓慢升高趋势,其变化温度值(ΔT)分别约为15 ℃与30 ℃,显示出良好的光热性能(图2A)。通过单线氧生成曲线分析发现:相比于PBS(空白对照组),PDA-PEG纳米复合物在0.7 W/cm2以及1.0 W/cm2功率下均可见大量单线氧生成,且功率越大,活性氧生成越多(图2B)。
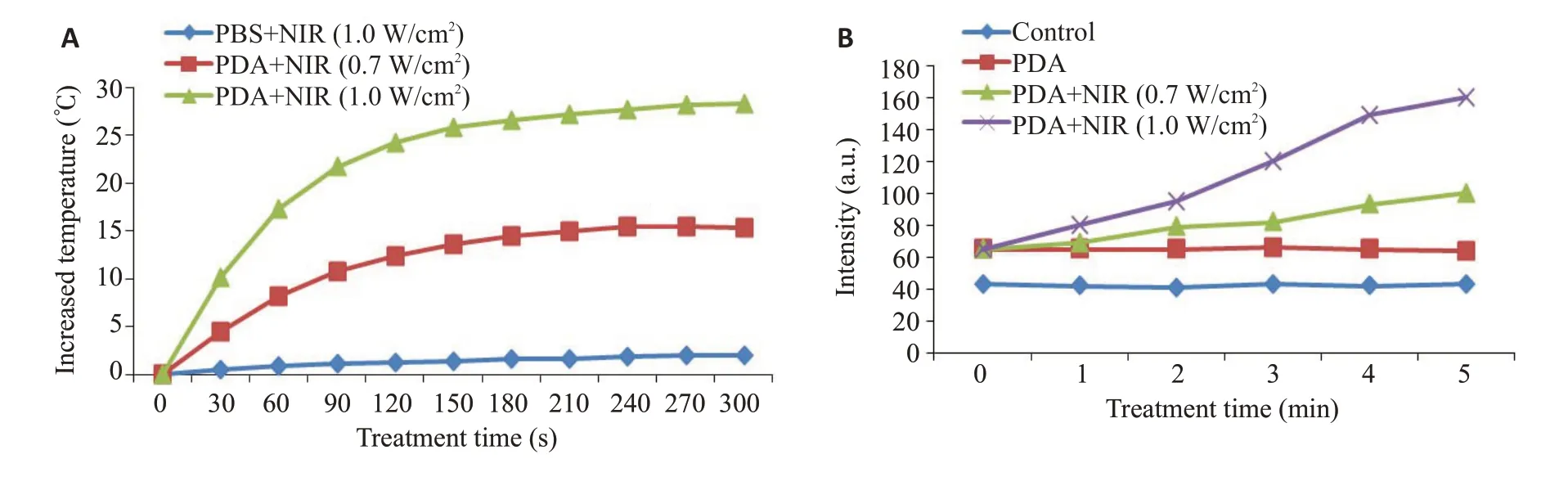
图2 PDA-PEG纳米的光热光动力性能Fig.2 Photothermal and photodynamic performance of PDA-PEG nanoparticles.A:Temperature curve generated by PDA-PEG nanoparticles and PBS in response to NIR irradiation at 0.7 and 1.0 W/cm2.B:Curve of singlet oxygen generation by PDA-PEG nanoparticles and PBS under NIR irradiation at 0.7 and 1.0 W/cm2.
2.3 类黑色素纳米颗粒可诱发卵巢癌细胞内活性氧生成
基于PDA-PEG纳米优良的光热光动力效应,我们进一步其在细胞内诱导氧化应激的能力。流式细胞学实验分析结果提示:相比于空白对照组,单纯材料组(PDA)不会引起细胞内活性氧(绿色荧光)生成,而PDA联合近红外光照射能显著提高ID8卵巢癌细胞内的活性氧(绿色荧光)生成能力(图3,P<0.001)。与此同时,相比较于低功率近红外(0.7 W/cm2)光照组,高功率近红外(1.0 W/cm2)处理的细胞内活性氧(绿色荧光)水平更高(图3,P<0.001)。
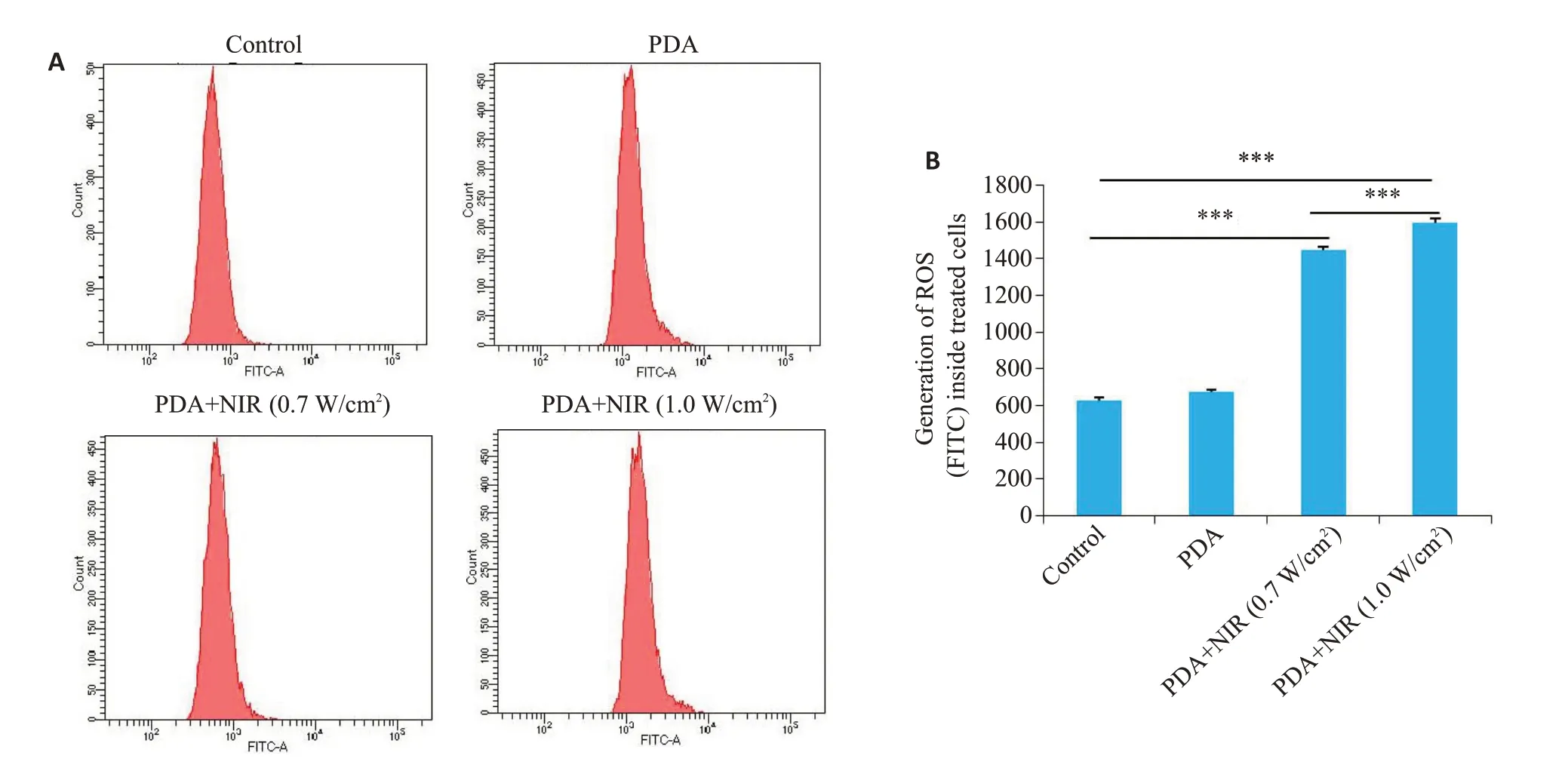
图3 PDA-PEG纳米的活性氧生成能力Fig.3 Ability of PDA-PEG nanoparticles for inducing reactive oxygen species(ROS)production.Flow cytometry was used for quantitative analysis of ROS production in ID8 cells following NIR irradiation at 0.7 or 1.0 W/cm2 for 5 mins.***P<0.001.Data are shown as Mean±SD(n=3).
2.4 类黑色素纳米颗粒可诱发卵巢癌细胞内线粒体膜电位失衡
流式细胞学实验分析结果提示:相比于空白对照组(control),单纯材料组(PDA)不会引起细胞内线粒体膜电位下降,而PDA联合近红外光照射能显著降低ID8卵巢癌细胞内的线粒体膜电位(红色荧光/绿色荧光;图4,P<0.001)。与此同时,相比较于低功率近红外(0.7 W/cm2)光照组,高功率近红外光照(1.0 W/cm2)的细胞线粒体膜电位水平更低下(红色荧光/绿色荧光;图4,P<0.01)。
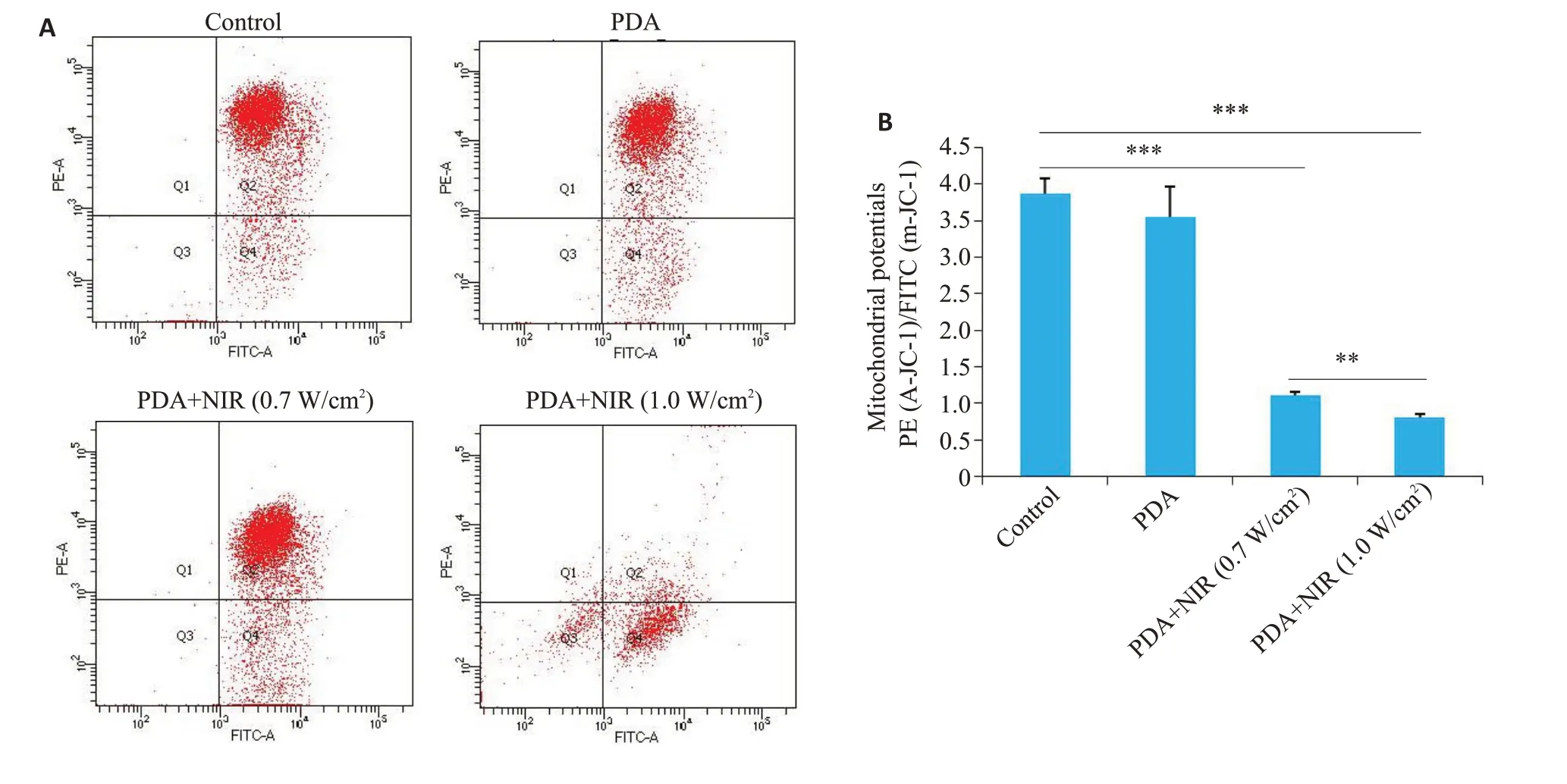
图4 PDA-PEG纳米诱导线粒体损伤的能力Fig.4 Flow cytometry for analyzing the ability of PDA-PEG nanoparticles for inducing mitochondria damage in ID8 cells with NIR irradiation at 0.7 or 1.0 W/cm2 for 5 mins.**P<0.01,***P<0.001.Data are shown as Mean±SD(n=3).
2.5 类黑色素纳米颗粒可诱导卵巢癌细胞死亡
CCK8实验(图5)表明:相比于纯材料(PDA)组,PDA联合近红外光照射能显著抑制ID8卵巢癌细胞的存活率(P<0.001)。与此同时,相比较于低功率近红外(0.7 W/cm2)光照组,高功率近红外(1.0W/cm2)光照处理的肿瘤细胞死亡率更高(P<0.001)。
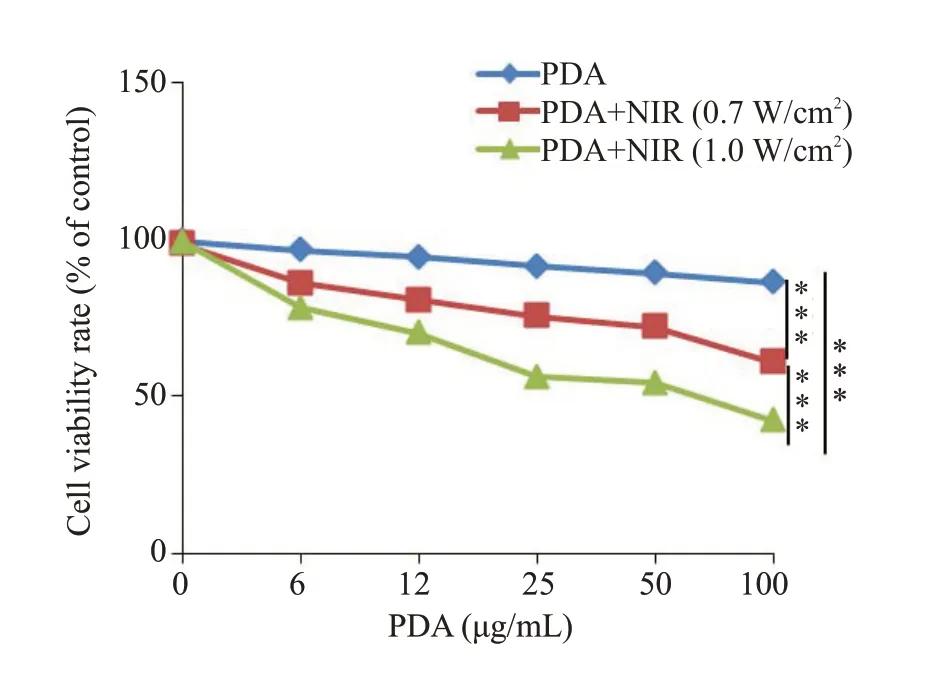
图5 通过CCK-8检测经PDA-PEG纳米联合近红外光诱导ID8 细胞死亡的能力Fig.5 ID8 cell death induced by PDA-PEG nanoparticles and NIR irradiation detected by CCK-8 assay.***P<0.001.Data are shown as Mean±SD(n=3).
2.6 类黑色素纳米颗粒可抑制卵巢癌细胞转移能力
Transwell细胞转移试验分析结果提示:相比于空白对照组,PDA 不会引起细胞的迁移能力的显著改变,而PDA 联合近红外光照射能显著抑制ID8 卵巢癌细胞的迁移能力(图6A、B,P<0.001)。与此同时,相比较于低功率近红外(0.7 W/cm2)光照组,高功率近红外(1.0 W/cm2)照射后ID8 的迁移细胞数目下降更明显(图6A、B,P<0.001)。
而Transwell细胞转移试验分析结果亦提示:相比于空白对照组,PDA不会引起细胞的侵袭能力的显著改变,而PDA联合近红外光照射能显著抑制ID8卵巢癌细胞的侵袭能力(图6C、D,P<0.001)。与此同时,相比较于低功率近红外(0.7 W/cm2)光照组,高功率近红外(1.0 W/cm2)照射后ID8的侵袭细胞数目下降更明显(图6C、D,P<0.001)。
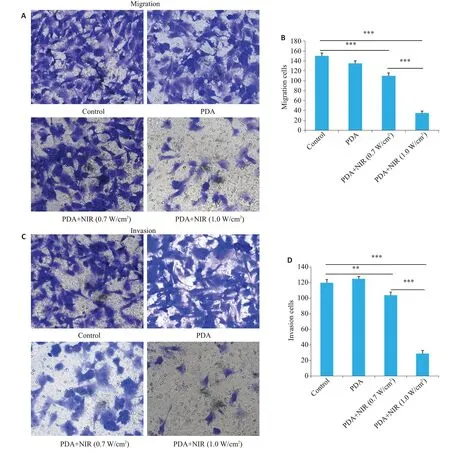
图6 PDA-PEG纳米联合近红外光抑制ID8卵巢癌细胞迁移与侵袭的能力Fig.6 PDA-PEG nanoparticles plus NIR irradiation(0.7 W/cm2 or 1.0 W/cm2 for 5 min)suppress migration and invasion of ID8 cells.A,B:Transwell assay for analyzing ID8 cell migration(Original magnification: ×200).C,D:Transwell assay for analyzing ID8 cell invasion(×200).**P<0.01,***P<0.001.Data are shown as Mean±SD(n=3).
2.7 类黑色素纳米颗粒的体内抗肿瘤效应
相对于生理盐水处理组,单纯的类黑色素纳米颗粒组没有显著抑制肿瘤生长,而PDA联合近红外光照射对肿瘤的抑制率高达70%(图7)。
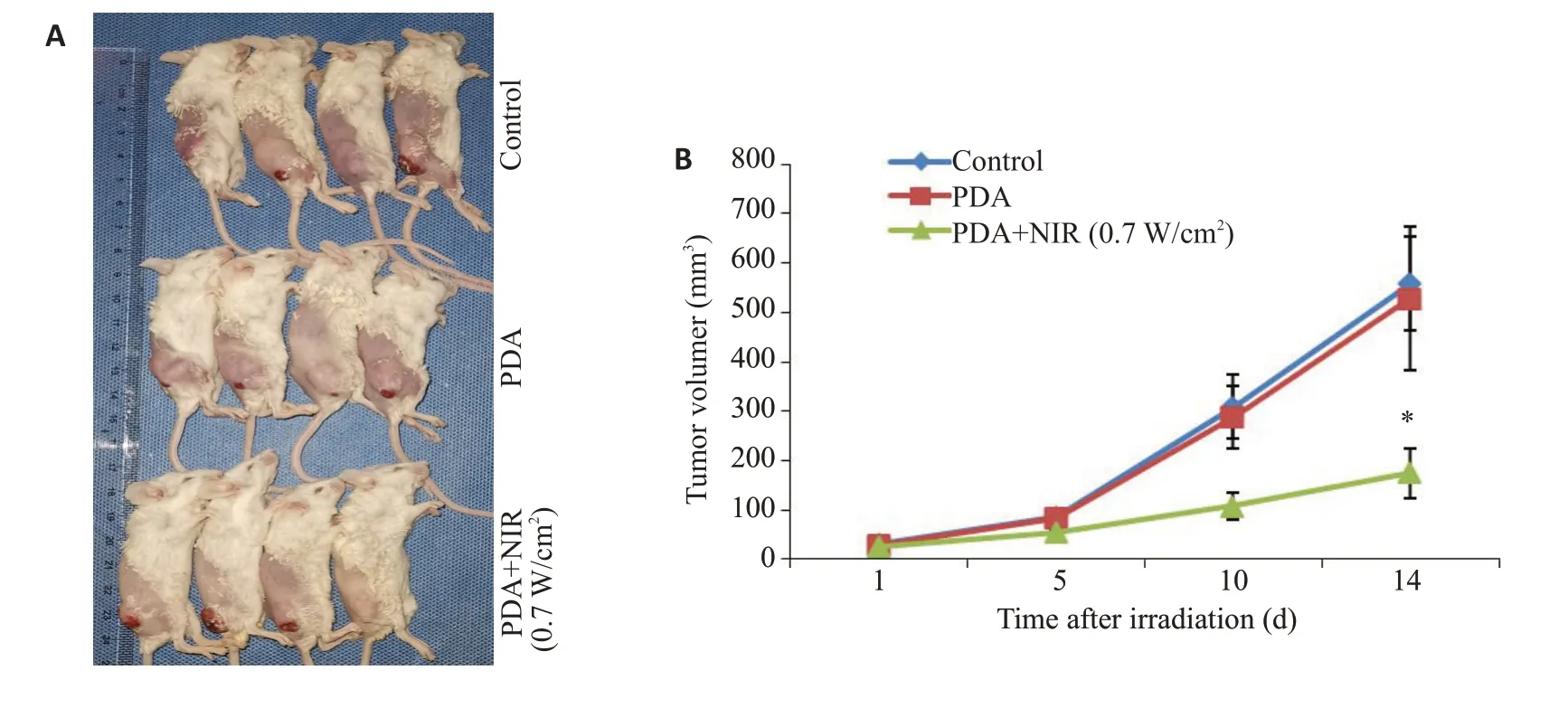
图7 PDA-PEG纳米体内抗肿瘤作用Fig.7 Anti-tumor effect of PDA-PEG nanoparticles in mice.A:The tumors in mice treated with PDA-PEG+NIR.B:Volume of the tumors dissected from the mice.Data are shown as Mean±SD(n=4).*P<0.001 vs control.
3 讨论
目前,针对新发卵巢癌患者,较为常用的治疗方法依然是手术和化疗相结合。根治性手术和化疗策略的关键进展提升了患者生存周期[13]。但卵巢癌依然存在较高的复发及治疗不佳患者。为了最大化地改善卵巢癌患者的预后,临床上一直在探索如何优化治疗方法,为患者提供更有效更经济的综合治疗方案。
近年来,基于近红外的光疗结合化疗,由于其精确的肿瘤定位、高效的消融能力和更好的生物相容性而被开发为一种理想的治疗策略[14]。肿瘤的光疗主要包括光热治疗(PTT)和光动力治疗(PDT)。对于光热治疗来说,在特定波长下的光照射光热剂,使得光热剂升温从而杀死肿瘤细胞[15];而对于光动力治疗来说,在特定的光照射下,光敏剂可以产生大量的活性氧自由基(ROS)从而可以杀死肿瘤细胞[16]。PDT还具有治疗其他肿瘤类型的潜力,有针对乳腺癌、头颈癌、胆管癌、膀胱癌、胰腺癌、宫颈癌的临床试验的支持性证据[17-20]。PTT可用于提高局部光加热和肿瘤组织消融的效率,但尚未在大型临床试验中进行测试;无PTT试剂的激光消融已在临床上使用[21],并且随着光热治疗的不断深入研究,细胞自身产生的热休克现象严重限制了光热治疗效率,单独使用PTT或PDT很难完全根除实体瘤[22]。因此,PTT和/或PDT与其他治疗方式的结合可以提供利用每种治疗方式的优点,从而产生附加的甚至是协同的治疗效果。天然黑色素有光吸收特性、抗肿瘤特性等突出优点[23],但由于天然黑色素会与蛋白质紧密结合,且难溶于有机溶剂和水[24]。近年来科学家们重点研究人工合成类黑色素,它们有着和天然黑色素相同的光学性质,因为其易合成的特点,现在也成为光热剂的热门材料[25]。本文研究的PDA作为类黑色素之一,它是一种光热性能良好的光热剂,它能够吸收光能高效地将其转化为热能,使肿瘤局部升温至45 ℃以上,进而杀死癌细胞,这种特性使PDA 在光热治疗方面有着较为良好的应用[26,27]。PDA具有超强的附着力,可粘附于各种材料的表面,对于其他材料进行修饰,而且PDA表面也存在大量的-OH基团,可以和其他金属离子反应[28],例如与Gd3+形成配位化合物,从而增强其载药或生物成像方面的特性[29];同时据研究报道,Li等[30]发现,具有精氨酸-甘氨酸-天冬氨酸-半胱氨酸(RGDC)功能并负载DOX的PDA可以有效地释放并诱导化学光热效应,产生显著的抗肿瘤效应;Liu等[31]证明天然黑色素纳米粒结合光热光动力学效应可以诱导肿瘤免疫原性细胞死亡,成功构建PDA包被的纳米颗粒用于靶向癌症治疗,由于PDA层的覆盖,他们的纳米药物能在近红外光激光照射下具有出色的光热转换能力,有机地结合了化疗盒光热疗法。因此,基于类黑色素优异的紫外线吸收效果、高效的自由基捕获能力以及表面带有的多种官能团,已被证明在肿瘤中具有良好的光热光动力效应,能产生良好的抗肿瘤作用。相比之下,本研究的纳米粒结构制备方法简易,充分利用了NIR与光热剂PDA的结合,为进一步增加其水溶性,对其进行聚乙二醇(PEG)修饰,我们的研究结果证明类黑色素纳米与近红外光联合应用可产生比单纯类黑色素纳米治疗更好的疗效。
综上,本研究成功合成了类黑色素,通过透射电镜,水合粒径,Zeta电位的研究分析表明,类黑色素被成功制备。同时,通过体外功能验证,证明其具有良好的光热光动力学效应。进而通过细胞实验表明其可以引起细胞活性氧升高,并从体内外实验中验证其抗高效的肿瘤效应。此研究为卵巢癌的非手术治疗提供了一种潜在的思路和手段。
