环境相关四环素长期暴露对吉富罗非鱼生长性能、肝脏脂肪代谢和抗氧化反应的影响
2022-11-25刘光辉徐一闯魏晓雷仲崇超刘香元
刘光辉 徐一闯 魏晓雷 仲崇超 刘香元 罗 智,2
(1. 华中农业大学水产学院, 营养与饲料实验室, 武汉 430070; 2. 青岛海洋科学与技术试点国家实验室(海洋渔业科学与食物产出过程功能实验室), 青岛 266299)
抗生素因其在农业、畜牧业和人类疾病治疗的高效性, 在世界范围内被广泛使用。然而抗生素的大量使用以及过期抗生素药品的处理不当等, 增加了抗生素在各种环境中的风险, 如地下水、地表水和沉积物[1,2]。四环素类抗生素(Tetracyclines,TCs)是一类由链霉菌产生的广谱类抗生素, 其成员包括金霉素(Chloretracyelin, CTC)、土霉素(Oxyeracyein, OTC)和四环素(Tetracycline, TC), 四环素是四环素类抗生素中最基本的化合物, 临床研究中一般使用其盐酸盐形式。近些年来, 越来越多的报道证实了四环素在水生环境中的存在, 通过对我国北方地区市政污水中抗生素含量分析, 检测到水体中四环素浓度为1114.27 ng/L[3]; 长江中游的洪湖及水系中被检测到的四环素含量为1454.8和304.8 ng/L[4], 在韩国汉河中检测出四环素抗生素为200 ng/L[5]。
相关研究表明, 相较于其他水体生物, 鱼类对水体中药物暴露敏感度较低[5,6], 这表明水生环境中药物的存在可能会给鱼类带来慢性危害, 即使在环境暴露水平下也可能导致鱼类遗传和组织学的变化[7]。许多研究报告了水体中ng/L水平的四环素抗生素可能会导致鱼类的分子和代谢紊乱[8], 包括增加鱼类的体重, 改变肠道微生物种群结构, 增加肝脏甘油三酯含量[9], 抑制线粒体β氧化, 促进脂肪酸的转运和甘油三酯的生成[10], 并诱导氧化应激和机体活性氧(ROS, Reactive Oxygen Species)的产生[2]。即使长期暴露在低于环境浓度和水产养殖允许剂量的抗生素中, 鱼体的抗氧化能力也会受到损伤并产生氧化应激, 并降低线粒体β氧化能力、增加肝脏脂肪积累及脂质过氧化[11]。因此, 详细地了解这一类抗生素在环境相关暴露水平下的作用机制, 对预防因四环素导致的鱼类生理功能紊乱是必要的。
罗非鱼是世界范围内水产养殖的重要鱼类, 因其优秀的生长性能、易于养殖及可得到的全基因组信息, 成为一种理想的实验模型[12]。本研究通过使用吉富罗非鱼(Oreochromis niloticus; 以下简称罗非鱼)为实验模型, 旨在评估环境相关的四环素长期暴露对罗非鱼生长和肝脏代谢的影响, 包括氧化应激、脂肪代谢和肝脏的组织学改变。
1 材料与方法
1.1 实验鱼
本实验中吉富罗非鱼购自于赤壁市养殖场, 选用225尾健康良好、规格均一的罗非鱼[均重:(5.38±0.01) g, 平均值±标准误]随机放养于9个玻璃缸中, 每个缸中25尾。设置3个四环素浓度: 0(对照)、400(低)和800(高) ng/L, 每个处理3个重复, 将盐酸四环素配制成实验浓度, 四环素的暴露浓度设置参考了中国和其他国家环境水域报告水平[3,4]。考虑到四环素是一种可光降解化合物[1,9], 因而实验期间避光处理。罗非鱼每天饱食投喂商品饲料2次[商品饲料中四环素含量为(32.62±1.07) ng/g], 每天换水2次, 每次换水后将四环素浓度调整为实验所需的浓度, 实验用水中四环素浓度未检出。实验共进行10周, 实验结束时每缸取12尾罗非鱼, 取罗非鱼的肝脏组织, 罗非鱼各项生长性能的计算方式如下:
1.2 实验材料和方法
实验材料盐酸四环素(Tetracycline Hydro-chloride, 分析级)购自于上海阿拉丁生化科技股份有限公司。RNA提取(TRIzol)试剂盒购自于Invitrogen公司、逆转录试剂盒和荧光定量试剂购自于TaKaRa公司、无水乙醇、氯仿和异丙醇等为中国国药分析纯产品, 购自于中国国药有限公司。甘油三酯(Triglyceride, TG)测定试剂盒、丙二醛(Malondialdehyde, MDA)测定试剂盒、总超氧化物歧化酶(Total superoxide dismutase, T-SOD)测定试剂盒、过氧化氢酶(Catalase, CAT)测定试剂盒、总抗氧化能力(Total antioxidant capacity, T-AOC)检测试剂盒和总蛋白质测定试剂盒购自于南京建成生物工程研究所有限公司, 四环素ELISA试剂盒购自于深圳容金科技有限公司。
基因表达分析参考文献[13]方法, 罗非鱼肝脏总RNA的提取按照说明书进行, 通过琼脂糖凝胶电泳进行检测其质量, 使用Nanodrop ND-2000分光光度计测定其浓度和纯度, 根据TaKaRa的逆转录试剂盒说明书, 合成第一链cDNA, 保存于–20℃。荧光定量引物见表 1, 选择了6个管家基因(β-actin、B2m、Rpl7、Hprt、Ubce和18S RNA)检测转录稳定性[13]。使用(https://genorm.cmgg.be/)geNorm分析,Rpl7和β-actin的基因表达水平最为稳定。因此, 将基因表达水平标准化为Rpl7和βactin的几何平均值, 通过2–ΔΔCt方法计算相对表达相对于对照组的变化倍数。
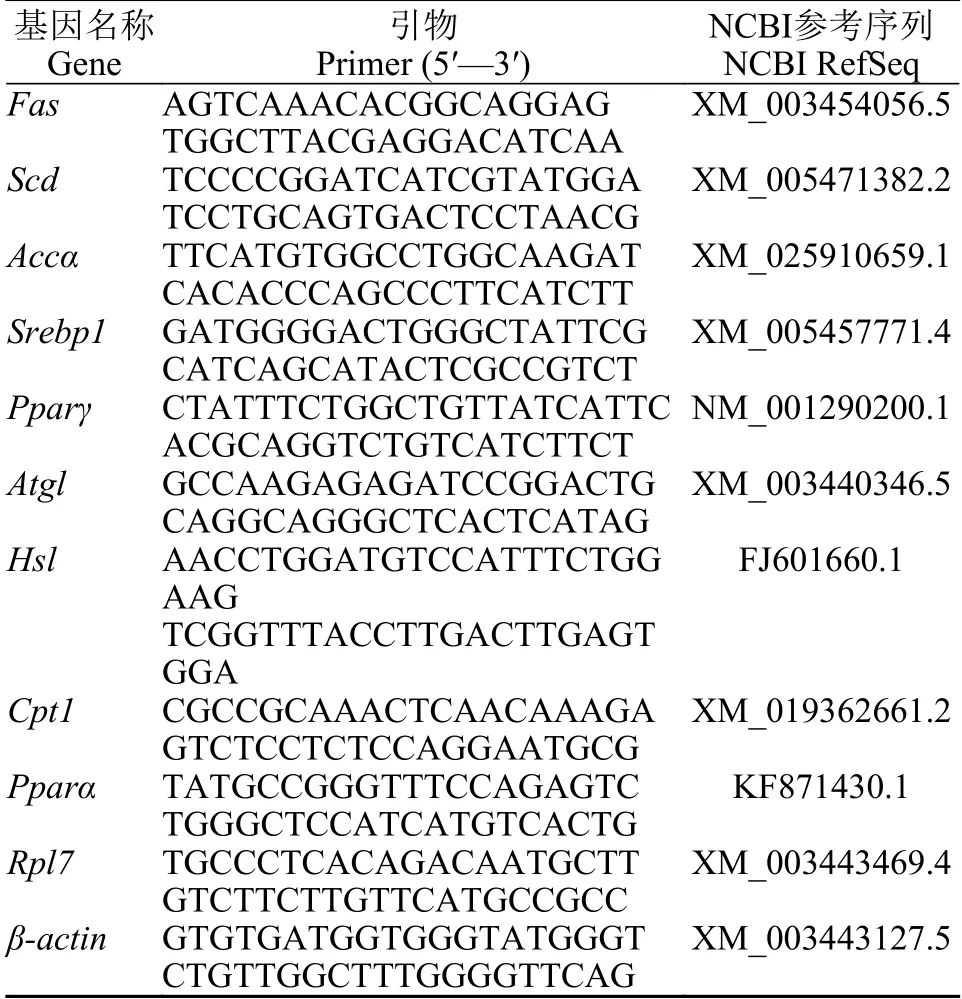
表1 荧光定量引物Tab. 1 Primers used for real-time PCR
肝脏TG含量、抗氧化酶活性、脂代谢酶活性测定和四环素残留检测肝脏TG含量、MDA、T-SOD、CAT、T-AOC和蛋白质浓度根据其商业分析试剂盒说明书测定, 根据本实验室方法测定6PGD (6-phosphogluconate dehydrogenase)、G6PD(Glucose 6-phosphate dehydrogenase)、ME (Malic enzyme)、ICDH (Isocitrate dehydrogenase)、FAS(Fatty acid synthase)和CPT1 (Carnitine palmitoyltransferase 1)的活性[13]。根据ELISA试剂盒说明书检测肝脏四环素浓度。
油红O染色、HE染色和透射电镜观察根据之前研究中描述的方法进行油红O染色和HE染色[13]。每个样品选取十个视野使用 Image J进行量化, 以收集油红O染色中脂滴数目和HE染色中肝脏空泡相对面积的统计数据。在武汉病毒所使用透射电镜观察肝脏线粒体形态。
数据统计分析使用SPSS 19.0软件对数据进行统计和分析, 以均值±标准误(mean±SE)表示结果。进行统计分析前, 采用Kolmogorov-Smirnov检验评估不同处理的正态性。各处理组间显著性使用单因素方差分析和Duncan多重比较检验,P<0.05被认为具有显著性差异, 采用不同字母表示不同四环素处理组间差异显著性。
2 结果
2.1 生长性能参数、四环素和脂肪积累
四环素暴露显著影响罗非鱼的生长性能参数和肝脏四环素含量。特定生长率、增重率和肝体比显著高于对照组(Control组), 前两者随四环素暴露浓度增加而增加(表2)。四环素暴露显著增加了罗非鱼肝脏中四环素含量和甘油三酯含量, 且依赖四环素的暴露浓度(图1a和1b)。
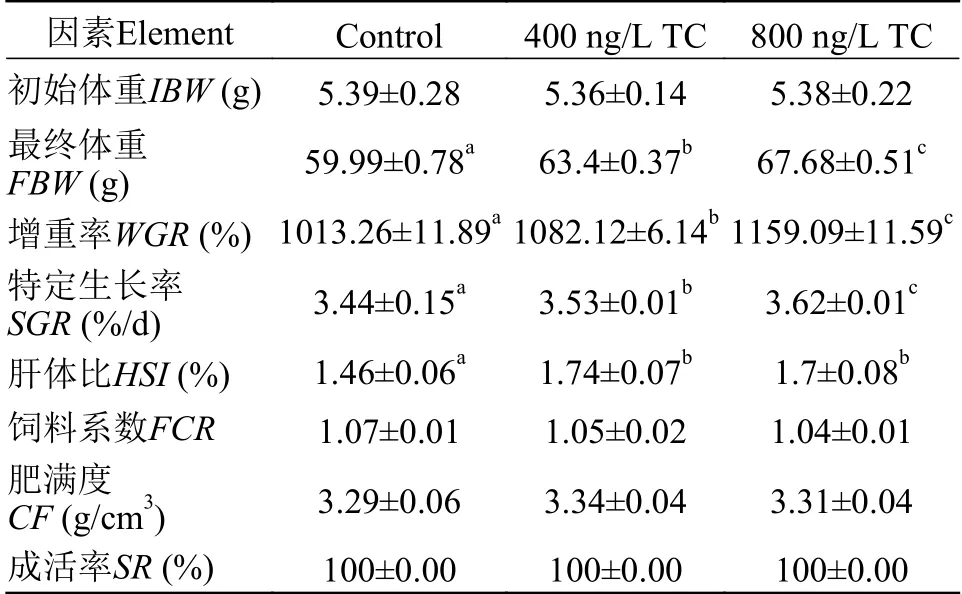
表2 不同四环素暴露水平对罗非鱼生长性能的影响Tab. 2 The effects of different tetracycline exposure levels on growth performance of Tilapia
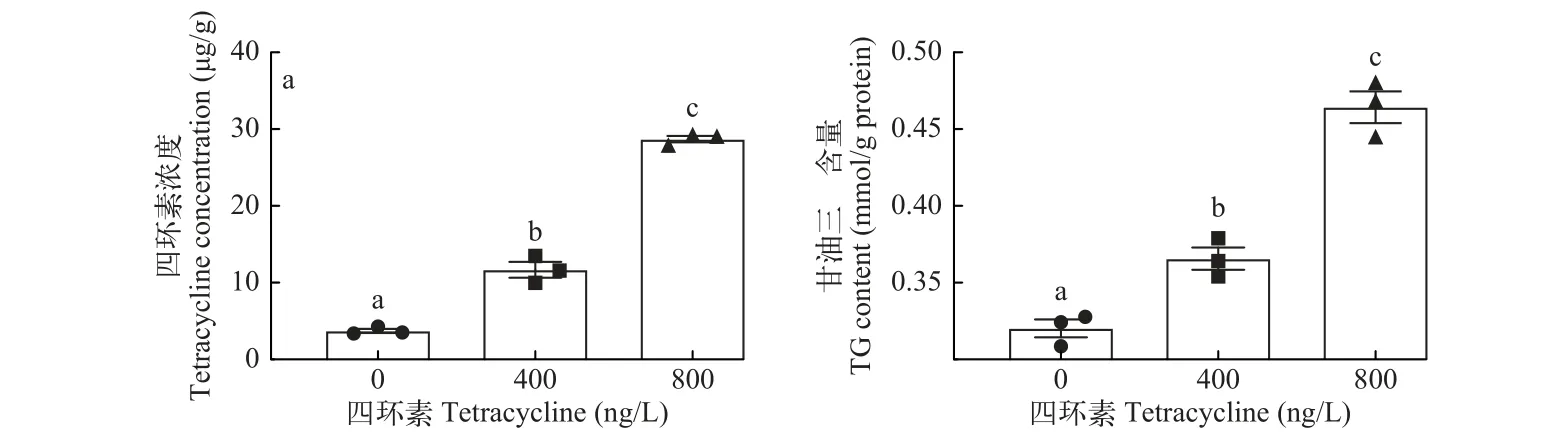
图1 四环素暴露后罗非鱼肝脏四环素浓度(a)和甘油三酯含量(b)的变化Fig. 1 The tilapia liver tetracycline concentration (a) and the triglyceride content (b) after tetracycline exposure
2.2 肝脏HE和油红O染色
肝脏中空泡的数量随四环素浓度增加而增加(图2a), 并且, 四环素暴露增加了肝脏脂滴的数量(图2b—d)。
2.3 脂肪代谢相关酶活性和基因表达
FAS的活性随着四环素浓度增加而增加(图3a),相对于Control组, 四环素暴露显著上调了ME、G6PD、ICDH和6PGD的活性(图3b—e), 而抑制了CPT1的活性(图3f)。参与脂肪合成的基因和转录因子(fas、scd、accα、srebp1和pparγ)随着四环素浓度增加而增加, 相反的, 与脂肪分解相关的基因和转录因子(atgl、hsl、cpt1和pparα)因四环素浓度增加而降低(图3g)。
2.4 肝脏超微结构观察
相较于Control组, 四环素暴露导致肝脏线粒体形态发生变化, 形态不规整, 线粒体嵴模糊(图4)。
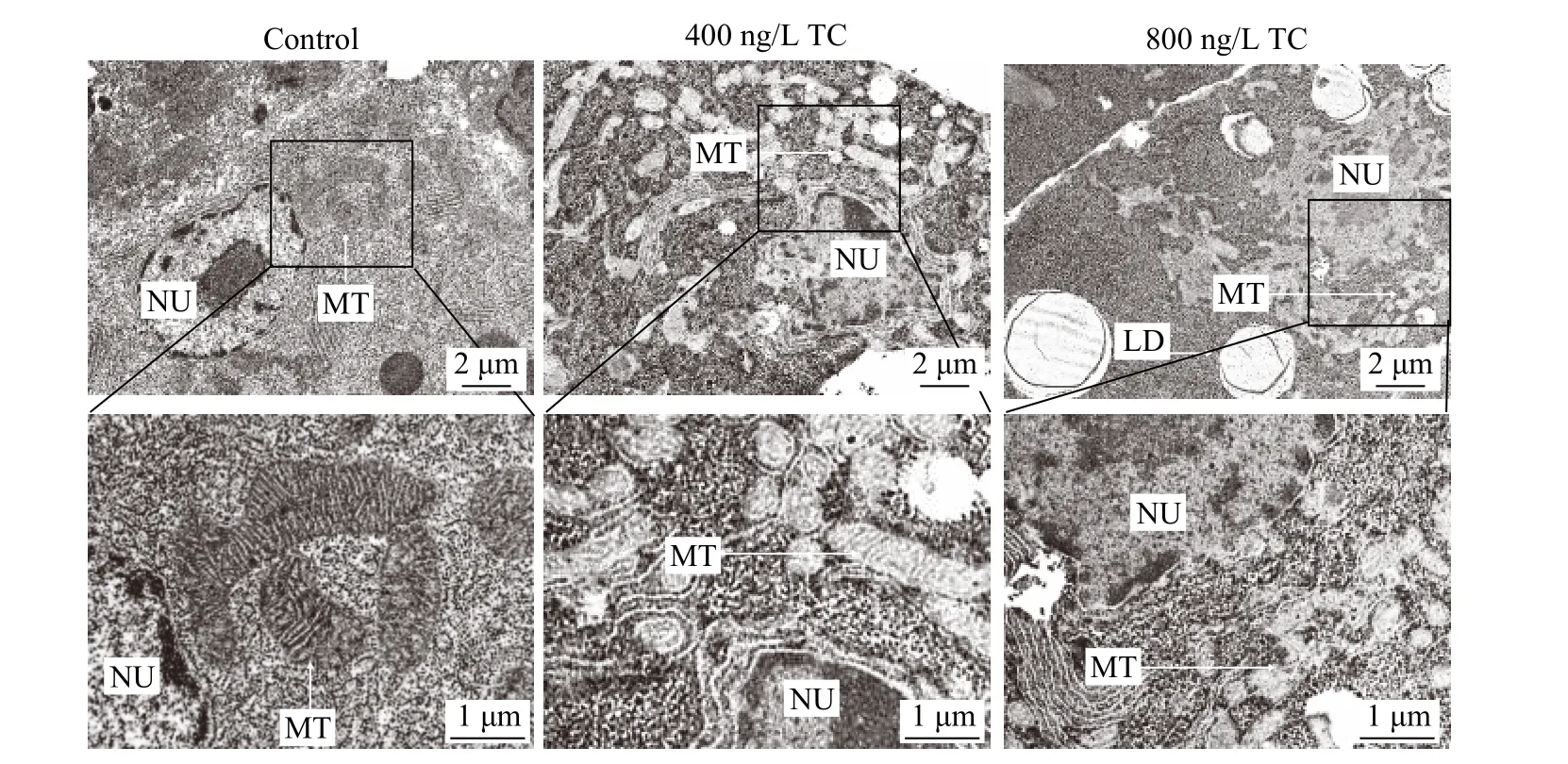
图4 四环素对罗非鱼肝脏线粒体形状的影响Fig. 4 Effect of Tetracycline on the shape of tilapia liver mitochondria
2.5 抗氧化能力和MDA水平
与Control组相比, 四环素暴露降低T-SOD和CAT的活性, 总抗氧化能力(T-AOC)显著降低(图5a—c), MDA水平随着四环素浓度增加而增加(图5d)。
3 讨论
抗生素在畜牧养殖、疾病防治和渔业生产等领域有着广泛的应用, 随着抗生素的使用增加, 抗生素长期暴露所产生的后果成为人们关注的对象。在生命的早期接触抗生素后, 会改变机体肠道微生物群的组成, 影响机体的功能代谢, 包括促进体重增加或者生长迟缓, 并且亚治疗剂量的抗生素会增加小鼠的总脂肪量[14]。本研究结果表明, 环境相关水平的四环素暴露显著增加了罗非鱼的增重率, 并且呈浓度依赖性, 相关的研究也报道了长期的四环素暴露会增加斑马鱼(Danio rerio)体重[9], 这与本研究相一致。
四环素具有诱导脂肪变性的潜力, 并且作为一种抗菌药物, 也有报道称四环素能够诱导肝损伤(DILI, Drug Induced Liver Injury)[15]。由于四环素的广泛使用, 在各种水生环境检测到不同浓度的四环素, 鱼类作为长期接触四环素的对象, 需要详细了解四环素抗生素对鱼类肝脏生理功能的影响及机制。肝脏是鱼体重要的脂质代谢和解毒器官, 首先检测了罗非鱼肝脏中甘油三酯含量及四环素浓度, 结果表明, 肝脏甘油三酯含量和四环素浓度随四环素暴露浓度增加而增加(图1a和1b)。同时, HE和油红O染色结果也表明四环素可以促进肝脏中脂肪的增加, 这与甘油三酯的增加是一致的(图2a和2b)。
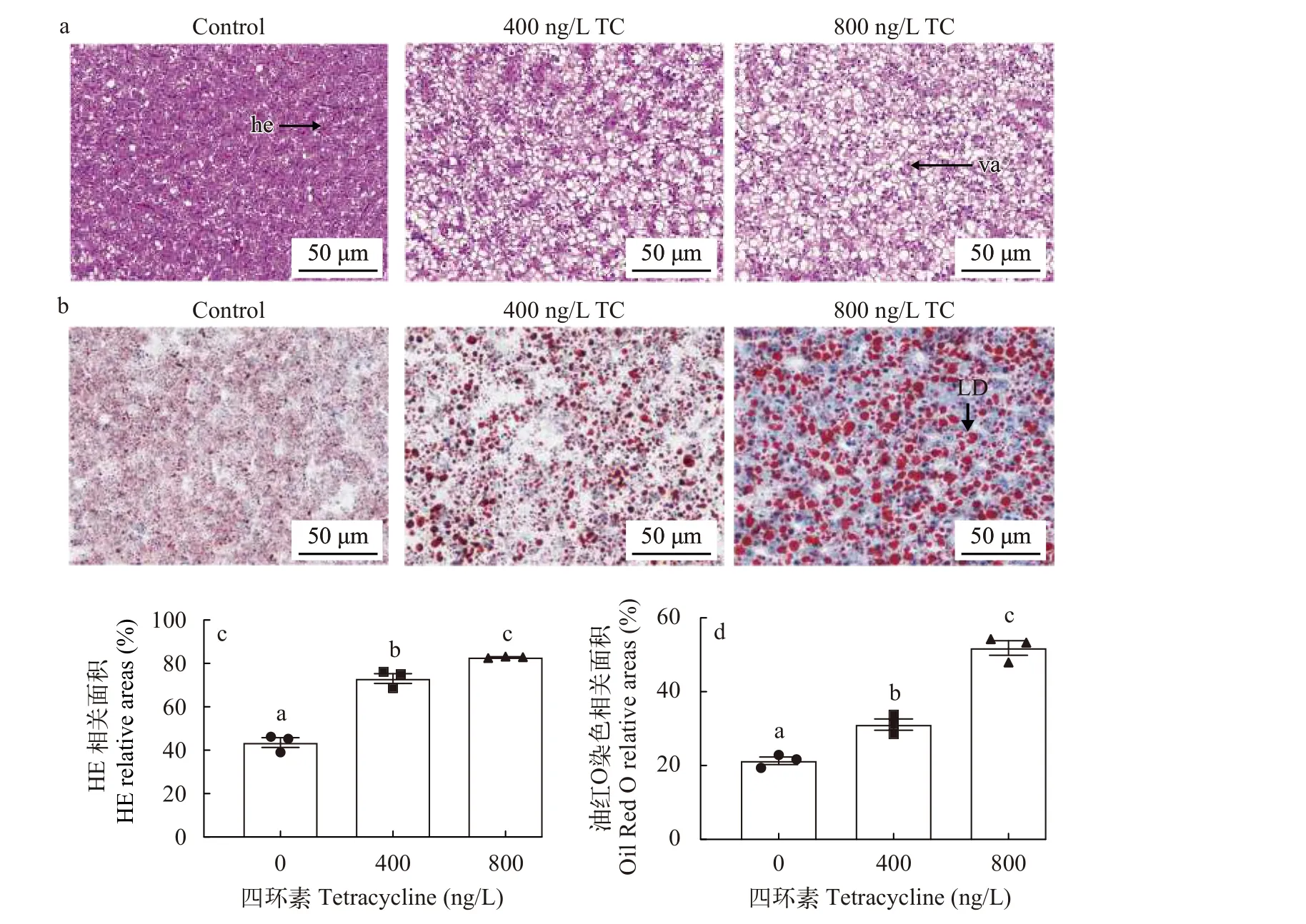
图2 四环素对罗非鱼肝脏组织学和组织化学的影响Fig. 2 The effects of tetracycline on liver histology and histochemistry of Tilapiaa. 肝组织学(HE); b. 组织化学(油红O染色); c和d. HE染色中空泡的相对面积和油红O染色中的脂滴的数目; 肝细胞(he); 液泡(va); 脂滴(LD)a. liver histology (HE); b. histochemistry (Oil red O staining); c and d. the relative area of vacuoles in HE staining and the number of lipid droplets in oil red O staining. Hepatocytes (he); Vacuole (va); Lipid droplets (LD)
为了研究四环素诱导罗非鱼肝脏脂肪积累的机制, 检测和分析了脂肪代谢相关酶的活性和基因表达(图3), 参与脂肪代谢的基因受到固醇调控元件结合蛋白1(Sterol regulatory element-binding protein,Srebp1)、过氧化物酶体增殖物激活受体γ(Peroxisome proliferator activated receptor γ,Pparγ)和过氧化物酶体增殖物激活受体α(Peroxisome proliferator activated receptor α,Pparα)转录因子的调控, 四环素显著上调了srebp1和pparγ的基因表达水平,srebp1和pparγ参与了脂质生成和脂质储存的调控,并且会优先调节参与甘油三酯合成基因的转录[16]。脂肪酸合成酶(Fatty acid synthetase,Fas)、硬脂酰辅酶A去饱和酶(Stearoyl-CoA desaturase,Scd)和乙酰辅酶A羧化酶α(Acetyl-CoA carboxylase α,Accα)是srebp1和pparγ下游的靶基因,fas、accα和scd的转录活性随四环素暴露浓度增加而增加, 这与相关的报道相一致[17]。脂肪甘油三酯脂肪酶(Adipose triacylglyceride lipase ,Atgl)和激素敏感性脂肪酶(Hormone-sensitive lipase,Hsl)催化脂质分解, 将甘油三酯转化为二酰基甘油(Diacylglycerol)和单酰基甘油(Monoacylglycerol)[13],pparα在脂质分解以及线粒体β氧化中发挥重要作用, 能诱导cpt1的基因表达[18], 在本研究中, 四环素通过降低pparα、atgl、hsl和cpt1的表达, 抑制了罗非鱼肝脏脂质分解。6PGD、G6PD、ME、ICDH和FAS在脂肪生成过程中扮演非常重要的角色, 四环素显著增加了6PGD、G6PD、ME、ICDH和FAS的酶活性(图3b—e), 提高了FAS的mRNA水平(图3a), 这有利于脂肪生成, CPT1是线粒体脂肪酸β氧化的主要调节酶和限速酶, 其转录表达和酶活性受到四环素的抑制(图3f)。已有的研究报道了四环素暴露会影响肝脏脂肪代谢相关基因的表达[17], 包括上调脂肪酸摄取相关基因、抑制脂肪酸β氧化进程和脂肪酸转出[10], 这与我们的研究结果相一致。在本研究中, 四环素诱导的罗非鱼肝脏脂肪沉积可归因于脂肪生成的增加和脂肪分解的降低。
氧化应激被认为是四环素诱导肝脏脂肪积累的可能机制[19]。SOD和CAT是抗氧化防御的第一道防线, SOD催化转化为H2O2, 而后CAT催化H2O2转化成H2O和O2保护细胞免受氧化损伤[20]。本研究结果显示, 四环素显著降低T-SOD和CAT的活性, 总抗氧化能力(T-AOC)被显著性抑制(图5a—c), 表明机体的抗氧化防御系统被破坏, 研究报道了高水平的四环素能够诱导ROS的产生[2]。因此,在本研究中, 四环素暴露可能通过对抗氧化能力的削弱和ROS的诱导致机体出现氧化应激, 进而导致肝细胞线粒体形状异常和损伤(图4), 线粒体β氧化受阻可能与此有关。此外, 抗氧化能力的降低也导致MDA水平上升(图5d), MDA是机体中不饱和脂肪酸发生过氧化反应的最终产物, 脂质过氧化的标志物。最近的研究表明高糖喂食增加了黄颡鱼肝脏中MDA的水平和黄颡鱼的生长性能[13]。增加的MDA含量和增加的生长性能与我们的结果相一致。此外其他研究也报道了在MDA增加的时候,鱼类体重出现了无差异和下降的趋势[21,22], MDA和体重之间的联系还需要进一步的研究。
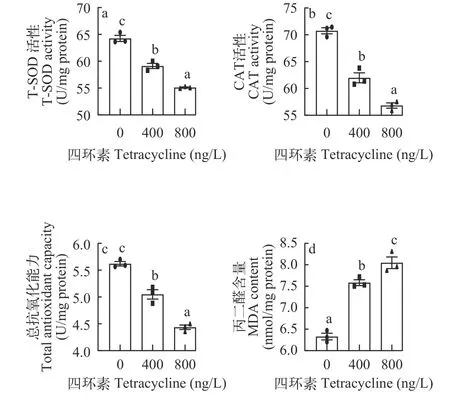
图5 四环素对罗非鱼肝脏抗氧化能力的影响Fig. 5 The effect of tetracycline on the antioxidant capacity of tilapia liver
本研究以吉富罗非鱼为模型, 评估了环境相关的四环素长期暴露对罗非鱼生长性能和肝脏脂质代谢的影响。环境相关四环素暴露会增加罗非鱼的体重, 这可能是早期接触四环素的结果。此外,四环素长期暴露会导致罗非鱼肝脏组织空泡和脂滴数目增加, 并引起罗非鱼肝脏产生氧化应激和脂肪积累, 进而导致肝脏脂质过氧化增加。本研究结果表明, 长期暴露于环境相关浓度的四环素中, 会增加鱼类氧化应激的风险, 影响肝脏正常的脂肪代谢, 损害肝脏脂质稳态和正常生理功能。
