环境铜离子对吉富罗非鱼生长性能、脂代谢、肝胰脏和脾脏组织的影响
2022-11-25颜子渊邓真德梁振业
颜子渊 邓真德 张 竞 梁振业 徐 畅
(海南大学海洋学院, 海南省水产种业工程研究中心, 海南省热带水生生物技术重点实验室, 海口 570228)
近年来, 我国由于近岸工厂大量排放未经处理的尾水, 导致地表水生态系统的重金属污染日益严重[1], 铜已经成为我国湖泊富集重金属的主要元素之一[2]。有报道称, 珠江口海域铜浓度已处于污染水平, 且具有潜在的生物毒性[3]。Jiang等[4]对太湖水体、间隙水和表层沉积物中的重金属含量进行详细调查, 研究表明, 太湖间隙水水体铜浓度为2.29—135.78 μg/L, 在珠山湾浓度最高。Kshetriya等[5]对印度梅加拉亚邦天然水体中重金属污染进行评估,季风期的西杰因蒂亚丘陵(West Jaintia Hills)铜污染严重, 铜浓度为416 μg/L。在水产养殖过程中, 硫酸铜通常用于预防刺激隐核虫(Cryptocaryon irritans)感染, 并能够有效地清除有害藻类。在池塘管理中过量使用硫酸铜, 可能会因为铜在池塘底泥中的积累而危及水环境的安全[6]。池塘养殖鱼类投喂饲料中带来的铜也会沉到底泥并富集, 通过食物链最终进入鱼体[7]。铜是鱼类生命生长过程中必需的一种微量元素, 是构成酶的活性基团及组成部分,但当其浓度超过生态阈值时, 必然会对鱼体造成一定的影响[8,9]。铜对鱼类的毒性作用是多方面的,如食欲降低[10]、肝细胞损伤[11]、血细胞减少[12]、诱导组织抗氧化损伤和应激反应[13]、影响鱼类的生长[14]、代谢酶活性[15]、胚胎发育[16]和生殖[17]等。铜对水生生物的毒理作用主要是通过Haber/Weiss反应催化自由基的产生[18], 过量的自由基会导致DNA的断裂和脂质过氧化等[19], 从而增加机体氧化胁迫, 诱发多种损伤[20], 甚至引起死亡[21]。有研究表明, 不同种的鱼类会对铜具有不同的生理响应机制[22]。可见, 研究环境铜对鱼类生长、健康和脂代谢的影响对其生产具有重要的意义。
目前, 有关水环境重金属对鱼类健康和脂代谢的影响已有诸多报道。Huang等[23]研究发现水体铜暴露影响矛尾复鰕虎鱼(Symechogobius hasta)的肝脏脂质沉积和代谢。Mazandarani等[24]报道称, 在高浓度水体硫酸铜暴露下, 鲤(Cyprinus carpio)血浆甘油三酯和胆固醇含量显著升高。Liu等[15]研究表明矛尾复鰕虎鱼暴露于亚急性铜后, 其肝脏中脂肪含量显著升高, 且脂蛋白脂酶和肝脂酶的活性显著下降。Chen等[25]发现, 黄颡鱼(Pelteobagrus fulvidraco)在不同浓度梯度的水体铜(2、24、71和198 μg/L)暴露6周后, 高浓度铜降低其肝脏脂肪合成酶活性和基因的表达水平, 但脂蛋白水解酶的活性及其mRNA表达水平显著提高。Tulasi等[26]发现, 攀鲈(Anabas testudineus)在暴露于浓度为5 mg/L的水体铅环境中30d后, 其肝脏总脂肪含量降低, 而游离脂肪酸含量升高。Zheng等[27]报道称, 黄颡鱼在低浓度锌水体中(0.05、0.35和0.86 mg/L)暴露8周后, 锌离子会通过抑制脂解代谢和促进脂肪生成反应而诱导脂质的蓄积。Yang等[28]研究发现, 河南华溪蟹(Sinopotamon honanense)在水环境镉暴露后, 肝胰腺中的脂蛋白脂酶活性显著下降, 其组织中的脂质水平也明显降低。尽管已有很多关于环境重金属对鱼类脂代谢影响的研究, 但有关罗非鱼在铜胁迫下脂代谢的报道却非常有限。
罗非鱼是世界上最具有经济价值和养殖价值的淡水养殖物种之一[29]。其中, 吉富罗非鱼(Oreochromisniloticus)因生存能力强、生长速度快、净出肉率高而在我国大面积推广[30]。近年来由于高密度精养模式发展, 长期投喂高脂肪、高能量的饲料, 使实际生产出的罗非鱼出现肝脏及腹腔脂肪蓄积现象[31,32]。同时, 罗非鱼清晰的基因和生物学基础, 也是研究水体环境对硬骨鱼类生理和健康影响的优质模式物种。目前有关水体铜暴露对罗非鱼的影响已有许多报道, 但主要聚焦于对其生长表现[14]、抗氧化系统[33]、免疫能力[34]、渗透调节[35]和离子平衡[36]等方面, 对脂代谢影响的相关研究较少。因此,本研究以罗非鱼为对象, 研究不同浓度铜暴露对罗非鱼的肝胰脏脂代谢及血清脂代谢的影响, 为进一步研究水体铜对罗非鱼毒理作用提供了数据参考。
1 材料与方法
1.1 实验动物
本实验对象为幼体吉富罗非鱼(GIFT tilapia,Oreochromis niloticus), 鱼苗购置于海南省文昌市某罗非鱼繁育公司。实验开始前将鱼苗在室内养殖缸环境中暂养1周, 暂养过程中采用商用饲料定时饱食投喂, 在暂养结束后, 将平均体重为(0.45±0.02) g的健康罗非鱼苗随机分配至养殖水箱中, 开始正式的养殖实验。
1.2 实验管理
根据前人的研究发现, 罗非鱼在水中硫酸铜暴露96h的半致死浓度为7.98 mg/L[37], 选择半致死浓度的1/10作为安全浓度(0.8 mg/L)。故养殖实验设置水体铜暴露浓度分别为0、0.2 、0.4 和0.8 mg/L,未添加硫酸铜的水体作为实验的对照组, 每个实验组设置3个实验重复。每个养殖水箱(60 cm×30 cm×35 cm)随机分配幼鱼15尾。以硫酸铜(CuSO4·5H2O,分析纯)作为铜源, 将其溶解在去离子水中配制成母液, 通过移液枪加入固定体积的母液至已知体积的水体中, 保持水体的铜浓度。在养殖过程中, 每日投喂3次, 投喂时间分别为7:00、12:00和20:00,饱食投喂, 且根据罗非鱼摄食情况进行调整。每日每缸更换1/2充分曝气的养殖用水, 并补充相应体积的铜溶液, 每隔4天更换全部养殖水体, 以确保水体中铜浓度的稳定。养殖期间水温控制在27—30℃, pH 7.5—8.0, 持续充气保证溶解氧不低于5 mg/L, 实验周期为4周。
1.3 样品采集
采样前, 罗非鱼禁食24h。将鱼麻醉后, 计算存活率, 并称量每条鱼体的重量, 计算增重率和特定生长率。每缸中随机取8尾鱼, 进行尾静脉取血, 血样在室温静置4h后, 转移至4℃冰箱过夜, 次日将血样在低温离心机中以4℃, 3000 r/min离心10min(3-18KS, Sigma,德国), 取上层血清分装于200 μL离心管中, 转至−80℃保存待测。在冰上快速分离罗非鱼的肝胰脏和脾脏, 肝胰脏称重以计算肝体指数,切取肝胰脏和脾脏的固定部位组织块固定于4%多聚甲醛, 用于制备组织石蜡切片(HE染色)。
1.4 指标测定
生长指标测定:
罗非鱼的存活率、增重率、特定生长率和肝体比采用下列公式进行计算:
存活率(Survival rate, %)=最终鱼数量/初始鱼数量×100
增重率(Weight gain rate,WGR, %)=(最终重量−初始重量)/初始重量×100
特定生长率(Specific growth rate,SGR, %/d)=(ln最终重量−ln初始重量)/实验天数×100
肝体比(Hepatosomatic index,HSI, %)=肝胰腺重量/体重×100
肝胰脏生化指标测定: 在肝胰脏解冻后, 准确称取组织重量, 按照重量(g)﹕体积(mL)=1﹕9的比例加入预冷的生理盐水, 在冰水浴的条件下, 制备成10%的组织匀浆, 在4℃, 3000 r/min离心10min(3-18KS, Sigma,德国), 取上清液分装至200 μL的离心管中, 甘油三酯(TG)、总胆固醇(T-CHO)、总可溶性蛋白含量和HMG-CoA还原酶活性均采用南京建成生物工程研究所提供的试剂盒测定, 测定的过程按照试剂盒中的说明书要求进行操作。
血清脂质成分测定: 高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)和总胆固醇(T-CHO)含量均采用南京建成生物工程研究所生产的试剂盒测定, 具体测定方法按照试剂盒说明书进行。
血清免疫指标测定: 谷丙转氨酶(GPT)和谷草转氨酶(GOT)活力均采用南京建成生物工程研究所生产的试剂盒测定, 具体测定方法按照试剂盒说明书进行。
组织学观察: 肝胰脏和脾脏组织用锋利的解剖刀切取固定部位后, 在4%多聚甲醛中固定24h后,经不同浓度的乙醇进行逐级脱水、经过二甲苯清洁透明后用石蜡包埋固定于包埋盒中, 进行组织切片, 石蜡切片厚度为5 μm。用苏木精和伊红对载玻片上的石蜡组织进行染色, 清洗掉多余染料烤干,再用树脂进行封片保存。将封好的石蜡切片于光学显微镜(Eclipse 200, Nikon, 日本)下观察, 并用图像分析软件(SBI image 2.0, 赛宝, 中国)进行拍摄记录。
1.5 数据分析
本实验中的全部数据均采用SPSS statistics 23(IBM, Armonk, 美国)进行统计分析。所有数据均为平均数±标准误(mean±SE)表示。对照组、0.2、0.4和0.8 mg/L 实验处理组之间的差异使用单因素方差分析(ANOVA),P<0.05表示为显著差异,P<0.01表示为极显著差异。
2 结果
2.1 生长性能
0.2 mg/L处理组罗非鱼的存活率和特定生长率均显著高于0.4和0.8 mg/L处理组(P<0.05), 但与对照组相比无显著差异(P>0.05; 图 1A和1C)。由图 1B可知, 水体铜处理实验组罗非鱼的增重率均显著低于对照组(P<0.05)。0.4和0.8 mg/L组罗非鱼肝体比显著高于0.2 mg/L组和对照组(P<0.05), 0.4和0.8 mg/L实验组之间无显著差异(P>0.05), 0.2 mg/L组罗非鱼肝体比与对照组相比虽有下降, 但无显著差异(P>0.05;图 1D)。

图1 水体中不同浓度铜对罗非鱼存活率(A)、增重率(B)、特定生长率(C)和肝体比(D)的影响Fig. 1 Effects of different waterborne Cu concentrations on the survival rate (A), weight gain rate (B), specific growth rate (C) and hepatosomatic index (D) of tilapia柱状图中不同字母上标表示组间具有显著性差异(P<0.05), 且d>c>b>a, 下同Different letters mean significant difference (P<0.05), and d>c>b>a, the same applies below
2.2 肝胰脏脂质代谢
随着水体铜浓度升高, 肝胰脏中的甘油三酯含量在0.4和0.8 mg/L组中显著升高(P<0.05), 0.2 mg/L组罗非鱼肝胰脏甘油三酯含量与对照组无显著差异(P>0.05; 图 2A)。0.2 mg/L组罗非鱼肝胰脏可溶性蛋白质含量显著高于其他各组(P<0.05), 其他各组之间无显著差异(P>0.05; 图 2C)。各实验组罗非鱼肝胰脏总胆固醇含量和HMG-CoA还原酶活力与对照组相比均无显著差异(P>0.05; 图 2B和2D)。
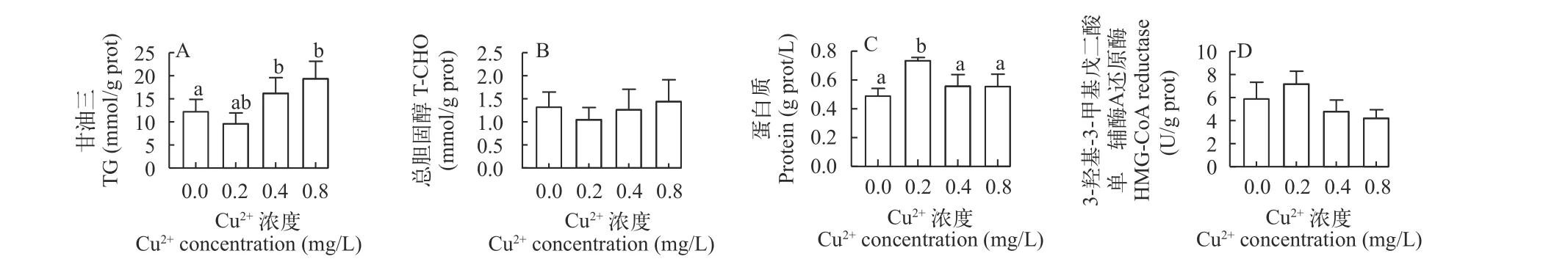
图2 水体中不同浓度铜对罗非鱼肝胰脏中甘油三酯(A)、总胆固醇(B)、蛋白质(C)和HMG-CoA还原酶(D)的影响Fig. 2 Effects of different waterborne Cu concentrations on the contents of triglycerides (A), total cholesterol (B), protein (C) and HMGCoA reductase (D) activity in hepatopancreas of tilapia
2.3 血清脂质代谢
各实验组罗非鱼血清中HDL-C与对照组相比无显著差异(P>0.05; 图 3A)。0.4和0.8 mg/L组鱼体血清中LDL-C显著高于0.2 mg/L组和对照组(P<0.05),0.4和0.8 mg/L组之间、0.2 mg/L和对照组之间均无显著差异(P>0.05; 图 3B)。0.8 mg/L组鱼体血清中甘油三酯含量显著高于0.2 mg/L组(P<0.05), 对照组、0.2和0.4 mg/L组之间, 对照组、0.4和0.8 mg/L组之间均无显著差异(P>0.05; 图 3C)。0.4和0.8 mg/L组鱼体血清中T-CHO的含量均显著高于0.2 mg/L组和对照组(P<0.05), 0.4和0.8 mg/L组之间、0.2 mg/L组和对照组之间均无显著差异(P>0.05; 图 3D)。0.8 mg/L组血清中GPT显著高于0.2和0.4 mg/L组(P<0.05),与对照组相比差异不显著(P>0.05), 对照组、0.2和0.4 mg/L组无显著差异(P>0.05; 图 3E)。0.8 mg/L组鱼体血清GOT显著高于对照组(P<0.05), 但0.2、0.4 mg/L组与对照组相比无显著差异(P>0.05; 图 3F)。
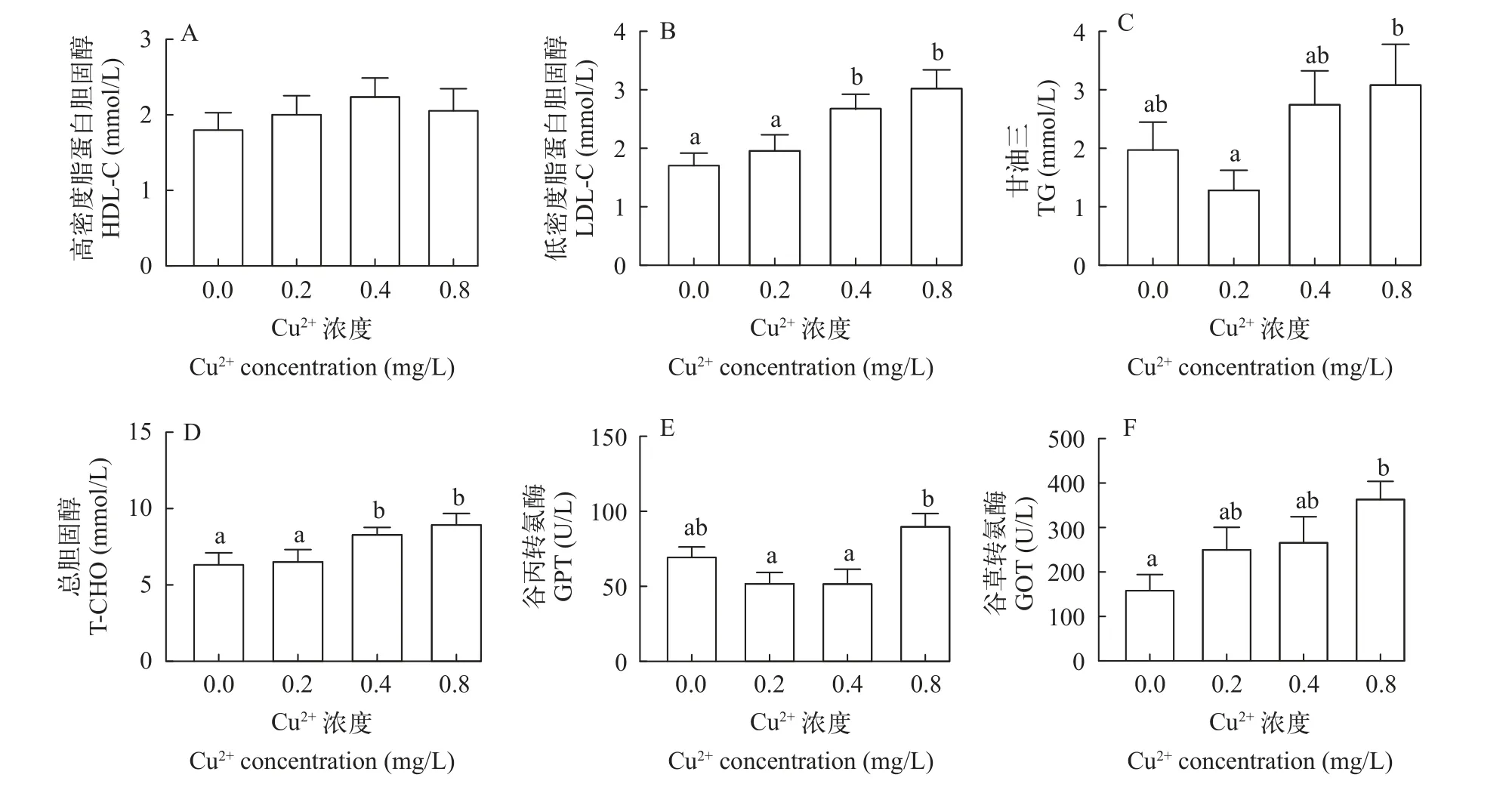
图3 水体中不同浓度铜对罗非鱼血清中高密度脂蛋白胆固醇(A)、低密度脂蛋白胆固醇(B)、甘油三酯(C)、总胆固醇(D)、谷丙转氨酶(E)和谷草转氨酶(F)的影响Fig. 3 Effects of different waterborne Cu concentrations on the contents of high-density lipoprotein cholesterol (A), low-density lipoprotein cholesterol (B), triglycerides (C), total cholesterol (D), alanine aminotransferase (E) and aspartate aminotransferase (F) activity in serum of tilapia
2.4 肝胰脏组织学
水环境铜暴露后, 罗非鱼肝胰脏组织学发生了明显的变化(图版Ⅰ)。与对照组相比, 0.2 mg/L组鱼体的肝胰脏细胞结构显示正常, 空泡数量与对照组相比无显著差异(图版Ⅰ-1, 2)。在0.4和0.8 mg/L组, 罗非鱼肝胰脏组织空泡数量显著增加, 肝胰脏细胞结构也呈现不规则形态(图版Ⅰ-3, 4)。
2.5 脾脏组织学
脾脏组织学切片结果显示, 当罗非鱼暴露于0.2 mg/L铜水体后, 脾脏中开始出现小面积的巨噬细胞中心(MMCs), 脂褐素的积累也明显多于对照组(图版Ⅱ-1, 2)。在0.4和0.8 mg/L 铜处理组中, 罗非鱼MMCs面积明显增大, 脂褐素的蓄积也随着环境铜离子浓度升高而增加(图版Ⅱ-3, 4)。
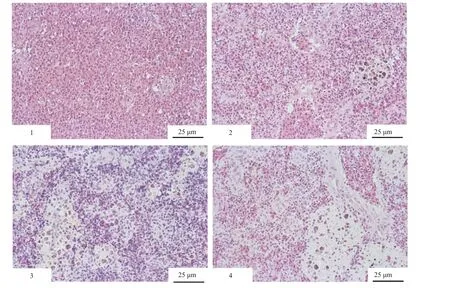
图版Ⅱ 水体中不同浓度铜暴露后罗非鱼脾脏HE染色切片PlateⅡ Spleen histology of tilapia exposed to different waterborne Cu concentrations
3 讨论
3.1 水体中不同浓度铜离子暴露对罗非鱼生长性能的影响
大量研究表明, 鱼类通过水体或食物摄入过多的铜离子均会抑制其生长性能。在本实验中, 随着铜离子浓度的升高, 罗非鱼的增重率、特定生长率和存活率均受到显著的抑制。这与Ali等[14]研究结果一致, 在铜离子浓度为0.15、0.3和0.5 mg/L的水体中, 尼罗罗非鱼的增重率和特定生长率相比于对照组显著下降, 且与水体中铜离子浓度增加呈线性正相关。王春秀[38]研究表明, 当水体中铜离子浓度大于0.3 mg/L时, 黄河鲤(Cyprinus carpio)的增重率显著降低。同时, Liu等[15]对矛尾复鰕虎鱼的研究发现, 当水体中铜离子浓度为0.15和0.3 mg/L时, 矛尾复鰕虎鱼的增重率、特定生长率以及存活率显著下降。已有研究表明, 水体铜暴露使鱼体生长性能的下降可能有两个原因, 首先是铜暴露使鱼体用于解毒和维持体内平衡的代谢支出增加[39], 其次是铜暴露使其摄食量减少, 从而导致其生长减慢[10,14]。罗非鱼作为重要的淡水鱼之一, 能耐受各种环境因素和应激条件[40], 在本研究中, 高浓度铜使罗非鱼生长受到了严重的抑制, 可能由于罗非鱼是热带鱼类, 环境中较高的水温增加了组织中铜的积累[41]。
3.2 水体中不同浓度铜离子暴露对罗非鱼肝胰脏脂代谢的影响
肝脏在脂质代谢中起着重要的作用[27], 水体中重金属暴露能够使鱼类脂代谢功能失调[42]。甘油三酯是脂肪的主要成分, 甘油三酯含量升高表明肝脏中脂肪的分解代谢较低[43]。在本实验中, 0.4和0.8 mg/L实验组罗非鱼肝胰脏中甘油三酯的含量与对照组相比显著升高, 而0.2 mg/L组甘油三酯含量稍微下降, 血清中甘油三酯含量的变化趋势相同,这可能是脂肪合成分解相关基因受到环境重金属的影响的原因[9,44]。黄超[45]的报道称, 经30d水体铜暴露后, 虾虎鱼肝脏脂肪含量显著增加, 但是水体铜暴露60d后, 鱼体肝脏脂肪的含量下降。相反,Levesque等[46]研究表明环境铜暴露降低黄金鲈(Perca flavescens)肝脏中甘油三酯的含量。综合可知, 铜对脂肪的含量的影响可能与鱼的种类以及水体中铜暴露浓度和时间有关。肝胰脏脂肪含量的变化通过组织学(HE染色)可以得到很好的证实, 同时肝体比也匹配上了肝胰脏脂肪含量的变化。本实验结果表明, 暴露于高浓度铜环境后, 罗非鱼肝体比显著增加, 表明肝胰脏代谢明显受到铜的影响, 这与单丹等[33]研究结果一致。Liu等[15]、Huang等[23]也报道称, 不同浓度铜离子暴露15d和30d均会使矛尾复鰕虎鱼肝体比显著增加。Grosell等[47]指出, 通常情况下海水鱼对水体铜离子的敏感度低于淡水鱼,通过上述研究与本实验的对比, 验证了这一结果。已有研究表明, 肝脏新陈代谢与肝体比成正相关[48]。
3.3 水体中不同浓度铜离子暴露对罗非鱼胆固醇代谢的影响
胆固醇是维持生命活动的重要保障, 而肝脏是胆固醇合成的主要场所[49]。HMG-CoA还原酶是胆固醇合成的主要限速酶, 且细胞内胆固醇的含量通过HMG-CoA还原酶实现负反馈调节[50]。已有研究表明, 用5 mg/L硝酸铅水体暴露攀鲈30d后肝脏中胆固醇含量降低[26]。在本实验中, 肝胰脏总胆固醇含量和HMG-CoA还原酶虽无显著差异, 但却存在一定变化趋势。总胆固醇含量随着环境铜离子浓度升高呈现增加的趋势, 而HMG-CoA还原酶正好相反, 证实了胆固醇的负反馈调节机制。
鱼类血液生化指标与其机体的代谢、营养状态和疾病密切相关[51]。胆固醇是许多类固醇激素的前体, 在体内有着广泛的生理作用, 但当其过量时便会导致脂质代谢和脂蛋白代谢紊乱, 对机体产生不利影响[52,53]。章龙珍等[54]研究发现, 中华鲟(Acipenser sinensis)在不同浓度的铜离子(0.40、0.89和2.00 μg/L)水体中暴露60d后, 血液中胆固醇含量随铜离子浓度的增加而升高。本研究中暴露于0.4和0.8 mg/L铜离子的罗非鱼血清总胆固醇含量显著高于对照组, 说明水体铜离子对胆固醇代谢产生显著影响, 与上述研究一致。低密度脂蛋白(LDL)是向组织转运肝脏合成的内源性胆固醇的主要形式; 高密度脂蛋白(HDL)则与其相反, 它是胆固醇的“清扫机”, 负责把胆固醇运回肝脏代谢[55], 两者在血液中分别以LDL-C和HDL-C结合胆固醇[56]。一般认为, HDL-C有预防动脉硬化效果, 而LDL-C易引起动脉硬化[57]。血清中总胆固醇是HDL-C和LDL-C二者综合作用的结果[56], 本研究中HDL-C和LDL-C含量均有升高的趋势, 且LDL-C含量产生显著差异, 符合血清总胆固醇变化趋势, 也进一步说明水体中铜离子可以诱导罗非鱼血脂异常, 从而促进处理组罗非鱼肝胰脏胆固醇向血液中转运, 增加了胆固醇在外周血管中的蓄积。
3.4 水体中不同浓度铜离子暴露对罗非鱼肝功能的影响
GPT和GOT是肝脏特异性酶, 能反映肝脏的组织病变[58]。脊椎动物在正常情况下, 组织细胞内的转氨酶只有少数释放到血浆中, 当组织病变细胞通透性增加时, 细胞内的转氨酶就会大量释放进入血浆[59]。王书凤等[40]发现, 在环境重金属铅、镉、铜和锌的条件下罗非鱼血浆GPT和GOT酶活力显著提高。潘鲁青等[60]研究表明在铜(0.1、0.2、0.5和1 mg/L)作用下, 96h凡纳滨对虾(Litopenaeus Vannamei)血液中GPT和GOT均有升高的趋势, 且血液中2种转氨酶活力的激活率为GPT 图版Ⅰ 水体中不同浓度铜暴露后罗非鱼肝胰脏HE染色切片PlateⅠ Hepatopancreas histology of tilapia exposed to different waterborne Cu concentrations1. 对照组; 2. 0.2 mg /L; 3. 0.4 mg/L; 4. 0.8 mg/L(×400, 下同)1. Control; 2. 0.2 mg/L Cu treatment; 3. 0.4 mg/L Cu treatment; 4. 0.8 mg/L Cu treatment (×400, the same applies below) 在正常情况下, 鱼类肝脏组织中脂滴数量较少,然而在病理情况下, 鱼类肝脏中脂滴会大量增多[42]。本实验结果显示, 在水体中铜离子暴露下罗非鱼的肝胰脏均出现空泡化, 且随着处理浓度的升高, 肝胰脏空泡化比例升高, 脂滴数量也随之增加, 表明外界水体铜浓度过高导致罗非鱼肝胰脏产生了病理损伤。黄超[45]研究表明经30d水体慢性铜(2、18、38和55 μg/L)暴露后, 虾虎鱼肝脏空泡比例随着水体铜浓度增加而增大, 与本实验结果一致, 且虾虎鱼是一种受刺激后易敏感的物种, 与罗非鱼相比,在水体铜暴露下其机体更容易受到损伤。 MMCs在鱼类中通常位于脾和肾等造血组织中, 在一些鱼类肝脏中也有发现[61]。MMCs的变化不仅可以作为鱼体本身健康状况的良好指标, 也可以作为水环境应激条件的敏感指标[61,62]。对新热带鲶(Rhamdia quelen)[63]的研究表明, 在11 μg/L铜离子暴露96h下, 肝脏中MMCs数量显著增加, 与本实验研究结果类似。本实验结果显示, 与对照组的脾脏相比, 处理组MMCs数量明显增加, 可以认为是铜暴露后的标志性变化, 反映了组织遭到破坏的情况。 已有研究表明脂褐素沉积可在大量的不同病理情况下出现[64]。陈其晨等[65]发现, 长期生活在遭受污染的水环境中, 大龄的白鲢(Hypophthalmichthys molitrix)和草鱼(Ctenopharyngodon idella)的肝、肾、脾等组织器官都发生了不同程度的病变。这些组织器官存在数量较多的巨噬细胞, 能吞噬大量的脂褐素, 形成脂褐素细胞团。在本实验中,与对照组相比, 0.2、0.4和0.8 mg/L处理组脾脏出现了较多的脂褐素, 表明铜离子暴露后组织和细胞受损伤导致了脾脏MMCs的脂褐素增多。 综上所述, 水体铜暴露显著抑制了罗非鱼的生长性能, 导致罗非鱼脂代谢紊乱以及肝胰脏脂肪大量蓄积, 且对脾脏免疫及机体健康造成了一定的损伤。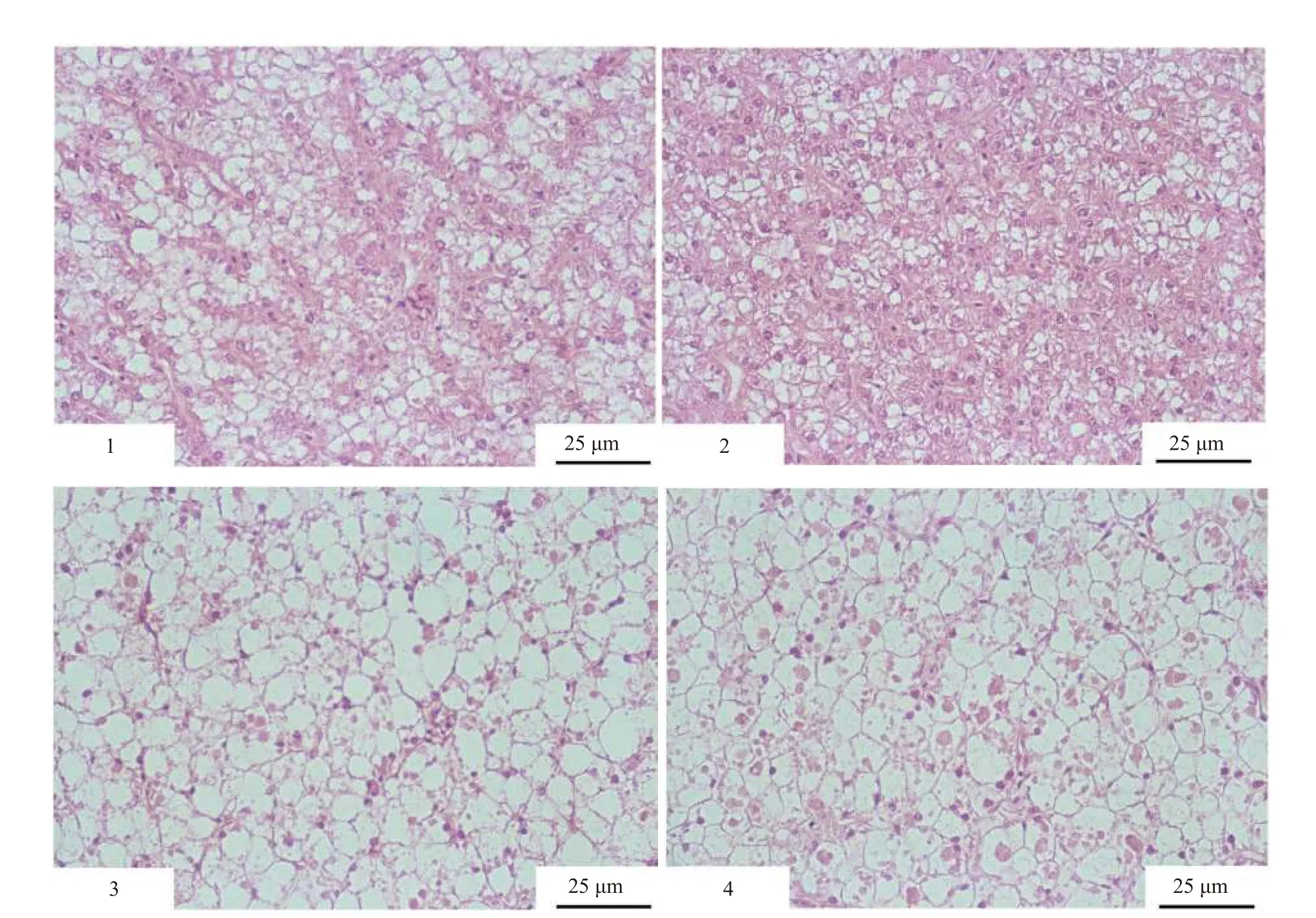
3.5 水体中不同浓度铜离子暴露对罗非鱼脾脏组织结构的影响
