低氧胁迫和恢复对杂交黄颡鱼“黄优1号”肠道组织的影响
2022-11-25程景颢沈铭浩杨智茹张伟健张国松尹绍武
程景颢 李 谣 沈铭浩 杨智茹 张伟健 张 凯 王 涛 张国松,2* 尹绍武*
(1. 南京师范大学海洋科学与工程学院, 江苏省特色水产育种与绿色高效养殖技术工程研究中心, 南京 210023;2. 菏泽学院, 山东省“十三五”高校生理生化及应用重点实验室, 菏泽 274015)
黄颡鱼(Pelteobagrus fulvidraco)隶属于鲇形目、鲿科、黄颡鱼属, 广泛分布于我国长江、黄河、松花江及珠江等水系[1], 因其肉质细嫩、蛋白丰富和肌间刺少等优点受到广大消费者青睐。据《中国渔业统计年鉴》统计, 2019和2020年黄颡鱼的养殖产量均超过5×108kg, 年均增幅为5.31%[2]。瓦氏黄颡鱼(P. vachelli)俗称江黄颡鱼、硬角黄辣丁、郎丝, 与黄颡鱼同为一属, 具有生长周期短、食性杂和适温性广等优点[3]。本研究团队以二代选育的瓦氏黄颡鱼为父本、三代选育的黄颡鱼为母本, 获得杂交黄颡鱼“黄优1号”(GS-02-001-2018), 其生长速度和成活率均高于母本黄颡鱼, 且抗病力强, 与父本瓦氏黄颡鱼相比, 可食用部分多, 更耐运输[4], 受到广大养殖户和消费者的喜爱, 目前已成为我国重要的优质养殖水产品种, 具有推动黄颡鱼产业升级的潜力[5]。
水体中的溶解氧是影响水生生物生存的一个重要生态因子[6], 低溶解氧对于鱼类而言是一种常见的现象。鱼类呼吸作用所吸收的一部分氧元素在生物体中转化为活性氧(Reactive Oxygen Species, ROS),少量的ROS参与细胞信号通路, 调控不同的细胞活性和基因表达, 而在低氧或恢复过程中ROS过量产生, 致使鱼类产生氧化应激反应[7]。如在杂交黄颡鱼的低氧胁迫研究中, Pei等[8]发现肝脏组织抗氧化酶(SOD、CAT、GSH-Px)和氧化应激参数(MDA)显著上调, 同样在多种硬骨鱼类如暗纹东方鲀(Takifugu fasciatus)[9]、团头鲂(Megalobrama amblycephala)[10]、葛氏鲈塘鳢(Perccottus glenii)[11]和尼罗罗非鱼(Oreochromis niloticus)[12]等, 在低氧胁迫下均激活抗氧化系统抵抗过量产生的ROS和氧化应激损伤。
尽管鱼类可通过一些急性应激反应来应对水体短期缺氧, 以维持其正常生理活动, 但是水体的严重低氧往往引起鱼类瞬间大量窒息死亡。研究表明, 鱼类大脑和心肌细胞在低氧状态下的凋亡,是导致“泛塘”的主要原因之一[13]。 然而, 目前关于鱼类低氧胁迫诱导细胞凋亡的分子调控机制研究仍处于初步阶段。王鹏飞等[14]通过对鳜(Siniperca chuatsi)肝脏转录组测序分析, 发现该鱼在低氧胁迫下bax和caspase8等促凋亡基因上调; 在长期低氧胁迫中, 鲤(Cyprinus carpio)[15]肝脏中bcl-2基因表达量显著上调; 丁晨雨等[16]发现低氧胁迫可诱导鲢(Hypophthalmichthys molitrix)心肌细胞发生凋亡。
肠道是鱼类消化吸收营养物质的场所和器官,大量微生物寄居其中。微生物菌群可以调控上百个基因的表达, 参与促使肠道细胞增殖、提高吸收能力和调节免疫应答等[17], 其组成变化与环境因子及宿主个体间关系密切, 当环境应激作用于鱼类个体时, 常常伴随着肠道环境的改变, 影响微生物数量和结构, 进而影响宿主的健康[18]。已有研究报道,日本沼虾(Macrobrachium nipponense)[19]、花鲈(Lateolabrax Maculatus)[20]和瓦氏黄颡鱼[21]等水生动物在低氧胁迫下肠道组织结构受损, 肠道微生物多样性显著下降, 致病菌数量显著增加。
目前, 国内外学者对鱼类肠道组织的环境胁迫研究逐渐重视, 而杂交黄颡鱼“黄优1号”肠道组织在低氧胁迫下的研究未见报道。鉴于近年来全国各地养殖户对杂交黄颡鱼“黄优1号”的需求扩大,了解其在低氧胁迫下的生理响应机制有助于推动黄颡鱼产业绿色发展。本文以杂交黄颡鱼“黄优1号”为研究对象, 探讨低氧胁迫对该鱼肠道的氧化应激、组织形态、细胞凋亡及肠道微生物组成的影响, 初步揭示低氧胁迫下杂交黄颡鱼的肠道组织内环境稳态的调控机制, 有助于更好地了解杂交黄颡鱼肠道的低氧响应机制, 可为后续开展鱼类耐低氧新品种选育提供一定的理论基础。
1 材料与方法
1.1 实验材料
实验所用杂交黄颡鱼“黄优1号”取自江苏省南京市水产科学研究所, 饲养条件为: 水温(27±1.0) ℃,pH 7.5—8.0, 以人工配合饲料投喂幼鱼, 每天喂食两次。挑选180尾无伤无病、体质健壮的杂交黄颡鱼(15.5±1.3) g随机平均分配于6个玻璃缸中(30尾/缸, 100 L), 在水流量5 L/min, 溶解氧浓度(Dissolved Oxygen, DO)6.8 mg/L条件下驯养14d, 正式实验前禁食24h。
1.2 实验设计与方法
实验设置对照组(7.0±0.5) mg/L和低氧组(1.0±0.1) mg/L, 每个处理组设3个重复, 实验过程中使用溶氧测定仪(LDO101, 上海鑫嵩公司)检测水体中DO值。对照组: 玻璃缸水体中始终充入空气将DO维持在(7.0±0.5) mg/L, 持续96h; 低氧组: 直接充入氮气25—30min使DO由(7.0±0.5)降至(1.0±0.1) mg/L,之后调节氮气充入量维持72h, 在低氧胁迫72h后停止充入氮气, 并充入30min空气使DO恢复至(7.0±0.5) mg/L, 维持24h[22]。在实验0、24h、48h、72h和恢复溶氧24h(记为H0、H24、H48、H72和R24),每个时间点对照组和低氧组分别解剖12尾鱼(每个缸随机选取4尾鱼)取中肠组织, 其中9尾鱼用于获取3个生物学重复样本, 经液氮处理后放置–80℃保存, 用于后续酶活、凋亡相关基因表达及肠道微生物的测定; 另外3尾鱼的中肠保存于4%多聚甲醛固定液中, 备用于切片检测。
1.3 肠道酶活性检测
称取0.1 g肠组织放入1.5 mL离心管中, 离心管置于冰盒中, 按照重量(g)﹕体积(mL)=1﹕9的比例加入0.9 mL的生理盐水, 冰水浴条件下进行机械匀浆,将所得到的组织匀浆液分装保存于–20℃冰箱。肠组织的蛋白浓度(TP)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)和乳酸脱氢酶(LDH)的活性, 丙二醛(MDA)和脂质过氧化物(LPO)的含量测定采用南京建成生物工程研究所提供的试剂盒进行操作。
1.4 肠道组织苏木精-伊红(HE)染色切片
用4%多聚甲醛对肠组织进行固定, 以防止细胞死亡后的自融或分解, 固定成功后进行流水冲洗,随后使用不同浓度的酒精(75%、85%和95%)进行脱水处理, 再将组织放置在石蜡的透明剂二甲苯中透明, 将组织放入融蜡箱中保温, 待石蜡完全浸没组织块进行包埋处理。接着对石蜡切片脱蜡水化,并进行苏木素和伊红染色。最后脱水封片, 并将切片置于显微镜下观察。
1.5 肠道组织TUNEL切片检测
将保存在4%多聚甲醛溶液中的肠组织进行常规石蜡包埋并切片, 石蜡切片脱蜡至水: 依次将切片放入二甲苯Ⅰ 20min-二甲苯Ⅱ 20min-酒精Ⅰ5min-酒精Ⅱ 5min-85%酒精5min-75%酒精5min-蒸馏水洗。切片稍甩干后滴加蛋白酶K工作液覆盖组织, 37℃温箱孵育20min。将玻片置于PBS(pH 7.4)中在脱色摇床上晃动洗涤3次, 每次5min。切片稍甩干后在圈内滴加新鲜配制的DAB显色液, 显微镜下控制显色时间。细胞核经苏木素着色变蓝,DAB显出来的阳性凋亡细胞核为棕黄色。
1.6 肠道组织细胞凋亡相关基因的时序表达分析
采用荧光定量PCR(qRT-PCR)检测凋亡相关基因(bax、bcl-2、p53和caspase 9)mRNA的表达情况。首先从课题组测得的转录组序列中获取相关基因序列, 使用Premier 5.0软件设计基因特异性上下游引物, 如表 1所示, 其中β-actin为内参基因。qRT-PCR反应的反应体系为正、反向引物各1 μL,Mix 10 μL, ddH2O 4 μL, 模板cDNA 4 μL, 总体积为20 μL。使用2–ΔΔCt公式计算基因的相对表达量。
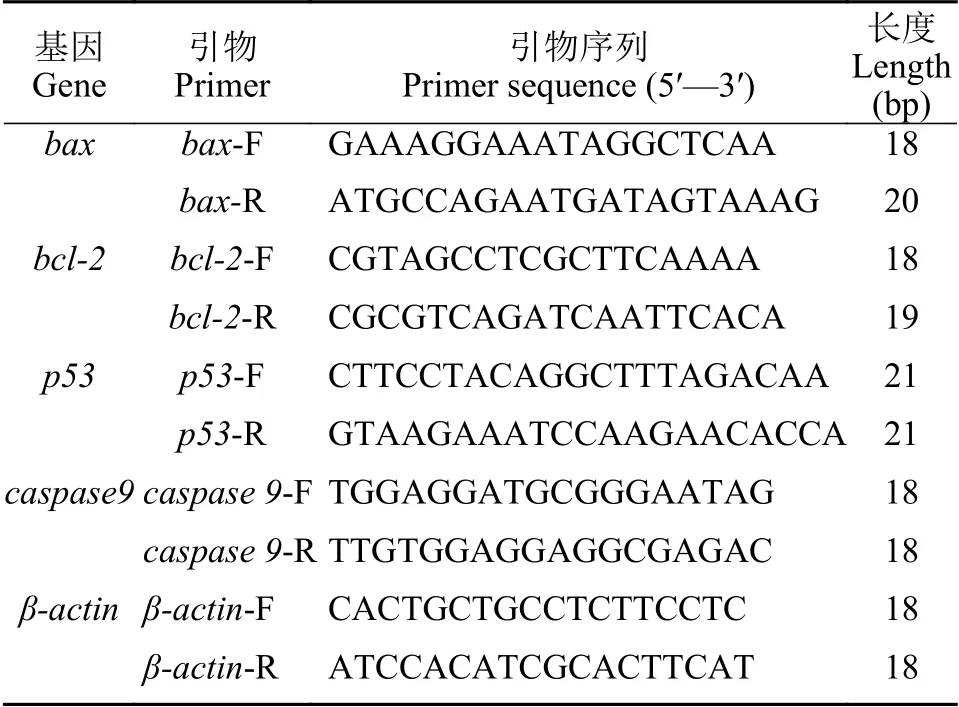
表1 引物列表Tab. 1 Description of primers used in this study
1.7 肠道微生物分析
对照组和低氧组的肠道组织在取材完毕后置于–80℃冰箱中保存, 送至武汉菲沙基因公司进行测序。采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库。通过质量初筛的原始序列按照Index和Barcode信息, 进行文库和样本划分, 去噪或OTU(Operational Taxonomic Units)聚类。根据ASV/OTU在不同样本中的分布, 评估每个样本的物种丰度、Alpha多样性水平。根据高通量测序结果, 预测各样本的菌群代谢功能, 找出差异通路, 并获得特定通路的物种组成。
1.8 数据统计分析
使用SPSS 22.0软件进行数据统计分析。数据采用One-way analysis进行方差检验, 分析同一时间点对照组和低氧组表达模式的数据采用t-test检验统计差异, 当P-value<0.05时认为差异显著(标为*),结果用平均值±标准差(mean±SD)表示。
2 结果
2.1 低氧胁迫和恢复对杂交黄颡鱼“黄优1号”肠道氧化应激的影响
杂交黄颡鱼在低氧胁迫和恢复下肠道组织中的4种酶活性和MDA、LPO变化见图 1。SOD和LDH酶活性在低氧胁迫下显著升高, 在H72达到最大, 恢复溶氧24h后仍与对照组有显著差异(P<0.05); CAT和GSH-Px酶活在H24出现显著差异(P<0.05), 恢复溶氧过程中酶活性下降, 在R24与对照组无显著差异(P>0.05); 在低氧胁迫下MDA和LPO较对照组均显著上升(P<0.05), 并在H72达到峰值, 恢复氧含量后逐渐下降, R24仍与对照组有显差(P<0.05)。
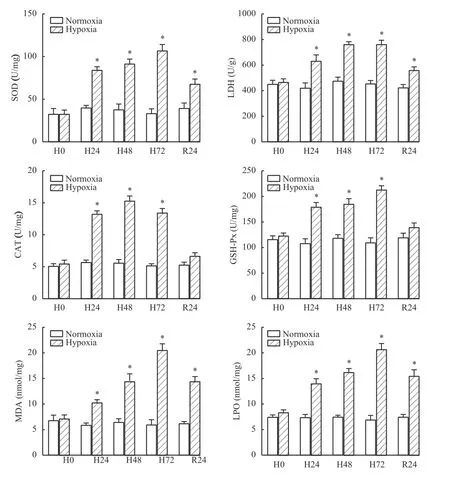
图1 杂交黄颡鱼“黄优1号”肠道氧化应激指标变化Fig. 1 Effects of index activities related to oxidative stress in the intestine of hybrid yellow catfish “Huangyou-1”
2.2 低氧胁迫和恢复对杂交黄颡鱼“黄优1号”肠道组织结构的影响
如图 2所示, H0中杂交黄颡鱼的肠道组织具有正常的形态结构, 单层柱状上皮细胞排列有序, 固有层紧密纤长, 杯状细胞饱满。胁迫开始后低氧组出现不同程度的损伤, H24杯状细胞肿胀, H48肠黏膜出现坏死并有空泡结构, H72肠道组织空泡数量增多, 绒毛侵蚀情况进一步加剧, 恢复溶氧24h后,低氧引起的肠道组织生理变化并未得到改善, 肠绒毛出现糜烂。
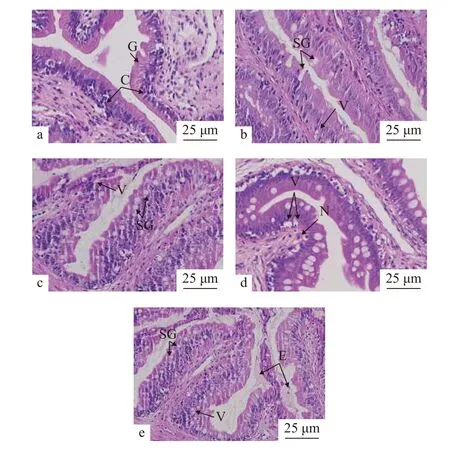
图2 低氧胁迫和恢复下杂交黄颡鱼“黄优1号”肠道组织形态Fig. 2 Intestinal tissue morphology of of hybrid yellow catfish“Huangyou-1” under acute hypoxia and reoxygenation conditionsa. H0; b. H24; c. H48; d. H72; e. R24; C. 柱状细胞; G. 杯状细胞;SG. 杯状细胞肿胀; V. 空泡; N. 黏膜层坏死; E. 肠绒毛糜烂a. H0; b. H24; c. H48; d. H72; e. R24; C. columnar cells; G. goblet cells; SG. swelling of goblet cells; V. vacuoles in the lamina propria;N. necrosis in the mucosal layer; E. erosion of villi
2.3 低氧胁迫和恢复对杂交黄颡鱼“黄优1号”肠道细胞凋亡的影响
肠道组织TUNEL检测结果TUNEL切片的检测结果显示, 低氧胁迫开始时杂交黄颡鱼肠道组织细胞凋亡现象较少, 而在低氧组中均检测到不同程度的细胞凋亡(图3)。进一步统计分析显示(表2),低氧可显著促进肠道组织发生凋亡, 随着低氧时间的延长, 各处理组之间的凋亡指数显著增加(P<0.05);R24的细胞凋亡指数与H48无显著差异(P>0.05)。

表2 肠道组织凋亡指数Tab. 2 Apoptosis index of intestinal tissue
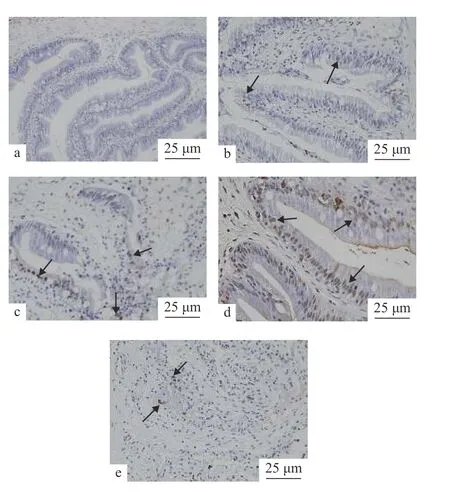
图3 肠道组织Tunel切片检测结果Fig. 3 Results of intestinal Tunel detectiona. H0; b. H24; c. H48; d. H72; e. R2;黑色箭头代表凋亡细胞a. H0; b. H24; c. H48; d. H72; e. R24. Black arrows mean apoptotic cells
低氧胁迫和恢复下杂交黄颡鱼“黄优1号”bax、bcl-2、caspase9和p53基因的时序表达分析在低氧胁迫下杂交黄颡鱼“黄优1号”肠道中bax和p53基因的表达量显著升高, 在H72达到峰值, 恢复溶氧后表达量下降。bcl-2基因的表达量在低氧胁迫下不断降低, 恢复溶氧后表达量上升, R24仍与对照组差异显著(P<0.05)。caspase9基因的表达量在低氧胁迫下显著升高, 恢复溶氧后表达量降低,R24仍与对照组有显著差异(P<0.05; 图 4)。

图4 低氧胁迫和恢复下杂交黄颡鱼“黄优1号”的肠道组织凋亡相关基因的表达模式Fig. 4 Temporal expression of apoptosis-related genes in the intestinal of hybrid yellow catfish “Huangyou-1” under acute hypoxia and reoxygenation conditions
2.4 低氧胁迫和恢复对杂交黄颡鱼“黄优1号”肠道微生物的影响
肠道微生物组间差异分析通过序列比对和注释, 选取每个处理组在门(Phylum)水平上占比较大的物种, 生成相对丰度柱形图(图5), 以便直观查看各处理组在门水平上相对丰度较高的物种及其比例。杂交黄颡鱼肠道菌群相对丰度较大的主要集中在变形菌门(Proteobacteria)、厚壁杆菌门(Firmicutes)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)。H72中变形菌门丰度较对照组明显下降(由32.53%下降到8.89%), 厚壁菌门和拟杆菌门则明显增多(由19.56%增加到42.38%, 由11.25%增加到32.58%)。且在H72的处理组中, 除拟杆菌门外, 厚壁菌门占据绝对优势。恢复溶氧后肠道菌群数量进一步丰富和增加, 这也表明低氧胁迫对杂交黄颡鱼肠道微生物的组成具有重要影响。
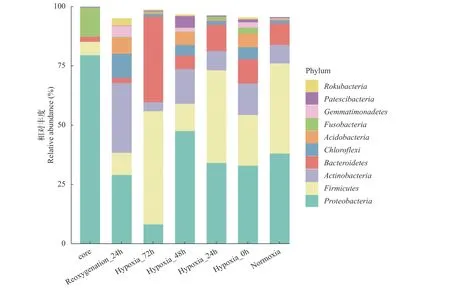
图5 杂交黄颡鱼“黄优1号”门水平上肠道微生物菌群组成Fig. 5 Composition of intestinal microbial at phylum level of hybrid yellow catfish “Huangyou-1”
对各处理组的肠道微生物Alpha多样性进行统计分析(图6), 以Chao1和Observed species指数表征丰富度, 以Shannon和Simpson指数表征多样性, 以Faith’s PD指数表征基于进化的多样性, 以Pielou’s evenness指数表征均匀度, 以Good’s coverage指数表征覆盖度。由图6可知, Chao1和Observed species指数随着低氧胁迫时间的延长而降低, R24 微生物菌群丰富度增加。Shannon指数在H48达到最低, R24指数有所增加, 同样Simpson指数在R24较低氧组有所回升。Faith’s PD和Pielou’s evenness的指数均在H48达到最低。在低氧组中Good’s coverage指数较对照组均略微升高, 表明微生物的均匀度也进一步增加。
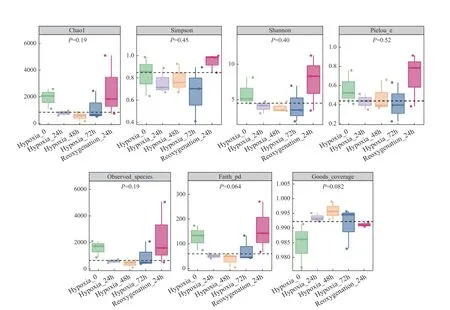
图6 Alpha多样性指数的分组箱线图Fig. 6 Block boxplot of Alpha diversity index
低氧胁迫和恢复对肠道优势菌群变化的影响统计结果表明, 低氧胁迫影响了杂交黄颡鱼肠道微生物菌群的变化, 具体体现在数量和种群丰富度上, 在属水平上对优势群落的丰度进行统计(表3)。由表 3可知, 低氧造成厌氧致病菌的大量繁殖, 具体表现在葡萄球菌属(Staphylococcus)、链球菌属(Streptococcus)和霍乱弧菌(Vibrio cholera)等致病菌数量的增加, 乳酸菌属(Lactobacillus)、罗斯氏菌属(Roseburia)和双歧杆菌属(Bifidobacterium)等有益菌数量的减少。
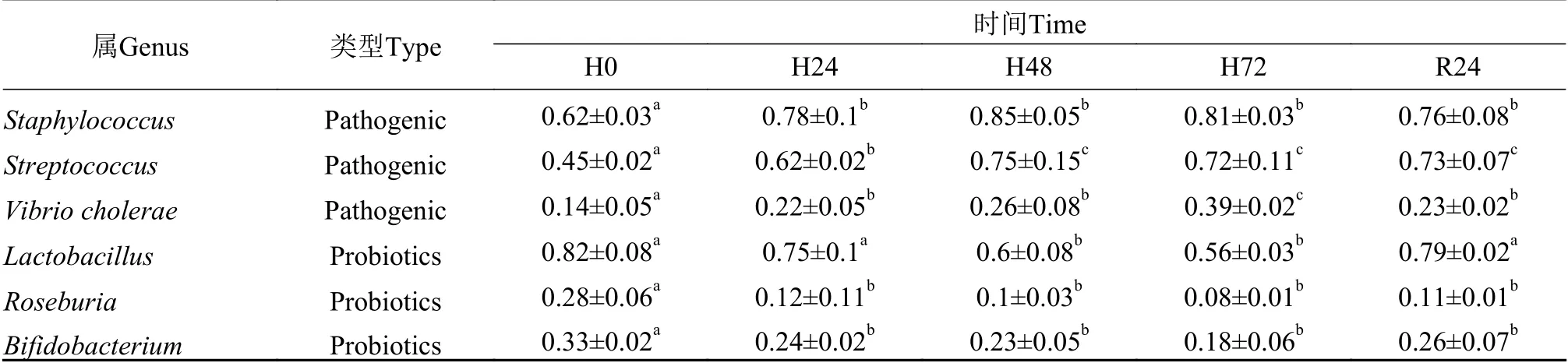
表3 低氧胁迫下杂交黄颡鱼“黄优1号”肠道组织致病菌和益生菌的相对丰度Tab. 3 Relative abundance of pathogenic and probiotics bacteria in intestinal tissues of hybrid yellow catfish “Huangyou-1” under hypoxia stress (%)
肠道微生物功能预测基于肠道微生物测序结果对低氧胁迫下杂交黄颡鱼的代谢通路进行统计和KEGG功能预测(图7)。结果显示, 肠道微生物在细胞进程(Cellular processes)、环境信息处理(Environmental information processing)、遗传信息处理(Genetic information processing)、人类疾病(Human diseases)、代谢(Metabolism)和生物体系统(Organismal systems)六大类代谢通路中均有分布,与代谢通路相关的微生物占大多数, 与疾病相关的也占有一定比例。
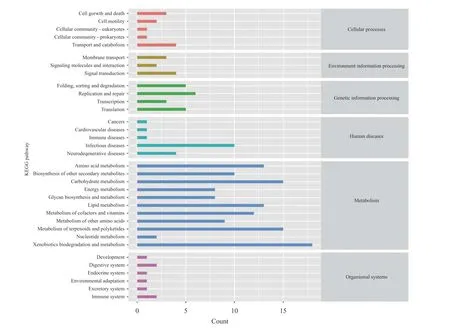
图7 肠道微生物的KEGG功能预测图Fig. 7 KEGG function prediction of intestinal microbial
3 讨论
3.1 低氧胁迫和恢复对杂交黄颡鱼“黄优1号”肠道氧化应激的影响
在鱼类受到胁迫后, 体内ROS含量会发生变化,尤其低氧胁迫导致的机体补偿代谢加剧了氧化应激反应[23]。据报道, 当细胞中ROS的产生速率快于氧自由基的清除速率时, 生物体内的抗氧化防御系统便会被激活[24], 如鲤[25]和青田田鱼(Cyprinus carpio var qingtianensis)[26]的大脑和肝脏暴露在急性低氧下, LDH、SOD、CAT和GSH-Px酶活性显著增加; 团头鲂幼体[27]在低氧胁迫过程中血清中
LDH和肝脏中GSH-Px、MDA含量均显著增加。在本研究中发现, 杂交黄颡鱼在低氧胁迫下肠道组织的SOD、CAT和GSH-Px活性水平较对照组均显著上升, 表明低氧胁迫使得杂交黄颡鱼肠道内抗氧化防御功能被激活, 以应对机体产生过量ROS引起的氧化损伤, 这与花鲈[28]的低氧胁迫研究结果一致。与对照组相比, LDH在低氧胁迫下显著升高,表明杂交黄颡鱼肠道中有氧利用得到限制导致ATP产生不足, 需通过无氧呼吸来弥补氧气不足所带来的机体能量供应紧缺, 这与李欣茹[9]对暗纹东方鲀在低氧胁迫下肝脏中LDH活力的研究结果相似。MDA和LPO被认为是反映生物体内氧化应激水平的标志物[29], 两者含量的变化能够反映出机体和细胞的损伤程度。在本研究中发现MDA和LPO的含量在低氧胁迫下不断升高, 表明杂交黄颡鱼体内的抗氧化物酶可能难以迅速清除大量脂质过氧化物, 从而导致二者含量迅速增加, 类似结果在鲻幼鱼(Mugil cephalus)[30]也有报道。
Lushchak等[31]认为鱼类在低氧条件下可提高自身抗氧化能力, 从而为应对复氧后的再次氧化应激做准备, 在本研究中可以发现杂交黄颡鱼的抗氧化防御系统在低氧24h就已全部启动, 这也进一步印证了上述观点。在恢复溶氧过程中抗氧化酶(SOD)、能量代谢酶(LDH)活性和氧化应激参数(MDA、LPO)含量略有下降, 但是较对照组仍有显差, 表明氧化应激在氧气恢复过程中也同样存在, 这可能是由于氧浓度的恢复使细胞进行大量有氧呼吸产生过量ROS导致; 值得注意的是, CAT和GSH-Px的活性在恢复溶氧24h后与对照组并无显著差异, 这可能是因为鱼体内的超氧自由基经SOD先还原为过氧化氢, GSH-Px与CAT之间存在代偿互补效应, 可以将过氧化氢转化成水, 彼此之间削弱活性[32]。上述研究结果证实了低氧和恢复均会对杂交黄颡鱼“黄优1号”造成氧化损伤, 而抗氧化防御系统的激活可以保护细胞并减少氧化应激对鱼体带来的损伤。
3.2 低氧胁迫和恢复对杂交黄颡鱼“黄优1号”肠道细胞凋亡和组织结构的影响
研究表明, 鱼类在低氧下不仅会产生过量的ROS导致氧化应激反应, 还会引起细胞发生凋亡[33], 本研究采用TUNEL染色法对杂交黄颡鱼肠道组织进行观察, 结果显示, 低氧胁迫加重了肠组织细胞的凋亡现象, 且随着低氧时间的延长, 凋亡细胞数目也在增加, 与团头鲂[10]和鲢[16]的心肌细胞在低氧胁迫下的研究结果相似。
低氧胁迫下杂交黄颡鱼肠道中caspase9基因的表达量较对照组显著增加, 推测可能是细胞色素C通过凋亡小体来激活下游的Caspase家族,caspase9的激活使胞膜内陷, 通过促使胞内蛋白降解,诱导细胞发生凋亡[34]。p53是一种肿瘤抑制基因,在本研究中p53的表达量在低氧胁迫下不断增加,并在H72达到最高, 表明p53在低氧条件下对细胞凋亡信号具有一定的促进作用。有研究认为,bcl-2和bax是鱼类细胞凋亡过程中起着关键调控作用的两个基因, 二者的比值在一定程度上决定了细胞的发展方向[35]。在我们的研究中发现, 杂交黄颡鱼肠道中bax和bcl-2的表达量随着低氧时间的延长分别上升和下降,bcl-2/bax的值逐渐减小, 显著促进了肠道细胞的凋亡。恢复溶氧后bax的表达量减少, 而bcl-2的表达量增加, 这可能是由于在细胞中形成了稳定的bcl-2/bax异源二聚体, “中和”了bax/bax同源二聚体诱导细胞凋亡的作用[36]。此外, 恢复溶氧24h后bax、bcl-2和caspase9的表达量与对照组仍有显著差异, 这可能是因为恢复过程中氧气的重新导入会使得鱼体产生氧化应激现象, 而这种氧化应激程度过强时, 机体同样会自发启动细胞凋亡程序。
研究报道, 高温[37]、摄食[38]和细菌感染[39]等常常引起鱼类肠上皮组织和细胞结构发生功能性变化, 在本研究中我们通过HE染色切片观察发现, 低氧胁迫下杂交黄颡鱼肠道组织中的杯状细胞数量显著减少、空泡数量增多, 且随着低氧时间的延长,肠绒毛排列杂乱, 出现糜烂现象, 在恢复溶氧后, 低氧引起的肠道组织生理变化并未得到改善; 表明低氧亦可改变杂交黄颡鱼肠道正常的组织形态, 此结果与大口黑鲈(Micropterus salmoides)[40]和日本沼虾[41]的低氧胁迫研究结果一致。
3.3 低氧胁迫和恢复对杂交黄颡鱼“黄优1号”肠道微生物的影响
肠道是鱼类体内重要的消化吸收器官, 生存着结构复杂且数量庞大的微生物菌群, 这些微生物菌群不仅与其营养代谢、免疫防御和能量传递有着密切联系, 还在维持肠道内环境稳态中起着重要作用, 它们与宿主的健康生长息息相关[42]。有研究认为, 放线菌的丰度代表着肠道的健康状况, 放线菌丰度越高说明肠道健康状况越好[43], 在H72的处理组中放线菌的数量显著低于对照组, 并且通过HE切片也可观察出H72中的肠道组织受损严重, 这也进一步印证了上述观点。肠道微生物丰度柱形图显示杂交黄颡鱼肠道核心菌群是变形菌门, 此结论印证了Harris[44]提出的水生动物存在固有的肠道微生物群落的观点。此外, 在门水平上肠道菌群组成差异较大, 说明低氧影响了杂交黄颡鱼肠道菌群的数量和结构。通过Alpha多样性分组箱线图, 我们发现在低氧胁迫过程中, 杂交黄颡鱼肠道中的Shannon和Simpson指数较对照组下降, 也说明了其微生物丰富度随着低氧时间的延长而降低。
水生动物在不同的水体环境下会产生应激反应, 进而使肠道内环境平衡受到冲击, 宿主的正常防御系统被破坏, 致病菌会转移、定植甚至侵袭鱼体组织器官[45]。Suo等[46]对凡纳滨对虾(Litopenaeus vannamei)研究发现, 长期暴露在亚致死浓度的硫化物水体中, 肠道组织结构受损, 梭杆菌数量显著增多。Kan等[47]发现五氯苯酚胁迫使得金鱼(Carassius auratus)肠道内大量积累这种物质, 导致其肠道内菌群数量发生改变。在我们的研究中发现随着低氧时间的延长一些厌氧菌得到大量繁殖, 其中不乏有致病菌(葡萄球菌、链球菌)的侵入及益生菌群(乳酸菌、双歧杆菌)数量的降低, 这与日本沼虾[19]和瓦氏黄颡鱼[21]的研究结果一致。通过绘制低氧胁迫下样本的KEGG功能预测图, 发现肠道微生物主营代谢功能, 但是在细胞进程和生物体系统等方面同样发挥着独特的功能, 值得注意的是, 在本次功能预测中, 与疾病相关的微生物也占有一定比例,说明低氧胁迫下杂交黄颡鱼的免疫防御系统会遭到损害, 从侧面揭示了低氧、肠道微生物和宿主免疫之间的复杂关系。
4 结论
综上所述, 低氧和恢复会诱导杂交黄颡鱼“黄优1号”肠道抗氧化酶(SOD、CAT和GSH-Px)、能量相关酶(LDH)活性和应激指标(MDA和LPO)含量显著升高, 凋亡指数及凋亡相关基因(bax、p53和caspase9)表达量显著升高,bcl-2基因的表达量则减少, 表明随着低氧时间的延长, 杂交黄颡鱼的肠道氧化应激损伤逐渐加大, 恢复溶氧后这种现象仍然存在, 这可能是肠道产生细胞凋亡的诱因之一。此外, 随着低氧时间的延长, 黏膜层坏死、空泡和绒毛侵蚀等肠道组织结构受损现象逐渐加剧, 葡萄球菌和链球菌等厌氧菌数量增多, 使肠道内环境稳态遭到破坏, 进而影响肠道功能。本研究结果为阐明低氧和恢复下杂交黄颡鱼“黄优1号”肠道组织内环境稳态调控机制提供理论依据。
