锂电池电解液电导率模型研究进展
2022-11-19周思飞王小飞张道明薛浩亮
周思飞,李 骏,王小飞,张道明,薛浩亮
(中国石化上海石油化工研究院,上海 201208)
电解液被称为“锂电池的血液”,其作用是在正负极间传输锂离子,对电池的能量密度、循环寿命、安全性能、高低温性能具有直接影响[1]。电导率是电解液最常规的物性,表征着电解液的传输特性,广泛应用于研究电解液溶液微观结构和微观粒子相互作用,帮助我们更好地理解电解液中复杂的微观现象[2-3]。另外在电池的开发过程中离子电导率低或黏度高的电解液在高电流密度或低温环境下往往表现出较差的循环稳定性,通过合适的数学模型可以帮助科研人员更好地进行电解液设计[4-5]。电解液电导率受溶质种类、溶剂组成、溶质浓度以及温度等因素影响[6-7],变量多且复杂,因此通过数学模型来探索电解液电导率与各因素之间的内在关系并寻找其中规律具有重要的研究意义。
本文综述了锂电池电解液溶液电导率的理论和数学两大类模型,理论模型包含经典溶液模型和统计热力学模型,数学模型包含半经验模型和数理统计方法。通过建立电导率理论模型,有助于研究锂离子在电解液中复杂的热力学和输运机制,加深对锂离子溶剂化效应的理解;在此基础上预测不同组分不同条件下的电解液电导率等关键物性参数,为高低温、倍率等功能型电解液设计提供参考;另外通过建立准确的锂电池电导率模型,也能辅助电池材料基因数据库的建设。
1 电导率理论模型
1.1 经典溶液模型
近一个世纪以来,许多研究人员试图从理论上解释电解质溶液的离子传输现象[8]。在电解液中电导率数据容易获得且精度高,研究人员构造出性质尽可能接近真实电解液溶液系统的物理化学模型,通过合理的假设条件推导出可靠的理论模型。通过理论模型与实验数据对比实现了研究人员对电解质行为的深入理解并进一步促进了理论的完善。
1.1.1 电导率与温度
电导率与温度的关系通常由阿仑尼乌斯方程和Vogel-Fulcher-Tammann (VFT)方程描述[9]。在微观水平上,微粒(分子或离子)的运动除了受到周围微粒的分子间作用力还受原子互相吸引力(包括所有种类共价键)的控制。这些力的大小取决于位置,并且在偶极相互作用的情况下,还取决于相互作用物质的取向。固体中分子以相对固定的方向占据平衡位置;无限稀释的溶液中,溶剂分子的数量众多,可以近似为固定方向,这两种情况下电导率将由热跳跃频率决定,电导率与温度符合阿仑尼乌斯关系:
κ是电导率,一般情况下,活化能Ea和指数前因子κ0是与温度无关的自变量。从基本统计力学的角度来看,阿仑尼乌斯方程意味着输运机制是一个热激活的过程,在激活的过程中,离子从一个位置或方向移动到另一个位置或方向必须跨越一道能量屏障(活化能)。如图1 所示,Han 等[10]用阿仑尼乌斯方程很好地拟合了不同锂盐在碳酸乙烯酯(EC)和碳酸甲乙酯(EMC)混合溶剂中-20~60 ℃下的电导率变化。双氟磺酰亚胺锂(LiFSΙ)具有中等尺寸的弱配位阴离子,是在有机碳酸盐溶剂中解离率最高的锂盐,图1也显示其作为锂盐的碳酸酯类电解液电导率最高,可作为指导今后设计新型高电导率锂盐的参考模型。
图1 采用阿伦尼乌斯方程预测不同锂盐在EC/EMC(体积比3∶7)混合溶剂中的电导率[10]Fig.1 Arrhenius plots of conductivity of 1 mol/L different Li salts in a mixture of EC/EMC(3∶7,volume ratio)[10]
当离子输运由溶剂的迁移决定时,电导率取决于溶剂的自由体积,可以通过VTF方程关联。
其中A和B是常数。A是与T12成比例的指前因子,B与离子传输的临界自由体积有关,T0是溶剂结构弛豫变为零的温度,可以认为是玻璃化转变温度Tg。VTF方程适用于熔融盐、聚合物电解质体系、高盐浓度水溶液及部分有机溶剂体系。
Fontanella 等[11-13]研究了六氟磷酸锂(LiPF6)在不同溶剂体系电导率与温度的关系,发现都很好地遵循了VTF方程。以常见的锂电池碳酸酯类电解液为例,尽管锂离子在较低盐浓度下也与溶剂分子强烈配位,由于可用的配位位置多,不需要溶剂分子的运动来创建空的配位位置促进锂离子运输[14-15]。因此,在低盐浓度,传导机制近似于阿仑尼乌斯行为。在较高的盐浓度下,离子传输所需的溶剂分子能量和空间上有利的配位位置的产生要求溶剂基质进行自身重组,其结果是离子传输受到溶剂的辅助[16-17]。
1.1.2 电导率与盐浓度
无序离子氛模型和有序晶格模型试图解释电解质溶液的微观结构及其与离子传输的关系[18];无序离子氛模型经过了近一个世纪的不断完善与发展,最早于1923 年由Debye 和Huckel[19-20]提出,其理论假设溶质盐完全解离成离子,离子等效为直径为a的刚性带电球体在连续介质中移动。在离子运动过程中,连续介质由溶剂的介电常数作静电描述,由其黏度作流体动力学描述,离子间复杂的相互作用被简化成各个中心离子与周边离子氛的静电引力。将离子视为点电荷,服从静电学原理泊松方程,并且电荷分布遵从玻尔兹曼指数分布。该理论只考虑了离子间的长程静电力,仅适用于非常稀释的完全解离电解液溶液系统。1957 年,Fuoss[21-23]提出一个基于原始模型的Bjerrum 修改模型,该模型将短程成对离子相互作用包含在缔合常数中,适用于对称溶质盐体系,涵盖介电常数大于10 的溶剂。为了消除实际溶液系统与原始模型的性质之间的差异,1975年Fuoss[24]提出了一个新模型:与之前的方程将配对距离R预设为Bjerrum 距离不同,新模型将R作为从实验数据中确定的参数,该模型进一步扩大应用范围,适用于混合溶剂系统[25-26]。1977 年Fuoss 等[27-29]又进一步将成对离子分为两类:只有溶剂分子作为最近邻的离子,以及具有相反电荷的离子作为内壳成员的离子。
用新的数学方法求解溶液中各种粒子的径向分布函数也能扩展原始连续介质模型的适用范围,将Fuoss-Onsager方程和平均球近似理论相结合[30-32],并考虑溶液中离子对的形成,为某些1∶1电解质提供了等效电导率的良好拟合,后来将电导率模型扩展到混合溶液,并进一步扩展到弱电解质缓冲溶液系统,但模型的准确性取决于作为可调参数的平均离子半径的选择。韩景立等[33-35]应用平均球近似理论计算了3种锂盐有机溶液的摩尔电导率,盐浓度达到1 mol/L,相对平均误差为4.8%。Wang 等[36]计算了25 ℃下不同锂盐在不同混合碳酸酯溶剂中的电导率,在盐浓度高达2.5 mol/kg的条件下,观察到与实验数据的良好一致性。图2展示了其中的一组数据,碳酸丙烯酯(PC)溶剂中不同LiPF6盐浓度下的平均球近似理论预测曲线对实验电导率的拟合。
图2 平均球近似理论(实线)对实验电导率的拟合[36]Fig.2 Fitting of the mean spherical approximation predicted and experimental conductivity[36]
有序晶格模型最早应用于熔盐体系,模型用单元晶格的概念取代离子氛,单元晶格的中心离子周围有固定的离子[37]。当模型应用于电解液溶液时,使用的方法是将“有序”模型与“随机”离子氛相结合,用统计方法调整离子氛模型中的弛豫和电泳效应,由此预测了离子电导率对浓度的立方根依赖性[38]。
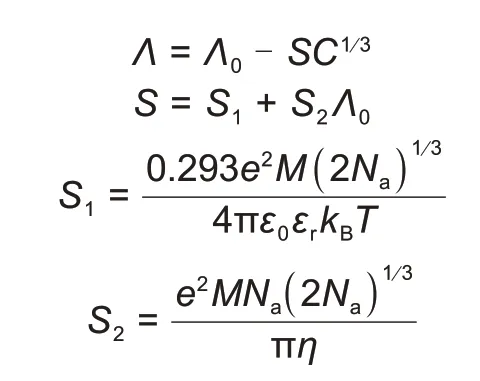
式中Λ是摩尔电导率,下标0表示无限稀释状态,ε0是空间的介电常数,εr是溶剂的相对介电常数,e是电子电荷,T是温度,kB是玻耳兹曼常数,Na是阿伏伽德罗常数,M是晶格参数。Chagnes等[39-40]研究了高氯酸锂(LiClO4)在γ-丁内酯(γBL)溶剂中的传输特性,在盐浓度为0.2~2 mol/kg时,有序晶格模型很好地预测了电解液溶液的摩尔电导率与盐浓度遵循立方根定律。
表1汇总了电导率经典溶液模型在常见电解液体系下的应用情况,对每种体系适用的温度、盐浓度以及预测的平均相对误差进行了归纳。综合来看,经典溶液模型在电解液溶液上的应用主要集中于对溶液微观结构和微观粒子相互作用的理解以及传导机制的定性分析。
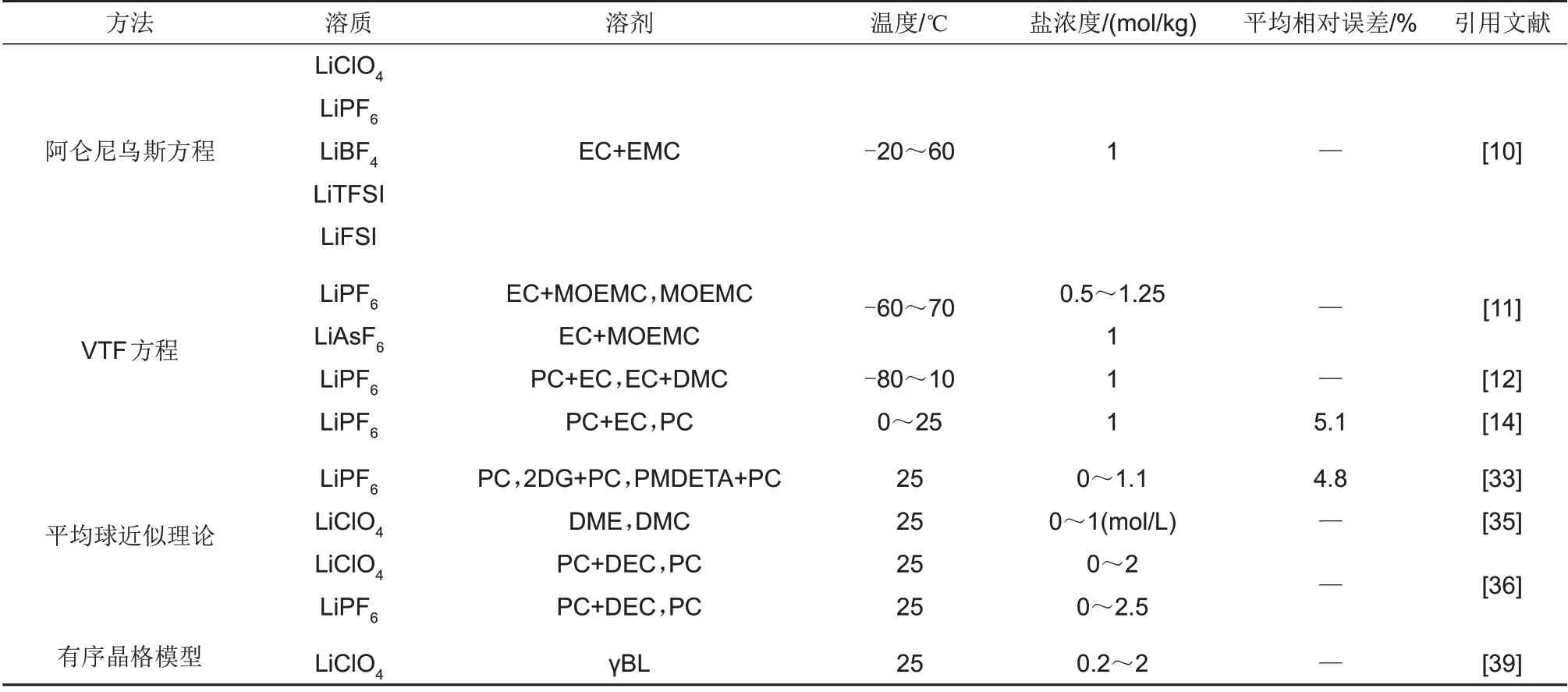
表1 电解液电导率经典溶液模型Table 1 Classical solution model of electrolyte conductivity
1.2 统计热力学模型
近年来,随着计算机技术和实验技术的不断提高,人们引入统计热力学方法,使得电解质溶液理论研究的发展越来越快[41-42]。
1.2.1 先进电解液模型(AEM)
离子电导率是在电场驱动下电解液溶液中所有自由离子整体迁移效应的总和。对于理想性电解液(溶剂盐完全解离,离子间互不干扰),根据斯托克斯定律和能斯特-爱因斯坦方程[43]:
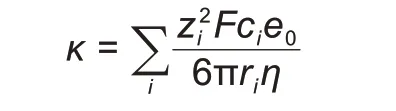
zi是离子的价态,F是法拉第常数,ci是离子浓度,e0是元电荷,ri是i离子的斯托克斯半径。为满足理想性的要求,电解液中的盐浓度需要无限低,而溶剂的介电常数需要足够高。锂电池电解液的盐浓度达到0.1 mol/L 时就会表现出非理想性。为了进一步将方程的适用性扩展到非理想性液体,需要分别考虑盐浓度对自由离子数和离子迁移率的影响[43-44]。
先进电解液模型(AEM)使用了斯托克斯定律的修正形式[45-46],它解释了简单斯托克斯定律忽略的附加效应,包括离子-离子相互作用,离子-溶剂相互作用和溶剂-溶剂相互作用。
无限稀释:

所有的离子种类的摩尔电导都可以用λj来表示,离子电导率表示为盐浓度与所有离子摩尔电导和的乘积。AEM中建模方法的统计力学基础是平均球面近似的非原始非限制结合形式(NPNRAMSA)[47-48],可精确解释真实电解质系统背后的化学物理,能有效预测发生显著离子缔合的非理想电解液溶液性质。NPNRAMSA 计算根据质量作用定律(MAL)导出的热力学控制方程通过离子大小和溶剂化量、溶液密度、溶液介电常数和离子数密度进行参数化,并作为溶液组成、盐浓度和温度的函数进行求解,得出电解质中存在的离子种类的估计值(例如接触离子对、溶剂分离离子对和三重离子)。离子溶剂化是所有电解质系统的核心考虑因素。这是一个动态过程,包括溶剂物种和离子之间的偶极-电荷吸引,以及离子周围溶剂化区域内的溶剂交换。AEM 计算速度快,效率高,这是由于关键分子相互作用指标的时间平均值的提前分配。
Gering等[43-45]验证了AEM对于宽温范围下常用锂盐在碳酸酯和羧酸酯以及砜类混合溶剂中电导率预测的良好效果,实验结果表明在盐浓度0~3.5 mol/kg的条件下平均相对误差为5%。Logan等[1]进一步扩大了电解液溶剂的选择范围,并比较了常用锂盐在不同溶剂组合中AEM的预测误差,如图3所示,除了含环丁砜溶剂的体系,其他体系的预测误差都较小。Chayambuka等[46]将AEM进一步扩展到了钠离子电解液电导率,温度-10~50 ℃,在盐浓度0~2 mol/kg的条件下六氟磷酸钠(NaPF6)在EC和PC混合溶剂中平均相对误差为7%。因此AEM可以满足各类不同体系电解液传输特性的快速预测的要求。
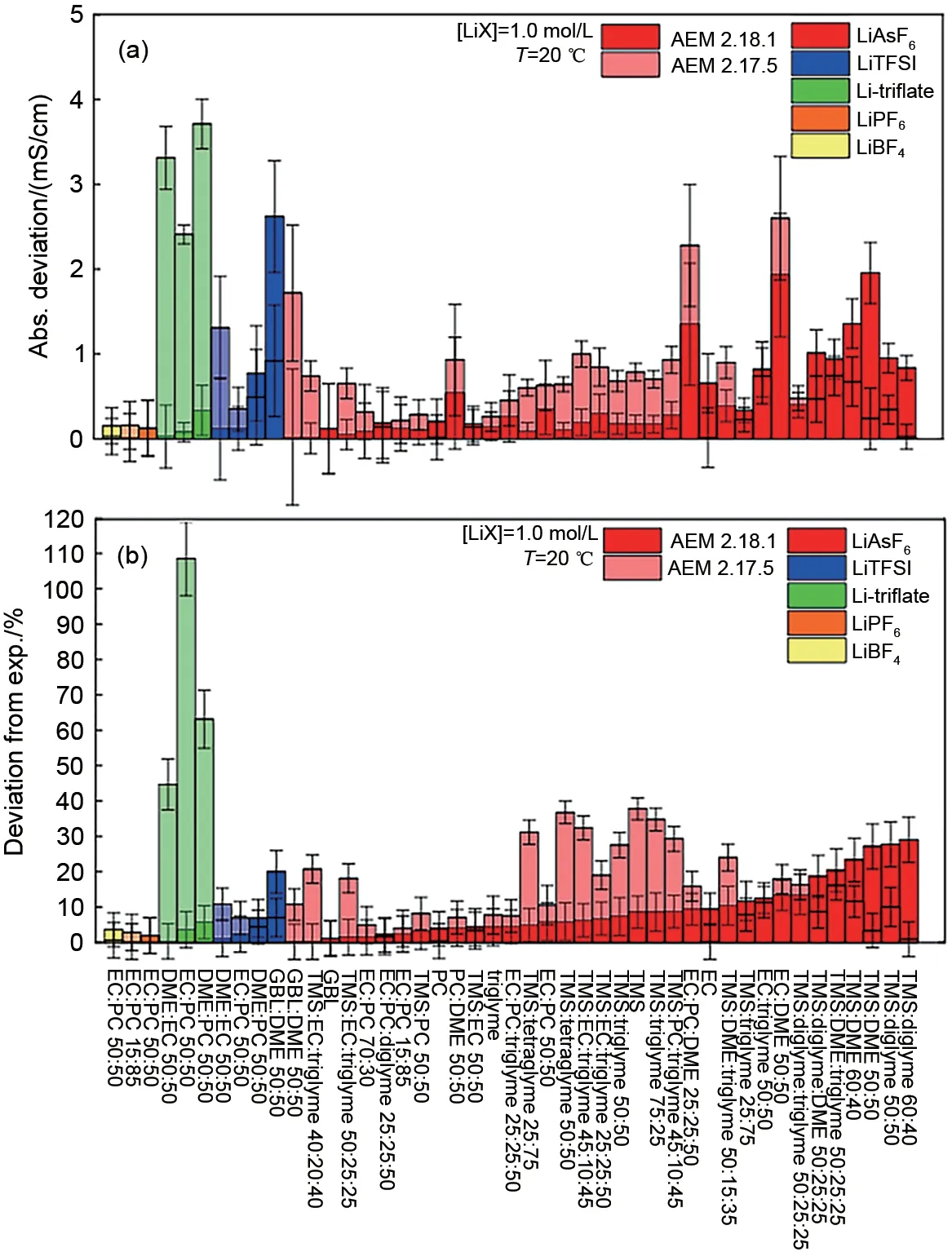
图3 电解液电导率实测值与AEM预测值误差(a)绝对误差(b)相对误差[1]Fig.3 Actual by AEM predicted value for electrolyte conductivity(a)Absolute deviation;(b)Relative deviation[1]
1.2.2 分子动力学模型
分子动力学方法最早由Alder 等[49-50]在1959 年提出,分子动力学模拟可以计算得到原子尺度的粒子运动的详细信息,包括位移和速度及其随时间的演变。通过计算模拟从微观上来描述粒子的迁移和扩散行为,利用统计物理的基本方法,对这些测量数据时间信息的平均等效为对系统的平均,然后通过Einstein关系可以计算离子电导率[51]。
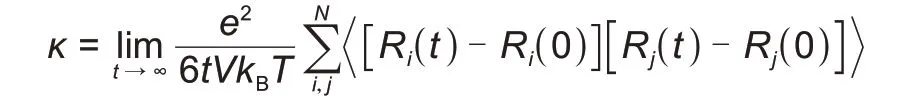
式中e是电子电荷,V为模拟单元的体积,T是温度,kB是玻耳兹曼常数,Ri(t)是离子i在时间t内的位移,N是模拟单元中阳离子和阴离子的总数量,括号<>表示对所有离子取整体平均值。Bata 等[52]和Kubisiak 等[53]提出了一种能有效降低计算成本的分子动力学的模拟计算,如图4所示,对于大量的不同锂盐与不同混合溶剂组合,在宽温及宽盐浓度范围进行计算后与实验结果相比相对平均误差为15%。这种方法作为电解液高传输性能快速筛选方法有一定的应用价值。Borodin 等[54]和Chae 等[55]模拟计算了LiPF6在25~60 ℃下不同碳酸酯类溶剂体系下的电导率,发现和实验之间有良好一致性。
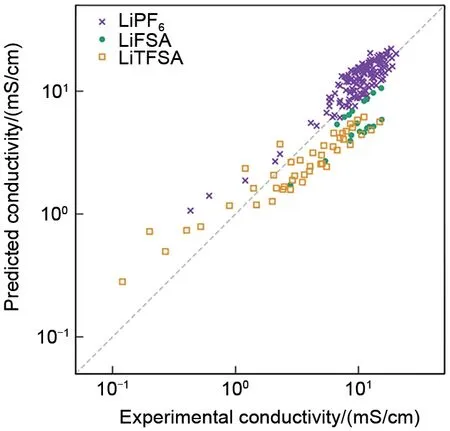
图4 分子动力学预测电导率与实验电导率的比较[52]Fig.4 Comparison of the molecular dynamics predicted and experimental conductivity[52]
1.2.3 蒙特卡洛模拟
蒙特卡洛模拟通过计算机产生满足玻尔兹曼指数分布随机样本,并对这些样本的统计行为进行分析来得到相应哈密顿量表达的物理系统的统计特性[56]。假设电解质溶液形成晶格结构,其位置由阳离子、阴离子或溶剂的无量纲点占据,分子传输是通过反复交换两个相邻的分子来实现[57]。该操作由基于与交换相关的能量差的蒙特卡洛方案进行采样,其中仅考虑最近邻相互作用[58-59]。Ozaki等[56]运用蒙特卡洛框架,将三种传输现象:扩散率、离子导电率和动态黏度成功地运用在LiClO4、高氯酸钠(NaClO4)与γBL溶剂体系中,且适用的盐浓度最高达到0.8 mol/kg。
表2为电导率统计热力学模型在常见电解液体系下的应用情况。综合来看,AEM 模型的适应性更广且精确度更高,而分子动力学模型能提供更详细的溶剂化配位信息。
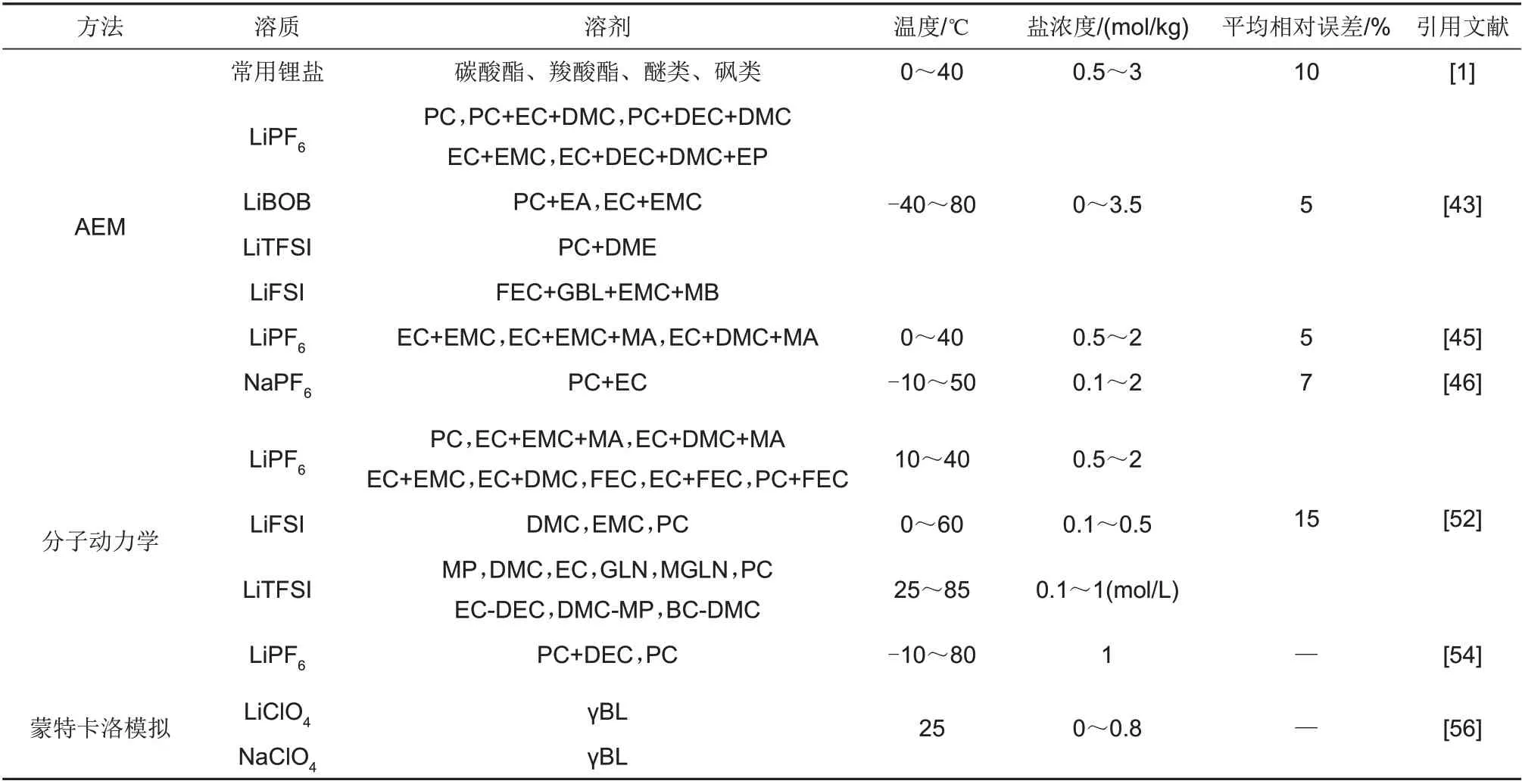
表2 电解液电导率统计热力学模型Table 2 Statistical thermodynamic model of electrolyte conductivity
2 电导率数学模型
2.1 半经验模型
Casteel等[60-61]为了找到合适的电导率与盐浓度关系的经验方程,提出方程需满足以下条件:在盐浓度为0 时电导率需为0,电导率需在有限盐浓度下取得最大值,在饱和盐浓度下,电导率为有限的正值。尝试了8 种不同的非线性方程对硫酸镁溶液数据进行拟合,拟合效果最好的是如下形式的方程:
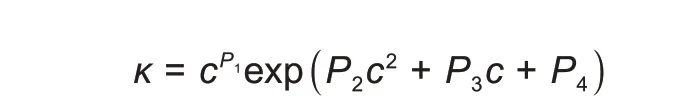
P1、P2、P3、P4为对不同电解质溶液数据拟合后得到的参数。该方程被广泛且成功地用于拟合各种电解质溶液的宽盐浓度范围内的电导率测量数据。通过对上式变形可得到一个更常用的形式。当绘制κ/κmax与c/cmax的关系曲线时,无论使用何种盐或溶剂,所有电解质水溶液都落入一条主曲线:
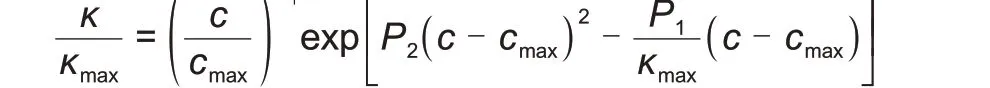
Werblan 等[62]验证了Casteel-Amis 方程在常用锂盐及各种不同溶剂组合下的拟合效果,图5展示了其中一种锂盐LiClO4在不同溶剂电导率的拟合结果。Madariaga 等[63]将温度对电导率的影响纳入Casteel-Amis 方程,通过对20 种不同水溶液体系的(κ,c,T)数据进行拟合,验证了模型的质量。Ding等[64-66]进一步将Casteel-Amis方程从单溶剂扩展到多溶剂,方法是将其4个参数设置为包含变量的多项式函数,变量包括温度和溶剂组成。
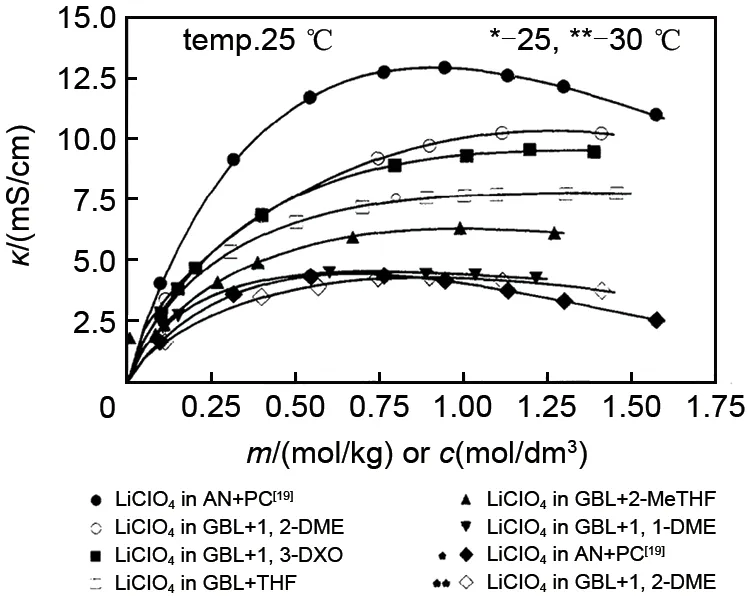
图5 Casteel-Amis方程(实线)与实验电导率的拟合[62]Fig.5 Fitting of the Casteel-Amis equation(solid lines)to the experimental conductivity[62]
基于电解质浓度和温度对自由离子数和离子迁移率的影响,Zhang等[67]提出了一个适用于纯溶剂和混合溶剂体系的五参数半经验模型,28 种电解质溶液的数据验证了所提出模型的可行性和准确性。在较宽的温度和浓度范围内,该模型能很好地拟合纯溶剂和混合溶剂体系的实验数据[68-69]。
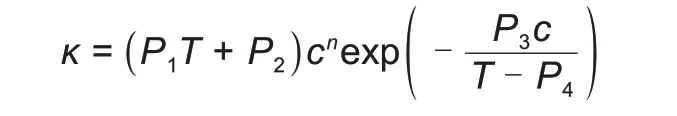
P1、P2、P3、P4和n是常数,与盐浓度和温度无关,但与溶剂组成有关,在高介电常数的溶剂中,n的值接近1。
2.2 数理统计方法
随着数理统计在化学领域的推广,纯数学方法在电导率模型中也开始发挥作用。Schweiger 等[70]应用数学优化领域中常用的单纯形法解决锂电池电解液电导率的优化问题,同样的,质量三角形法和响应曲面法也能很好地解决电解液电导率优化问题[71-73]。如图6 所示,通过少量实验由响应曲面法对数据进行处理建模得到不同温度下不同组分对应的电导率等高线图,从而得到综合最优的电导率组分区间。日本丰田中央研发实验室使用并行贝叶斯优化方法自动化筛选最优电导率的电解液配方,大大提高了实验效率。另外,周思飞等[74]提出了一种结合空间填充混料设计与高斯过程回归的电导率优化设计方法,以包括环状碳酸酯及不同种类线性碳酸酯、羧酸酯的电解液溶剂组成作为模型的输入,电导率作为模型的输出,并运用最大似然估计求解超参数,模型可预测满足任意电导率要求的电解液溶剂配方。
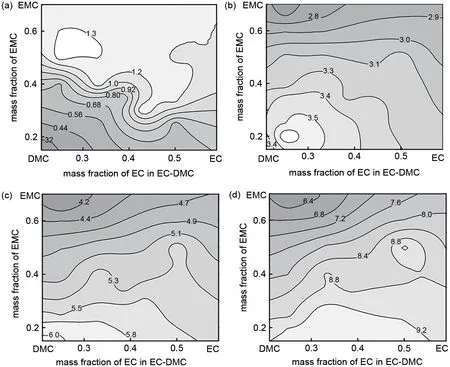
图6 1 mol/L LiPF6在EC-DMC-EMC三元溶剂中不同温度下的电导率曲线(a)-40 ℃;(b)-20 ℃;(c)0 ℃;(d)25 ℃[72]Fig.6 Conductivity contour maps of 1 mol/L LiPF6 in EC-DMC-EMC ternary electrolytes at different temperatures[72]
表3汇总了电导率数学模型在常见电解液体系下的应用情况,对每种体系适用的温度、盐浓度以及预测的平均相对误差进行了总结与归纳。
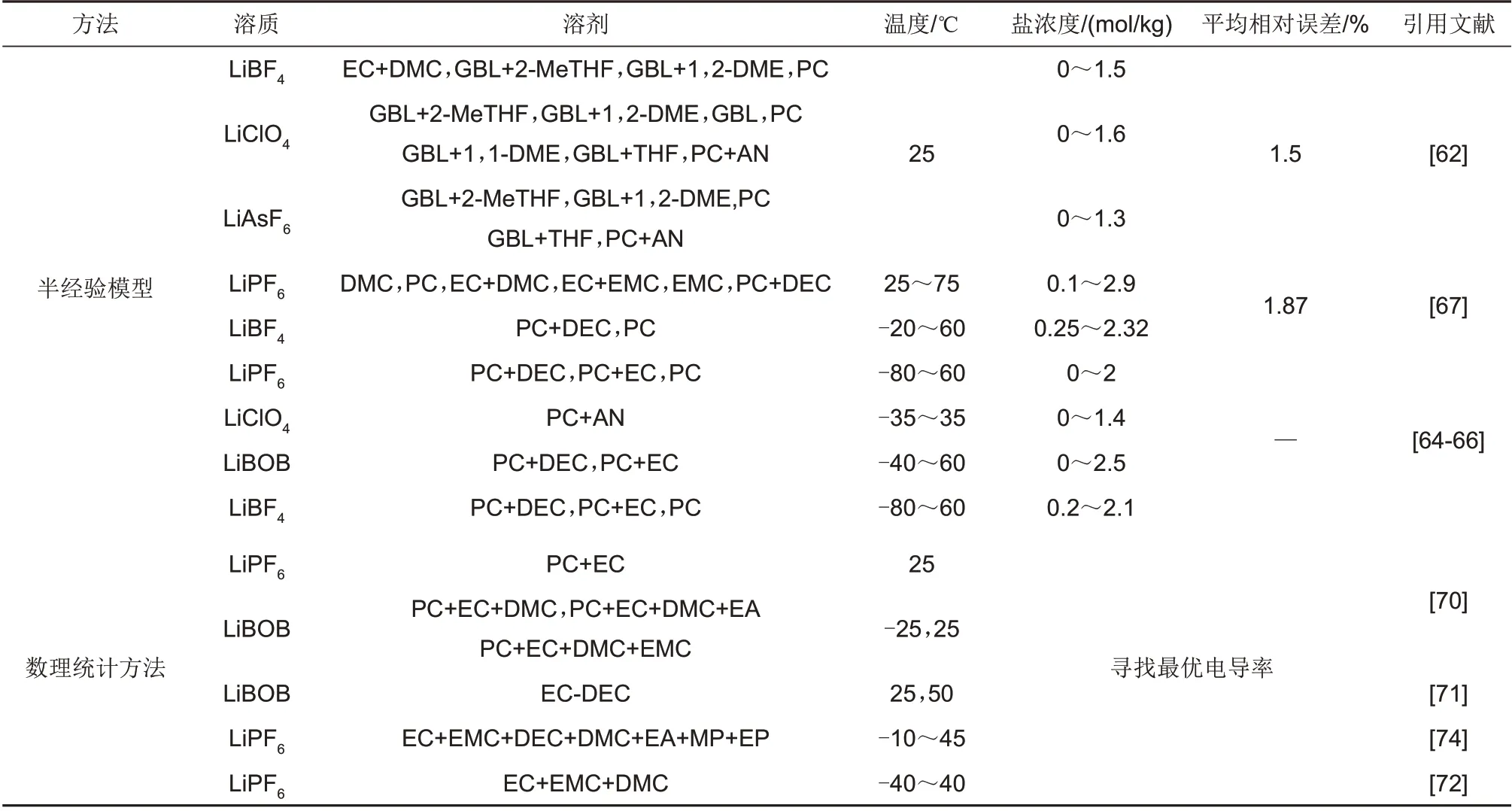
表3 电解液电导率数学模型Table 3 Mathematical model of electrolyte conductivity
3 结 论
鉴于电解液溶液中各种复杂的相互作用,尤其是在多种混合溶剂以及混合溶质盐、高浓或局部高浓体系中,对锂电池电解液电导率理论模型的研究将更多地集中于分子动力学方法,通过对分子动力学方法进行改进和优化,包括对模拟计算的准确性与模拟尺寸、时间、成本以及独立模拟次数关系的深入理解,建立起阳离子、阴离子、溶剂、盐浓度、温度以及力场与离子传输的构效关系。
另外,随着电解液组分的多样化和复杂化,电导率数学模型已从传统的半经验模型转向数理统计方法,数理统计方法通过科学的实验设计以及先进的模型拟合方法可以以较小的实验规模得到适应性好的电导率模型,并可运用算法自主搜索具有最大离子电导率的电解液组分。如果能将数理统计方法与自动化技术结合则能大大加快研发效率,但需要提高算法的稳定性和自动化技术真实场景下的可行性以实现更高效的应用。
