五种布鲁氏菌核酸检测试剂盒检测性能的评价
2022-11-19宋春志刘佳音杨晓雯田国忠赵鸿雁朴东日
范 玉,姜 海,塔 娜,宋春志,丛 宇,刘佳音,杨晓雯,田国忠,赵鸿雁,张 宇,朴东日
布鲁氏菌病(简称为“布病”),是由布鲁氏菌属的细菌侵入机体引起的人兽共患的传染-变态反应性疾病。该病在世界上广泛流行,危害人民健康,同时也严重影响畜牧业、旅游业、国际贸易的发展,还会带来食品安全隐患。人间布鲁氏菌病是《中华人民共和国传染病防治法》规定报告的乙类传染病,同时也是《职业病分类和目录》规定的生物因素所致的职业病。动物布鲁氏菌病是《中华人民共和国动物防疫法》规定管理的二类动物疫病[1]。近年来我国的人间布病发病数逐年上升,将2020年的我国发病数按病种排序,布病居于13位,发病数为47245。大多数患者通过直接或间接接触受感染的动物或动物产品感染,大多数动物感染是从患病动物、受污染的饲料和饮水点处摄入病原体所致。高效的布鲁氏菌检测方法能帮助我们快速诊断布鲁氏菌病及识别环境中的污染源。
随着分子生物学的发展,PCR技术已应用于多种病原体的检测中,其高特异性、高敏感性、简便快速的特点使其得以快速推广应用。1993年Higuchi等[2]报道了实时PCR,全封闭单管扩增、简便快速、重复性好、无扩增产物污染的可能性和易于自动化的优点使其应用越来越广,目前实时PCR技术已应用于布鲁氏菌、肝炎病毒、流感病毒、埃博拉病毒、结核杆菌、肺炎支原体等多种病原体的检测中[3]。2001年Redkar首次将实时荧光PCR应用于布鲁氏菌种的区分[4]。2004年Probert又在此基础上对其进行了改进,发展了多重实时荧光PCR技术用于布鲁氏菌种的区分[5]。近年来国内学者也纷纷致力于该领域的研究[6-9]。目前市场中有多种布鲁氏菌核酸实时荧光PCR检测试剂盒,为了对这些试剂盒进行评估,本研究选取了5种试剂盒,对其进行了初步的比较。
1 材料与方法
1.1 材 料
1.1.1 样本来源 样本组成:1)病原学检测阳性样本:2021年5月来自内蒙古赤峰市疾控中心的经双相培养瓶培养、单相特异性血清A、M、R凝集实验、染料抑菌实验、噬菌体裂解试验确定为布鲁氏菌阳性的血液样本38份,种型鉴定结果及患者的基本信息如表1,种型鉴定的具体试验结果如表2。38份样本的种型分布为:24份布鲁氏菌羊种3型,12份布鲁氏菌羊种1型,1份布鲁氏菌羊种2型,1份布鲁氏菌变异株。2)阴性样本:2020年9月来自通辽市地方病防治站的健康人血液样本24份;实验室保存的潘氏变形杆菌、溶藻弧菌、河弧菌、铜绿假单胞菌、肺炎克雷伯菌DNA各1份。根据卫生部2006年发布的《人间传染的病原微生物名录》、卫生部2005年第45号令《可感染人类的高致病性病原微生物菌(毒)种或样本运输管理规定》和国际民航组织文件Doc 9284《危险品航空安全运输技术细则》的分类包装要求,本研究中的布鲁氏菌阳性血液样本按照A类UN 2814的要求包装和空运,运输条件参考《WS/T400-2012血液运输要求》。健康人血液样本运输条件参考《WS/T400-2012血液运输要求》。

表1 38份布鲁氏菌阳性血液样本的信息对照Tab.1 Information on 38 Brucella positive blood samples
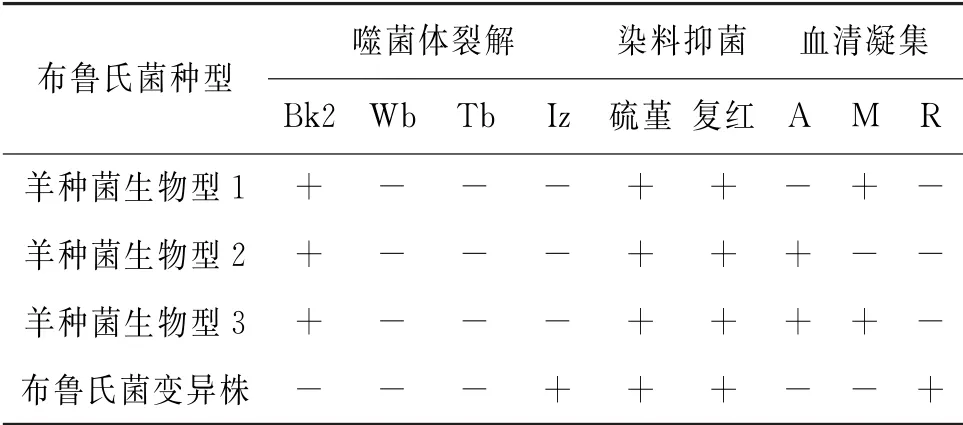
表2 38份布鲁氏菌阳性血液样本的布鲁氏菌种型鉴定试验结果Tab.2 Brucella species identification results for 38 Brucella positive blood samples
1.1.2 试剂 QIAGEN DNA核酸提取试剂盒。选取5家试剂厂商提供的布鲁氏菌核酸检测试剂盒,分别用A-E表示,此5种试剂盒均采用Taqman探针法对布鲁氏菌的特异性DNA进行检测,各试剂盒的结果判定方法见表3。A、C试剂盒声明的最低检出限是103copies/m L,B为5×103copies/m L,D试剂盒声明的最低检出限是只要反应体系含有1个布鲁氏菌核酸DNA拷贝数,即可出现阳性结果,E试剂盒声明的最低检出限是104copies/m L。

表3 5种布鲁氏菌核酸检测试剂盒的结果判定标准汇总Tab.3 Summary of evaluation criteria for five Brucella nucleic acid detection kits
1.1.3 主要仪器设备 离心机;Roche Light Cycler 480实时荧光定量PCR仪;Eppendorf移液枪。
1.2 方 法
1.2.1 DNA提取及实时荧光PCR 将38份布鲁氏菌阳性血液样本使用双相血培养瓶培养1周,取其中的液相培养基200μL使用QIAGEN试剂盒提取DNA,得到38份布鲁氏菌DNA样本。取24份健康人血液各200μL使用QIAGEN试剂盒提取DNA,得到24份布鲁氏菌核酸阴性的DNA样本,另有5份用于特异性检测的其他菌株DNA。按照5个试剂盒的说明书设置相应反应程序后使用同一台Roche LightCycler 480实时荧光定量PCR仪对38份阳性样本和29份阴性样本分批进行扩增检测,并依据试剂盒说明书对检测结果进行判定。
1.2.2 真实性和可靠性评价 记录38份阳性样本和29份阴性样本的检测结果,并将检测结果与已知的用病原学方法鉴定后的结果做对比,计算灵敏度、假阴性率、特异度、假阳性率、正确指数、阴性似然比等真实性评价指标,符合率、Kappa值等可靠性评价指标。
1.2.3 检出能力及批内重复性评价 选取1份经过E试剂盒检测结果Ct值为20.2的阳性样本提取的核酸,用无RNA酶水进行20、40、80、160、320、640、1280倍浓度梯度稀释,对该7个浓度的核酸使用E试剂盒进行荧光定量PCR检测,发现核酸浓度每稀释4倍,Ct值约增加2。将稀释了1280倍的核酸样本(经E检测,Ct值为32.5)命名为浓度1,用无RNA酶水对浓度1进行4、16、64和256倍浓度梯度稀释,最终得到5个浓度梯度(浓度1:4453.13 fg/μL,浓 度2:1113.28 fg/μL,浓 度3:278.32 fg/μL,浓度4:69.58 fg/μL,浓度5:17.40 fg/μL)。预计E试剂盒对浓度1-5检测的Ct值为32.5、34.5、36.5、38.5、40.5,而E试剂盒的阴阳性判定界限为38,因此该浓度梯度可确定出试剂盒的最低检测浓度。使用5种试剂盒对每个浓度梯度重复检测3次,记录Ct值、阴阳性结果,计算各试剂盒在每个浓度下Ct值的变异系数和各试剂盒的阳性检出率(阳性结果数/总测量次数)。
2 结果
2.1 真实性和可靠性评价 5种试剂盒对67份DNA样本的检测结果汇总见表4。根据各试剂盒说明书的判读标准,ABDE的灵敏度和符合率均为100.00%和100.00%,C的 灵 敏 度 和 符 合 率 为97.37%和98.51%。除C的假阴性率为2.63%外,其他4种试剂盒的假阴性率均为0,C最可能出现样本实际阳性但被检测为阴性的情况。5种试剂盒的特异度均为100%,极不可能出现样本实际阴性但被检测为阳性的情况。ABDE的正确指数均为1,真实性最高,C的正确指数为0.9737,真实性较低。
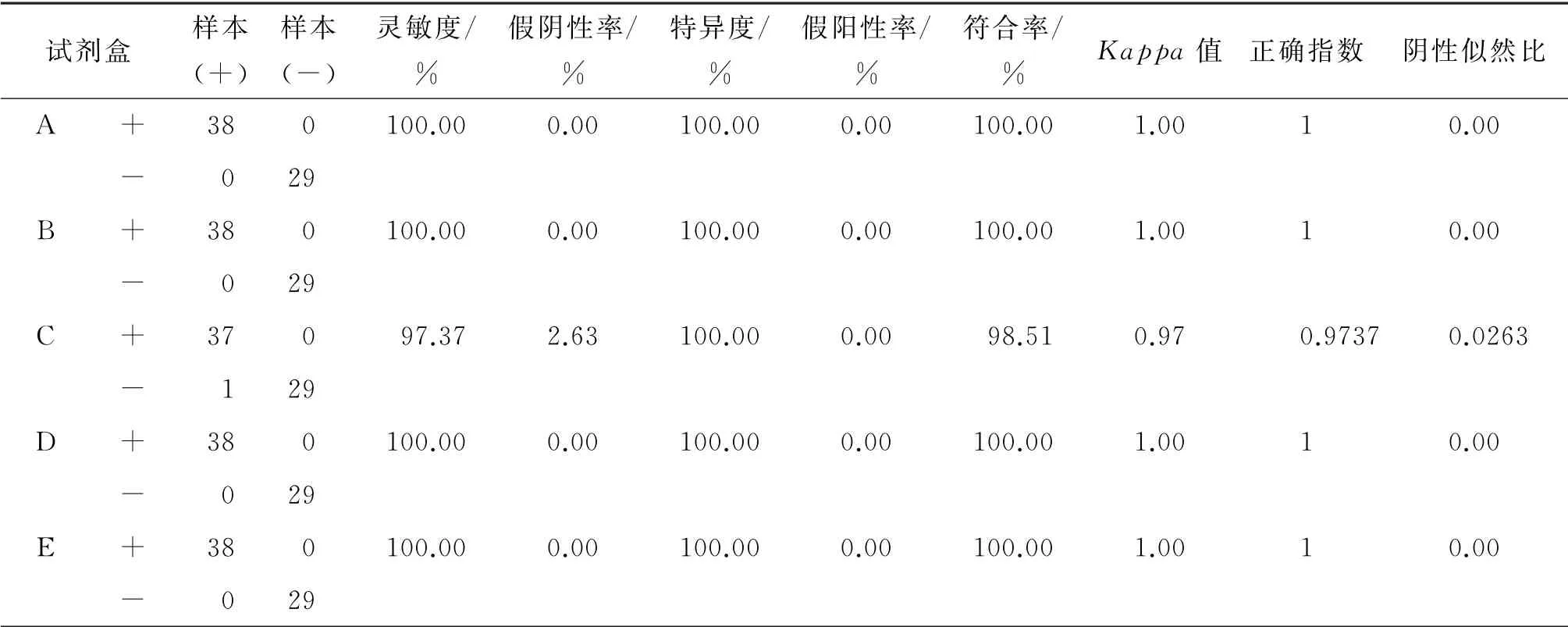
表4 67份DNA样本的真实性和可靠性评价Tab.4 Validity and reliability of 67 DNA samples
2.2 批内重复性评价和检出能力评价 5种试剂盒对浓度1-5每个梯度重复检测3次的检测结果及变异系数见表5,同一浓度3次检测结果Ct值的变异系数均小于5%,检测性能稳定。浓度1至3时,A试剂盒的变异系数最小,为1.59%、1.92%和2.42%,重复性最佳。在浓度1至浓度4梯度区间,5个试剂盒的阳性检出能力比较显示试剂盒A、B、D为11/12,试剂盒C和E为8/12。当浓度为浓度1、2时,5种试剂盒对3份重复性样本均能全部检出;浓度3时,仅试剂盒A、B、D可检出全部重复性样本,试剂盒C、E仅能检出部分重复性样本;浓度4时,5种试剂盒都仅能检出部分重复性样本;浓度5时,5种试剂盒检测3份重复性样本均为阴性。5种试剂盒对浓度1至5第1次重复性样本检测的实时荧光PCR扩增图谱见图1。根据上述结果判断试剂盒C和E的检出限在浓度2(1113.28 fg/μL)和浓度3(278.32 fg/μL)之间,试剂盒A、B、D的检出限在浓度3(278.32 fg/μL)和浓度4(69.58 fg/μL)之间。
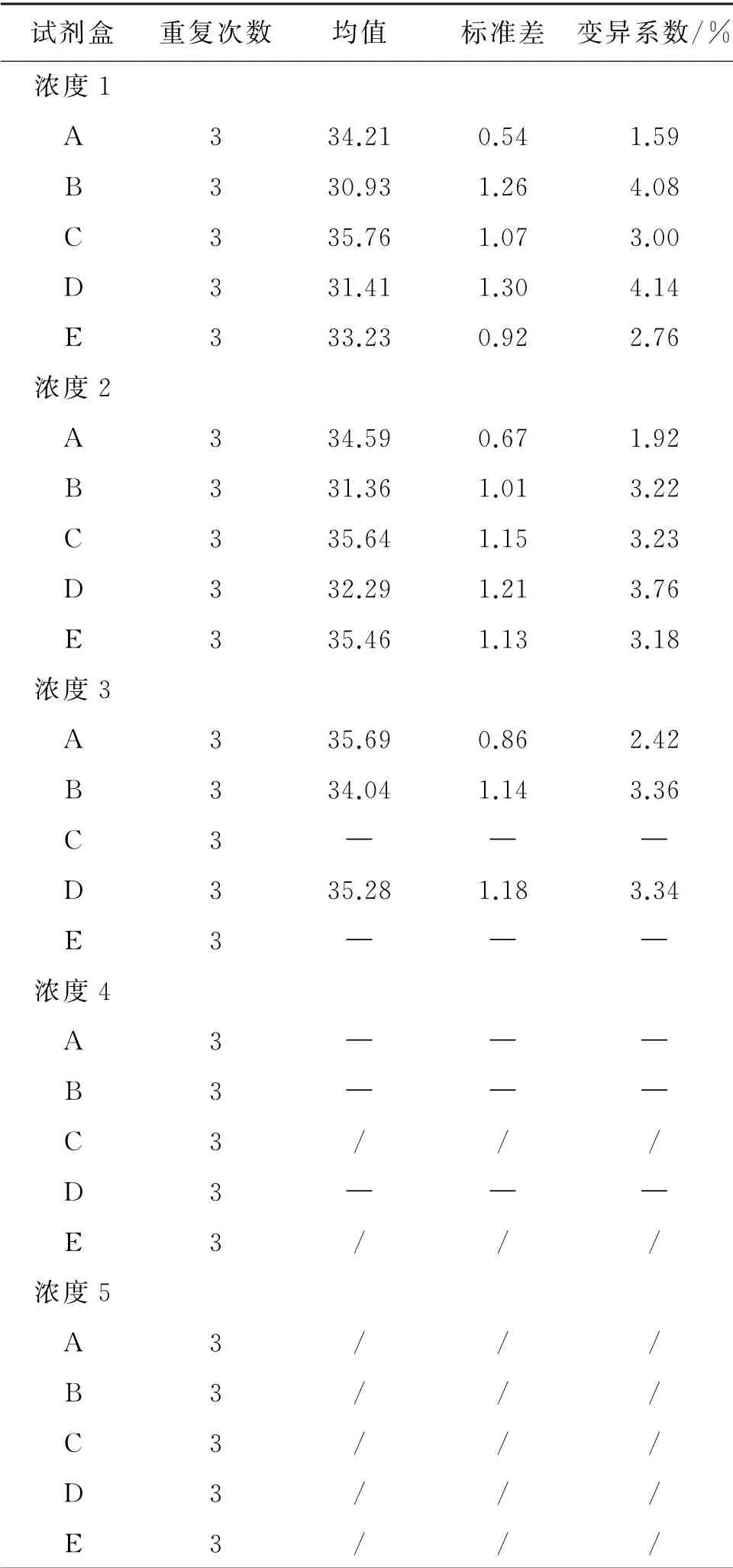
表5 5种试剂盒在不同浓度梯度检测的批内重复性结果Tab.5 Intra-batch repeatability of five kits at different concentration gradients
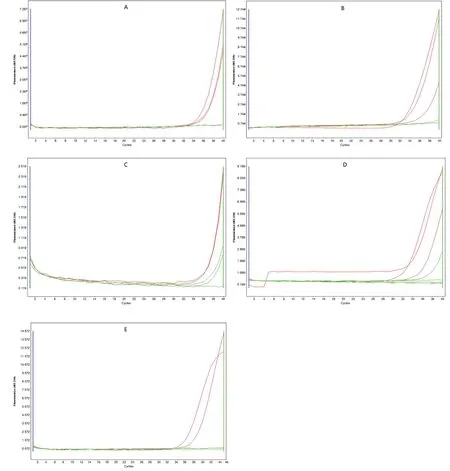
图1 5种试剂盒对浓度1-5的实时荧光PCR扩增图谱Fig.1 Real-time PCR amplification of five kits at concentrations 1-5
3 讨论
根据国家卫生行业标准WS 269-2019,目前对布鲁氏菌病诊断的实验室检测为血清学诊断、病原学检测。血清学诊断方法耗时较长且操作过程较为繁琐,且难以严格区分疫苗免疫和自然感染引发的血清学反应。病原学检测过程涉及活菌的分离培养及后续鉴定,在此过程中实验操作者与活菌接触的机会增大,感染风险增加,且布鲁氏菌的培养通常要数天甚至数周时间,不利于实现对病人的快速诊断。而PCR技术高特异性、高敏感性、简便快速的特点的则可以与血清学诊断、病原学检测优势互补,有利于该菌的快速筛检。另外,布病患者可通过接触感染动物或各种污染物感染,如带有布鲁氏菌的牲畜流产物、乳及乳制品、血液、肉和内脏、皮毛、衣物、水、土壤和尘埃等[1],对污染物的早发现早清除能在很大程度上预防人和动物布病的发生。而血清学诊断方法不适用于对上述环境样本和食品样本的检测,PCR技术的原理则是检测样本中的布鲁氏菌核酸,因此可应用于该领域。另外,实时荧光PCR技术还被应用于疫苗株和野毒株的鉴别诊断[10]。因此,实时荧光PCR技术对布鲁氏菌的检测可广泛应用于临床诊断、疾病研究、海关的卫生检疫、食品安全检测等方面。
近年来很多研究者致力于布鲁氏菌荧光定量PCR方法的建立,根据布鲁氏菌属种的保守区基因建立出单重和多重的荧光定量PCR方法[7,11-13],并依据这些方法进行试剂盒的研制[14-17]。生物科技公司纷纷对科研成果进行转化,市面上出现了多种布鲁氏菌核酸荧光PCR检测试剂盒,目前还未有研究对这些商品化的试剂盒进行过性能的比较评价,本研究对5种商品化的试剂盒进行了真实性和可靠性评价、批内重复性评价、检出能力评价。
经查阅资料[18],当待评价的筛检实验的灵敏度小于20%或大于80%时,使用n=公式计算阳性样本量,其中p为待评价的实验方法的灵敏度。在预实验中使用19份阳性样本得出5个试剂盒的最低灵敏度为94.74%,故将p设为93%,得出n=37.74,因此在原有的19份阳性样本量基础上增加了19份阳性样本,此次研究的阳性样本数合计为38份。
通过对比5种试剂盒对67份阴、阳性样本的检测结果,发现各试剂盒对布鲁氏菌核酸样本检测的灵敏度和符合率稍有差别,特异度均为100%。其中试剂盒A、B、D、E对67份样本的检测结果与病原分离鉴定的结果完全一致,而试剂盒C则有一份样本检测结果的出入,该份样本的病原分离鉴定结果为布鲁氏菌阳性,但3次使用试剂盒C的检测结果均为阴性,推断可能是由于靶序列的基因突变导致引物结合或探针杂交失败,从而引起了漏检。基于这个问题,未来试剂盒厂商或许可以考虑发展双靶标的检测方法,以规避因检测靶序列突变导致假阴性和近缘序列突变导致假阳性的风险。
选取1份阳性样本通过梯度稀释得到了5个浓度梯度(浓度1-浓度5),同一浓度3次检测结果Ct值的变异系数均小于5%,各个试剂盒的精密度都较高,检测性能稳定。为了减少除试剂盒之外的其他影响因素,在做重复性实验时应将样品提前分装,避免反复冻融造成的检测结果差异。使用5种试剂盒对浓度1和浓度2重复检测3次,阳性检出率均为100%,表明该5种试剂盒对核酸浓度较高的阳性样本检出能力强。5种试剂盒对浓度3、4的阳性检出率不同,试剂盒A、B、D为83.33%,试剂盒C、E为33.33%,因此部分试剂盒对低浓度核酸样本的检出能力较差,可使用多种试剂盒对低浓度核酸样本进行复核,以保障结果的准确性。
利益冲突:无
引用本文格式:范玉,姜海,塔娜,等.五种布鲁氏菌核酸检测试剂盒检测性能的评价[J].中国人兽共患病学报,2022,38(10):883-889.DOI:10.3969/j.issn.1002-2694.2022.00.128
