16株军团菌全基因组比较及重要毒力因子分析
2022-11-19陈爱平张拥军
陈爱平,张拥军
军团菌是一种革兰氏阴性兼性细胞内寄生菌,广泛存在于各种水体环境中,包括江、河、湖泊、冷却塔水、温泉、喷泉、加湿器、自来水等,已经分离鉴定至少59种,超过70个血清群。与人类疾病关系最密切的是嗜肺军团菌(Legionellapneumophila,LP),以血清1型军团菌(LPl)引发的军团菌肺炎最为常见,占85%;非嗜肺军团菌(非LP)引起人类感染的有米克戴德军团菌(L.micdadei)、博杰曼军团菌(L.bozemanae)、杜莫夫军团菌(L.dumoffii)、长滩军团菌(L.longbeachae)等[1-4]。
细菌全基因组(WGS)是精准鉴定生物遗传多样性的方法。运用各种生物信息学软件、生物学数据库,结合菌株的流行病学背景资料进行生物信息学分析,能够从多个角度较全面揭示病原菌的遗传特征。基于基因组序列的流行病学分析已经广泛运用于病原菌的分型鉴定,WGS更加全面、准确地描述不同来源分离株的遗传特征,精准确定菌株的克隆性和遗传相关性,揭示疫情相关菌株的传染来源、传播途径和流行规律等,已经成为传染病疫情分析、研判中重要的技术手段和趋势[1,5]。
本文通过生物信息学分析16株军团菌参考菌株基因序列,了解临床和外环境分离的军团菌、LP1与非LP之间的基因组特征,全面比较不同菌株的毒力因子、耐药基因、遗传差异和种系发生关系,从而深入认识不同军团菌的遗传特征、遗传联系以及潜在的致病性。
1 材料与方法
1.1 实验用参考菌株 从NCBI数据库中选择基因组序列完整、背景清楚、不同种以及不同来源(临床、外环境)的16株军团菌代表性参考菌株。选用的外环境非LP都是已知对人类有潜在致病性的。下载全长基因组序列,菌株信息见表1。包括5株LP1临床参考菌株:D-5387、Lens、NY23、Philadephia-1、Paris,3株 外 环 境LP1参 考 菌 株:Yu237、BJ-9、SZ2012007,4株不同种的外环境非LP参考菌株:NCTC11533、FDAARGOS_200、NCTC11988、NCTC11983,4株米克戴德临床参考菌株:2014LM、LMI、NZ2015、NZ2016。
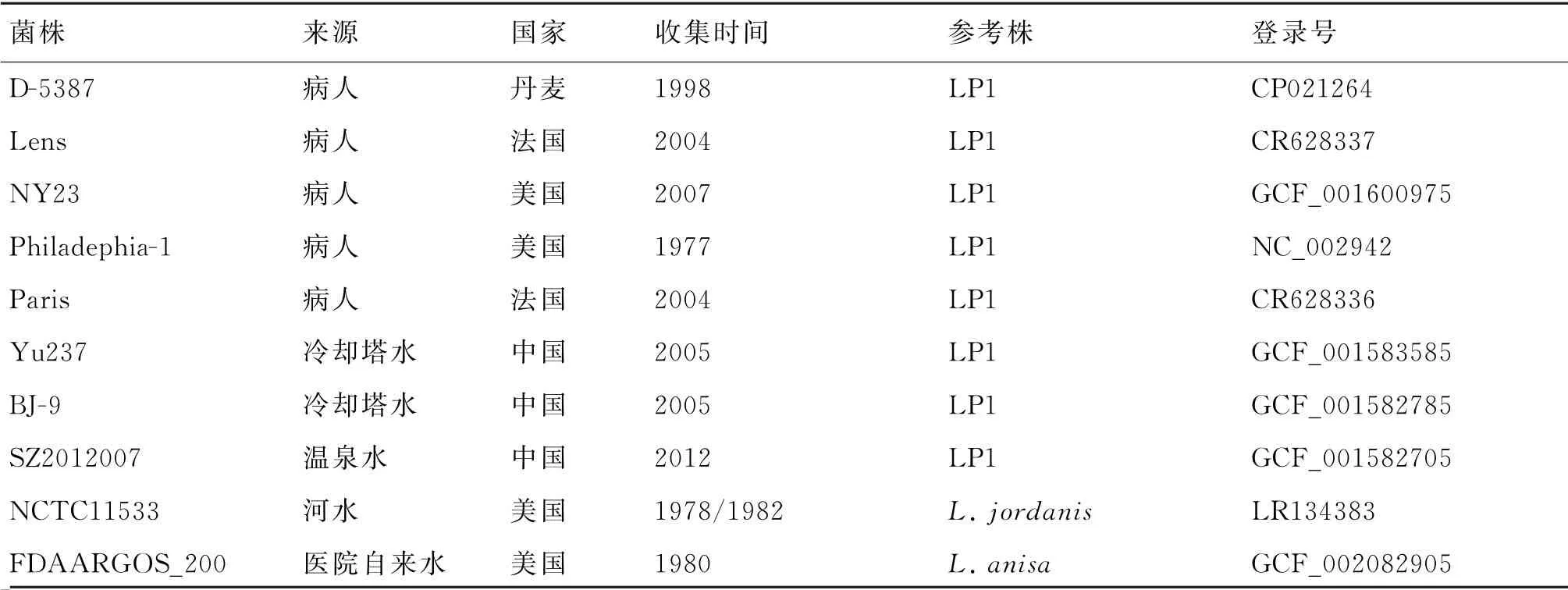
表1 16株军团菌参考菌株信息一览表Tab.1 List of 16 Legionella species reference strains

表1 (续)
1.2 军团菌参考菌株全基因组功能注释 分别将16株参考菌株基因组序列导入RAST(Rapid Annotation using Subsystem Technology,https://rast.nmpdr.org/)服务器[6],逐一进行在线分析,下载各自的基因组注释结果并进行比较。
1.3 军团菌参考菌株多基因组比对 运用MAUVE软件(version 20150226),选择16株中的9株参考菌株进行多基因组比对[7]。对于存在多个重叠群记录的基因组序列,运用Mauve软件的move contigs功能,以线性的参考菌株Philadephia-1全基因组序列(GenBank登录号:NC_002942)作为参照,对这些基因组重叠群进行重排,最终以重排后的序列在MAUVE里完成多基因组比对。
1.4 基于16S r RNA基因的军团菌参考菌株种系发生 在RAST服务器确定本研究16株参考菌株的16S r RNA基因在全基因组中的位置,运用BioEdit软件(version 7.2.5)编辑所有菌株的16S r RNA基因序列,随后,运用MEGA软件(version 7.0.21)中最大似然法进行遗传进化和种系发生分析。
1.5 军团菌参考菌株毒力因子生物信息分析 选择16株中7株参考菌株,在VFDB(Virulence Factor of Pathogenic Bacteria)(http://www.mgc.ac.cn/VFs/)服务器上运用VFanalyzer在线分析菌株所有潜在的毒力因子,导出结果并进行比较。
1.6 军团菌耐药基因生物信息分析 在CARD(The Comprehensive Antibiotic Resistance Database)(https://card.mcmaster.ca/genomes)服务器上分别预测分析16株参考菌株的耐药基因,导出每个菌株耐药基因预测结果并进行比较。
2 结果
2.1 军团菌参考菌株全基因组的功能注释 16株参考菌株基因组大小(3.13~4.23)Mbp。GC含量38.2%~41.7%,其 中8株LP1菌 株GC含 量38.2%~38.4%,4株临床分离的米克戴德GC含量40.5%~40.6%,4株 外 环 境 非LP菌 株GC含 量37.1%~41.7%。RAST服务器的特色就是将功能相似或相关的基因合并称为亚系统,16株参考菌株亚系统数量265~387个,最少的是参考菌株2014LM,其余菌株数量均为380个左右。编码基因(CDSs)数量在3018~3954,最少的菌株是NCTC11533,最多的菌株是NCTC11988。详见表2。

表2 军团菌参考菌株全基因组主要特征Tab.2 Genomic characterization of Legionella reference strains
2.2 军团菌参考菌株多基因组比对 对16株参考菌株中的9株运用MAUVE进行多基因组比对分析,结果显示4株LP1(D-5387、Pairs、Yu237、BJ-9)之间显示一致的局部共线区(Locally Collinear Blocks,LCBs)结构,包括LCBs大小、数量以及排列位置。2株临床分离的L.micdadei(2014LM、LMI)LCBs结构也相对一致。3株外环境分离的非LP(NCTC11533、FDAARGOS_200、NCTC11988)之间基因组大小差异大;相对于LP1和临床分离的L.micdadei基因组,外环境分离的非LP基因组内部存在较多的非保守区域。详见图1。

图1 军团菌参考菌株多基因组比对结果Fig.1 Multiple genome alignment of selected Legionella reference strains
2.3 军团菌参考菌株基于16S r RNA基因的种系发生 16株参考菌株全长16S r RNA基因序列,利用MEGA软件绘制种系发生树。8株LP1属于同一个主分枝,细分为3个小分枝;4株外环境分离的非LP有2个分枝,其中一个分枝跟LP1的遗传距离较近;4株临床分离的米克戴德在同一个主分枝上,相对于LP1参考菌株,跟非LP参考菌株(NCTC11533)的遗传关系较近。详见图2。

图2 16株军团菌参考菌株16S r RNA基因的种系发生Fig.2 Phylogenetic analysis of 16S r RNA genes for 16 Legionella reference strains
2.4 军团菌参考菌株毒力因子比较 毒力因子是细菌致病性的重要因素,VFDB是目前功能最齐全的毒力因子数据库。对16株中的7株参考菌株运用VFDB服务器进行在线分析,分别检索可能存在的毒力因子类别和毒力因子。结果发现共计存在11类毒力因子类别。
临床分离的LP1(D-5387、Philadephia-1、Paris)携带的毒力因子类别和毒力因子数量比外环境分离的LP1(Yu237)和 非LP(FDAARGOS_200、NCTC11983)参考菌株要多。
临床分离的米克戴德2014LM携带的脂肪酸代谢和内毒素毒力因子类别,在其它参考菌株中未发现。
外环境非LP(FDAARGOS_200、NCTC11983)携带的压力适应毒力因子类别,在其它参考菌株中未发现。
细菌分泌系统是重要的毒力因子。7株军团菌参考菌株中与分泌系统有关的毒力因子,除了Yu237缺失Dot/Icm T4BSS外,其余菌株都携带有Dot/Icm T4BSS、Lsp T2SS、Lvh T4ASS和T4BSS效应蛋白4种毒力因子,数量分别为23~24、8~11、3~11和3~35个;其中3株临床分离的LP1携带的T4BSS效应蛋白毒力因子数量为31~35个,其它参考菌株数量3~5个。详见表3。

表3 军团菌参考菌株毒力因子比较Tab.3 Comparison of virulence factors for selected Legionella reference strains
2.5 军团菌参考菌株耐药基因比较 CARD数据库是常用的全面分析细菌耐药性的平台。分别将16株参考菌株基因组导入CARD平台分析,检索参考菌株可能携带的耐药基因(表4)。发现16株均携带有可对氟喹诺酮类、四环素类抗生素产生耐药的adeF耐药基因。2株临床LP1(Yu237、Paris)和1株外环境LP1(BJ-9)携带有Lpe A、LpeB耐药基因,可对大环内酯类抗生素产生耐药。2株外环境非LP(FDAARGOS_200、NCTC11983)携带有FEZ-1耐药基因,可对碳青霉烯类、头孢菌素、青霉烷类抗生素产生耐药。
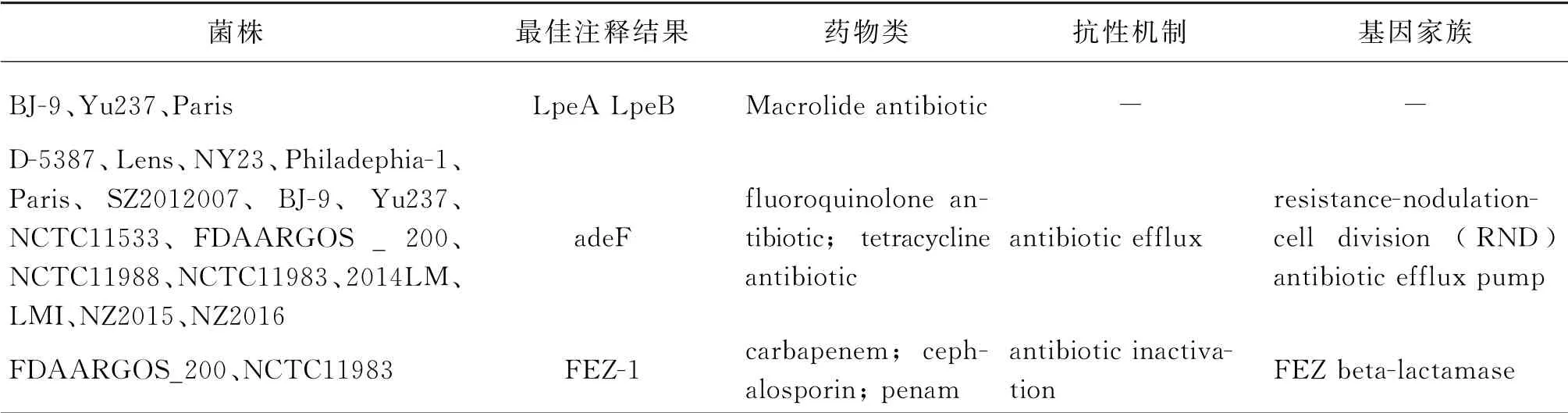
表4 军团菌参考菌株耐药基因Tab.4 Antimicrobial resistance genes in Legionella reference strains
3 讨论
军团菌是机会致病菌,广泛分布于外环境水体,特定的菌种也存在于潮湿的土壤中;军团菌能够在真核的吞噬细胞中寄生和复制,阿米巴是其主要的自然宿主[8-10]。阿米巴为军团菌提供双重的作用:一是提供细菌在细胞内复制的小生态,二是保护细菌免于外环境中抗生素、化学物质、热、渗透性等损害[11]。由于病原体和宿主之间紧密的关系,军团菌和原虫通过基因水平转移(HGT)交换遗传物质,尤其在长期共进化中存在真核到原核的基因水平转移[8,12],其主要证据就是军团菌基因组中存在各种真核功能的效应蛋白和亚基[13-15]。本文对参考菌株进行全基因组注释和多基因组比对结果都提示,不同种军团菌无论基因组大小、CDCs数量、GC含量以及LCBs结构都存在着差异;说明军团菌不同种间基因组差异大。有文献报道军团菌基因组之间存在高度的变异和分化,而宿主阿米巴充当了军团菌进化的熔炉[15-17]。
同种的军团菌GC含量基本相同;多基因组比对提示LP1和L.micdadei各自的基因组保守区域LCBs的大小、数量以及排列位置基本相同,种内基因组的大小差异较小;16S r RNA基因的种系发生树显示8株LP1和4株L.micdadei各自属于一个种系进化分支;以上结果都说明军团菌基因组种内相对保守;但是种系发生树也提示主要致病型别LP1存在种内基因组变异分化现象。军团菌不同的种具有独立遗传的保守核心基因组,同时能够选择性获得潜在提高毒力的基因[12],是军团菌种内基因组相对保守、种间差异大的生物学基础。LP种内存在基因重组,是推动LP遗传分化的主要因素,但是LP和其它军团菌种间DNA重组事件很少发生[10,12]。外环境分离的不同血清型的非LP军团菌GC含量、基因组大小都存在较大差异,相对于临床分离的LP1和L.micdadei,外环境菌株基因组中间有较多的非保守区域。外环境存在大量的可以整合到军团菌的外源DNA[12],导致可能有更多的基因水平转移事件发生,因此不致病的军团菌比致病的军团菌的遗传分化更多[18]。
16S r RNA基因是细菌上编码核糖体RNA(r RNA)相对应的DNA序列,存在于所有细菌的基因组中,由高度变异区域、可变区域和保守区域构成,可以作为生物的进化距离和关联性的标志,是研究细菌种系发生最常用的遗传标志[19-21]。本研究中,16株参考菌株16S r RNA基因种系发生分析结果显示,相同的军团菌种的不同参考菌株都有各自的主进化分支,证实了16S r RNA基因作为遗传标志的可靠性。
临床最常见的致病军团菌种LP1携带的毒力因子类别和数量比其它的参考菌株更多,提示军团菌的致病能力跟毒力因子紧密相关。在众多的毒力因子中对军团菌的分泌系统及其效应蛋白研究较多。军团菌适应细胞内和细胞外不同的环境是通过不同的分泌系统及其分泌的效应蛋白实现的。其中高度保守的IVB分泌系统(type IVB secretion system-T4BSS)也称为Dot/Icm T4BSS分泌系统[16,22],对军团菌适应细胞内环境以及细胞内复制非常关键,Dot/Icm T4BSS横跨细胞膜转移300多种细菌的效应蛋白进入宿主细胞[10,16,22-23];同时阻止溶酶体对细菌的降解并从宿主细胞获得营养[11]。本研究中临床LP1均携带Dot/Icm T4BSS;同时携带的T4BSS效应蛋白毒力因子数量明显多于其它参考菌株。有文献报道军团菌编码大量的效应蛋白,很多只存在于LP,不同的军团菌种中具有较大的差异[11,24],具有高度变异蛋白结构域的效应蛋白具有种的特异性[12];结果也提示我们T4BSS效应蛋白跟LP1的致病能力紧密相关,军团菌在宿主细胞环境中分泌效应蛋白是其在细胞内生存以及产生致病力的关键因素[25-26]。菌株Yu237缺失Dot/Icm T4BSS,与先前报道Dot/Icm T4BSS在LP军团菌中是高度保守的结果不符[10-11],由于本研究挑选的菌株是序列完整的全基因,可能原因是菌株来源的差异导致结果的不同。
参考菌株的毒力因子分析显示均有2型分泌系统(T2SS)和IVA分泌系统(Lvh T4ASS),其中T2SS毒力相关因子的数量在菌株间差异不大,Lvh T4ASS毒力因子在临床分离的LP1和米克戴德中的种类和数量比外环境分离的非LP菌株要多。T2SS有助于军团菌生物膜的形成,以及细菌在阿米巴和巨噬细胞内复制和抑制感染细胞的细胞因子反应等功能[11]。Lvh T4ASS主要作用是帮助军团菌在特定的环境下生长,如低温、水压、β-内酰胺抗生素、过氧化氢、漂白水等,同时保护LP不受巨噬细胞免疫应答产生的活性氧自由基的损害[10]。
军团菌培养条件严苛,生长缓慢,国内外关于军团菌耐药情况的研究比较少,军团菌的耐药情况可能被低估。临床基本上基于经验性用药,首选的药物是包括氟喹诺酮类(环丙沙星、左氧氟沙星、莫西沙星)、大环内酯类抗生素(阿奇霉素)和四环素类的药物(多西环素)[27];没有快速和准确的用药指导方案,降低了抗生素的治疗效率。参考菌株的耐药基因分析发现16株参考菌株都携带有adeF耐药基因,对氟喹诺酮类、四环素类抗生素有潜在的耐药风险。部分携带有LpeA、LpeB、FEZ-1耐药基因,可能对大环内酯类、碳青霉烯类、头孢菌素、青霉烷类抗生素产生耐药。临床上已经有发现对氟喹诺酮类耐药的LP菌株[28-29],也有报道在军团菌中发现β-内酰胺类、四环素抗性基因[12]。运用全基因组生物信息分析技术,可以快速对可能的耐药基因进行预测,对临床治疗提供辅助参考。
综上所述,本文运用基于细菌全基因组序列的生物信息学分析,对16株军团菌参考菌株的基因组结构、功能进行了全面的解析,深入认识了军团菌的致病性和遗传进化特征,有助于未来开展基因组流行病学研究,促进军团菌病的防控。
利益冲突:无
引用本文格式:陈爱平,张拥军.16株军团菌全基因组比较及重要毒力因子分析[J].中国人兽共患病学 报,2022,38(10):854-861.DOI:10.3969/j.issn.1002-2694.2022.00.137
