绿原酸通过Bax/Bcl-2/Caspase-3信号通路对喉癌Hep-2细胞增殖、凋亡的影响Δ
2022-11-11张立坤邵东风王东海
张立坤,邵东风,王东海,李 扬
(1.唐山市协和医院耳鼻咽喉头颈外科,河北 唐山 063000; 2.华北理工大学附属医院呼吸与危重症医学科,河北 唐山 063000)
喉癌是具有早期淋巴结转移和高侵袭特性的恶性肿瘤,全球发病率估计为2.32/10万[1-2]。减轻患者病痛和经济压力尤为重要,寻找用于临床的有效药物显得极为迫切。绿原酸(chlorogenic acid,CGA)是具有悠久历史的中药多酚,金银花、杜仲、小粒咖啡和绿茶等植物中都含有该物质。目前,CGA的抗肿瘤、抗炎、抗真菌和抗氧化等方面的研究已有报道[3-4]。研究结果发现,CGA对乳腺癌等肿瘤的治疗有积极的影响[5]。然而,关于CGA对喉癌细胞影响的研究还未见报道。B淋巴细胞瘤2(Bcl-2)在淋巴瘤细胞中被发现,当Bcl-2过表达时,能有效抑制细胞程序性死亡或者凋亡[6]。凋亡相关因子Bcl-2相关X蛋白(Bax)与Bcl-2具有氨基酸同源性,在体内Bax与Bcl-2可形成异型二聚体,过表达的Bax能有效抑制Bcl-2的活性[7]。Bax与Bcl-2是细胞凋亡重要的开关分子,其在恶性肿瘤细胞凋亡中具有重要的作用[8]。胱天蛋白酶(Caspase)家族主要通过线粒体通路、死亡受体通路促进细胞凋亡,Caspase-3是细胞凋亡过程中的关键因子,具有蛋白失活和切割作用,激活Caspase-3蛋白后可促进细胞的凋亡[9]。本研究采用不同浓度CGA及Bax/Bcl-2/Caspase-3信号通路抑制剂处理喉癌Hep-2细胞,探究CGA对喉癌Hep-2细胞及Bax/Bcl-2/Caspase-3信号通路的影响,为临床治疗喉癌提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验细胞:喉癌Hep-2细胞(批号为CCL-23)购自上海中乔新舟生物科技有限公司。
1.1.2 仪器:BPH-9162型细胞培养箱(上海一恒科学仪器有限公司);Celldiscoverer 7型倒置显微镜(卡尔蔡司上海管理有限公司);A49891型细胞计数器(美国赛默飞世尔科技有限公司);SAF-680T型酶标仪(上海巴玖实业有限公司);EX-1026型流式细胞仪、EL-3047型蛋白凝胶成像仪(常州必达科生物科技有限公司)。
1.1.3 药品与试剂:CGA(原料药,纯度为98.5%,批号为S30617-3)购自西安天广源生物科技有限公司;Bax/Bcl-2/Caspase-3通路抑制剂Bax inhibitor peptide V5(批号为A15337)购自南京百鑫德诺生物科技有限公司;DMEM培养液(批号为P-CA-307)、细胞计数试剂盒-8(CCK-8,批号为P-CA-402)和细胞凋亡双染试剂盒(Annexin V-FITC/PI,批号为P-CA-201)购自武汉普诺赛生命科技有限公司;蛋白提取试剂盒(批号为ab113476)购自美国Abcam公司;BCA蛋白浓度测定试剂盒(批号为GK10009)购自美国GlpBio公司;鼠源Bax(批号为sc-7480)、Bcl-2(批号为sc-7382)、Caspase-3(批号为sc-7272)、凋亡相关蛋白(p53,批号为sc-23900)、增殖相关蛋白(ki-67,批号为sc-1269)、GAPDH抗体(批号为sc-47724)和羊抗人二抗(批号为sc-51993)购自上海江莱生物科技有限公司。
1.2 方法
1.2.1 细胞培养及含药培养液制备:取喉癌Hep-2细胞,于96孔培养板中,用90%DMEM培养基和10%胎牛血清,在37 ℃、5%二氧化碳与95%空气的条件下在培养箱中进行培养,细胞密度达到80%以上进行传代,每3 d更新1次培养液;倒置显微镜观察到细胞长满培养瓶。将CGA溶解于DMEM培养液中,配制成含有0、250、500、750和1 000 μmol/L的CGA培养液,用于后续实验[10]。
1.2.2 CCK-8法检测不同浓度CGA对喉癌Hep-2细胞增殖抑制率的影响:取对数生长期喉癌Hep-2细胞,调整喉癌Hep-2细胞浓度为2×105个/孔,接种于24孔培养板,分别用含有0、250、500、750和1 000 μmol/L的CGA培养液处理喉癌Hep-2细胞24、48 h,用CCK-8法检测喉癌Hep-2细胞增殖能力,每孔加入CCK-8溶液10 μL,培养1 h后,于酶标仪(450 nm)中测定各孔吸光度(OD450)值,根据公式计算细胞增殖抑制率,细胞增殖抑制率(%)=(1-实验组OD450值/对照组OD450值)×100%,其中实验组为各浓度CGA培养液,对照组为0 μmol/L的CGA培养液,以此寻找出最适宜CGA的浓度和处理时间。实验重复6次。
1.2.3 细胞分组及处理:取对数生长期喉癌Hep-2细胞,分为对照组(正常培养的喉癌Hep-2细胞)、CGA低浓度组(CGA培养液750 μmol/L)、CGA高浓度组(CGA培养液1 000 μmol/L)、CGA高浓度+通路抑制剂组(CGA培养液1 000 μmol/L+Bax/Bcl-2/Caspase-3通路抑制剂Bax inhibitor peptide V5 50 μmol/L,Bax inhibitor peptide V5的浓度依据试剂盒说明书进行设置),各组喉癌Hep-2细胞按照上述方式给药进行培养。
1.2.4 CCK-8法检测各组喉癌Hep-2细胞增殖抑制率:取各组对数生长期喉癌Hep-2细胞,测定方法同“1.2.2”,分别在培养至48 h时测定于每孔细胞在450 nm处OD450值,并计算喉癌Hep-2细胞增殖抑制率。实验重复6次。
1.2.5 流式细胞仪检测各组喉癌Hep-2细胞凋亡情况:用胰蛋白酶消化各组喉癌Hep-2细胞,终止消化后用胎牛血清培养基进行培养,调整细胞密度为2×105个/mL,用PBS清洗2次,3 300 r/min离心(离心半径为15 cm)5 min去除上清液,加入500 μL稀释的膜联蛋白V结合缓冲液重悬细胞,再加入Annexin V-FITC 5 μL和PI 5 μL染色,室温(25 ℃)避光孵育20 min后于流式细胞仪检测细胞凋亡情况。实验重复6次。
1.2.6 蛋白质印迹法检测各组喉癌Hep-2细胞增殖、凋亡和Bax/Bcl-2/Caspase-3信号通路相关蛋白表达:取各组喉癌Hep-2细胞,调整细胞浓度为5×105个/mL接种于24孔板中,按照蛋白提取试剂盒操作流程提取各组喉癌Hep-2细胞的总蛋白,8 500 r/min离心(离心半径为15 cm)5 min取上清液,根据BCA蛋白浓度测定试剂盒的操作流程测定其中蛋白质含量,使用凝胶电泳1.5 h,分离等量蛋白质,转移至聚偏氟乙烯膜上,加入封闭液封闭1 h,添加鼠源p53(1∶ 300)、ki-67(1∶ 300)、Bax(1∶ 500)、Bcl-2(1∶ 500)、Caspase-3(1∶ 1 000)、GAPDH(1∶ 500)一抗孵育4 ℃过夜,添加羊抗人二抗(1∶ 2 000)后室温孵育2 h。采用蛋白凝胶成像仪对相关蛋白水平进行半定量分析。实验重复6次。
1.3 统计学方法

2 结果
2.1 不同浓度CGA对喉癌Hep-2细胞增殖抑制率的影响
与0 μmol/L CGA相比,250、500、750和1 000 μmol/L的CGA对喉癌Hep-2细胞增殖抑制率显著升高,差异均有统计学意义(P<0.05),且呈现浓度依赖性;其中750、1 000 μmol/L的CGA对喉癌Hep-2细胞增殖抑制率相对较高,因此,选择750、1 000 μmol/L的CGA用于后续的实验;与24 h相比,250、500、750和1 000 μmol/L的CGA对喉癌Hep-2细胞处理48 h后的增殖抑制率显著升高,差异均有统计学意义(P<0.05),因此,后续实验对喉癌Hep-2细胞处理48 h,见表1。
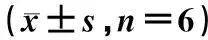
表1 不同浓度CGA对喉癌Hep-2细胞增殖抑制率的影响Tab 1 Effects of different concentrations of CGA on proliferation inhibition rate of laryngeal cancer Hep-2
2.2 四组喉癌Hep-2细胞增殖抑制率比较
与对照组相比,CGA低、高浓度组喉癌Hep-2细胞增殖抑制率显著升高;CGA高浓度组喉癌Hep-2细胞增殖抑制率高于CGA低浓度组;与CGA高浓度组相比,CGA高浓度+通路抑制剂组喉癌Hep-2细胞增殖抑制率显著降低,上述差异均有统计学意义(P<0.05),见表2。
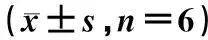
表2 四组喉癌Hep-2细胞增殖抑制率比较Tab 2 Comparison of proliferation inhibition rate of laryngeal cancer Hep-2 cells among four groups n=6)
2.3 四组喉癌Hep-2细胞凋亡率比较
与对照组相比,CGA低、高浓度组喉癌Hep-2细胞凋亡率显著升高;CGA高浓度组喉癌Hep-2细胞凋亡率高于CGA低浓度组;与CGA高浓度组相比,CGA高浓度+通路抑制剂组喉癌Hep-2细胞凋亡率显著降低,上述差异均有统计学意义(P<0.05),见表3、图1。
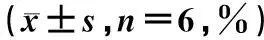
表3 四组喉癌Hep-2细胞凋亡率比较Tab 3 Comparison of apoptosis rate of laryngeal cancer Hep-2 cells among four groups n=6,%)
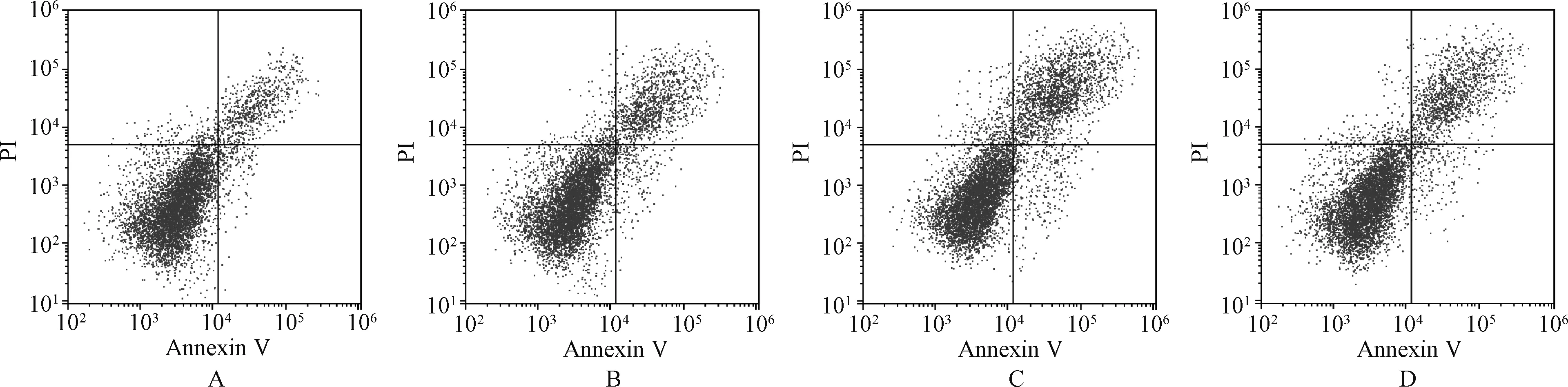
A.对照组;B.CGA低浓度组;C.CGA高浓度组;D.CGA高浓度+通路抑制剂组A. control group; B. CGA low concentration group; C. CGA high concentration group; D. CGA high concentration+pathway inhibitor group图1 四组喉癌Hep-2细胞凋亡流式图Fig 1 Flow cytometry of laryngeal cancer Hep-2 cells apoptosis among four groups
2.4 四组喉癌Hep-2细胞增殖、凋亡相关蛋白表达水平比较
与对照组相比,CGA低、高浓度组喉癌Hep-2细胞中ki-67蛋白表达水平显著降低,p53蛋白表达水平显著升高;CGA高浓度组喉癌Hep-2细胞中ki-67蛋白表达水平低于CGA低浓度组,p53蛋白表达水平高于CGA低浓度组;与CGA高浓度组相比,CGA高浓度+通路抑制剂组喉癌Hep-2细胞中ki-67蛋白表达水平显著升高,p53蛋白表达水平显著降低,上述差异均有统计学意义(P<0.05),见表4、图2。
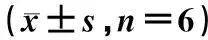
表4 四组喉癌Hep-2细胞增殖、凋亡相关蛋白表达水平比较Tab 4 Comparison of expression levels of proliferation and apoptosis related proteins in laryngeal cancer Hep-2 cells

A.对照组;B.CGA低浓度组;C.CGA高浓度组;D.CGA高浓度+通路抑制剂组A. control group; B. CGA low concentration group; C. CGA high concentration group; D. CGA high concentration+pathway inhibitor group图2 四组喉癌Hep-2细胞p53、ki-67蛋白质印迹图Fig 2 Western blotting of p53 and ki-67 in laryngeal cancer Hep-2 cells among four groups
2.5 四组喉癌Hep-2细胞Bax/Bcl-2/Caspase-3信号通路相关蛋白表达水平比较
与对照组相比,CGA低、高浓度组喉癌Hep-2细胞中Bax、Caspase-3蛋白表达水平显著升高,Bcl-2蛋白表达水平显著降低;CGA高浓度组喉癌Hep-2细胞中Bax、Caspase-3蛋白表达水平高于CGA低浓度组,Bcl-2蛋白表达水平低于CGA低浓度组;与CGA高浓度组相比,CGA高浓度+通路抑制剂组喉癌Hep-2细胞中Bax、Caspase-3蛋白表达水平显著降低,Bcl-2蛋白表达水平显著升高,上述差异均有统计学意义(P<0.05),见表5、图3。
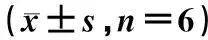
表5 四组喉癌Hep-2细胞Bax/Bcl-2/Caspase-3信号通路相关蛋白表达水平比较Tab 5 Comparison of expression levels of Bax/Bcl-2/Caspase-3 signal pathway related proteins in laryngeal cancer Hep-2 cells among four groups n=6)
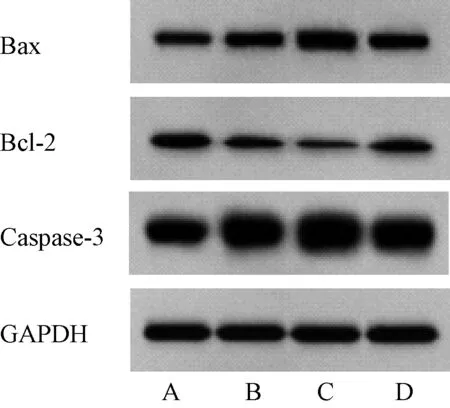
A.对照组;B.CGA低浓度组;C.CGA高浓度组;D.CGA高浓度+通路抑制剂组A. control group; B. CGA low concentration group; C. CGA high concentration group; D. CGA high concentration+pathway inhibitor group图3 四组喉癌Hep-2细胞Bax、Bcl-2和Caspase-3蛋白质印迹图Fig 3 Western blotting of Bax, Bcl-2 and Caspase-3 in laryngeal cancer Hep-2 cells among four groups
3 讨论
喉癌在头颈部恶性肿瘤中的发病率居第2位,喉癌的治疗需要考虑根治问题,还需要考虑保留喉功能,术后进行化疗辅助是一种公认的根治方法,寻找新型的化疗药,提高根治率和患者健康水平,保留喉功能显得尤为重要[11-13]。CGA可以减轻肺炎危害,影响肺炎中巨噬细胞由M1向M2极化,抑制炎症发生[14];并被证明可以用于辅助治疗乳腺癌,对乳腺癌MCF-7细胞具有更强的抑制作用[15]。本研究结果显示,250、500、750和1 000 μmol/L的CGA均具有抑制喉癌Hep-2细胞增殖的作用,且具有浓度依赖性,其中750、1 000 μmol/L的CGA对喉癌Hep-2细胞的抑制作用较为显著,因此,选择750、1 000 μmol/L的CGA用于后续实验。使用750、1 000 μmol/L CGA处理喉癌Hep-2细胞48 h后,结果发现,与对照组相比,CGA低、高浓度组喉癌Hep-2细胞增殖抑制率、细胞凋亡率显著升高,p53蛋白表达水平显著升高,ki-67蛋白表达水平显著降低,表明CGA可以显著抑制喉癌Hep-2细胞的增殖,促进其凋亡。
Bax/Bcl-2/Caspase-3信号通路与细胞的凋亡过程有密切关系,Bax的过表达能有效抑制Bcl-2表达,并能激活Caspase-3,激活后的Caspase-3导致染色质凝聚和核酸酶激活,进一步促进细胞凋亡,在细胞凋亡过程中Caspase-3发挥最后执行者的作用,而Bcl-2过表达时能有效抑制Bax和Caspase-3的表达,显著抑制细胞凋亡[16]。Bcl-2与Bax能够特异性结合而发挥抗凋亡作用,Bax、Bcl-2和Caspase-3能够发生级联反应促进细胞凋亡[17]。刘磊峰等[18]的研究结果发现,通过影响Bax、Bcl-2和Caspase-3蛋白的表达水平,可以促进喉癌Hep-2细胞的凋亡。p53基因是肿瘤抑制基因的一种,当促进p53蛋白高表达时,能有效诱导细胞凋亡[19];ki-67是细胞核中增殖能力的标志物,其高表达提示细胞具有活跃的增殖能力[20]。本研究结果显示,CGA低、高浓度组喉癌Hep-2细胞Bax、Caspase-3蛋白表达水平高于对照组,Bcl-2蛋白表达水平低于对照组,表明CGA可促进喉癌Hep-2细胞中Bax、Caspase-3蛋白表达,抑制Bcl-2蛋白表达。本研究结果还发现,与CGA高浓度组相比,CGA高浓度+通路抑制剂组喉癌Hep-2细胞增殖抑制率、细胞凋亡率,p53、Bax和Caspase-3蛋白表达水平显著降低,ki-67、Bcl-2蛋白表达水平显著升高,表明Bax/Bcl-2/Caspase-3通路抑制剂Bax inhibitor peptide V5能够逆转CGA抑制喉癌Hep-2细胞增殖和诱导其凋亡的作用,因此,CGA可能通过激活Bax/Bcl-2/Caspase-3信号通路发挥抑癌作用。
综上所述,CGA可显著抑制喉癌Hep-2细胞的增殖,并促进其凋亡,可能与Bax/Bcl-2/Caspase-3信号通路激活有关,但影响喉癌增殖与凋亡的因素较多,信号通路纷繁复杂而且未进行体内验证,因此仍需进一步研究。
