CPT1C 的表达水平与甲基化的关联及其对胃癌预后的影响
2022-11-09陈继军陈赵乐樊菲菲刘传明
陈 科,陈继军,陈赵乐,樊菲菲,刘传明
(解放军空军军医大学第一附属医院急诊科,陕西 西安 710032)
胃癌(gastric cancer,GC)是最为常见的消化道恶性肿瘤之一。流行病学数据显示,2020 年美国GC新确诊患者27 600 例,当年病死于胃癌者11 010例,GC 已成为癌症相关死亡的主要原因之一[1,2]。目前我国GC 患者整体预后较差的主要原因为早期诊断不完善,早期或超早期患者比例较少,胃癌患者常发现于晚期,大多已出现远处转移或区域淋巴结转移[3]。因此,探索新的与胃癌发生发展密切相关的基因,对于开发新的胃癌患者预后或治疗反应率的生物学分子标志物,以及可能成为胃癌靶向分子的意义重大。本研究通过公共数据库探讨肉碱棕榈酰转移酶1C(carnitine palmitoyltransferase 1C,CPT1C)在胃癌组织中的基因表达水平和与甲基化的关联,及与患者临床病理特征和预后的关系,并通过GSEA富集分析对CPT1C 可能参与的信号通路进行分析,以期为CPT1C 在胃癌中的研究提供依据和方向。
1 材料与方法
1.1 TCGA 资料下载 从TCGA 数据库(https://portal.gdc.cancer.gov)下载有关胃癌的表达谱数据和临床表型数据,采用R 语言(版本:3.5.1)提取CPT1C 数据,分析其表达水平与临床病理参数及预后的关系。
1.2 TCGA 数据处理和分析 删除胃癌患者中生存时间<30 d 的样本,以CPT1C 表达量的中位数将其分为高表达组和低表达组。然后使用GSEA 4.0.1 软件对高表达组和低表达组的样本进行基因集富集分析,其中c2.cp.kegg.v 6.0.symbols.数据集从GSEA 网站的MisgDB 数据库获取,采用缺省加权富集统计方法进行富集分析,设置随机组合次数为1000 次。最后使用R 语言的ggplot2 包进行多GSEA 富集分析的图形绘制。
1.3 Kaplan-Meier Plotter 数据分析 在Kaplan-Meier Plotter 数据分析平台中检索CPT1C 基因,并应用在线分析软件绘制CPT1C 高低表达的生存曲线,限定条件为总生存和无疾病进展生存,对肿瘤病理类型、临床分期、分级等不做限制。探索CPT1C 的表达与性别、TNM 分期、劳伦分型、HER2 状态等胃癌临床病理因素的关系。
1.4 DNMIVD 数据分析 在DNA 甲基化交互可视化数据库(DNMIVD)中,分析CPT1C 基因甲基化与mRNA 表达水平的关联。并依据CPT1C 基因的甲基化水平将其分为高/低甲基化两组,比较CPT1C 甲基化水平与胃癌患者预后的联系。
1.5 统计学方法 采用Wilcoxon 秩和检验对胃癌和癌旁组织中CPT1C 基因表达量进行差异分析。采用R 语言,survival 数据包,进行生存分析并绘制生存曲线,采用Log-rank 检验对生存率进行比较。采用R3.5.1 统计学软件进行差异表达基因分析及图形的绘制。采用GSEA 4.0.1 软件进行基因集富集分析,其中将错误发现率(FDR)<0.05 的基因集作为显著富集基因集。
2 结果
2.1 CPT1C 的表达水平与胃癌预后的关系 对来自TCGA 数据库中的343 例胃癌组织和30 例癌旁组织的CPT1C 基因表达量进行差异分析,结果显示,与癌旁组织相比,CPT1C 在胃癌中显著高表达,差异有统计学意义(P=0.003),见图1。之后将生存时间<30 d 的样本删除后,共有306 例癌样本,以CPT1C 基因表达的中位数为分界点,将胃癌患者分为CPT1C 高表达组(n=153)和CPT1C 低表达组(n=153)。生存分析结果显示,CPT1C 高表达组患者的预后更差,其中位生存时间为396 d,CPT1C 低表达组患者的中位生存时间为463 d,差异有统计学意义(Log-rank 检验,P=0.01),见图2。之后在Kaplan-Meier Plotter 数据库中,同样观察到高表达CPT1C胃癌患者与不良预后显著相关,见图3。
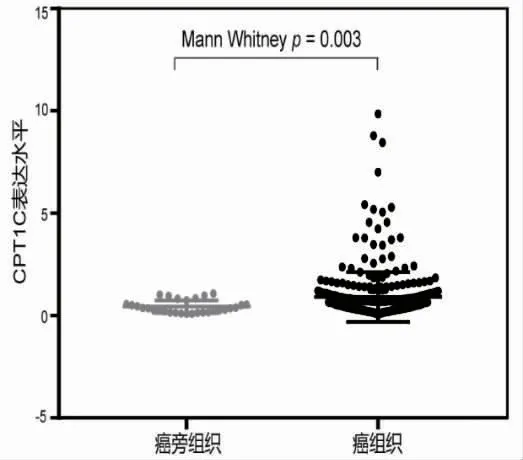
图1 CPT1C 在343 例胃癌和30 例癌旁组织中的差异表达
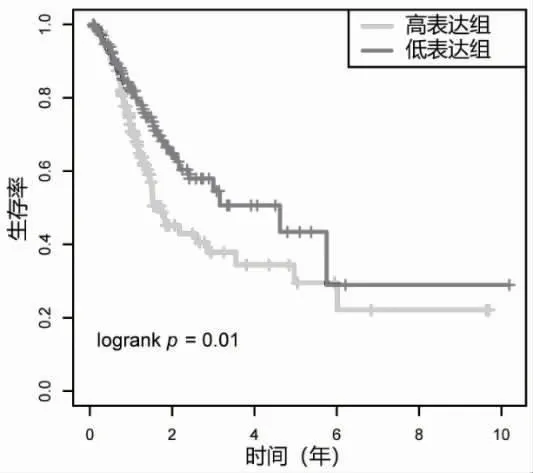
图2 TCGA 胃癌患者中CPT1C 高低表达的生存曲线
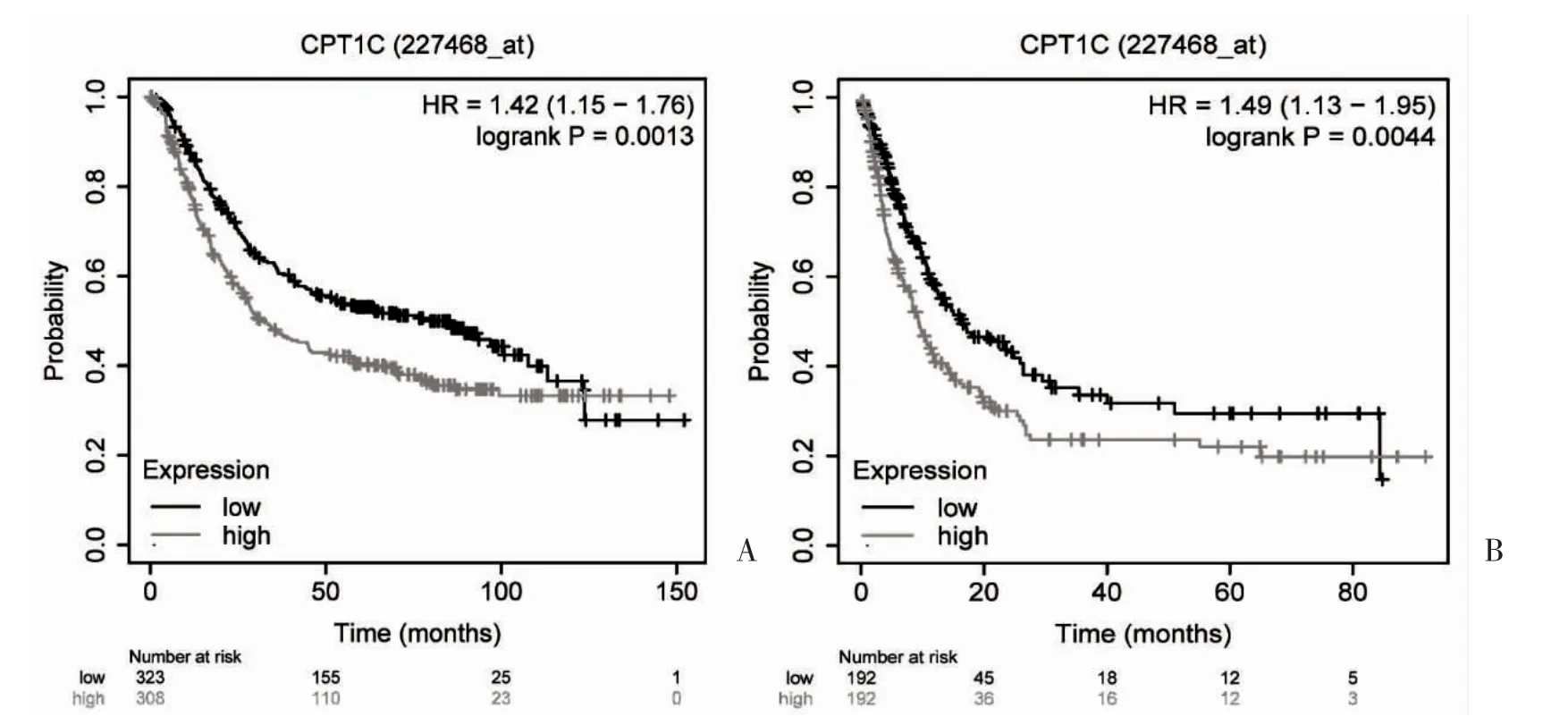
图3 CPT1C 高低表达胃癌患者生存曲线
2.2 CPT1C 表达水平与胃癌患者临床病理特征的关系 Kaplan-Meier Plotter 数据库中,以胃癌组织中CPT1C 表达水平的中位数为界,将患者分为CPT1C高表达组和CPT1C 低表达组,探索CPT1C 的表达水平与胃癌患者临床病理特征的关系。在总生存分析组中,胃癌组织中CPT1C 表达与患者性别、TNMⅢ期、T3、N 分期(N1、N2和N1+2+3)、劳伦分型(肠型)和HER2 阴性有关(P<0.05),而与TNM 分期(Ⅰ、Ⅱ和Ⅳ期)、T 分期(T2和T4分期)和分化程度等临床病理因素无明显相关性(P>0.05)。在无病生存期分析组中,胃癌组织CPT1C 表达与男性患者、TNMⅢ期、T3、N 分期(N1+2+3)、劳伦分型(肠型)和HER2 阴性有关(P<0.05),而与女性、TNM 分期(Ⅰ、Ⅱ和Ⅳ期)、T 分期(T2和T4分期)和分化程度等临床病理因素无明显相关性(P>0.05),见表1。

表1 Kaplan-Meier plotter 探索不同临床病理因素对胃癌CPT1C 基因表达及临床预后的影响
2.3 影响胃癌患者总生存的单因素和多因素Cox 回归分析 对来自TCGA 的胃癌患者进行单因素Cox回归分析见表2,结果显示高表达CPT1C 的患者与不良预后显著相关(HR=1.43,P=0.02)。其他临床病理因素如:年龄、性别、TNM 分期、N 分期、肿瘤状态和残余肿瘤也与胃癌患者总生存有明显相关性(P<0.05)。此外,多因素Cox 回归分析结果显示,高表达CPT1C 和带瘤状态仍与胃癌患者不良预后相关(P<0.05)。综合以上结果提示CPT1C 的表达水平能够成为影响胃癌患者生存的独立预后因素,并且高表达CPT1C 与不良预后相关。
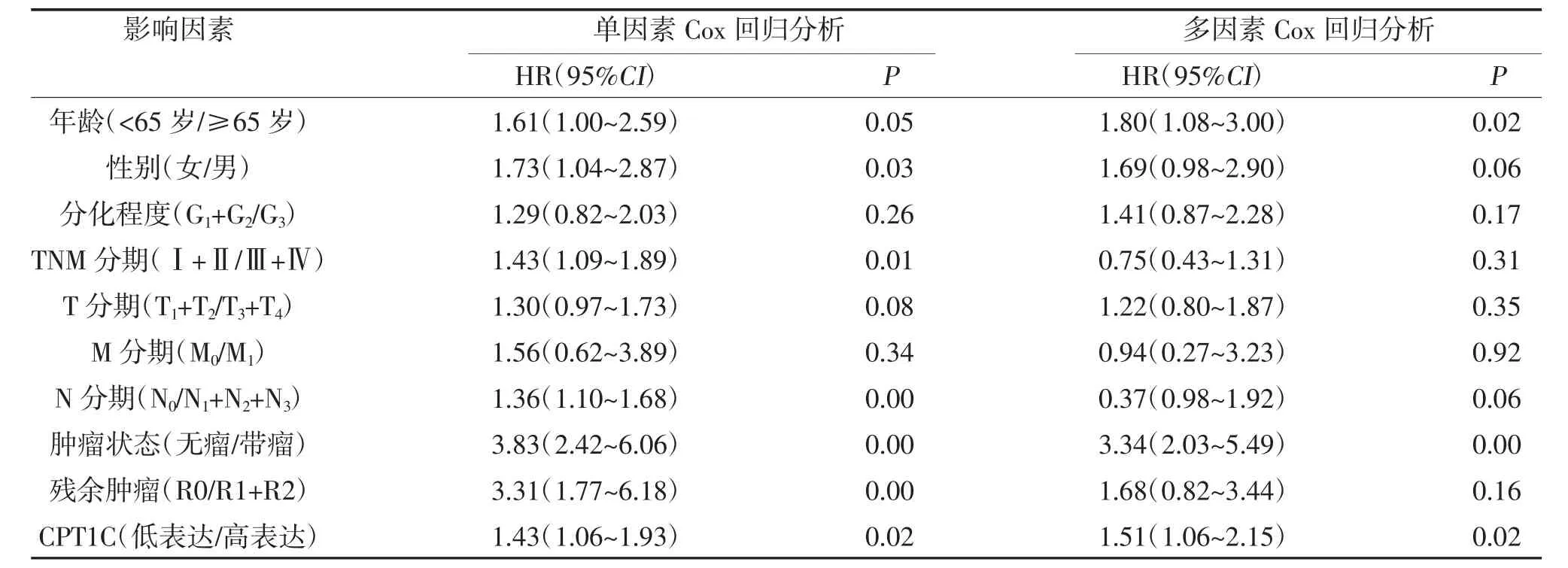
表2 影响胃癌患者的总生存单因素和多因素回归分析
2.4 CPT1C 的甲基化水平及其与预后的关系 利用DNMIVD 探讨CPT1C 的表达水平与启动子甲基化水平的相关性,结果显示:CPT1C 启动子甲基化β值与基因表达水平呈负相关(r=0.33,P=6.60e-10)。并且将根据CPT1C 甲基化中位值分为高/低甲基化表达组,可以观察到高甲基化表达组的患者预后更好(P<0.05),见图4。
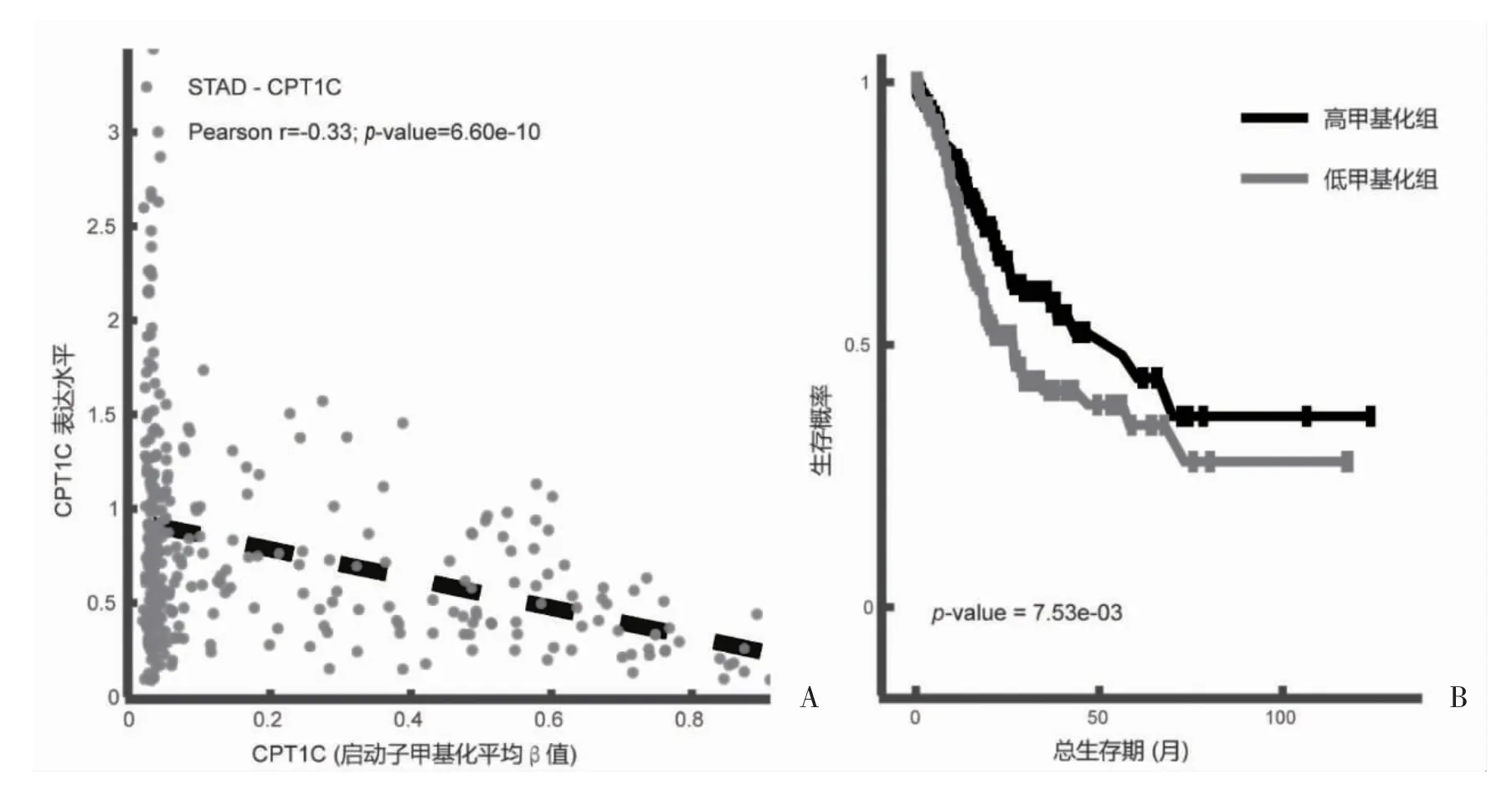
图4 CPT1C 表达量与启动子甲基化水平的相关性及其总体生存期的关系
2.5 CPT1C 功能的基因富集分析 GSEA 分析结果显示,CPT1C 高表达样本富集了ECM 受体相互作用、Ca 离子信号通路和HEDGEHOG 信号通路等相关基因集,而CPT1C 低表达样本则富集了剪接体、碱基切除修复和氧化磷酸化等相关基因集,见图5。
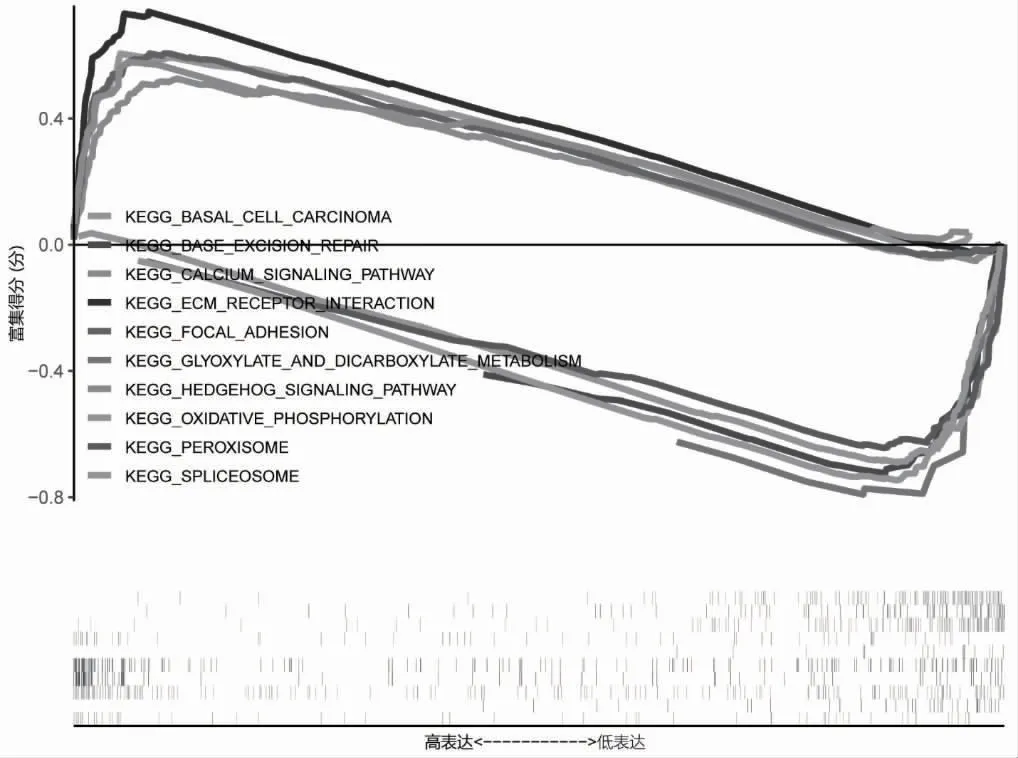
图5 胃癌患者中CPT1C 高、低表达样本的GSEA 富集分析
3 讨论
代谢重编程作为癌症的特征之一[4,5],为癌细胞的生长、分裂和生存提供所需的能量和物资。脂肪酸氧化代谢在癌症中的重要性,已经引起研究者的关注,其不仅参与癌症转移微环境的形成,而且对癌细胞的增殖、生存和耐药性有重要作用[6-9]。肉毒碱棕榈酰转移酶1(Carnitine palmitoyltransferase 1,CPT1)是控制脂肪酸氧化代谢的主要因子[10-12]。CPT1基因家族共包括3 个基因成员(CPT1A、CPT1B 和CPT1C),其中CPT1C 位于人类第19 号染色体上,于2002 年首次并且最后一个被发现的CPT1 家族成员,其主要分布在内质网和线粒体上。既往研究表明其在多种肿瘤中表达明显上调,并参与肿瘤的增殖和转移[13-15]。Rui W 等[13]研究发现,CPT1C 在甲状腺乳头状癌中高表达,并且CPT1C 的表达上调可促进癌细胞增殖和转移。Wan Y 等[14]研究显示,CPT1C 可能通过线粒体相关代谢重编程调控肿瘤细胞增殖和凋亡。并且近期研究提示[15],通过代谢组学分析,观察到,相比于正常生长的PANC-1 细胞衰老的胰腺癌PANC-1 细胞系中CPT1C 的表达和活性降低。而且在小鼠模型中,敲除多种癌细胞系的CPT1C 表达,能引起线粒体功能障碍,导致生长抑制和细胞衰老,抑制代谢应激下的细胞存活,从而抑制肿瘤的发生和进展,预示其可能成为潜在肿瘤治疗靶点。此外,有研究发现CPT1C 在结肠癌组织中高表达,并且与不良预后相关[16]。这些研究表明CPT1C 在胃癌发生发展中有重要作用,可能作为治疗的潜在靶点和预测预后的标志物。
TCGA 是目前世界上最大的癌症基因信息数据库,包含了30 多种癌症的多组学数据和尤其宝贵且 详细的预后随访信息;Kaplan-Meier Plotter 数据库[17]的来源包括GEO(Gene Expression Omnibus,https://www.ncbi.nlm.nih.gov/geo/),EGA(European Genome-phenome Archive,https://ega-archive.org)和TCGA。这些数据库为发现分析预后标记物的发现和验证、肿瘤基因组的改变以及研究其生物学分子机制提供海量的数据。本研究对TCGA 和Kaplan-Meier Plotter 数据平台中的胃癌患者CPT1C 基因表达数据进行分析,结果显示胃癌组织中的CPT1C 表达水平在癌组织中显著高于癌旁正常组织,其高表达与患者的不良预后和部分临床病理因素(男性、TNMⅢ期、T3、N1+2+3、肠型和HER2 阴性)显著相关,表明CPT1C 很可能为癌基因,且通过单因素/多因素回归分析发现,CPT1C 高表达组依然比低表达组预后更差。同时本研究中的数据来自TCGA、GEO和EGA,纳入的大量胃癌样本,数据可重复性高,具有较高价值,提示CPT1C 可能是胃癌的独立预后标志物。
目前CPT1C 基因参与胃癌发生发展及被调控机制尚不明确,DNA 甲基化是调控基因表达的一种重要方式。有研究通过分析DNMIVD 在线数据库发现[18,19],CPT1C 启动子甲基化β 值与基因表达水平呈显著负相关,并且低甲基化水平的CPT1C 患者预后较低甲基化组更差,这与本研究中CPT1C 高表达预后不良一致,提示CPT1C 的表达,可能受表观遗传的调控,并对胃癌的预后有重要影响。同时利用GSEA 富集分析发现,CPT1C 高表达组主要富集在ECM 受体相互作用、Ca 离子信号通路和HEDGEHOG 信号通路,这是与既往报道[14,20,21]的CPT1C 主要通过脂质代谢发挥重要作用不同,也为未来进一步研究CPT1C 在胃癌中的作用机制提供一定依据和方向。
综上所述,CPT1C 在胃癌肿瘤组织中高表达,并与患者预后不良相关,其表达水平可能受DNA 甲基化调控,且可能通过ECM 受体相互作用、Ca 离子信号通路和HEDGEHOG 信号通路等通路发挥作用,可作为预测胃癌预后的生物标志和潜在的治疗靶点。
