多西他赛联合四君子汤对RM-1前列腺癌荷瘤小鼠的肿瘤抑制作用及免疫功能的影响*
2022-11-07胡佳贞何春峰吴晓慧张青川
胡佳贞,何春峰,吴晓慧,张青川
(上海中医药大学附属普陀医院,上海 200062)
前列腺癌(prostate carcinoma)在发达国家的发病率位列第一、而死亡率位列第二[1-2]。在我国新增确诊的前列腺癌患者中中期、晚期患者的比例明显高于美国等发达国家[3]。现代医学将多西他赛(Docetaxel,DXT)作为治疗前列腺癌的一线化疗药物,在2004年美国FDA审核准予其正式成为临床上治疗难治性前列腺癌的药物[4-5],是临床上常用的标靶药物[6]。多西他赛治疗效果明确,但其副作用随着临床应用日益凸显,急需探索能够同时减轻患者的化疗副作用、协同抑瘤,进而提高机体免疫力的综合治疗方法。中医学认为前列腺癌脏腑病变主要在于肾与膀胱,病机主要为正虚邪实,以虚为主。由于前列腺癌临床表现不同且复杂,不同中医医家对其诊治分型各有不同[7]。前列腺癌以虚证为主,而四君子汤是益气补气的经典方。四君子汤源自《太平惠民和剂局方》。全方由4味中药组成:人参(君药)性甘,有补气益气之功效;白术(臣药)性温,具有健脾、益气及辅助运化之功效;茯苓(佐药)性平,有渗湿、润燥、益气之功效;甘草(使药)性甘,有辅助调和诸药、健脾益气的功效。全方共奏扶正固本、益气补气、补脾利湿之功[8]。肿瘤进展与体内免疫状态密切相关,机体抗肿瘤占主导作用的是细胞免疫[9]。有相关研究发现以人参为君药的参芪扶正液具有提高免疫力的功能[10]。本研究在前期实验研究的基础上,拟探讨四君子汤联合多西他赛对RM-1前列腺癌荷瘤小鼠皮下移植瘤的生长情况及对机体细胞免疫功能的影响。
1 材 料
1.1 实验动物6周龄SPF级C57BL/6雄性小鼠共30只,体质量(20±2)g,购自上海斯莱克实验动物有限责任公司,实验动物合格证编号:20170005012229,动物生产许可证号:SCXK(沪)2017-0005。动物实验环境:恒温26℃,湿度50%~70%,压差25 Pa,噪声≤60 dB,照度150 Lux。本实验由上海同济大学沪北动物实验中心伦理委员会审查批准,并开展动物实验。实验完毕后脱颈椎处死小鼠。
1.2 细胞株小鼠前列腺癌RM-1细胞株,购自中国科学院上海分院。
1.3 药物与试剂多西他赛(Medchem ExPress公司,批号:114977-28-5);中药材人参粉(上海信德中药饮片厂,批号:20160149)、白术颗粒剂(批号:9025022)、茯苓颗粒剂(批号:9050432)、炙甘草颗粒剂(批号:9045682)均购自广东一方制药有限公司;胎牛血清(北美BI,批号:04-001-1AUS);胰酶(Gibco公司,批号:25200056);细胞培养基(RPMI-1640)(Hyclone公司,批号:SH30809.01);Fc block(BD Pharminge公司,批号:8086608);Staining Buffer(BD Pharminge公司,批号:554656);Collagenase IV(Biofroxx公司,批号:EZ4567D111);DNase酶(Biofroxx公司,批号:EZ3416D319);红细胞裂解液(北京索莱宝科技公司,批号:R1010);PE-anti mouse CD3抗体(上海Biolegend,批号:100206);FITC-anti mouse CD4抗体(美国BD Bioscience,批号:11-0041-81);APC-anti mouse CD8抗体(美国BD Bioscience,批号:561093);Cy5.5-anti mouse CD11c抗体(美国BD Bioscience,批号:117328);PE-anti mouse CD80抗体(上海Biolegend,批号:104713);FITC-anti mouse CD86抗体(美国eBioscience,批号:11-0862-81);Cy5.5-anti mouse CD8抗体(美国BD Bioscience,批号:551162);FITC-anti mouse CD44抗体(美国eBioscience,批号:11-0441-82);APCanti mouse CD62L抗体(美国BD Bioscience,批号:553152);Mouse T-Cell surface Glycoprotein CD4 Elisa试剂盒(CUSBIO公司,批号:CSB-E13393m);Mouse Cluster of differentiation 8a Elisa试剂盒(DLDEVELOP公司,批号:DL-CD8a-Mu)。
1.4 主要仪器DNP9082型恒温孵育箱(上海精宏实验设备有限公司);5427R型低温高速离心机(EPPendorf公司);MM-1型微量震荡器(金坛市医疗器械厂);CKX41型倒置显微镜(OlymPus公司);Bit1000型电热恒温水浴锅(精宏实验设备有限公司);BSA124S型电子天平(Sartorius公司);CytoFLEX LX型流式细胞仪(BECKMAN COULTER公司);Synergy LX型多功能荧光酶标仪(美国BIOTEK公司)。
2 方 法
2.1 分组与造模30只C57BL/6雄性小鼠饲养于无特定病原体的动物实验室,适应性饲养1周,均存活。按随机数字表法分为空白对照组、荷瘤模型组、多西他赛组、四君子汤组、多西他赛联合四君子汤组,每组6只。无菌条件下配置RM-1细胞悬液(细胞密度为5×107个/L),放于冰上低温暂存。除空白对照组外,其余各组建立小鼠荷瘤模型,外科精细剪刀剪去移植部位黑色毛发,小鼠前列腺癌RM-1细胞悬液以0.2 mL/只接种于小鼠的右侧腋窝皮下,接种7 d后测量肿瘤直径达到约0.5 cm即为造模成功,最终24只小鼠均造模成功。
2.2 药物制备四君子汤颗粒剂,方药组成:人参9 g,白术颗粒2.7 g(相当于饮片9 g),茯苓颗粒0.45 g(相当于饮片9 g),炙甘草颗粒1.2 g(相当于饮片6 g)。按照人与小鼠体表面积换算成用药组小鼠所需药量:四君子汤颗粒剂给药量2 g/kg(前期预实验结果)。1剂四君子汤颗粒剂加66 mL的三蒸水配置成含药量0.2 g/mL所需药液,4℃保存。多西他赛加0.9%氯化钠溶液配制成2.5 mg/kg所需溶度。
2.3 实验给药多西他赛组小鼠腹腔注射给予多西他赛溶液,0.2 mL/只;四君子汤组小鼠灌胃给予四君子汤药液,2 g/kg;多西他赛联合四君子汤组小鼠腹腔注射多西他赛溶液(0.2 mL/只)的同时灌胃给予四君子汤药液(2 g/kg);空白对照组和荷瘤模型组小鼠给予等量的生理盐水灌胃、等量的生理盐水腹腔注射,1次/d。各组小鼠连续干预10 d。
2.4 观察指标
2.4.1 抑瘤率 每2天测量小鼠肿瘤体积变化并记录数据,用游标卡尺测量瘤体最大横径线a、垂直短径b,体积=b×b×a/2。末次给药后禁食不禁水24 h后颈椎脱臼法处死,剥除瘤体,测量瘤体体积、瘤质量,计算抑瘤率。抑瘤率(TIR)=(荷瘤模型组瘤体积-给药组瘤体积)/荷瘤模型组瘤体积×100%。
2.4.2 流式细胞仪检测小鼠淋巴结树突状细胞(CD11c、CD80、CD86)、肿瘤瘤体T淋巴细胞(CD3、CD4、CD8)、脾脏记忆T淋巴细胞(CD3、CD8、CD44、CD62L)分别摘取右侧腋窝淋巴结,完整剥除瘤体、脾脏。取淋巴结消化制成密度为1×106个/mL的细胞悬液,Fc block(1 μL/100 μL)冰上孵育5 min,加入表面分子抗体Cy5.5-anti mouse CD11c抗体、PE-anti mouse CD80抗体、FITC-anti mouse CD86进行染色。取瘤体消化制成密度为1×106个/mL的细胞悬液,加入表面分子抗体PE-anti mouse CD3抗体、FITC-anti mouse CD4抗体、APC-anti mouse CD8抗体进行染色。取脾脏消化制成密度为1×106个/mL的细胞悬液,加入表面分子抗体PE-anti mouse CD3抗体、Cy5.5-anti mouse CD8抗 体、FITC-anti mouse CD44抗 体、APC-anti mouse CD62L抗体。均在室温避光孵育15 min,2 000 r/min低温离心10 min,弃去上清,取200 μL Stain buffer重悬细胞,上细胞流式仪检测细胞比例。实验重复3次,取平均值。
2.4.3 ELISA法检测小鼠血清CD4+T淋巴细胞、CD8+T淋巴细胞 末次给药后禁食不禁水24 h后,颈椎脱臼处死前,双侧眼眶取血,EDTA抗凝,室温静置1 h后,2 000 r/min离心10 min,取上清液。采用ELISA双抗体夹心法免疫试剂盒检测,计算CD4+T细胞、CD8+T细胞表达。血清样品1∶5稀释,100 μL混匀后分别加入各待测孔中,加盖,置于37℃孵育2 h。甩干弃液后每孔加入Biotin-antibody(1×)100 μL、封板37℃下孵育1 h后洗板3次。每孔加入HRP-avidin(1×)100 μL后,封板37℃下孵育1 h后洗板5次。每孔加入90 μL TMB显色剂,封板37℃下孵育15 min避光。每孔加入50 μL的ELISA终止液终止反应,在5 min内用荧光酶标仪在450 nm波长条件下检测吸光度。实验重复3次,取平均值。
2.5 统计学方法采用SPSS 22.0统计学软件进行分析。计量资料用“均数±标准差”(±s)表示。重复测量计量资料比较采用重复测量方差进行分析。计量资料比较采用单因素方差分析,组间两两比较使用LSD-t检验,P<0.05为差异有统计学意义。图表应用Graph pad prism 5作图图像分析处理软件。
3 结 果
3.1 各组小鼠瘤体体积比较所有小鼠瘤体体积随时间延长均明显增大,差异有统计学意义(P<0.05),即存在时间效应,4组均如此。4组小鼠瘤体体积总体比较,差异有统计学意义(P<0.05),即存在分组效应;第3、5、7、10天,多西他赛组、四君子汤组及多西他赛联合四君子汤组小鼠瘤体体积均低于荷瘤模型组(P<0.01);多西他赛联合四君子汤组小鼠瘤体体积均低于多西他赛组、四君子汤组(P<0.01);四君子汤组小鼠瘤体体积明显高于多西他赛组(P<0.01)。时间因素与分组因素间存在交互效应(P<0.05)。(见表1、图1)
表1 各组小鼠瘤体体积比较(±s,mm3)
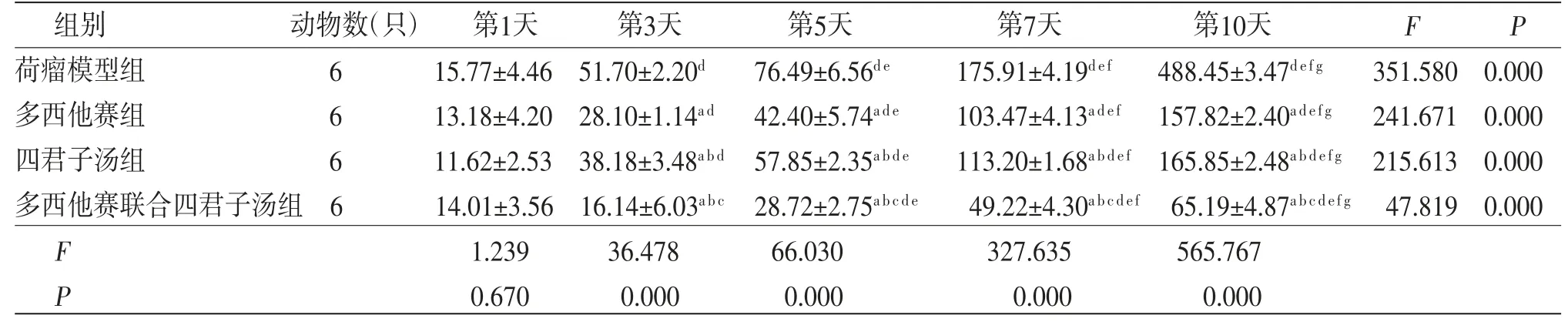
表1 各组小鼠瘤体体积比较(±s,mm3)
注:F交互效应=11.617,P交互效应=0.000;F时间主效应=20.876,P时间主效应=0.000;F组别主效应=29.312,P组别主效应=0.000;与荷瘤模型组比较,aP<0.01;与多西他赛组比较,bP<0.01;与四君子汤组比较,cP<0.01,与第1天比较,dP<0.01;与第3天比较,eP<0.01;与第5天比较,fP<0.01;与第7天比较,gP<0.01
组别 动物数(只) 第1天 第3天 第5天 第7天 第10天 F P荷瘤模型组 6 15.77±4.46 51.70±2.20d 76.49±6.56d e 175.91±4.19d e f 488.45±3.47d e f g 351.580 0.000多西他赛组 6 13.18±4.20 28.10±1.14a d 42.40±5.74a d e 103.47±4.13a d e f 157.82±2.40a d e f g 241.671 0.000四君子汤组 6 11.62±2.53 38.18±3.48a b d 57.85±2.35a b d e 113.20±1.68a b d e f 165.85±2.48a b d e f g 215.613 0.000多西他赛联合四君子汤组6 14.01±3.56 16.14±6.03a b c 28.72±2.75a b c d e 49.22±4.30a b c d e f 65.19±4.87a b c d e f g 47.819 0.000 F 1.239 36.478 66.030 327.635 565.767 P 0.670 0.000 0.000 0.000 0.000

图1 各组小鼠瘤体体积交互效应轮廓图
3.2 各组小鼠第10天瘤体质量及抑瘤率比较多西他赛组、四君子汤组及多西他赛联合四君子汤组小鼠第10天瘤体质量均低于荷瘤模型组(P<0.01);多西他赛联合四君子汤组小鼠第10天瘤体质量均低于多西他赛组、四君子汤组(P<0.01);四君子汤组小鼠第10天瘤体质量与多西他赛组比较,差异无统计学意义(P>0.05)。多西他赛组、四君子汤、多西他赛联合四君子汤的抑瘤率分别为67.68%、67.06%、86.65%。(见表2)
表2 各组小鼠第10天瘤体质量比较(±s,g)
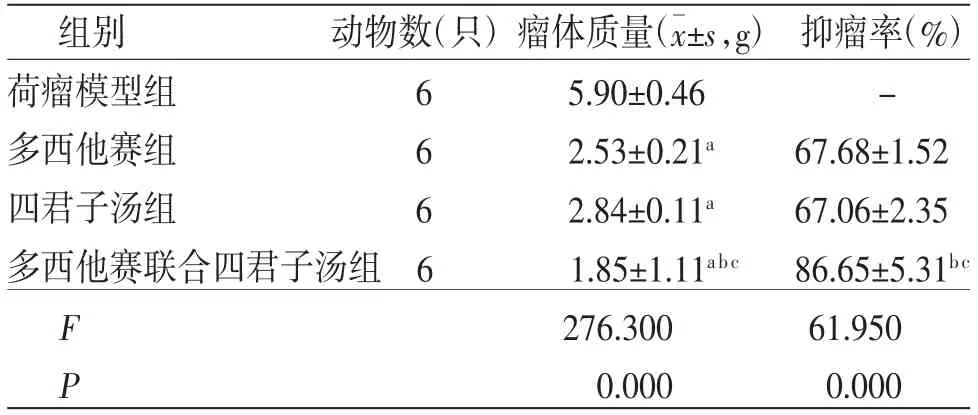
表2 各组小鼠第10天瘤体质量比较(±s,g)
注:与荷瘤模型组比较,aP<0.01;与多西他赛组比较,bP<0.01;与四君子汤组比较,cP<0.01
组别 动物数(只)瘤体质量(images/BZ_6_979_1892_998_1929.png±s,g) 抑瘤率(%)荷瘤模型组 6 5.90±0.46 -多西他赛组 6 2.53±0.21a 67.68±1.52四君子汤组 6 2.84±0.11a 67.06±2.35多西他赛联合四君子汤组6 1.85±1.11abc 86.65±5.31bc F 276.300 61.950 P 0.000 0.000
3.3 各组小鼠淋巴结树突状细胞DCs比较荷瘤模型组、多西他赛组、四君子汤组及多西他赛联合四君子汤组小鼠淋巴结CD11c+CD80+细胞比例、CD11c+CD86+细胞比例、CD11c+CD80+CD86+细胞比例均明显高于空白对照组(P<0.01);多西他赛联合四君子汤组小鼠淋巴结CD11c+CD80+细胞比例、CD11c+CD86+细胞比例、CD11c+CD80+CD86+细胞比例均明显高于荷瘤模型组(P<0.01);四君子汤组小鼠淋巴结CD11c+CD86+细胞比例、CD11c+CD80+CD86+细胞比例均明显高于荷瘤模型组(P<0.01);多西他赛联合四君子汤组CD11c+CD80+细胞比例、CD11c+CD86+细胞比例、CD11c+CD80+CD86+细胞比例均明显高于多西他赛组、四君子汤组(P<0.01)。(见表3、图2)
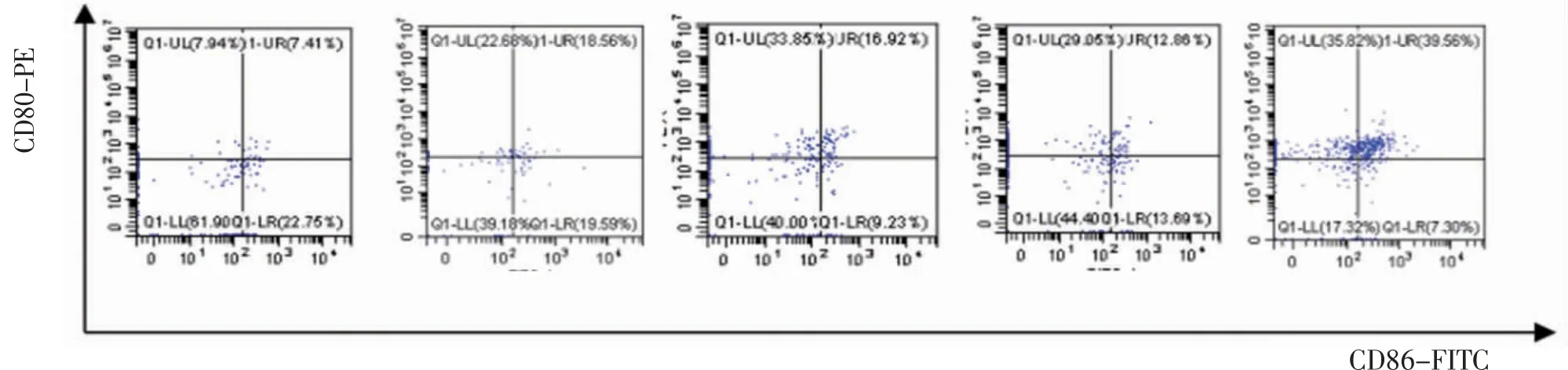
图2 各组小鼠淋巴结树突状细胞CD11c+CD80+、CD11c+CD86+、CD11c+CD80+CD86+比较
表3 各组小鼠淋巴结CD11c+CD80+、CD11c+CD86+、D11c+CD80+CD86+细胞比例比较(±s,%)

表3 各组小鼠淋巴结CD11c+CD80+、CD11c+CD86+、D11c+CD80+CD86+细胞比例比较(±s,%)
注:与空白对照组比较,aP<0.01;与荷瘤模型组比较,bP<0.01;与多西他赛组比较,cP<0.01;与四君子汤组比较,dP<0.01
组别 动物数(只)CD11c+CD80+CD11c+CD86+CD11c+CD80+CD86+空白对照组 6 17.38±2.13 22.52±1.44 10.09±1.73荷瘤模型组 6 46.56±4.95a 31.71±6.06a 17.12±2.78a多西他赛组 6 45.68±8.15a 34.61±7.20a 19.07±2.70ab四君子汤组 6 46.15±3.20a 39.91±1.59ab 27.57±3.16abc多西他赛联合四君子汤组6 79.36±1.15abcd 46.72±1.25abcd 40.58±2.42abcd F 135.100 15.810 80.210 P 0.000 0.000 0.000
3.4 各组小鼠瘤体T淋巴细胞比较多西他赛组、四君子汤组、多西他赛联合四君子汤组小鼠瘤体CD3+CD8+T细胞比例均明显高于荷瘤模型组(P<0.05),CD3+CD4+T细胞比例均明显低于荷瘤模型组(P<0.05);多西他赛联合四君子汤组小鼠瘤体CD3+CD8+T细胞比例均明显高于多西他赛组、四君子汤组(P<0.05),CD3+CD4+T细胞比例均明显低于多西他赛组、四君子汤组(P<0.05);四君子汤组小鼠瘤体CD3+CD8+T细胞比例、CD3+CD4+T细胞比例与多西他赛组比较,差异无统计学意义(P>0.05)。(见表4、图3)
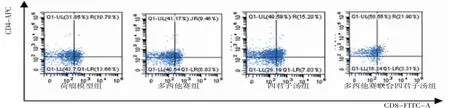
图3 各组小鼠瘤体CD3+CD8+、CD3+CD4+T淋巴细胞比较
表4 各组小鼠瘤体CD3+CD8+T细胞比例、CD3+CD4+T细胞比例比较 (±s,%)
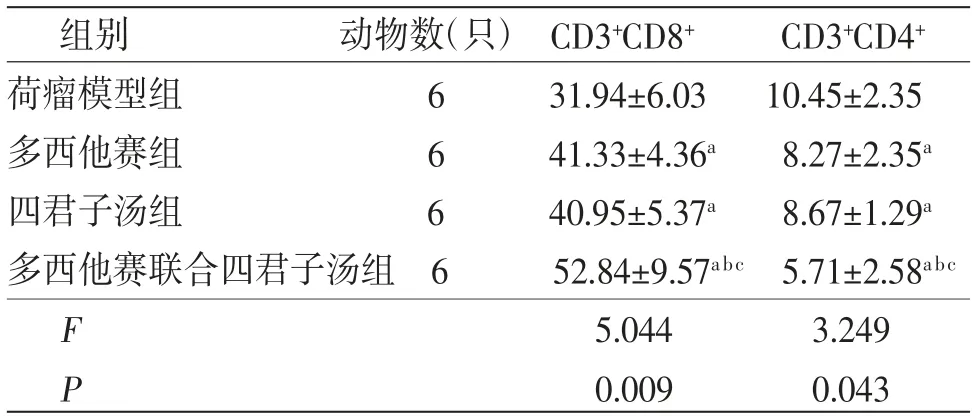
表4 各组小鼠瘤体CD3+CD8+T细胞比例、CD3+CD4+T细胞比例比较 (±s,%)
注:与荷瘤模型组比较,aP<0.05;与多西他赛组比较,bP<0.05;与四君子汤组比较,cP<0.05
组别 动物数(只)CD3+CD8+ CD3+CD4+荷瘤模型组 6 31.94±6.03 10.45±2.35多西他赛组 6 41.33±4.36a 8.27±2.35a四君子汤组 6 40.95±5.37a 8.67±1.29a多西他赛联合四君子汤组6 52.84±9.57abc 5.71±2.58abc F 5.044 3.249 P 0.009 0.043
3.5 各组小鼠脾脏CD3+CD8+T淋巴细胞比较荷瘤模型组小鼠脾脏CD3+CD8+CD44+CD62L-T细胞比例明显高于空白对照组(P<0.01),CD3+CD8+CD44-CD62L+T细胞比例明显低于空白对照组(P<0.01);多西他赛组、多西他赛联合四君子汤组小鼠脾脏CD3+CD8+CD44+CD62L-T细胞比例均明显低于荷瘤模型组(P<0.01),多西他赛组、四君子汤组、多西他赛联合四君子汤组小鼠脾脏CD3+CD8+CD44-CD62L+T细胞比例均明显高于荷瘤模型组(P<0.01);多西他赛联合四君子汤组小鼠脾脏CD3+CD8+CD44+CD62L-T细胞比例均明显低于多西他赛组、四君子汤组(P<0.05或P<0.01),CD3+CD8+CD44-CD62L+T细胞比例均明显高于多西他赛组、四君子汤组(P<0.05或P<0.01)。(见表5、图4~5)

图4 各组小鼠脾脏CD3+CD8+CD44、CD62L流式细胞仪门控选择
表5 各组小鼠脾脏CD3+CD8+CD44+CD62L-、CD3+CD8+CD44-CD62L+T细胞比例比较(±s,%)
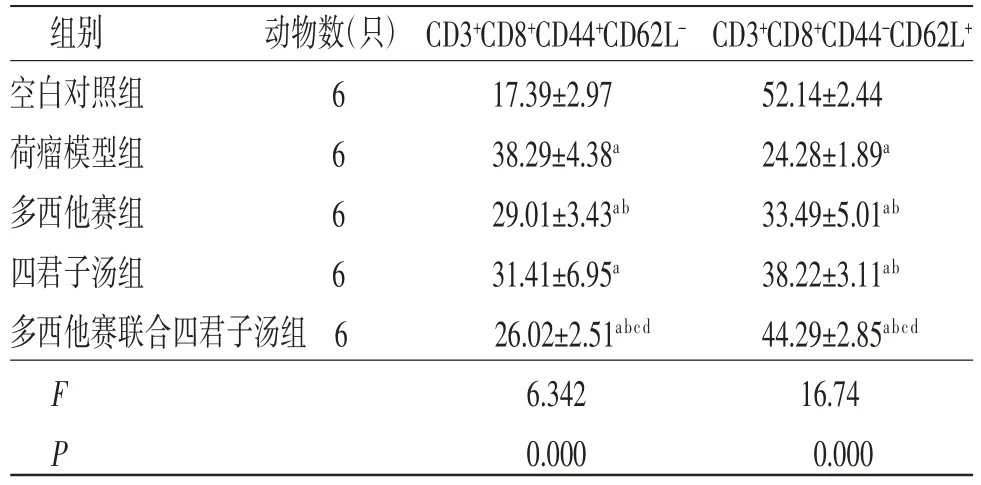
表5 各组小鼠脾脏CD3+CD8+CD44+CD62L-、CD3+CD8+CD44-CD62L+T细胞比例比较(±s,%)
注:与空白对照组比较,aP<0.01;与荷瘤模型组比较,bP<0.01;与多西他赛组比较,cP<0.05;与四君子汤组比较,dP<0.01
组别 动物数(只)CD3+CD8+CD44+CD62L-CD3+CD8+CD44-CD62L+空白对照组 6 17.39±2.97 52.14±2.44荷瘤模型组 6 38.29±4.38a 24.28±1.89a多西他赛组 6 29.01±3.43ab 33.49±5.01ab四君子汤组 6 31.41±6.95a 38.22±3.11ab多西他赛联合四君子汤组6 26.02±2.51abcd 44.29±2.85abcd F 6.342 16.74 P 0.000 0.000
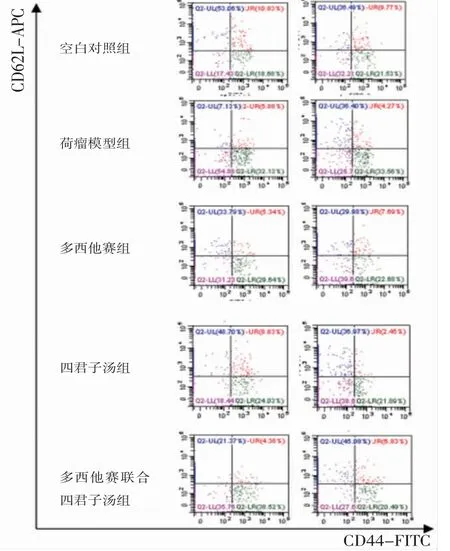
图5 各组小鼠脾脏CD3+CD8+CD44+CD62L-、CD3+CD8+CD44-CD62L+T细胞比较
3.6 各组小鼠血清T淋巴细胞比较荷瘤模型组、多西他赛组、四君子汤组、多西他赛联合四君子汤组小鼠血清CD4+T细胞、CD8+T细胞比例均明显高于空白对照组(P<0.05);四君子汤组、多西他赛联合四君子汤组小鼠血清CD4+T细胞比例均明显高于荷瘤模型组(P<0.05),多西他赛联合四君子汤组小鼠血清CD8+T细胞比例明显低于荷瘤模型组(P<0.05);多西他赛组小鼠血清CD4+T细胞、CD8+T细胞比例均明显低于荷瘤模型组(P<0.05);多西他赛联合四君子汤组小鼠血清CD4+T细胞比例明显高于多西他赛组、四君子汤组(P<0.05),CD8+T细胞比例明显低于多西他赛组、四君子汤组(P<0.05)。(见表6)
表6 各组小鼠血清CD4+T细胞、CD8+T细胞比较(±s,pg/mL)
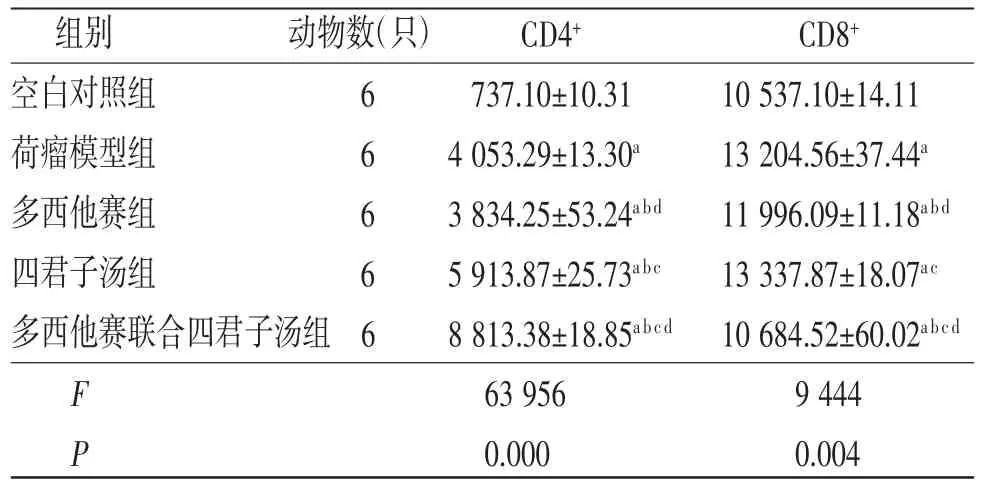
表6 各组小鼠血清CD4+T细胞、CD8+T细胞比较(±s,pg/mL)
注:与空白对照组比较,aP<0.05;与荷瘤模型组比较;bP<0.05;与多西他赛组比较,cP<0.05;与四君子汤组比较,dP<0.05
组别 动物数(只) CD4+ CD8+空白对照组 6 737.10±10.31 10 537.10±14.11荷瘤模型组 6 4 053.29±13.30a 13 204.56±37.44a多西他赛组 6 3 834.25±53.24abd 11 996.09±11.18abd四君子汤组 6 5 913.87±25.73abc 13 337.87±18.07ac多西他赛联合四君子汤组6 8 813.38±18.85abcd 10 684.52±60.02abcd F 63 956 9 444 P 0.000 0.004
4 讨 论
中医药可以辅助恶性肿瘤的治疗,体现在调动免疫系统,缓解化疗药物的副作用等方面。故化疗药物联合中药,可以帮助患者度过免疫系统被抑制的化疗期,提高患者的耐受性[11-12]。中医常用“扶正-活血-解毒”治疗方法,即是中医药治疗肿瘤的精髓[13]。本研究表明多西他赛联合四君子汤具有协同抑瘤作用,这与蒋志明等[14]的研究结果相符。蒋志明等[14]应用加味四君子汤联合奥沙利铂及5-氟尿嘧啶治疗晚期结直肠癌患者,与单纯化疗组患者相比,联合组患者的KPS体力评分量表分数明显升高,瘤体缩小更明显。
淋巴结树突状细胞DCs具有强大的抗原提呈功能,如何调动激活机体DCs,是最近研究免疫抗肿瘤的重点和热点[15]。本研究发现小鼠淋巴结内树突状细胞在CD11c+总数量没有明显变化的前提下,多西他赛联合四君子汤组小鼠淋巴结内CD11c+CD80+、CD11c+CD86+、CD11c+CD80+CD86+细胞表达明显高于多西他赛组。说明四君子汤与多西他赛联合应用,更能有效刺激淋巴结CD11c+CD80+、CD11c+CD86+、CD11c+CD80+CD86+细胞的增殖,增强了其抗原递呈功能,表明DCs更多的转化为成熟DC,抗原递呈功能被明显激活。这与田晋生等[16]的研究相一致,该研究表明当处于IL-4的炎症因子刺激下,小鼠骨髓DCs中CD11c+CD80+、CD11c+CD86+明显升高。徐雪莲等[17]综述发现近年来DCs疫苗已经应用到消化道恶性肿瘤的临床治疗中,DCs疫苗联合化疗,可明显改善结直肠癌患者的预后。
T淋巴细胞的数量变化、T淋巴细胞的功能变化,常与肿瘤的发生、进展高度相关。其中T淋巴细胞亚群又是体内细胞免疫最重要的组成部分,肿瘤内CD8+T细胞的比例越高,其机体抗肿瘤的免疫功能越强。本研究通过对小鼠瘤体T淋巴细胞亚群检测发现多西他赛联合四君子汤组小鼠瘤体CD8+T细胞表达明显升高,CD4+T细胞表达明显降低,优于多西他赛组。说明多西他赛联合四君子汤具有协同作用,缓解了小鼠机体的免疫抑制,提高了小鼠的免疫功能,具有调节T淋巴细胞亚群的作用。这与王婷等[18]的研究结果相一致。王婷等[18]通过分组观察益气复生方联合化疗对胃癌荷瘤小鼠体内肿瘤淋巴细胞CD4+、CD8+的影响,结果发现联合组明显优于单用化疗组。胡喜珍等[19]研究发现肿瘤浸润性淋巴细胞在浆液性卵巢癌中,CD8+T浸润程度与肿瘤的预后成正相关。初始T细胞(Native T cell,Tn)表达CD3+CD8+CD44-CD62L+,抗凋亡能力最强,但杀伤能力最弱,Tn接受抗原刺激后形成效应记忆性T细胞(Effective Memory T cell,Tem)。Tem位于分化终止期,杀伤能力最强,Tem表面表达CD3+CD8+CD44+CD62L-。本研究结果表明,多西他赛联合四君子汤组下调脾脏CD3+CD8+CD44+CD62LT细胞作用最显著;与多西他赛组比较,多西他赛联合四君子汤组小鼠脾脏CD3+CD8+CD44-CD62L+T细胞下调至更接近正常水平。多西他赛联合四君子汤使化疗荷瘤小鼠记忆性T细胞保持在更为原始的状态,从而降低了效应性杀伤性CD8+T细胞的增殖分化。
正常情况下,机体血清CD4+T细胞、CD8+T细胞表达的动态平衡维持正常的免疫功能,一旦比例失调,提示机体的免疫功能减弱[20]。本研究检测了小鼠的血清T淋巴细胞亚群,多西他赛联合四君子汤能明显提高机体辅助性CD4+T细胞、回调CD8+T细胞表达水平,联合应用能够有效提高化疗小鼠机体的免疫功能。有相关研究也提出化疗联合中药化疗效果更好,如陆蓉等[21]研究显示参芪扶正注射液联合多西他赛能上调乳腺癌患者CD3+CD4+T细胞比例,下调CD3+CD8+T细胞比例,联合应用抑制肿瘤更有效,同时有改善化疗后机体的免疫抑制状态。计小清等[22]研究发现四君子汤合当归补血汤能提高化疗小鼠机体自身免疫功能。
综上所述,多西他赛与四君子汤联合应用,能提高RM-1前列腺癌荷瘤小鼠的免疫功能,同时缓解了单用多西他赛的化疗副作用。其机制与调动化疗荷瘤小鼠免疫抑制状态、激活机体免疫功能有关。
