生理状态下小鼠听阈及耳蜗内IL-1β、IL-6、TNF-α、CCL-2和GR mRNA水平昼夜变化的研究
2022-11-05李世昌王梓敬王文伦杨阳韩琳余力生郑宏伟
李世昌王梓敬王文伦杨阳韩琳余力生郑宏伟*
1北京清华长庚医院(北京 102218)
2北京积水潭医院(北京 100035)
3山东大学齐鲁医院(山东 250063)
4北京大学人民医院(北京 100044)
昼夜交替使外界环境呈现出可预测的周期性变化。为了更好的适应外界环境的周期性变化,生物进化出了生物钟,使生物能有预见性的提前调整自身状态,从而增强其对环境的适应性。很多生理现象呈现出以24h为周期的节律性变化,称为昼夜节律。如哺乳动物体内糖皮质激素水平往往在活跃期开始时最高,然后逐渐下降,非活跃期时降至最低,活跃期来临前再次升高,周而复始[1]。生理状态下人体外周血中IL-1β、IL-6和TNF-α等炎症介质的含量在晚上升高,白天逐渐降低[2]。外周血中炎症介质水平昼夜变化可能与人体内糖皮质激素含量的昼夜变化有关,糖皮质激素通过降低外周血中炎症细胞的数量和抑制炎症介质的基因表达水平来影响外周血中炎症介质的含量水平[2,3]。糖皮质激素是临床上治疗内耳疾病(如梅尼埃病、突聋、噪声性聋等)的常用药物[4]。在细胞水平,糖皮质激素通过与糖皮质激素受体(glucocorticoid receptors,GR)结合发挥作用。GR是一种转录因子,存在于细胞质内,与糖皮质激素结合后进入细胞核内,对下游基因的表达产生促进或抑制作用[5],其广泛存在于内耳组织中[6]。有研究发现GR参与调控耳蜗对噪声暴露的敏感程度[7]。炎症反应是多种耳蜗病变的机制之一,如噪声性聋、突聋、老年性聋、梅尼埃病等。IL-1β、IL-6、TNF-α及趋化因子配体2(chemokine(C-C motif)ligand 2,CCL-2)是内耳病理生理研究中关注较多的几种炎症介质[8]。
近年来有研究发现小鼠、大鼠及正常人的听觉惊跳反射幅度均可呈现昼夜差异[9-11]。正常人耳的自发性耳声发射频率和2F1-F2畸变产物耳声发射在一天内也有所变化[12,13]。这在某种程度上说明耳蜗的生理功能也有昼夜差异。且有研究发现动物耳蜗对不同时间相同强度有害刺激(如噪声、耳毒性药物)的敏感性不同[14]。这些现象是否与耳蜗内的炎症介质水平有关,耳蜗内炎症介质水平是否有昼夜变化等问题值得探讨。听性脑干反应(auditory brainstem Response,ABR)是评估耳蜗生理功能常用的检测手段。炎症介质水平的昼夜变化是否会导致ABR指标的昼夜变化。本研究旨在监测正常生理状态下不同时间点小鼠耳蜗内IL-1β、IL-6、TNF-α、CCL-2和GR的mRNA水平,同时监测小鼠ARR阈值ABR及ABR I波幅值和潜伏期,以期探讨小鼠耳蜗这些指标在一天内是否有所变化。
1 材料与方法
1.1 实验动物驯化和分组
选用3周龄雄性C57BL/6J小鼠42只,体重为12~15g,小鼠均无噪声接触史、无中耳炎史,检查动物双侧耳廓反射灵敏,双侧外耳道畅洁,鼓膜完整无充血。并对小鼠行听力检测,听力正常者纳入本研究。由北京维通利华实验动物技术有限公司提供。小鼠驯养在室内灯光模拟昼夜交替变化的动物房内,动物房内完全隔音,开灯时间为6:00,关灯时间为18:00,每30分钟自动通风一次,室内温度保持在23±1°C,相对湿度50~60%。3只小鼠为一笼,驯养2周后开始分组实验操作[15,16]。整个驯化过程中所有小鼠均可自由进食饮水。18:00至次日6:00没有灯光,此段时间有实验操作时用微弱的红光(<1 lux,λ>650 nm)照明。驯养结束后将42只小鼠从1~42编号,随机分为两部分,第一部分36(6×6)只用于在6个时间点被处死取耳蜗做PCR分析,每个时间点6只,第二部分6只小鼠用来在6个时间点行ABR检测。6个时间点为00:00、04:00、08:00、12:00、16:00、20:00。本研究实验方案已得到了北京大学人民医院动物护理和使用委员会的批准(2019PHE072)。
1.2 仪器与试剂
荧光定量PCR仪(Thermo Fisher;7500),Trizol动物总RNA提取试剂(4A Biotech,MRN1101-100),逆转录试剂盒、SYBR Green master mix荧光定量PCR试剂盒(赛默飞A25780),引物由生工生物工程(上海)股份有限公司合成。
1.3 ABR阈值及I波幅值和潜伏期
麻醉前称体重,按照每100g体重0.4ml 10%水合氯醛腹腔注射的方式麻醉小鼠。测听在隔音屏蔽室内进行,室内温度维持在25°C左右。测听过程中,关闭房间内所有的灯,同时关闭两道隔音门。小鼠麻醉满意后,用酒精棉球擦拭针状电极,将参考电极置测试耳耳后皮下,接地电极置对侧耳耳后皮下,记录电极置颅顶正中皮下,调整电极的位置和深度,使电阻小于3KΩ。将给声喇叭置于测试侧外耳道口,不要接触周围皮肤。启动TDT(Tucker-Davis Technologies,美国)设备,逐次启动各模块,系统运行稳定后,打开SigGen/Biosig(Tucker-Davis Technologies,美国)测听软件,实验采用短声(click)和 4k、8k、16k、32k短纯音(tone burst,上升/下降时间1ms,平台 4ms)作为刺激声,带通滤波为300~3000Hz,叠加次数为1024次,扫描时间10ms。刺激声强度从90dB SPL开始依次递减给声,以10dB为步距逐渐递减,直至检测不出重复的ABR波形,再向上递增5dB,直至能检测出重复的II波为止,此刻声强即为听力阈值。收集的实验数据有小鼠在 click、4k、8k、16k、32k各刺激声的ABR阈值以及80dB SPL声强下ABR波形中I波的幅度和潜伏期。ABR中I波由上升波形和下降波形组成,波峰与基线间的差值为I波幅度,潜伏期为刺激声开始到波峰出现的时间长度。
1.4 耳蜗取材及实时荧光定量PCR
依次在00:00,04:00,08:00,12:00,16:00,20:00,每个时间点随机选出6只小鼠脱臼处死后断头,解剖颅骨,并迅速将双侧耳蜗从耳囊中取出,TRIzol分离总RNA,逆转录试剂盒将RNA反转录形成cDNA,扩增目的基因(IL-1β、IL-6、TNF-α、CCL-2、GR)和内参。qRT-PCR反应条件:95°C 5min;95°C 30s,60°C 30s,40个循环。以β-actin为内参来计算不同组别间基因mRNA表达水平的相对差异。所有数据均使用2-△△CT方法进行处理,目的基因引物序列如表1所示。
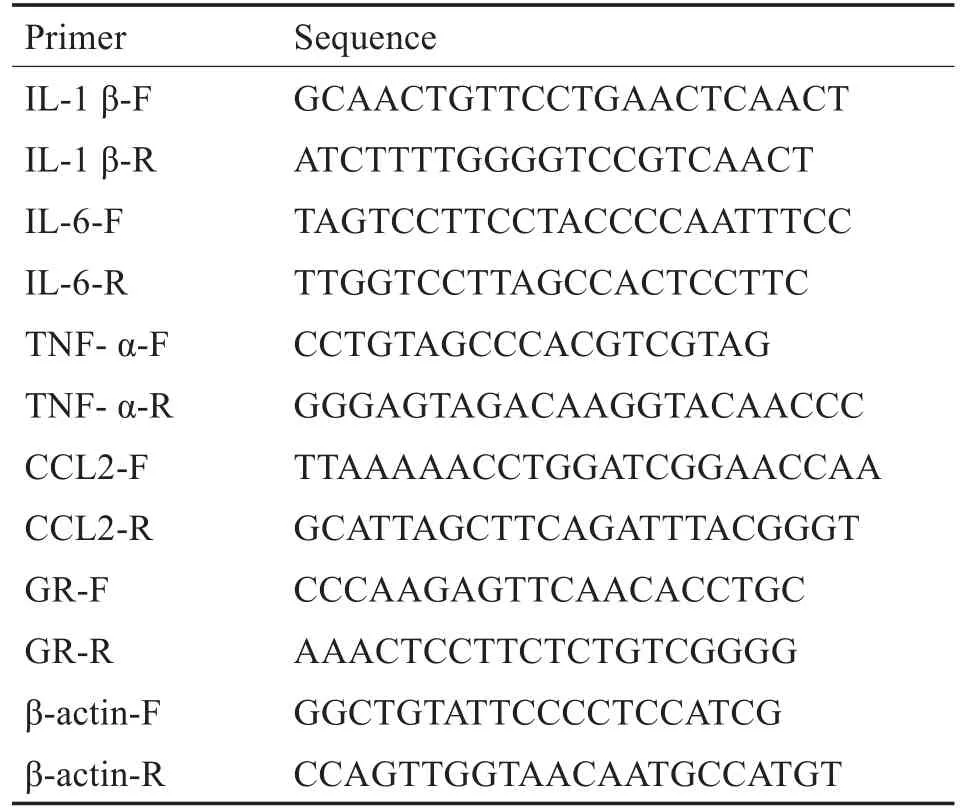
表1 各炎症因子基因引物Table 1 Primers for qRT-PCR
1.5 统计学方法
采用SPSS 21.0(IBM,美国)统计分析软件处理,计量资料用均数±标准差()来表示,采用单因素方差分析,事后检验用Bonferroni’s检验。检测结果P<0.05表示具有统计学差异。经过处理的数据通过Origin 2019b(OriginLab,美国)软件绘图。
2 结果
2.1 生理状态下不同时间点小鼠听阈水平的变化情况
将小鼠驯养在06:00~18:00光照,18:00~06:00黑暗的环境中两周后,事先随机抽取的6只小鼠(12耳蜗)在08:00,12:00,16:00,20:00,00:00,04:00时间点测量click,4k,8k,16k和32k的ABR阈值,如图1所示,各时间点之间ABR阈值无统计学差异。

图1 各时间点ABR阈值无统计学差异(n=12)。Fig.1 The ABR threshold at each time point.There were no statistically significant differences in ABR threshold between different time points.(*P<0.05,**P<0.01,***P<0.001)(n=12)
2.2 生理状态下不同时间点在80dB SPL声刺激下小鼠ABR I波的幅值和潜伏期的变化情况
本研究记录了在08:00,12:00,16:00,20:00,00:00,04:00时间点click,4k,8k,16k和32k在80dB SPL声刺激下诱发的ABR I波的幅值和潜伏期,如图2所示,各时间点各刺激声的ABR I波幅值和潜伏期无统计学差异。

图2 各时间点ABR I波幅值与潜伏期无统计学差异(n=12)。Fig.2 The ABR wave I amplitude and latency at each time point.There were no statistically significant differences in ABR wave I amplitude and latency between different time points.(*P<0.05,**P<0.01,***P<0.001)(n=12)
2.3 生理状态下不同时间点小鼠耳蜗内IL-6,IL-1β,TNF-α,CCL2和GR mRNA相对表达量的变化情况
将小鼠驯养在06:00~18:00光照,18:00~06:00黑暗的环境中2周后,随机抽取小鼠在08:00,12:00,16:00,20:00,00:00,04:00时间点处死,每个时间点抽取6只(12个耳蜗),测试每个时间点小鼠耳蜗中IL-6,IL-1β,TNF-α,CCL2和GR的mRNA相对表达量,结果如图3所示,20:00 IL-1β的mRNA相对表达量与00:00,04:00和08:00相比,有统计学差异(P=0.002,P=0.005,P=0.001),IL-6,TNF-α,CCL2和GR的mRNA相对表达量在不同时间点无统计学差异。

图3 各时间点IL-6,CCL2,TNF-α,GR和IL-1β的mRNA相对表达水平。各时间点IL-6,CCL2,TNF-α和GR的mRNA相对表达水平无统计学差异,在20点IL-1β的mRNA相对表达水平明显高于0点、4点和8点的表达水平(P=0.002,P=0.005,P=0.001)。(*P<0.05,**P<0.01,***P<0.001)(n=72)Fig.3 The relative mRNA expression of IL-6,CCL2,TNF-α,GR and IL-1β in the cochlea at each time point.There were no statistically significant differences in the relative mRNA expression of IL-6,CCL2,TNF-α and GR between different time points.While,the relative mRNA expression of IL-1β at 20 o'clock increased significantly compared with that at 0 o'clock,4 o'clock,8 o'clock(P=0.002,P=0.005,P=0.001),(*P<0.05,**P<0.01,***P<0.001)(n=72)
3 讨论
有研究发现正常人耳声发射的频率在24h内会发生变化[12,17]。正常大鼠、小鼠和人类的听觉惊跳反射幅度有昼夜差异[9,10]。这些现象均说明在正常生理状态下耳蜗和毛细胞的生理功能并不是恒定不变的。除了这些现象之外,生理状态下耳蜗其他生理功能或指标是否也有波动,如ABR,这些指标的波动是否与耳蜗内炎症介质水平有关?
本研究监测生理状态下24h内不同时间点小鼠ABR阈值及ABR I波幅值和潜伏期的变化特点,同时用实时荧光PCR的方式检测小鼠耳蜗内常见炎症介质 IL-1β,TNF-α,IL-6,CCL-2和 GR 的mRNA相对表达量变化情况。结果发现虽然不同时间点小鼠ABR阈值及I波幅值和潜伏期存在变化,但变化幅度不大,均无统计学差异。早在1992年,Chabot就通过听觉惊跳反射探索了大鼠一天之内听阈的变化情况,因当时条件所限,只能测量0kHz和40kHz两个频率的听力水平,没有发现听力阈值有昼夜变化[18]。本研究中用ABR替代了当时的测量方法,测量频率更广,测量方法更客观准确,但仍未发现听力水平有昼夜差异。虽然Harrison[19]研究的主要目的不是探讨小鼠生理状态下不同时间点听力阈值变化情况,但在噪声暴露前小鼠一天内不同时间点的ABR阈值亦无统计学差异。ABR I波的幅值与潜伏期是反应动物听觉神经功能的重要指标,尤其与带状突触的数量和功能密切相关[20,21]。本研究中I波的幅值与潜伏期也无明显昼夜变化。说明这些电生理指标本身可能不受昼夜节律影响。但也可能是因为这些指标的昼夜差异过小,超出了ABR的分辨范围;虽然听觉惊跳反射和耳声发射的昼夜变化说明耳蜗和毛细胞的生理功能有昼夜变化,但ABR阈值是耳蜗、蜗神经及中枢共同作用的结果,不除外耳蜗本身感音功能存在昼夜差异,但中枢的调控补偿了耳蜗功能的昼夜差异,因为在活跃期和非活跃期,动物均需敏锐察觉周围环境的声音变化,及时识别危险信号。
因哺乳动物体内糖皮质激素含量的昼夜变化,使许多组织或器官的生理指标呈现出昼夜节律性变化。如外周血中白细胞数量及分类、炎症介质、淋巴细胞和自然杀伤细胞的活性等[22-24],以及唾液、汗液、泪液、脑脊液和尿液中炎症介质的含量[3,25-30]。有研究发现动物脑组织中IL-6,IL-1β和TNF-α的mRNA含量存在昼夜差异[31,32]。不同脑区这些炎症介质含量的昼夜变化在调控动物睡眠/觉醒和进食等生理功能中有重要作用[33]。现已证明耳蜗并非免疫豁免器官,耳蜗内的炎症反应参与多种内耳疾病(如噪声性聋、突聋、梅尼埃病和老年性聋等)的发生和发展[34-37]。IL-6、IL-1β、CCL-2 和TNF-α是耳蜗内研究较多的炎症介质。IL-6是一种重要的炎症介质,多种有害刺激均可使组织内IL-6表达量增加。IL-6可使免疫系统从稳定状态转向炎症状态[38]。IL-6可介导趋化因子的表达,尤其是CCL-2,CCL-2是炎症细胞重要的趋化因子,能使外周血巨噬细胞、单核细胞等炎症细胞向炎症部位聚集[39]。Wakabayashi发现IL-6受体拮抗剂可减轻噪声暴露后小鼠耳蜗内炎症细胞浸润程度,并减轻听力下降程度[40]。IL-1β参与多种疾病的病理生理如肿瘤血管生成、类风湿关节炎、骨关节炎和糖尿病等[41]。IL-1β受体阻断剂已成为治疗相关疾病的重要突破口。耳蜗内IL-1β表达量的增加参与毛细胞的凋亡过程[42]。CCL-2是启动炎症反应的关键因子之一,通过与其膜受体结合,使单核细胞和巨噬细胞向炎症部位迁移[43]。CCL-2参与多种炎症相关疾病的演化和进展,如动脉粥样硬化、关节炎和癌症等[43]。有研究发现,敲除CCL-2基因的小鼠会有严重听力下降[44]。糖皮质激素广泛应用于突聋、耳鸣、梅尼埃病、噪声性聋和内耳免疫性疾病的治疗[7]。糖皮质激素与其受体结合后通过稳定细胞膜和抑制炎症介质的表达发挥强大的抗炎作用。GR是一种转录因子,存在于细胞质内,与糖皮质激素结合后进入细胞核内,对下游基因的表达产生促进或抑制作用[5]。在耳蜗内毛细胞、支持细胞、螺旋韧带、螺旋神经节和血管纹均有GR的表达[7]。有研究发现应激反应或噪声刺激均能使耳蜗内GR表达量下降[45,46]。糖皮质激素对听觉系统的作用受GR数量、活性的影响[7]。炎症介质在神经系统的生长发育中有重要作用,并在耳蜗发育及功能维持方面有重要作用[44,47]。本研究发现正常状态下,小鼠耳蜗内有IL-1β,TNF-α,IL-6,CCL-2和GR mRNA的基础表达,在24h内,小鼠耳蜗内TNF-α,IL-6,CCL-2和GR的mRNA表达量变化无统计学差异,而IL-1β的mRNA表达量在20:00时明显高于00:00 04:00和08:00,结果有统计学意义。对耳蜗组织的转录组学分析发现,80%与免疫和炎症相关的基因在耳蜗内可固定表达[48]。如图3所示,随着小鼠进入活跃期,IL-1β的mRNA表达量逐渐下降。这可能与小鼠体内肾上腺皮质醇酮的昼夜变化有关,因小鼠为夜行性动物,昼伏夜出,体内肾上腺皮质醇酮的变化趋势与人类相反,即白天含量低,晚上含量逐渐升高[49]。IL-1β的mRNA表达量变化会滞后于肾上腺皮质醇酮的变化趋势,因此IL-1β的mRNA表达量在20:00时最高,随后迅速下降,总体呈现出夜间降低,白天升高的变化趋势。我们推测,高水平的mRNA含量可能对应更多的IL-1β储备量,受到有害刺激后可激发更快更强的炎症反应。多位学者发现在非活跃期,大鼠耳蜗对耳毒性药物更敏感[14,50,51]。这可能是耳蜗对有害刺激昼夜敏感性有差异的原因之一。
本研究也存在一定的局限性,如只是从IL-1β,TNF-α,IL-6,CCL-2和GR的mRNA水平进行了评估,我们没有从这些炎症因子蛋白水平上进一步验证。这将是我们下一步研究的内容之一。
