以水稻秸秆为基质里氏木霉产酶条件优化
2022-11-05曹雅淇白光剑文晓霞
李 韬,曹雅淇,邹 伟,白光剑,文晓霞
(四川轻化工大学 生物工程学院,四川 宜宾 644005)
水稻秸秆是世界三大农作物秸秆之一,其主要成分为纤维素、半纤维素、木质素[1]。水稻秸秆结构独特,生物质顽抗性很强,结晶度高,难以直接利用,每年有大量的秸秆资源被浪费,水稻秸秆的资源化利用逐渐被社会重视起来[2]。研究发现,通过微生物降解的方法可以将木质纤维素中的能源逐步释放出来,将能得到绿色无害的可持续资源[3]。以木质纤维素为原料、以微生物为工具,将木质纤维素中的生物质能逐步导出,使其流向有价值的方向,被称为木质纤维素的生物炼制,是木质纤维素资源化利用中最有前景的新方向,而木质纤维素的糖化是其中的重要领域和关键环节[4-5]。
纤维素酶是由多种水解酶组成的一个复杂酶系,是在各种酶组分协同作用下,能降解纤维素,使之变成纤维寡糖、纤维二糖和葡萄糖的复合酶,主要由外切β-葡聚糖酶、内切β-葡聚糖酶和β-葡萄糖苷酶等组成,还有很高活力的木聚糖酶。纤维素酶被称为木质纤维素糖化的发动机,获取低成本高酶活的纤维素酶是木质纤维素糖化工业化持续发展的关键因素。纤维素酶属于诱导酶,是微生物体内的一种“智能酶”,受到多重调节机制影响[6]。通常在自然发酵的状态下,没有纤维素底物的存在时,微生物不合成纤维素酶;当环境中有纤维素碳源且其他碳源不足时,才会合成纤维素酶,水解纤维素产糖[7-8]。当环境中可发酵糖类充足时,纤维素酶的合成受到抑制,这些都为提高纤维素酶的产量带来了阻碍[9]。
丝状真菌是生产纤维素酶的主要微生物菌株,其中包括木霉菌、曲霉菌和青霉菌,特别是里氏木霉(Trichoderma reesei)及其相关的菌株。它具有降解天然木质纤维素的3种酶,即内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶,所产生的纤维素酶系统完整,遗传性状稳定,抗代谢抑制能力强,生产的酶活性高,易于提取和纯化,并且该菌株安全无毒[10]。
因此,本研究为了提高纤维素酶生产效率,以里氏木霉(Trichoderma reesei)为研究对象,对水稻秸秆进行糖化试验。采用单因素试验及响应面试验对产酶培养基进行优化,采用单因素试验对里氏木霉的酶解条件进行优化,旨在优化其糖化效果,提高秸秆的资源化利用。
1 材料与方法
1.1 材料与试剂
1.1.1 材料和菌株
预处理水稻秸秆:参考白光剑等[11]方法进行预处理;里氏木霉(Trichoderma reesei)CICC41027:中国工业微生物菌种保藏管理中心。
1.1.2 化学试剂
蛋白胨、酵母粉、尿素(均为生化试剂):北京奥博星生物技术有限责任公司;(NH4)2SO4、MgSO4·7H2O、KH2PO4、FeSO4·7H2O、吐温-80、羧甲基纤维素钠(carboxyl methyl cellulose-Na,CMC-Na)、蔗糖、葡萄糖、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(均为分析纯):成都市科隆化学品有限公司。
1.1.3 培养基
秸秆发酵培养基[11]:预处理水稻秸秆20 g/L、蛋白胨2 g/L、MgSO4·7H2O 0.5 g/L、KH2PO42 g/L、吐温-80 0.5 mL/L、FeSO4·7H2O 0.002 g/L、微量元素液10 mL/L,pH自然6.0~6.5。121 ℃灭菌20 min。
1.2 仪器与设备
HZ150L多功能培养摇床:上海沪奥明科学仪器有限公司;SHZ-82恒温振荡器:宁波市鄞州华丰仪器厂。
1.3 方法
1.3.1 里氏木霉发酵培养基优化
(1)单因素试验
氮源选择:在初始秸秆发酵培养基的基础上,选择不同的氮源(2 g/L):蛋白胨、(NH4)NO3、(NH4)2SO4、酵母粉、麸皮、尿素。设定初始发酵条件为培养温度28 ℃、接种量5%、初始pH 6.5、摇床转速120 r/min、发酵时间5 d。考察不同氮源对羧甲基纤维素钠酶活(carboxyl methyl cellulose-Na activity,CMCA),滤纸酶活(filter paper activity,FPA)和β-葡萄糖苷酶活(β-glucosidase activity,BGA)的影响。
碳源选择:在初始秸秆发酵培养基的基础上,以(NH4)2SO4为氮源,选择不同的碳源:麸皮、预处理水稻秸秆段、CMC-Na、蔗糖、葡萄糖。发酵条件同上,考察不同碳源对CMCA、FPA和BGA的影响。
(2)响应面试验
①Plackett-Burman试验
在单因素试验基础上,以预处理水稻秸秆、(NH4)2SO4添加量、MgSO4·7H2O、KH2PO4、吐温-80、FeSO4·7H2O及微量元素液添加量为自变量,纤维素酶活为响应值,每个因素取2个水平,筛选出对CMCA、FPA和BGA影响较为显著的因素。Plackett-Burman(PB)试验法优化培养基成分设计见表1。

表1 Plackett-Burman试验设计因素与水平Table 1 Factors and levels of Plackett-Burman experiments design
②最陡爬坡试验
根据PB试验的结果,选出主要影响因素,根据主要因素的最速上涨路径与变化步长,如果系数为正,则该因素水平增加,反之就递减;再按照各因子响应值的大小来确定变化步长,能够快速、有效地贴近最佳值区[12]。
③Box-Benhnken试验
根据最陡爬坡试验的结果,确定显著影响因素和相应因素的响应面中心值,选取预处理水稻秸秆(X1)、KH2PO4(X2)、吐温-80(X3)3个因素设计响应面试验,并以滤纸酶活(Y)为响应值,并用Design-Expert8.0.6软件进行Box-Benhnken试验设计,Box-Benhnken试验因素与水平见表2。

表2 Box-Benhnken试验设计因素与水平Table 2 Factors and levels of Box-Benhnken experiments design
1.3.2 发酵条件优化
以优化后的培养基为基础,设置250 mL锥形瓶装液量40%,分别在不同发酵温度(24 ℃、26 ℃、28、30 ℃、32 ℃、34 ℃),不同初始pH(3.0、3.5、4.0、4.5、5.0、5.5、6.0、7.0、8.0),不同接种量(2.5%、5.0%、7.5%、10.0%、12.5%),不同转速(90 r/min、120 r/min、150 r/min、180 r/min、210 r/min),不同发酵时间(2 d、3 d、4 d、5 d、6 d、7 d、8 d、9 d、10 d)条件下,分别考察发酵温度、发酵时间、接种量及转速对里氏木霉产酶的影响。
1.3.3 分析检测
还原糖测定:参照国标GB/T 5009.7—2008《食品中还原糖的测定》中的DNS法[13];纤维素酶活(CMCA、FPA和BGA)测定:参照中华人民共和国能源行业标准NB/T 13005—2016《用于生物燃料乙醇制备的纤维素酶酶活力测定方法》[14]。
羧甲基纤维素钠酶活定义:在50 ℃、指定pH值条件下(酸性纤维素酶pH=4.8,中性纤维素酶pH=6.0),水解羧甲基纤维素钠底物,以每分钟降解产生出相当于1 μmol葡萄糖所需要的酶量为1个酶活力单位(U/mL)。
羧甲基纤维素钠酶活计算公式如下:

式中:X为羧甲基纤维素钠酶活,U/mL;c为产生0.5 mg葡萄糖的酶浓度;0.185为转换系数。
滤纸酶活定义:在50 ℃、指定pH值条件下(酸性纤维素酶pH=4.8,中性纤维素酶pH=6.0),以50 mg滤纸为底物,截取在60 min释放2.0 mg葡萄糖当量的还原糖(转化率4%)来计算滤纸活力,以每分钟降解产生出相当于1 μmol葡萄糖所需要的酶量为1个酶活力单位(PFU/mL)。
滤纸酶活计算公式如下:

式中:X为滤纸酶活,PFU/mL;c为产生2.0 mg葡萄糖的酶浓度;0.37为转换系数。
β-葡萄糖苷酶活定义:在50 ℃、指定pH值条件下(酸性纤维素酶pH=4.8,中性纤维素酶pH=6.0),水解纤维二糖(或其结构类似物)为底物,以每分钟降解产生出相当于1 μmol葡萄糖所需要的酶量为1个酶活力单位(U/mL)。
β-葡萄糖苷酶活计算公式如下:

式中:X为β-葡萄糖苷酶活,U/mL;c为产生1.0 mg葡萄糖的酶浓度;0.092 6为转换系数。
2 结果与分析
2.1 里氏木霉产酶培养基的优化
2.1.1 氮源的选择
由图1可知,添加不同氮源的实验组中,蛋白胨组的CMCA最高,为(0.790±0.012)U/mL,其次是(NH4)2SO4组,为(0.720±0.031)U/mL;而BGA在(NH4)2SO4组最高,为(0.120±0.021)U/mL,其次是蛋白胨组,为(0.090±0.011)U/mL。FPA是最能反映酶液的综合酶解能力的指标[6],在6组实验中蛋白胨组和(NH4)2SO4组相当,分别为(0.320±0.022)PFU/mL和(0.310±0.013)PFU/mL,其次是麸皮组,为(0.290±0.015)PFU/mL,酵母粉组为(0.280±0.016)PFU/mL。综合分析6种氮源对里氏木霉产纤维素酶的影响,蛋白胨和(NH4)2SO4最好。蛋白胨是有机碳源,营养丰富,微生物生长快,但成本高,可以作为种子液中的氮源,(NH4)2SO4是小分子无机氮源,易于吸收,价格便宜,可以用作大规模发酵的氮源。因此,选择(NH4)2SO4为发酵培养基中的最适氮源。

图1 不同氮源对里氏木霉产酶的影响Fig.1 Effect of different nitrogen sources on the enzyme production by Trichoderma reesei
2.1.2 碳源的选择
碳源是微生物发酵中最基本的物质,是物质基础和能量基础[15]。由图2可知,其中3种酶活的从大至小的顺序是预处理水稻秸秆、CMC-Na、麸皮、葡萄糖、蔗糖。实验结果符合纤维素酶的合成代谢特点,纤维素酶是一类诱导酶,当环境中有纤维素物质且易利用糖类较少时,纤维素酶合成较多[16]。水稻秸秆段是天然木质纤维素,CMC-Na是类纤维素,麸皮中含有较多的纤维素成分,因此其发酵液中维素酶酶活较高,FPA达(0.400±0.011)PFU/mL、CMCA达(1.080±0.091)U/mL、BGA达(0.110±0.013)U/mL。蔗糖和葡萄糖实验组中所测的FPA和CMCA都很低,其原因可能是蔗糖和葡萄糖都是易被微生物利用的碳源,需要合成纤维素酶。但是也发现葡萄糖实验组中的BGA是5组实验中最高的(0.310±0.022)U/mL,其原因尚不清楚,可能是发酵液较多的葡萄糖通过某种机制激发了BGA,不同碳源对产酶的影响实验可知,纤维素酶的合成需要纤维素的诱导。因此,选择预处理水稻秸秆为发酵培养基中的最适碳源。

图2 不同碳源对里氏木霉产酶的影响Fig.2 Effect of different carbon sources on the enzyme production by Trichoderma reesei
2.2 培养基优化响应面试验
2.2.1 PB试验
水稻秸秆在产酶发酵培养基中可作为碳源,同时又是产纤维素酶的诱导物[17];(NH4)2SO4作为氮源可促进蛋白质的合成[18];KH2PO4为微生物的生长提供磷元素的同时也可作为发酵液pH的缓冲剂[19];MgSO4提供镁元素,是许多酶系的辅助因子和激活剂,FeSO4·7H2O提供铁元素[20];吐温-80能改变细胞膜的通透性,促进纤维素酶分泌到胞外,同时降低菌体结成球[21];微量元素液提供微生物生长所必需的微量元素[22]。培养基中的成分对微生物的生长繁殖及代谢都有重要的影响作用,以FPA为指标,通过PB试验可以找到在一定水平范围内培养基中的成分变化对所检测的结果的影响趋势,从而对发酵培养基进行优化。PB试验结果见表3,采用Design Expert 8.0.6 软件对PB试验各因素进行主效应分析,结果表4。
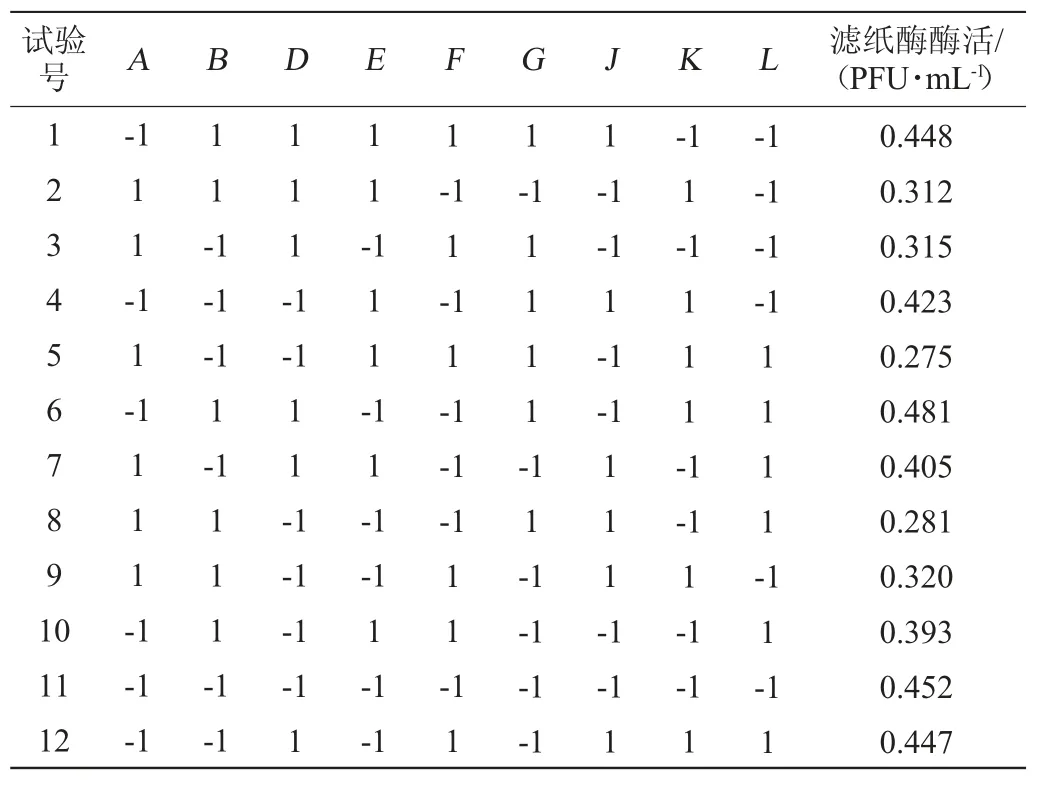
表3 Plackett-Burman试验设计及结果Table 3 Design and results of Plackett-Burman experiments

表4 Plackett-Burman试验各因素主效应分析Table 4 Main effect analysis of each factor of Plackett-Burman experiments
由表4可知,模型的P值=0.006 8<0.05表现为影响显著。其中因素D(KH2PO4)和F(吐温-80)对产酶影响显著(P<0.05),因素A(预处理水稻秸秆)对产酶有极显著影响。因此,选择对产酶影响较大的因素A(预处理水稻秸秆)、D(KH2PO4)、F(吐温-80)进行最陡爬坡试验,为响应面试验确定中心条件。
2.2.2 最陡爬坡试验
根据PB试验的结果,预处理水稻秸秆和吐温-80的t值为负,说明其随添加量呈负效应,KH2PO4的t值为正,其随添加量呈正效应。在最陡爬坡试验设计中,预处理水稻秸秆和吐温-80因素水平增加,KH2PO4因素水平递减。最陡爬坡试验结果见表5。由表5可知,FPA酶活在试验组3时最大,为(0.551±0.013)PFU/mL。因此,选择试验组3为响应面试验的中心条件,即预处理水稻秸秆16 g/L、KH2PO43 g/L、吐温-80 0.6 mL/L。

表5 最陡爬坡试验结果Table 5 Results of the steepest climbing tests
2.2.3 Box-Benhken试验
根据最陡爬坡试验的结果,选取预处理水稻秸秆(X1)、KH2PO4(X2)、吐温-80(X3)三个因素设计响应面试验,并以滤纸酶活(Y)为响应值,并用Design-Expert 8.0.6软件进行Box-Benhnken试验设计,Box-Benhnken试验设计及结果见表6,并对表6试验数据进行多元回归拟合及方差分析,结果见表7。
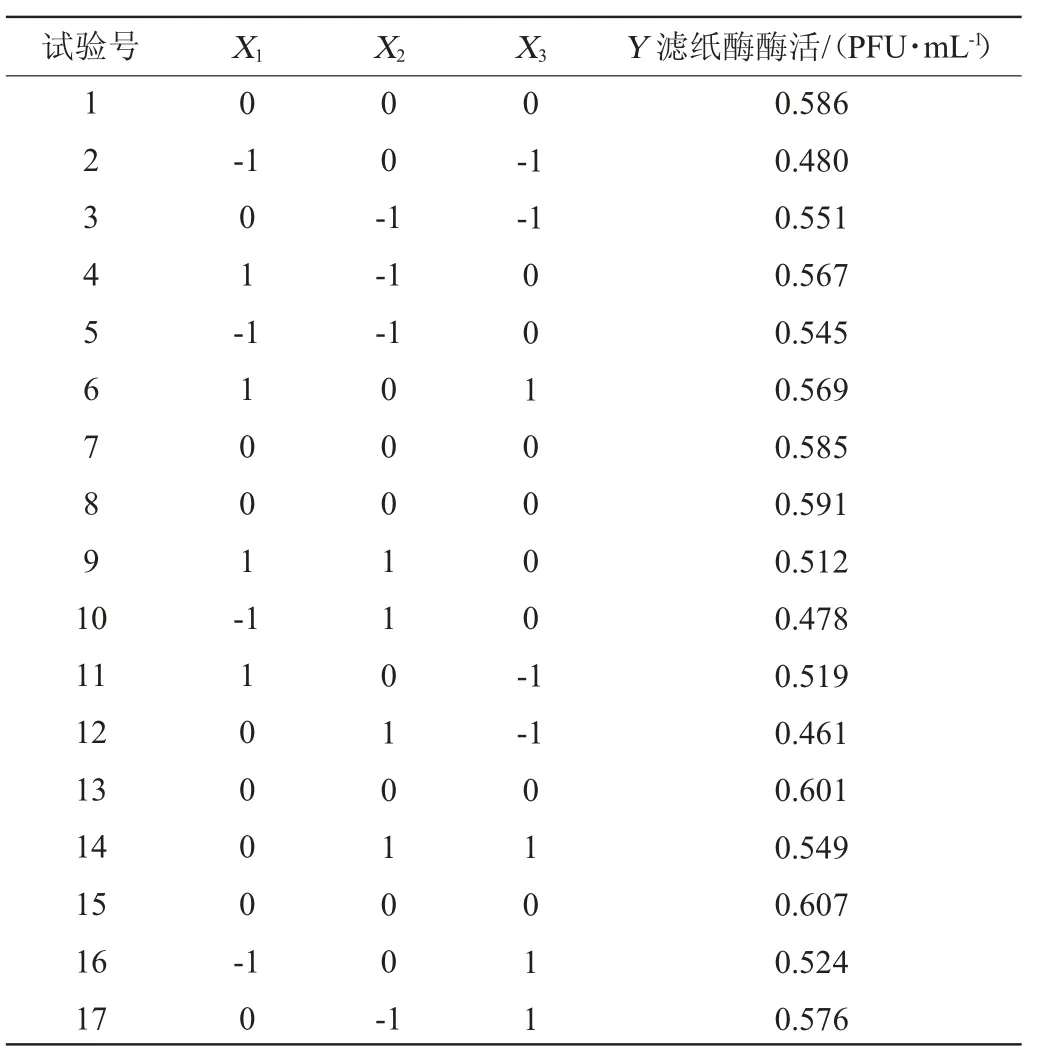
表6 Box-Benhken试验设计及结果Table 6 Design and results of Box-Benhken experiments

表7 回归模型方差分析Table 7 Variance analysis of regression model
采用Design-Expert8.0.6软件对表6数据进行分析,得到模型的回归方程为:

图3 水稻秸秆、KH2PO4及吐温-80添加量对产酶影响的响应面及等高线Fig.3 Response surface plots and contour lines of effect of interaction between rice straw,KH2PO4 and Tween-80 addition on the enzyme production

运用F检验分析模型是否显著,对回归模型进行方差分析,如表7所示,模型P值=0.000 2<0.01,表明模型极显著;失拟项P值=0.853 6,表明回归模型与实际值非常吻合。该模型决定系数R2=0.968 9,调整决定系数R2Adj=0.928 9,表明该模型可信。由F值可知,3个因素对FPA的影响顺序为X1(预处理水稻秸秆)>X3(吐温-80)>X2(KH2PO4)。由P值可知,其中一次项X1,二次项X12、X22、X32对响应值影响极显著(P<0.01);一次项X2、X3,交互项X2X3对响应值影响显著(P<0.05)。经过响应面试验优化过后,得到最优发酵培养基为:预处理水稻秸秆15.3 g/L、KH2PO43.2 g/L,吐温-80 0.47 mL。此优化条件下得到FPA预测值为0.602 PFU/mL。为了便于实际操作,将发酵培养基参数修正为预处理水稻秸秆15.0 g/L、KH2PO43.0 g/L和吐温-80 0.5 mL。在此优化条件下进行3次平行验证试验,FPA实际值为0.612 PFU/mL,与预测值相比,误差为1.66%。与初始培养基相比,FPA由0.401 PFU/mL提高至0.612 PFU/mL,提高了52.6%。
2.3 发酵条件的优化
2.3.1 发酵温度对里氏木霉产酶的影响
温度影响微生物的生长代谢过程从而影响产酶,真菌的最适生长温度为26~34 ℃[23]。
由图4可知,发酵温度在24~29 ℃时,酶活随之升高;在发酵温度29 ℃时,酶活达到最大,为(0.650±0.017)PFU/mL;发酵温度高于29 ℃之后,酶活有所下降。温度对产纤维素酶的影响可能是二重的,一方面温度过高或过低,对产酶微生物的生长代谢造成影响,从而直接影响酶的产量[24];另一方面,真菌纤维素酶的最适酶解温度在40~60 ℃范围内,温度升高,可能有利于增强纤维素酶的酶解效果,提升发酵液中的还原糖含量,从而反馈抑制纤维素酶基因的合成,使发酵液中的纤维素酶活降低。因此,选择最佳发酵温度为29 ℃。

图4 发酵温度对里氏木霉产酶的影响Fig.4 Effect of fermentation temperature on enzyme production by Trichoderma reesei
2.3.2 初始pH值对里氏木霉产酶的影响
由图5可知,初始pH值在3~6时,酶活随初始pH升高而增加;初始pH值为6时,酶活达到最大,为(0.68±0.023)PFU/mL;初始pH>6之后,酶活开始下降。因此,选择最佳初始pH值为6。

图5 初始pH对里氏木霉产酶的影响Fig.5 Effect of initial pH on enzyme production by Trichoderma reesei
2.3.3 接种量对里氏木霉产酶的影响
根据微生物的不同,发酵过程和发酵条件的不同以及所需的代谢产物不同,适宜的接种量有助于提高产物产量[25]。
由图6可知,在接种量为2.5%~5.0%时,酶活随接种量升高而增加;在接种量为7.5%时,酶活最高,为(0.720±0.024)PFU/mL;在接种量>5.0%之后,酶活开始下降。因此,选择最佳接种量为5.0%。

图6 接种量对里氏木霉产酶的影响Fig.6 Effect of inoculum on enzyme production by Trichoderma reesei
2.3.4 转速对里氏木霉产酶的影响
里氏木霉是好氧真菌,发酵液中的氧气含量对微生物的生长代谢有影响[26];里氏木霉发酵过程中会结成小球,不同转速对此有一定影响。由图7可知,转速为90~150 r/min时,酶活随接种量升高而增加;在转速为150 r/min时,酶活最高,为0.78±0.015 PFU/mL;在转速>150 r/min之后,酶活以后开始下降。发酵液过高或过低的转速都会对最终产酶有影响。因此,选择最佳转速为150 r/min。

图7 转速对里氏木霉产酶的影响Fig.7 Effect of speed on enzyme production by Trichoderma reesei
2.3.5 发酵时间对里氏木霉产酶的影响
微生物的发酵过程中不同时间段发酵的主要状态和目的是不同的,因此根据所需要的产物不同其发酵所需的时间也不同[27]。
由图8可知,在里氏木霉的水稻秸秆发酵产酶过程中,发酵时间在1~8 d时,随着发酵时间延长酶活升高;在发酵时间为8 d时,酶活最高,为(1.180±0.011)PFU/mL;在发酵时间超过8 d之后,酶活开始下降。因此,选择最佳发酵时间为8 d。

图8 发酵时间对里氏木霉产酶的影响Fig.8 Effect of fermentation time on enzyme production by Trichoderma reesei
3 结论
选择里氏木霉作为发酵产酶菌株;通过单因素试验及响应面试验对发酵产酶培养基进行优化,得到优化后的产酶培养基为水稻秸秆15 g/L、(NH4)2SO42 g/L、KH2PO43 g/L、MgSO4·7H2O0.5g/L、吐温-800.5mL/L、FeSO4·7H2O0.005g/L、微量元素液10 mL/L。在优化后的培养基的条件下:菌株的FPA由0.401 PFU/mL提高至0.612 PFU/mL,提高了52.6%。优化发酵产酶条件为:发酵温度29 ℃,初始pH 6、接种量5.0%、转速150 r/min、发酵时间8 d。在此优化条件下,酶活为1.12 PFU/mL,提高了83.2%。
