GDY/HMX复合含能材料的热分解动力学和机理
2022-11-04赵宁宁曾见有姚二岗马海霞赵凤起
赵宁宁,曾见有,姚二岗,安 亭,马海霞,赵凤起
(1.西安理工大学 理学院,陕西 西安 710054;2.西北大学 化工学院,陕西 西安 710069;3.西安近代化学研究所 燃烧与爆炸技术重点实验室,陕西 西安 710065)
引 言
在含能材料制造工艺技术及性能优化途径中,添加燃烧催化剂可有效调节含能材料的能量输出特性。HMX具有高爆热(5249kJ/kg),分解后产生大量低分子量气态产物(902L/kg),常用于固体推进剂、炸药和烟火剂[1]。然而,HMX热分解活化能较高,HMX基推进剂燃烧速率控制困难,压强指数高[2]。研究发现,掺杂催化剂能够改变HMX的热分解及燃烧性能。Elbasuney等[3]通过共沉淀技术制备Fe2O3/Al/HMX纳米复合材料,发现Fe2O3(5nm)/Al(100nm)能够使HMX热分解放热量提高53%,分解温度降低13℃,活化能降低24%~30%。Fe2O3(8nm)/Al(80nm)[4]可使HMX放热量提高82%,活化能降低25%。Song等[5]采用超声喷雾干燥技术成功制备Ph-Fe/HMX复合微球。与HMX相比,Ph-Fe/HMX复合微球的分解峰温度和活化能分别降低15.6℃和7.0kJ/mol。Zhang等[6]构建的3D核/壳LaFeO3@MNO2异质结构使HMX热分解峰温降低9.6℃,其催化性能优于LaFeO3。Wang等[7]通过溶剂热辅助原位合成法获得MgWO4-GO纳米复合材料,可使HMX热分解峰温降低15.06℃。He等[8]利用3D打印技术成功设计和制备了梯度结构HMX/Al,并发现通过控制Al和HMX的梯度质量比可调控HMX/Al的燃烧反应及能量输出。
应用于含能材料领域的催化剂繁多复杂,轻质碳材料如石墨、富勒烯、碳纳米管、石墨烯等对HMX热分解影响已有较多报道[9-11]。不同于上述sp2、sp2/sp3杂化碳基材料,石墨二炔(GDY)是一种具有sp和sp2两种杂化态的新型二维全碳同素异形体[12-15],由于其独特的分子结构,使GDY与离子、原子、分子、纳米粒子等多种物质间产生特异性相互作用,表现出卓越的电荷传输能力、独特的传质和能量转换优势[16]。目前,GDY和GDY基复合材料已在催化、太阳能电池、储能、水净化、探测器、传感器、气体分离以及生物医学和治疗等诸多领域显示出其优异性能[17-18]。在含能材料领域,GDY可加快C—N键断裂,从而促进RDX的热分解[19]。GDY在NC热解过程中能够驱动O—NO2键断裂,降低NC热分解能垒,并增加热量释放[20]。以上研究表明,GDY在催化含能材料热分解方面具有潜在应用价值。
为进一步拓展GDY在含能材料领域的应用范围,探讨其对HMX热分解特性的影响,本实验首次运用差示扫描量热法(DSC)和热红质联用技术(TG/DTG-FTIR-MS)研究了GDY/HMX复合含能材料的热行为及催化热分解机制,以期为GDY在含能材料领域的实际应用提供参考。
1 实 验
1.1 原料
石墨二炔(GDY),自制;HMX,西安近代化学研究所。
1.2 GDY/HMX复合物的制备
将GDY与HMX按质量比1∶4研磨混合,得到GDY/HMX复合物。
1.3 样品表征
采用ZEISS Gemini 300型扫描电子显微镜(SEM)对GDY/HMX形貌进行表征,加速电压3kV;采用Thermo Scientific K-Alpha型X射线光电子能谱仪(XPS)对材料表面元素及其化学状态进行分析,X射线源采用Al Kα(hv=1486.6eV),工作电压12kV,灯丝电流6mA,分析室真空度优于5.0×10-7mBar。
1.4 热分解特性测试
采用美国TA公司Q2000型差示扫描量热仪(DSC)进行实验,在动态高纯氮气气氛保护下,测试分析GDY对HMX热分解特性的影响,动态气氛流速为50mL/min,温度范围50~350℃,升温速率15、20、25、30℃/min,参比物为α-Al2O3,试样质量0.20~0.50mg,盛放试样的样品池为铝质坩埚。采用美国赛默飞世尔科技公司TGA-DSC3/IS0/GSD320型同步热重/红外光谱/质谱联用仪(TG/DTG-FTIR-MS)在高纯氩气气氛下(流速为20mL/min)分析GDY/HMX复合物热解气体产物。
2 结果与讨论
2.1 表征分析
采用扫描电子显微镜对GDY/HMX样品进行结构分析,结果如图1所示。图2为GDY、HMX和GDY/HMX的XPS全谱扫描图和 C1s的XPS谱图。

图1 GDY/HMX的SEM图Fig.1 SEM image of GDY/HMX
由图1可知,GDY纳米墙呈三维纳米片阵列结构,其上负载HMX颗粒。GDY网络中苯环间链接双炔键,使其网络框架具有孔隙结构,有助于空气的吸附。由图2(a)可知,在284.5、400.1及532.1eV处出现C1s、N1s及O1s轨道的特征峰,其中,N1s及O1s峰是由于GDY样品暴露在空气中时,空气吸附在其网络结构的孔隙中所致。HMX和GDY/HMX的XPS全谱图均显示存在C1s、N1s及O1s轨道的特征峰。图2(b)GDY的C1s轨道的高分辨图谱表明,284.5、285.3、286.9和288.5eV的4个子峰依次归属于C—C(sp2)、C—C(sp)、C—O和C═O键。sp2和sp杂化碳的计算比例约为2,与GDY的理论组成一致[12]。HMX的C1s图谱显示在284.4eV和287.5eV处出现HMX的C—C和N—C—N的典型特征峰[21]。在GDY/HMX的C1s图谱中出现C—C(284.5eV)、C—C(sp,285.2eV)、C—O(286.1eV)、N—C—N(287.1eV)和C═O(288.5eV)的特征峰,证实GDY与HMX复合。
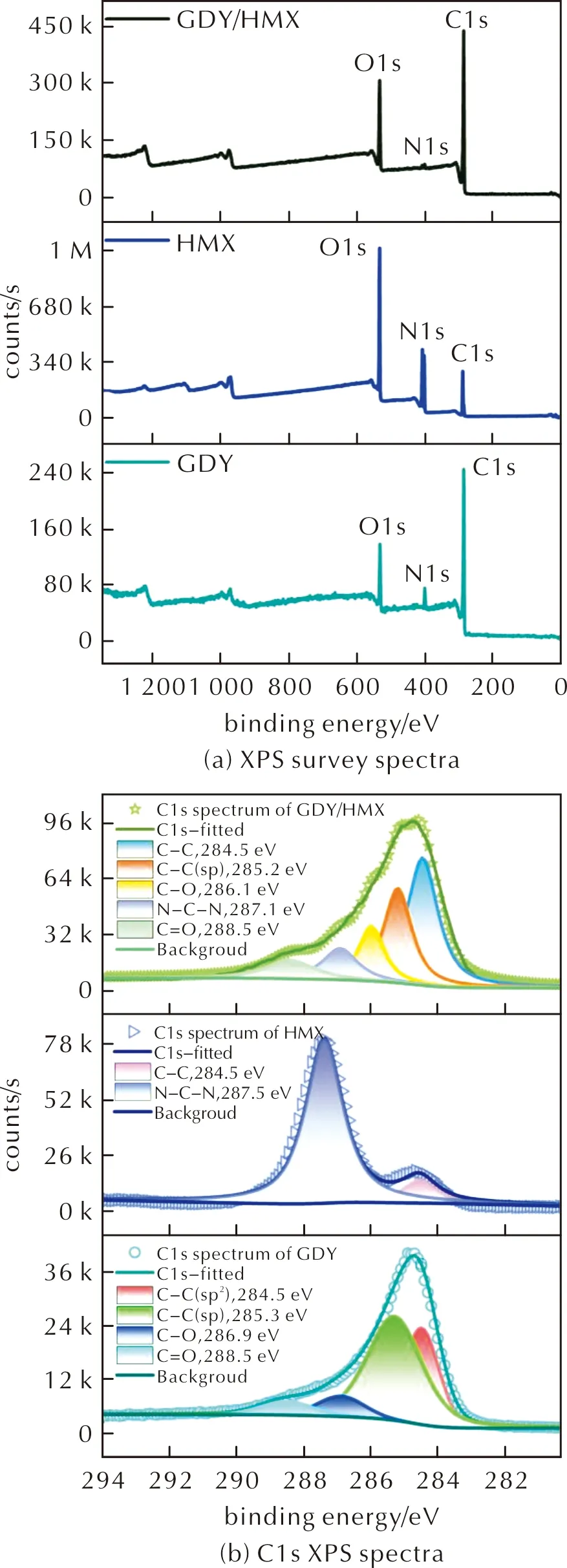
图2 GDY、HMX和GDY/HMX的XPS全谱扫描图和C1s的XPS谱图Fig.2 XPS survey and C1s XPS spectra of GDY, HMX and GDY/HMX
2.2 GDY/HMX热分解行为分析
图3为HMX及GDY/HMX在升温速率15、20、25及30℃/min下的热分解曲线。由图3可知,HMX的熔点在281℃左右,加入GDY后,未使HMX熔化峰温度产生明显偏移,说明GDY对HMX熔化过程影响不大。在升温速率15、20、25及30℃/min下,GDY/HMX热分解峰温度比HMX热分解峰温度依次降低0.8、1.7、2.3、0.1℃,说明GDY可促进HMX的热分解过程。
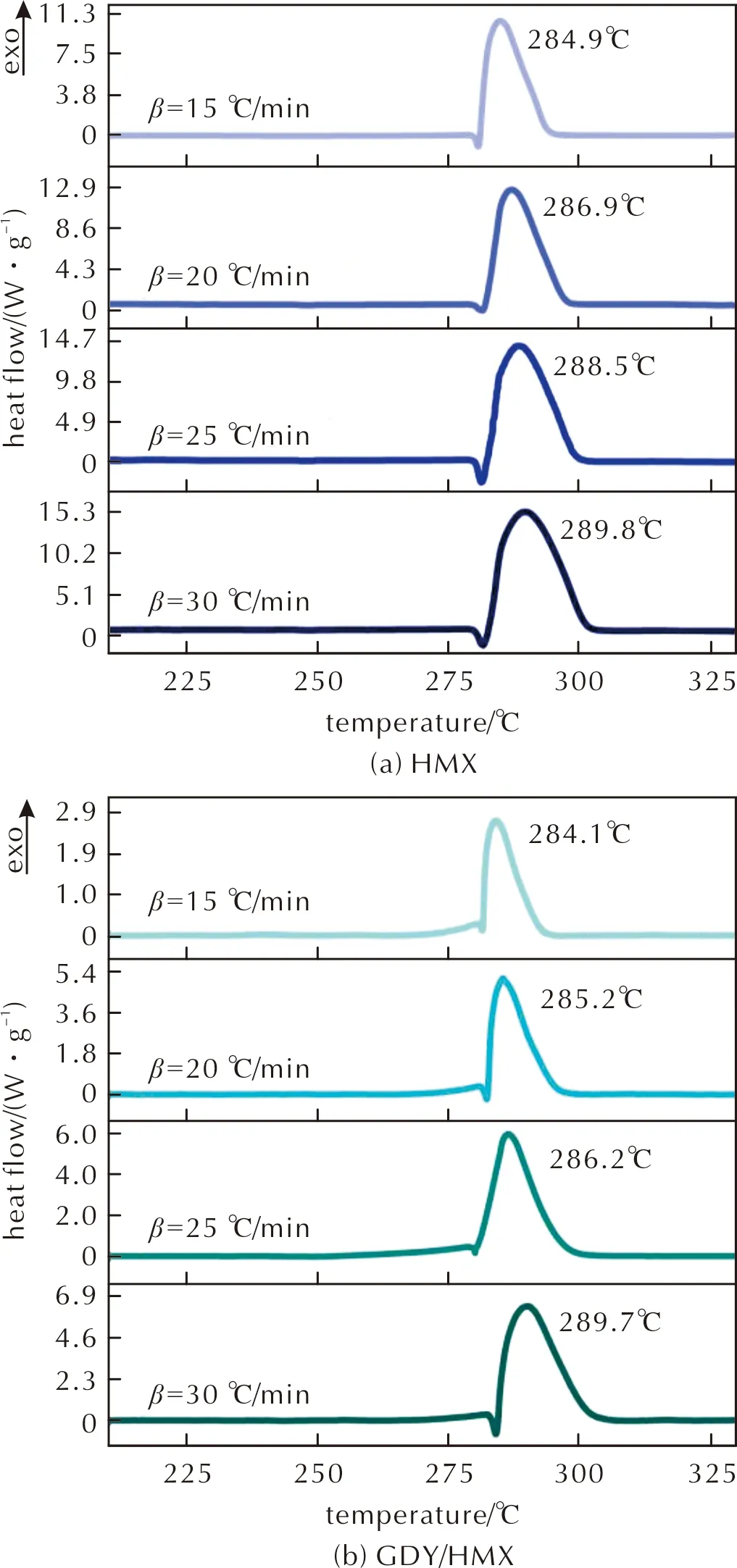
图3 HMX及GDY/HMX在不同加热速率的DSC曲线Fig.3 DSC curves of HMX and GDY/HMX obtained at different heating rates
2.3 GDY/HMX热分解动力学
基于上述HMX和GDY/HMX的热分解峰温及升温速率,通过Kissinger法[式(1)][22]、Flynn-Wall-Ozawa (FWO)法[式(2)][20]、Kissinger-Akahira-Sunose (KAS)法[式(3)][23]、Starink法[式(4)][24]、Kissinger-迭代法[式(5)~式(7)][25]及Ozawa-迭代法[式(6)~式(9)][26]对HMX和GDY/HMX的表观活化能进行计算。
(1)
(2)
(3)
(4)
(5)
(6)
(7)
(8)
(9)
式中:β为升温速率,℃/min或K/min;T为热分解峰温度,℃或K;const为常数项;A为指前因子;R为摩尔气体常数,kJ/(mol·K);E为表观活化能,kJ/mol;G(α)为积分机理函数;H(u)或Q4(u)为u(u=E/RT)的变量。
Kissinger法、FWO法、KAS法、Starink法、Kissinger-迭代法及Ozawa-迭代法计算所得GDY/HMX的表观活化能分别为285.6、280.5、285.6、284.6、285.7和285.7kJ/mol,均低于HMX的表观活化能(359.9、351.1、359.8、358.3、359.9和359.9kJ/mol)。且6种方法计算值相差不大,取平均值可得HMX的表观活化能为358.2kJ/mol,接近文献报道值[27-28]。GDY/HMX的表观活化能为284.6kJ/mol,与HMX相比,GDY/HMX的表观活化能降低了73.6kJ/mol。
为探讨HMX和GDY/HMX热分解动力学机理函数,将常见固相反应遵循的理想动力学反应模型与HMX、GDY/HMX热分解实验物理模型曲线进行对比研究,结果如图4所示,其中,D2、D3为二维、三维扩散模型,F1为单分子衰变定律(瞬时成核和一维生长)模型(Avrami-Erofeev方程,n=1),R2、R3为相界控制反应(收缩面积、收缩体积)模型,L2、L8为随机链断裂模型(L=2、L=8),A2、A3和A4为成核-核生长模型(Avrami-Erofeev方程,n=2、3、4)。
由图4可知,原始 HMX 和GDY/HMX的热分解过程接近于随机链断裂(L2)模型,但与理想L2模型主曲线比较,由实验数据所得HMX和GDY/HMX的反应模型主曲线并不与之完全符合,尤其在转化率小于0.5的范围内,其相关性较差。为获得相关性理想的物理模型,引入修正后的esták-Berggren经验方程[29]对其反应动力学模型进行重建,结果如图4所示,HMX和GDY/HMX热分解机理最终可描述为n级动力学模型,其表达式分别为f(α)=2.97α0.38(1-α)1.15和f(α)=3.04α0.39(1-α)1.17。
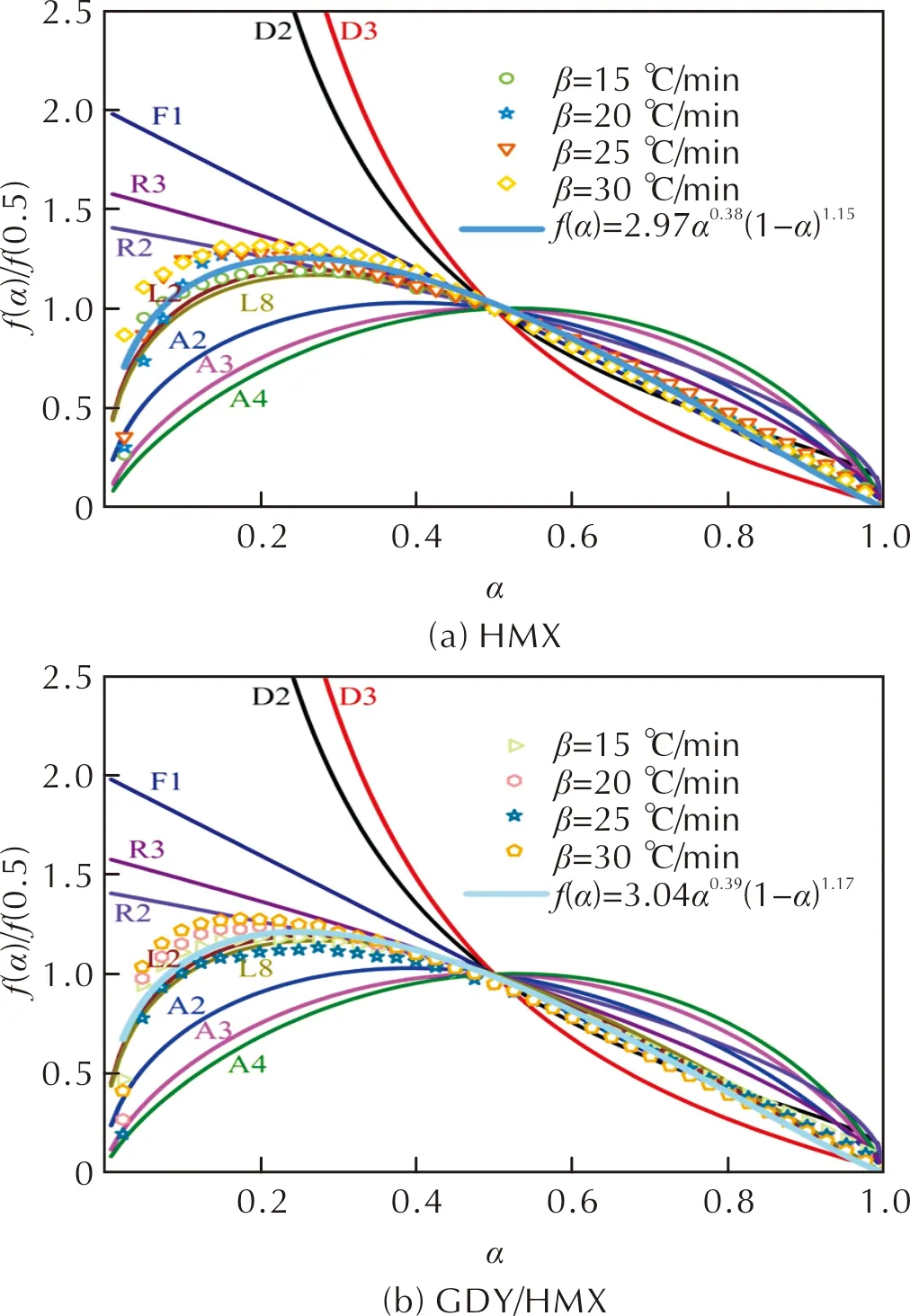
图4 HMX和GDY/HMX反应模型曲线与理想反应模型建立的理论主曲线之间的比较Fig.4 Comparison between normalized curves of the reaction models for HMX and GDY/HMX and theoretical master curves established from the ideal reaction models
2.4 TG/DTG-FTIR-MS分析
采用TG/DTG-FTIR-MS热红质联用技术对比研究HMX和GDY/HMX的热分解过程。图5为升温速率10℃/min时HMX和GDY/HMX的TG/DTG曲线,图6为升温速率10℃/min时GDY的TG曲线。由图5可知,HMX、GDY/HMX热分解峰温分别为284.5℃和281.3℃。将GDY与HMX复合后,GDY/HMX热分解峰温较纯HMX热分解峰温低3.2℃,说明GDY的加入可促进HMX分解。HMX、GDY/HMX热分解过程的最大质量损失分别为97.4%和91.4%,而GDY在284.5℃和281.3℃ 时的质量损失分别为7.8%和7.5%(图6),说明GDY/HMX混合体系的质量损失由HMX和GDY分解两部分所引起。且GDY/HMX混合体系中GDY与HMX质量比为1∶4,若组分HMX完全分解,则其最大质量损失应为80%,而GDY/HMX质量损失为91.4%,故其中至少11.4%由GDY分解所致,又比较图5实验结果可知,在281.3℃ 时GDY的热分解质量损失至少增加3.9%,说明HMX在一定程度上也能促进GDY的分解。
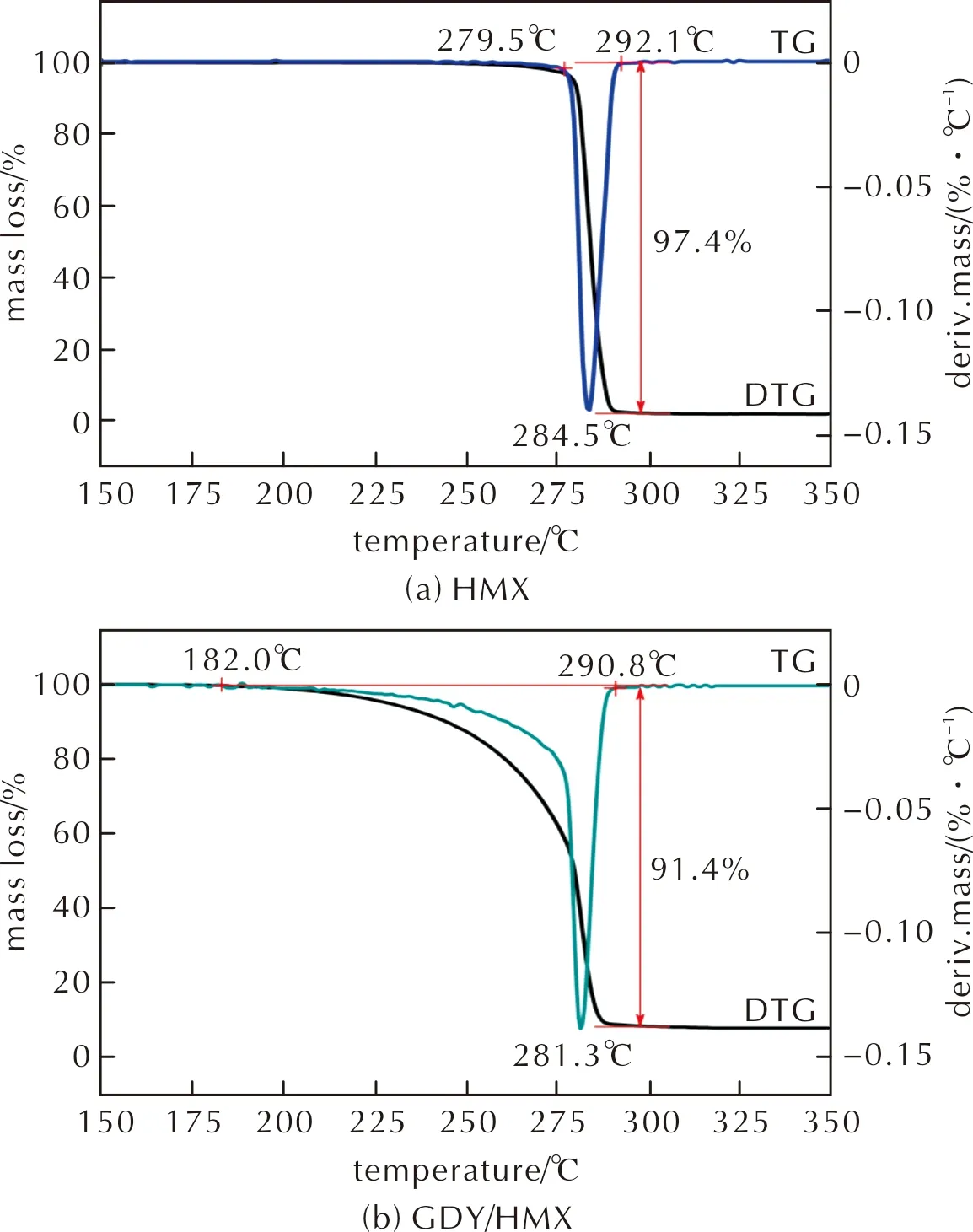
图5 HMX和GDY/HMX的TG/DTG曲线Fig.5 TG/DTG curves of HMX and GDY/HMX
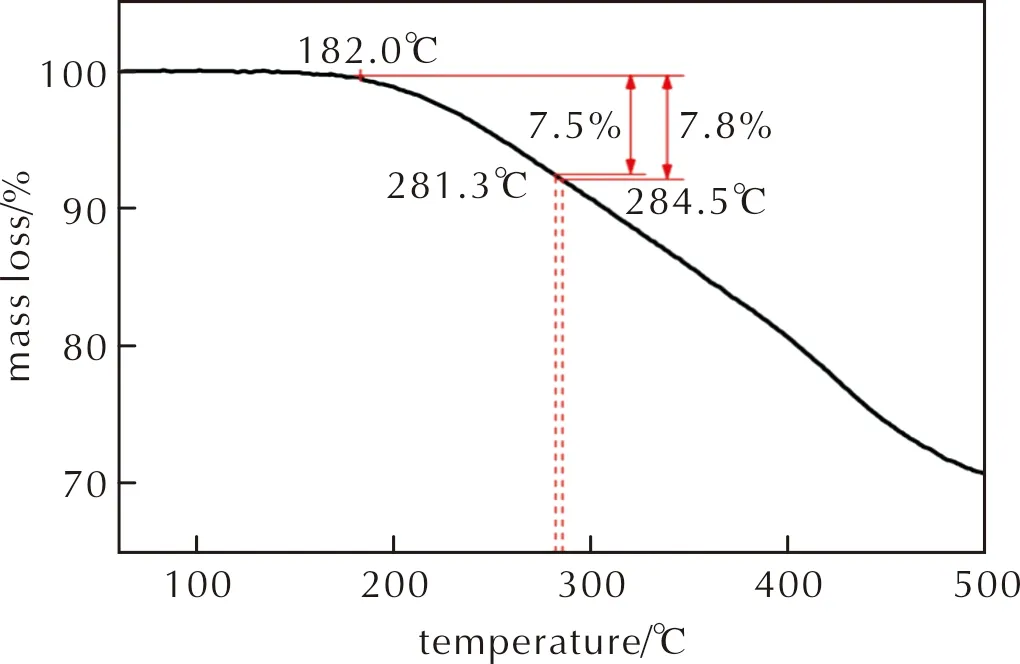
图6 升温速率为10℃/min时GDY的TG曲线Fig.6 TG curve of GDY at a heating rate of 10℃/min
研究表明[30],影响HMX热分解过程的因素众多,如温度、压力、晶型、结构缺陷、粒径、杂质等。总体而言,HMX的初始热分解普遍认为是环C—N键断裂和N—NO2键断裂的竞争过程,两者分别以产物(CH2O+N2O)和[HCN+HONO(H2CN+NO2或H·+NO2+HCN)]为标志[31]。通过实验及理论研究,HMX热分解过程的气体产物为N2O、NO、NO2、CH2O、HCN、CO、N2、CO2和H2O[32-33]。加入纳米金属离子、金属氧化物、盐类等添加剂后,HMX的热解机制会发生变化,分解产物也有所不同。
图7为在170~310℃范围内选取的9个不同温度对应的红外光谱。图8为HMX和GDY/HMX热解产物的3D-FTIR图谱。
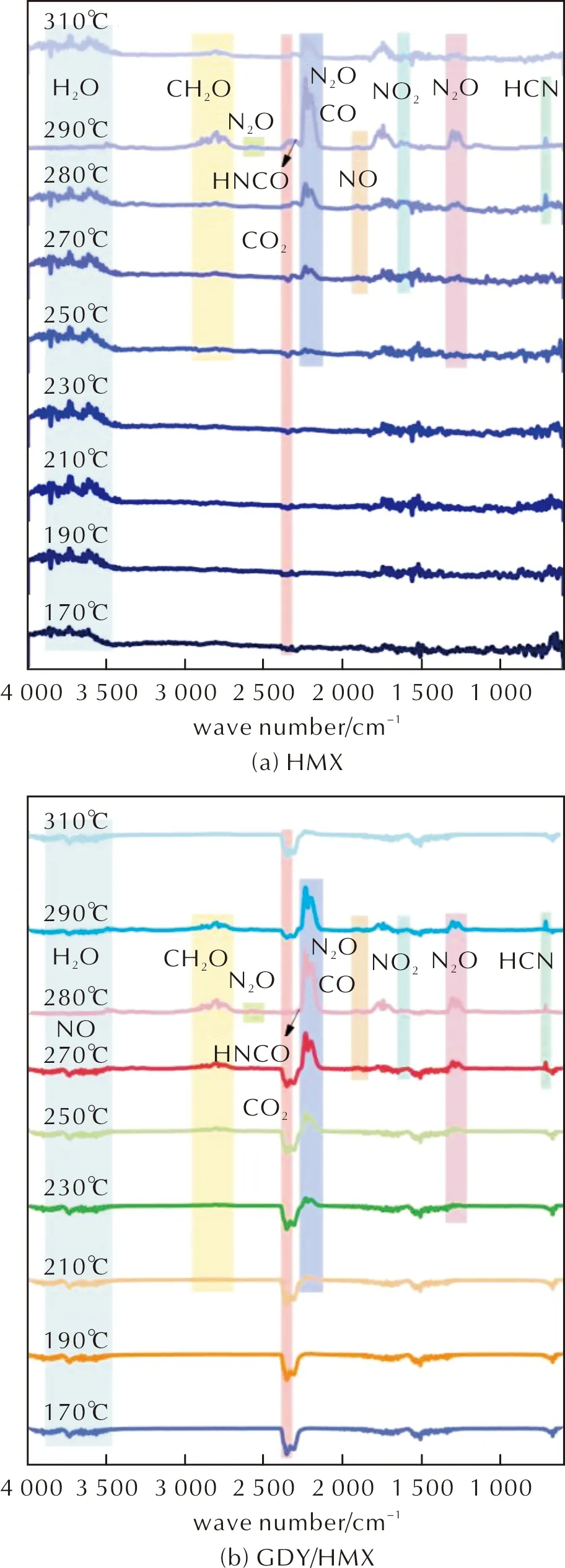
图7 HMX和GDY/HMX热解产物的FTIR图谱Fig.7 FTIR spectra of decomposition products detected during the degradation of HMX and GDY/HMX
图8 HMX和GDY/HMX热解产物的3D-FTIR图谱Fig.8 3D-FTIR spectra of decomposition products detected during the degradation of HMX and GDY/HMX
在HMX、GDY/HMX热分解开始前,两者170℃对应的FTIR图谱显示在3590~3759cm-1处出现H2O的特征吸收峰;在2360和670cm-1处出现CO2特征吸收峰。且发现在210℃和190℃时H2O吸收峰、CO2吸收峰强度无明显变化,由此可确定在HMX、GDY/HMX热分解开始时检测到的H2O、CO2来源于环境,为杂质峰。同时发现,210℃时在2239cm-1处检测到N2O的红外吸收峰。在2813cm-1处检测到CH2O的红外吸收峰,但吸收强度较弱。230℃时,CH2O的红外吸收峰越来越明显,在2239cm-1处的N2O吸收峰强度也逐渐增大,同时在1260~1309cm-1处出现微弱的N2O吸收峰[34]。250℃时,CH2O、N2O吸收峰强度不断增大。至此,H2O、CO2吸收峰强度仍无明显变化,说明GDY/HMX热分解过程在低于250℃时不生成H2O、CO2。对比HMX在190~250℃的红外吸收峰,250℃时检测到N2O的红外吸收峰,而此时CH2O的红外吸收强度非常弱。以上结果说明,HMX和GDY/HMX均首先发生公式(10)所示分解途径且由于GDY的加入,使环C—N键提前断裂。
C4H8N8O8→N2O+CH2O
(10)
为进一步确定HMX的初期热分解为C—N键断裂或是N—NO2键断裂,基于质谱检测结果,绘制HMX和GDY/HMX热分解产物N2O和HCN的离子流强度比随温度的变化关系曲线,如图9所示。图10为HMX和GDY/HMX热解产物的质谱图。由图9可知,分别在HMX起始热分解温度279~290℃、GDY/HMX起始热分解温度182~287℃时,N2O和HCN的离子流强度比大于1,说明HMX或在GDY作用下的HMX分解初期过程是C—N键断裂占优。据文献报道[35],当HMX中添加纳米氧化物TiO2、Fe2O3、Al2O3、SiO2时得到相同结论。
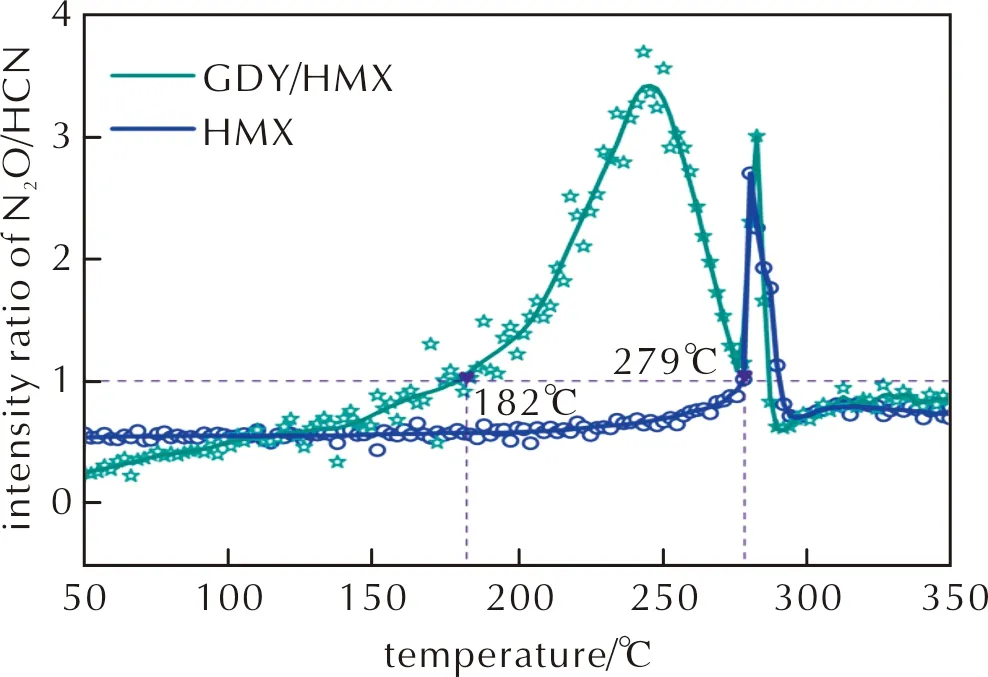
图9 HMX和GDY/HMX热解产物N2O/HCN离子流强度比—温度曲线Fig.9 Ion current intensity radio of decomposition products N2O/HCN vs. temperature curves detected during the degradation of HMX and GDY/HMX
由图7(b)可知,270℃时,除CH2O、N2O外,在717cm-1处检测到明显的HCN吸收峰,在1693~1806cm-1范围内出现微弱的NO吸收峰,还可检测到热解产物NO2(1578~1655cm-1)、CO(2195cm-1)、CO2和H2O。图7(a)显示HMX热解产物HCN出现在280℃,在270℃时检测到CH2O、N2O、NO、NO2、CO、CO2和H2O。其中,CH2O、NO2吸收峰较弱,可能涉及复杂的次级反应[36]:
5CH2O+7NO2→3CO+7NO+5H2O+2CO2
(11)
NO2NO+1/2O2
(12)
根据图7及图8红外检测结果,在577、656、776cm-1未出现HNCO的特征吸收峰,可能出现在1338cm-1和3529cm-1HNCO的吸收峰与N2O、H2O吸收带叠加。对于HMX,图7(a)所示290℃时检测到HNCO的微弱吸收峰,且由图10(a)可知,m/z=43处出现HNCO质子峰。图7(b)显示在280℃时2285cm-1处检测到HNCO的微弱吸收峰,但由图10(b)质谱图所示,m/z=43处并未出现HNCO质子峰。综合FTIR-MS结果,在HMX分解过程中可产生HCNO,而HNCO不是稳定的GDY/HMX热解产物。对于NO2气体,出现类似情况,在图7及图8所示红外谱图中可检测到其吸收峰,在图10(a)中279~290℃范围内m/z=46处出现NO2的特征峰,而图10(b)中m/z=46处无明显NO2特征峰,且检测到CO或N2(m/z=28)、CO2或N2O(m/z=44)、H2O(m/z=18)信号峰。由此推断,HNCO与NO2在GDY催化下可迅速发生以下选择性催化反应[37]:
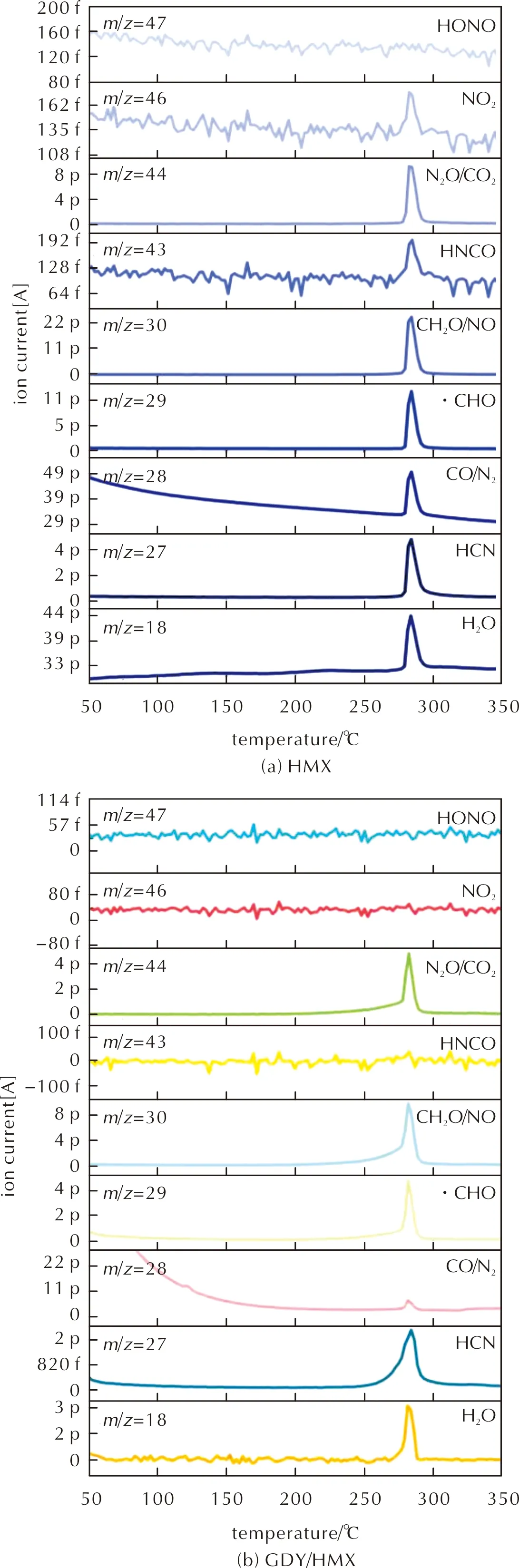
图10 HMX和GDY/HMX热解产物的质谱图Fig.10 Mass spectra of decomposition products detected during the degradation of HMX and GDY/HMX
(13)
CO与N2O红外吸收峰部分重叠,结合图10在m/z=28处的特征信号峰,推测CO是可能的次级分解产物,对比图10(a)和图10(b)m/z=28处的特征信号峰,发现图10(b)中m/z=28处信号峰明显减弱,说明CO份量减少,推测在O2及GDY存在时CO会被氧化:

(14)
可能的反应机理为:GDY上吸附的O2通过Eley-Rideal机制氧化CO,经历O—O键的断裂、亚稳类碳酸盐中间态的形成,最终产生CO2分子[38]。充分体现了具有高比表面积的GDY对CO氧化反应的高催化效率和活性。
另外,HONO也是可能存在的活性物种,其1696cm-1处红外吸收峰可能与NO红外吸收峰重叠。在图10中未出现m/z=47信号峰,其原因为HONO在高升温速率下仅存在几秒钟,此后迅速分解为NO、NO2和H2O[39]:

(15)
290℃时,GDY/HMX热分解过程几近结束,所有气体产物吸收强度均较大程度减小,而NO2吸收峰几乎消失。大于300℃时,分解产物为少量N2O、CH2O和HCN,此时CO2和H2O吸收峰强度与GDY/HMX热分解前游离CO2和H2O吸收峰强度基本一致。结合图5TG/DTG结果,GDY/HMX含能复合物在290.8℃时已结束分解,故上述气体可能由于被GDY薄膜吸附后在高温下脱附所致。
由图10所示GDY/HMX热分解产物的质谱图可知,主要气体产物及自由基包括:H2O(m/z=18)、HCN(m/z=27)、N2或CO(m/z=28)、NO或CH2O(m/z=30)、CO2或N2O(m/z=44)、·C(m/z=12)、·N(m/z=14)、·O(m/z=16)、·OH(m/z=17)、·CN(m/z=26)、·CHO(m/z=29)、·CH2C≡CH(m/z=39)。其中,HMX分子内的·O自由基从—NNO2基转移到—CH2-上,导致C—H 键断裂,并生成CH2O和N2O[40]。由·CH2C≡CH(m/z=39)自由基的产生可能来源于GDY苯环的分解,据本课题组前期研究,在182~300℃范围内,GDY质量损失率约为8.5%[19]。
综上所述,GDY催化作用下,C—N键断裂是HMX的主要热分解途径,伴随着氧转移过程,首先释放出CH2O和N2O气体。并发生复杂的次级反应,进而检测到N2O、NO、NO2、CH2O、HCN、CO、HCNO、N2、CO2和H2O气体(见图11)。
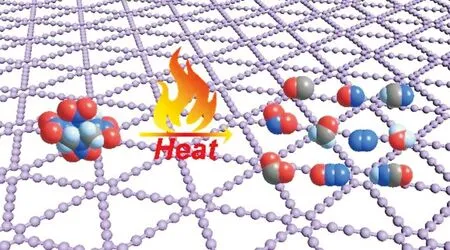
图11 GDY/HMX热解过程示意图Fig.11 Proposed thermal decomposition process of GDY/HMX
3 结 论
(1)基于DSC数据研究了GDY/HMX复合含能材料的热分解过程。与单组分HMX相比,GDY/HMX热分解表观活化能降低73.6kJ/mol,热分解过程接近于随机链断裂模型,其动力学机理函数遵循f(α)=3.04α0.39(1-α)1.17。
(2)TG/DTG-FTIR-MS分析结果表明,GDY/HMX热分解过程首先断裂C—N键,生成CH2O和N2O气体。在GDY催化作用下,伴随发生复杂的次级反应,生成N2O、NO、NO2、CH2O、HCN、CO、N2、HCNO、CO2和H2O气体。
