低温对甘薯淀粉理化特性及代谢关键基因表达量的影响
2022-10-31崔鹏赵逸人姚志鹏庞林江陆国权
崔鹏,赵逸人,姚志鹏,庞林江,陆国权
低温对甘薯淀粉理化特性及代谢关键基因表达量的影响

1浙江农林大学现代农学院,杭州 311300;2山东滨州国家农业科技园区管理服务中心,山东滨州 256600;3浙江农林大学食品与健康学院,杭州 311300
【目的】淀粉是甘薯块根的主要组成成分,淀粉理化特性直接决定着甘薯的主要用途;同时,甘薯是较为典型的喜温作物,对储藏温度较为敏感。因此,研究低温对淀粉理化特性的影响,为甘薯安全储藏提供参考。【方法】本研究以‘烟薯25’和‘商薯19’为试验材料,设置适温(13℃,CK)和低温(4℃)储藏14 d,分析甘薯块根淀粉粒径大小与分布、热焓特性、糊化特性、吸湿性及膨胀力等特征指标的差异。【结果】不同甘薯品种的直链/支链淀粉含量存在显著差异,‘商薯19’的直链淀粉含量(31.47%)显著高于‘烟薯25’(25.86%),支链淀粉则完全相反;‘烟薯25’和‘商薯19’的平均粒径、体积和表面积均分别分布于≤2.50 μm、2.50—5.00 μm和5.00—25.00 μm三个区间,低温胁迫使二者的淀粉颗粒平均粒径降低,体积和表面积减小,吸湿性和膨胀力降低;‘烟薯25’和‘商薯19’薯块淀粉在糊化过程中的起始温度(T0)、峰值温度(Tp)和热晗值(△H)与CK相比均显著下降,其中,‘烟薯25’的△H变化幅度高于‘商薯19’,表明低温对‘烟薯25’淀粉热特性的影响程度高于‘商薯19’;低温储藏条件下,‘烟薯25’和‘商薯19’的最高黏度(PKV)、崩解值(BDV)和回复值(CSV)均显著下降,糊化温度(PT)受低温的影响不显著,但品种间差异显著;低温下,基因(ADP-葡萄糖焦磷酸化酶)、、(淀粉分支酶)和的表达量均显著下降,而(淀粉水解酶)和则显著上升。【结论】温度是影响甘薯淀粉理化品质的重要因素,甘薯块根淀粉理化特性变化与甘薯储藏温度密切相关。
甘薯;低温胁迫;淀粉;理化特性;基因
0 引言
【研究意义】甘薯(L.)是我国第四大粮食作物,中国是世界甘薯产量最高的国家,联合国粮食及农业组织(FAO)统计数据显示,2018年我国甘薯总产量占世界的57%[1]。甘薯以块根为收获物,新鲜薯块含水量高,呼吸旺盛,且收获后通常经过合理贮藏延迟销售以增加农民收入。作为起源于热带的薯类作物,甘薯抗寒能力较弱,对储藏温度较为敏感。淀粉是甘薯块根的主要组成部分,占其干物质量的50%—80%[2-3],淀粉理化特性直接决定着甘薯块根的主要用途[4]。目前我国甘薯储藏多采用冷库和地窖等方式,呼吸作用使淀粉等碳水化合物在储藏过程中被大量消耗,其物理特性在呼吸过程中改变较大。因此,研究低温与淀粉物理特性的关系对甘薯合理储藏具有重大意义。【前人研究进展】研究表明,甘薯直链淀粉含量和膨胀势等对面条品质影响显著[5]。甘薯淀粉的理化特性虽然受遗传因素控制[6],但外界环境、栽培及贮藏方式的影响同样比较重要[7-9],如唐忠厚等[10]研究结果显示,钾元素缺乏改变了甘薯块根淀粉组分及粒径大小,影响甘薯块根淀粉的糊化特性、热特性等理化指标。一般认为,甘薯的最适宜储藏温度为12—15℃,低温储藏可降低甘薯呼吸速率,但贮藏时间会缩短[11]。Li等[12]研究表明4℃储藏28 d可促进甘薯糖化,相似的表型及特征也出现在葡萄[13]及枇杷[14]中。江凌峰等[15]研究结果显示低温贮藏条件下(4℃),甘薯直链淀粉含量有所增加,淀粉溶解度和膨胀势下降,-淀粉酶在淀粉降解过程中起主导作用。(ADP-葡萄糖焦磷酸化酶a)、、(淀粉分支酶I)和被认为是影响淀粉代谢的关键酶基因[16],AGPase是淀粉合成的限速酶,被沉默后,会导致淀粉中直链淀粉的含量显著增加,(淀粉水解酶)和可将淀粉水解为可溶性糖类。【本研究切入点】低温胁迫造成的冷害会导致甘薯生理生化特性发生变化,甚至腐烂霉变,严重影响甘薯品质和经济价值。目前对于甘薯低温的研究主要集中于抵御胁迫和安全储藏技术层面,而低温胁迫对淀粉组成成分、粒径分布、热焓值以及RVA特性等理化性质的影响尚未见报道。【拟解决的关键问题】本研究以‘烟薯25’和‘商薯19’为试验材料,设置适温(13℃)和低温(4℃)储藏14 d,分别测定淀粉的理化特性;同时利用qRT-PCR手段,检测低温下淀粉合成代谢关键基因的表达量变化,为甘薯低温下合理储藏提供理论依据。
1 材料与方法
试验于2021年在浙江农林大学平山大棚试验基地进行。
1.1 试验材料及处理
本研究选取‘烟薯25’(鲜食型)和‘商薯19’(淀粉型)两个甘薯品种,均于2021年4月在浙江农林大学平山大棚试验基地统一常规种植。经120 d后收获,随机选取大小基本一致,无病害病斑薯块,存放于13℃(对照,CK)和4℃(低温low temperature,LT),湿度保持一致,均为80%。储藏14 d后,分别测定不同储藏温度下甘薯块根的淀粉组分、理化性质及合成代谢关键基因的表达量,试验设置3次重复。
1.2 试验方法
1.2.1 淀粉主要化学组分 直链淀粉含量测定参照唐忠厚等[17]的方法;支链淀粉含量测定参照徐锡明等[18]的方法。
1.2.2 淀粉粒径大小与分布 采用激光衍射粒度分析仪(Micromeritics,美国),参照唐忠厚等[10]的方法,测定淀粉粒级分布及粒径大小,每个样品3次重复。
1.2.3 淀粉热焓分析 热焓分析采用差示扫描量热分析仪(Mettler Toledo)测定。参考唐忠厚等[10]的方法,测定吸热曲线上的起始温度(onset temperature,T0)、峰值温度(peak temperature,TP)、终止温度(conclusion temperature,Tc)和热焓变化(enthalpy of transition,ΔH)。
1.2.4 RVA特性测定 RVA特性测定利用Tech-master RVA仪(Perten),参考唐忠厚等[8]的方法。测定指标包括最高黏度(PKV)、热浆黏度(HPV)、最终黏度(CPV)、崩解值(BDV)、回复值(CSV)和糊化温度(PT)等。
1.2.5 吸湿性测定 参考唐忠厚等[10]的方法,淀粉样品过100目筛测定吸湿性。
1.2.6 膨胀力测定 参照RASPER方法[18]并加以改进,以每g淀粉所占体积(mL·g-1)表示淀粉的膨胀力。
1.2.7 qRT-PCR检测基因表达量 称取‘烟薯25’和‘商薯19’两个品种的甘薯块根0.1 g(试验设计及处理同1.1,3次重复),放入液氮中速冻,后迅速磨成甘薯粉末。提取各品种的RNA(RNAprep Pure总RNA提取试剂盒,天根),经反转录获得cDNA。利用qRT-PCR方法分析、、、、和在低温下的表达差异。引物信息见表1。
1.3 数据统计
采用Microsoft Excel 2016和SPSS13.0统计分析与处理数据,Origin 2018作图。
2 结果
2.1 低温对甘薯块根淀粉主要化学组分的影响
甘薯淀粉主要由直链和支链淀粉组成。由表2可知,不同甘薯品种的直链/支链、氮、磷和总脂肪含量存在显著差异,‘商薯19’的直链淀粉含量(31.47%)显著高于‘烟薯25’(25.86%),支链淀粉则完全相反(<0.05)。低温储藏下两个甘薯品种的直链/支链含量相较于对照均略有下降,未达显著水平,品种间达到显著差异(<0.05)。而氮、磷和总脂肪含量在低温储藏条件下则显著上升,处理间和品种间均达到显著差异(<0.05)。

表1 引物信息

表2 低温对甘薯块根淀粉主要组分含量的影响
不同小写字母表示差异显著(<0.05)。下同 Different lowercase letters indicate significant difference (<0.05). The same as below
2.2 低温对甘薯块根淀粉粒径大小及分布的影响
2.2.1 甘薯块根淀粉粒径与体积分布比较分析 淀粉粒大小、粒径分布等是影响淀粉功能特性的重要因素之一。由表3可以看出,‘烟薯25’和‘商薯19’的平均粒径及体积均分布于≤2.50 μm、2.50—5.00 μm和5.00—25.00 μm三个区间,其中80%以上都处于5.00—25.00 μm。在低温储藏条件下(4℃),‘烟薯25’甘薯品种平均粒径≤2.50 μm的百分比显著减少,而‘商薯19’的显著增加(<0.05),增加了3.18%,两个品种平均粒径2.50—5.00 μm的百分比均有所增加,其中‘商薯19’达显著水平(<0.05),增加了2.36%;低温下‘烟薯25’平均粒径在5.00—25.00 μm的百分比显著增加(<0.05),而‘商薯19’则显著减少(<0.05),减少幅度为5.54%。由此推断,‘商薯19’的淀粉粒径大小及体积分布受低温影响的程度高于‘烟薯25’。
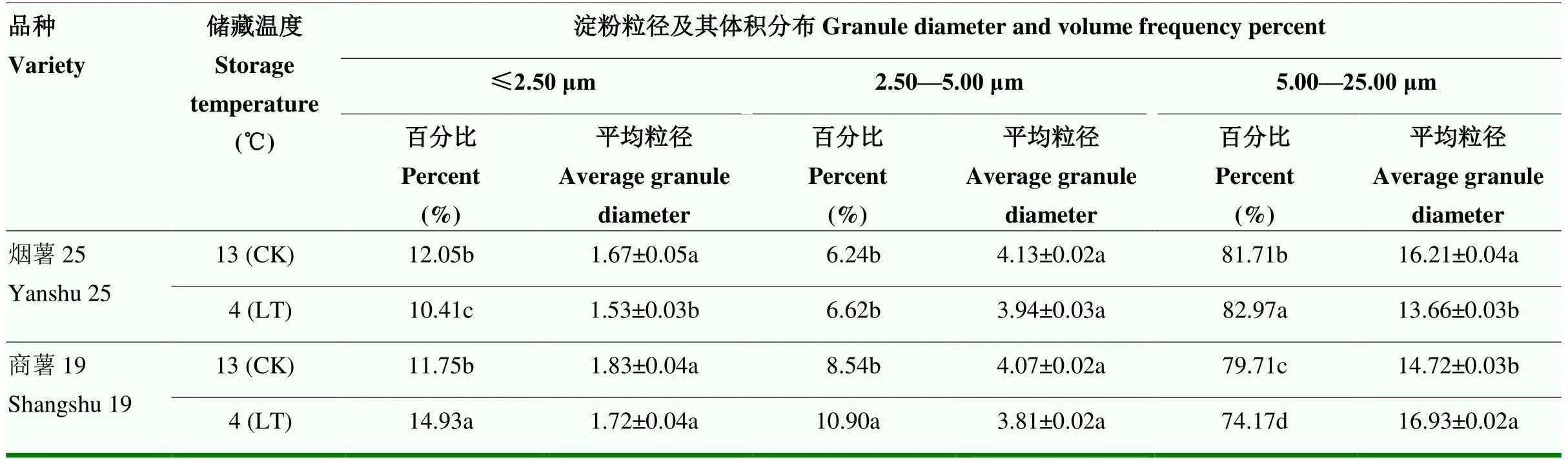
表3 低温对甘薯块根淀粉粒径及其体积分布的影响
2.2.2 甘薯块根淀粉粒径与表面积分布比较分析 两个甘薯品种的平均粒径及表面积分布于≤2.50 μm、2.50—5.00 μm和5.00—25.00 μm三个区间,其中50%以上都≤2.50 μm。在低温储藏条件下(4℃),‘烟薯25’和‘商薯19’平均粒径及表面积的百分比相较于对照(13℃)均无显著性差异,但品种间存在显著性差异(<0.05)。除5.00—25.00 μm外,‘烟薯25’另外两个区间的百分比均显著小于‘商薯19’。≤2.50 μm范围内,‘烟薯25’在4℃储藏下的平均粒径显著增加,‘商薯19’显著减少(<0.05);2.50—5.00 μm范围内,‘烟薯25’和‘商薯19’的平均粒径均显著降低(<0.05);5.00—25.00 μm范围内,‘烟薯25’在低温储藏下的平均粒径显著降低(<0.05),而‘商薯19’则显著增加(表4)。

表4 低温对甘薯块根淀粉粒径及其表面积分布的影响
2.3 低温对甘薯块根淀粉热焓特性的影响
由表5可知,低温处理(4℃)下,‘烟薯25’和‘商薯19’薯块淀粉在糊化过程中的起始温度(T0)、峰值温度(Tp)和热晗值(△H)与CK相比均显著下降(<0.05),应该与淀粉组分变化有一定关联;其中‘烟薯25’的△H高于‘商薯19’,表明低温对‘烟薯25’淀粉热特性的影响高于‘商薯19’;‘商薯19’的Tp在13℃和4℃下均高于‘烟薯25’,但未达显著性差异;‘商薯19’的热焓值△H低于‘烟薯25’,起始温度T0则表现相反,表明‘商薯19’的热稳定性较好;最终温度Tc受低温影响较小,与CK相比未存在显著差异。
2.4 低温对甘薯块根淀粉RVA特性的影响
由表6可知,‘烟薯25’的最高黏度(PKV)、最低黏度(HPV)、崩解值(BDV)和最终黏度(CPV)显著高于‘商薯19’,但回复值(CSV)与糊化温度(PT)低于‘商薯19’,该结果可能与其直链淀粉含量及淀粉粒径大小相关;低温胁迫下,‘商薯19’的PKV最低,PT最高,与淀粉DSC分析结果相一致;温度对PT的影响不显著,但品种间差异显著(<0.05),表明二者更多受基因型控制,其他外界因素影响较小。对比CK储藏条件,低温胁迫使‘烟薯25’和‘商薯19’的PKV、BDV和CSV均显著下降(<0.05),‘烟薯25’的CPV显著上升,‘商薯19’则表现相反。
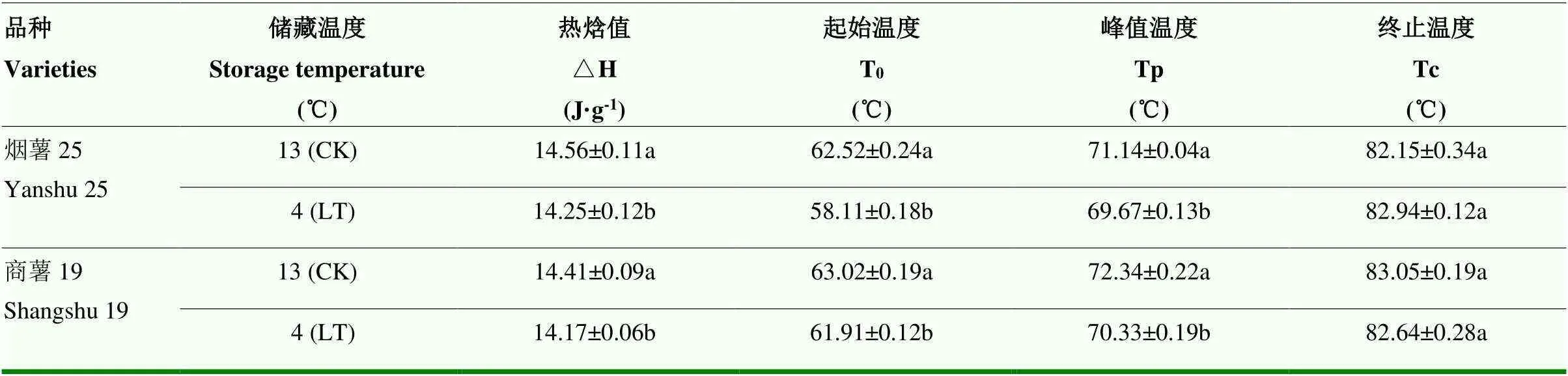
表5 低温对甘薯块根淀粉DSC特征参数的影响

表6 低温对甘薯块根淀粉RVA特征参数的影响
2.5 低温对甘薯块根淀粉吸湿性的影响
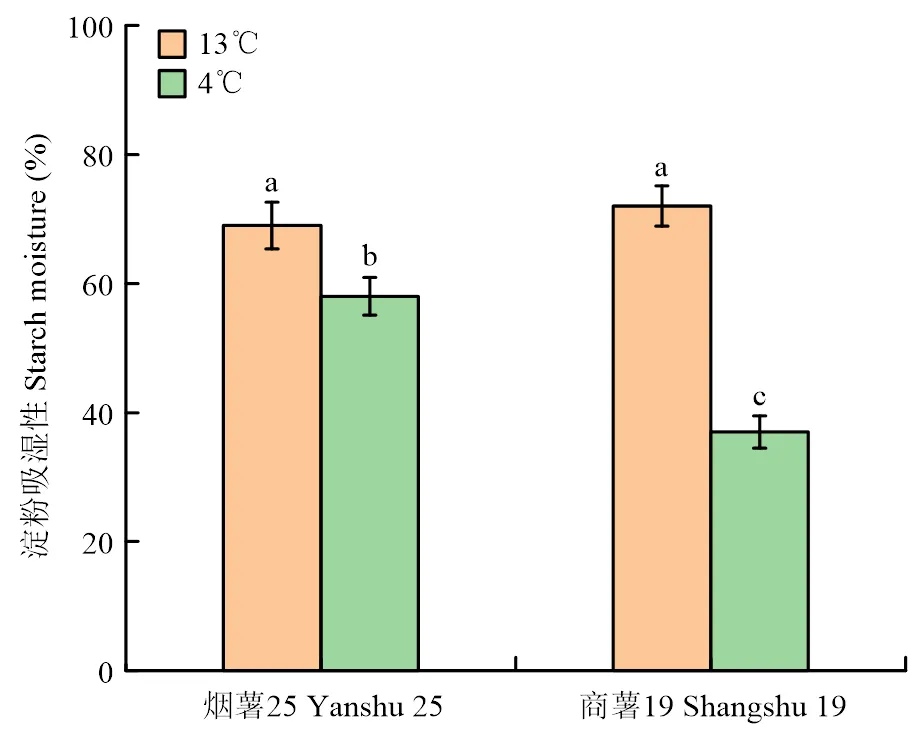
由图1所示,适温储藏条件下(13℃),‘烟薯5’和‘商薯19’的淀粉吸湿性无显著差异,而低温储藏下(4℃),二者的淀粉吸湿性均有显著性下降,其中‘烟薯25’显著高于‘商薯19’(<0.05),这可能是由于温度降低减小了淀粉的溶解力,从而使淀粉的吸湿性降低。
2.6 低温对甘薯块根淀粉膨胀力的影响
适温储藏条件下(13℃),‘烟薯25’和‘商薯19’的淀粉膨胀力无显著性差异,低温胁迫下(4℃),二者的淀粉膨胀力均有不同程度的上升,其中‘烟薯25’上升幅度较大,达到35.13 mL·g-1,与对照相比差异显著,且显著高于‘商薯19’(<0.05),而‘商薯19’在两个储藏温度下未达到显著性差异(图2)。
不同字母表示在0.05水平上差异显著。下同
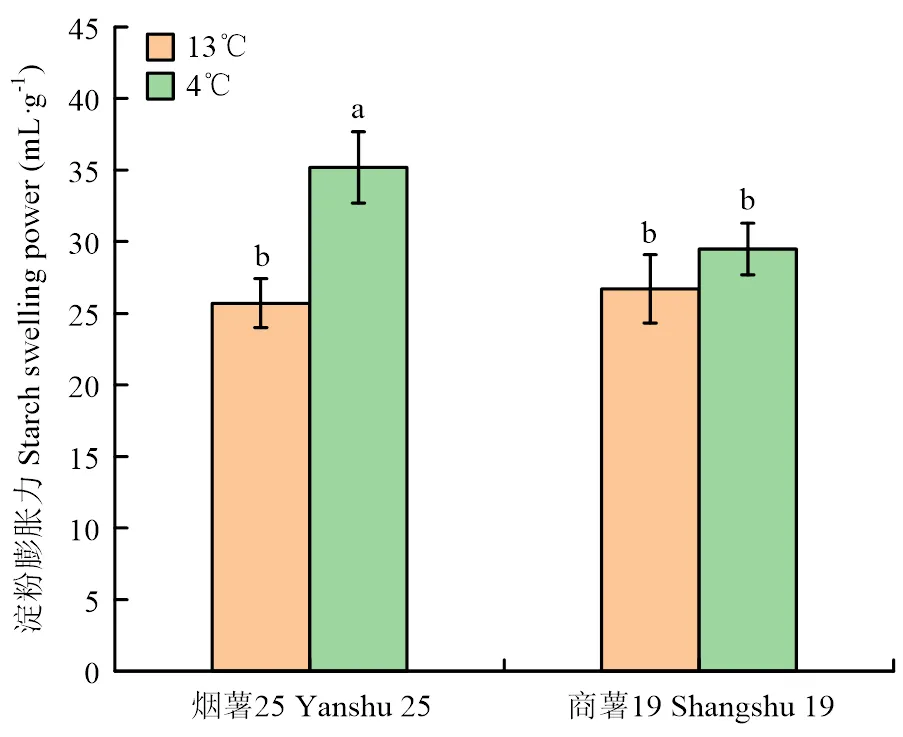
图2 低温对甘薯块根淀粉膨胀力的影响
2.7 低温对甘薯块根淀粉代谢关键基因表达量的影响
目前,关于淀粉合成代谢的关键酶正在被越来越多人关注。如ADP-葡萄糖焦磷酸化酶(AGPase)、淀粉分支酶(starch branching enzyme,SBE)和淀粉水解酶(分为-amylase和-amylase)。低温储藏条件下(4℃),(图3-A)、(图3-B)、(图3-C)和(图3-D)的表达量均显著下降(<0.05),且‘烟薯25’的下降幅度高于‘商薯19’,而(图3-E)和(图3-F)则显著上调(<0.05),‘烟薯25’的(图3-E)表达量相较于CK升高了14.8倍,这可能是由于‘烟薯25’是典型的鲜食品种,低温促进了淀粉水解,使淀粉转化为可溶性糖,从而抵御低温胁迫引起的氧化损伤。
3 讨论
3.1 低温影响甘薯淀粉组分和粒径分布
甘薯是一种富含膳食纤维的淀粉类块根作物,但甘薯怕冷,温度过低时易受冻,形成硬心,因此,储藏温度对淀粉结构及特性的影响较大。虽然目前已有资料中尚未查询到有关低温对甘薯淀粉组分和理化性质影响的报道,但小麦淀粉研究表明,低温导致的水分迁移和冰晶形成会使面团黏度增大且延展性变差[19];低温处理也会增加面团中受损淀粉的数量[20],因此,低温处理可能会导致甘薯淀粉颗粒结构变化,进而影响甘薯的食味及加工品质。
甘薯的淀粉颗粒大多呈多边形或圆形,部分呈椭圆和铃铛状,主要由直链淀粉和支链淀粉组成[10],另外含有少量氮、磷和总脂肪。本研究中,‘商薯19’的直链淀粉含量显著高于‘烟薯25’,支链淀粉则完全相反,这可能由于‘商薯19’属淀粉型品种,重点用于工业生产中的淀粉生产和加工,需要的淀粉结构较简单,直链淀粉含量较高,分支数少;而‘烟薯25’属鲜食型品种,需分支数较多,可使食味甜糯,质地变软,因此淀粉组分和结构特性决定了二者的用途。‘烟薯25’和‘商薯19’的平均粒径及体积与表面积分布于3个区间,这与唐忠厚等[10]的结果一致,但与史春余等[21]划分不一致,这可能与测定方法不同有关,需进一步验证分析。
3.2 低温影响甘薯淀粉理化特性
淀粉糊化是其高温溶胀、分裂形成均匀糊状溶液的物理特性,淀粉热焓值变化是评价淀粉膨润度的重要指标,淀粉热焓值变化减少,膨润度增加[10]。本研究结果显示,低温储藏条件下,‘烟薯25’的△H降低了0.31 J·g-1,‘商薯19’降低了0.24 J·g-1,由此可见,低温提升了二者的淀粉膨润度。淀粉黏滞特性(RVA)特征值是反映淀粉糊化特性的另一重要指标。本研究中,支链淀粉含量高的甘薯品种(‘烟薯25’),最高黏度较大,崩解值高,糊化温度较低,这与PYCIA等[22]的研究结果一致。低温显著降低了两个试验品种的PKV和BDV,且‘烟薯25’的降低程度高于‘商薯19’,表明‘烟薯25’的淀粉RVA特性受低温影响更显著,由此推断,‘烟薯25’对低温的抗性可能低于‘商薯19’。另外,本研究中低温储藏下(4℃),二者的淀粉吸湿性相较于CK(13℃)均有显著性下降,这可能是由于低温使淀粉颗粒形成悬浮液,当被加热到一定温度时,淀粉颗粒开始不可逆地剧烈膨胀,淀粉溶解力提升[10]。

图3 低温对淀粉合成代谢酶基因相对表达量的影响
3.3 低温影响甘薯淀粉合成代谢关键基因的表达
直链和支链淀粉的合成由一系列酶催化参与,首先在ADP-葡萄糖磷酸焦磷酸化酶(AGPase)的催化下,葡萄糖-1-磷酸(G1P)和ATP生成直链和支链淀粉合成的共同前体ADP-Glc,从而为淀粉链的延伸提供糖基。支链淀粉延伸主要由淀粉分支酶(starch branching enzyme,SBE)参与,将淀粉糖引入分支,最后形成淀粉粒。而淀粉水解主要由淀粉水解酶(分为-amylase和-amylase)参与,最终转化为可溶性糖[23-26]。
糖不仅仅作为植物体主要能量物质,而且承担着抗氧化、清除植物体内ROS的任务,可溶性糖还是一种渗透调节物质,糖的积累可稳定细胞渗透压,保护细胞膜[27]。“糖是抗氧化剂”这一概念已经被越来越多的研究者所认同[28-30]。SPERDOULI和MOUSTAKAS[31]报道高浓度可溶性糖有利于拟南芥叶片抵御干旱胁迫下的细胞过氧化损伤,CUI等[32]的蛋白组学和代谢组学研究结果表明,低温胁迫下,甘薯中大部分蛋白、初生和次生代谢物都集中于糖化通路,且均呈上调表达。本研究中,低温储藏条件下,淀粉向可溶性糖方向转化趋势增强,反向减弱,表明低温促进了淀粉水解,使淀粉转化为可溶性糖,促进其糖化,从而抵御低温过氧化胁迫损伤。
4 结论
低温胁迫对甘薯块根淀粉组分及其品质理化特性产生较大影响,改变了淀粉粒径分布并导致淀粉吸湿性和糊化过程中热稳定性降低,淀粉合成关键基因的表达量显著降低,淀粉水解酶编码基因表达量显著升高。同时,不同类型甘薯对低温响应存在差异,低温处理下,‘烟薯25’和‘商薯19’薯块淀粉在糊化过程中的起始温度(T0)、峰值温度(Tp)和热晗值(△H)与CK相比均显著下降,低温对鲜食型‘烟薯25’淀粉热特性的影响高于淀粉型‘商薯19’。此外,低温促进了甘薯淀粉向可溶性糖的转化,增强了甘薯对低温的抗性。因此,温度是影响甘薯淀粉理化品质的重要因素,甘薯块根淀粉理化特性变化与甘薯储藏温度密切相关。
[1] 王欣, 李强, 曹清河, 马代夫. 中国甘薯产业和种业发展现状与未来展望. 中国农业科学, 2021, 54(3): 483-492. doi: 10.3864/j.issn. 0578-1752.2021.03.003.
WANG X, LI Q, CAO Q H, MA D F. Current status and future prospective of sweetpotato production and seed industry in China. Scientia Agricultura Sinica, 2021, 54(3): 483-492. doi: 10.3864/j.issn. 0578-1752.2021.03.003. (in Chinese)
[2] ZHOU W Z, YANG J, HONG Y, LIU G L, ZHENG J L, GU Z B, ZHANG P. Impact of amylose content on starch physicochemical properties in transgenic sweet potato. Carbohydrate Polymers, 2015, 122: 417-427. doi: 10.1016/j.carbpol.2014.11.003.
[3] ZHANG K, WU Z D, TANG D B, LUO K, LU H X, LIU Y Y, DONG J, WANG X, LV C W, WANG J C, LU K. Comparative transcriptome analysis reveals critical function of sucrose metabolism related- enzymes in starch accumulation in the storage root of sweet potato. Frontiers in Plant Science, 2017, 8: 914.
[4] HOOVER R. Composition, molecular structure, and physicochemical properties of tuber and root starches: A review. Carbohydrate Polymer, 2001, 45(3): 253-267.
[5] 谭洪卓, 谭斌, 刘明, 田晓红, 谷文英. 甘薯淀粉性质与其粉丝品质的关系. 农业工程学报, 2009, 25(4): 286-292.
TAN H Z, TAN B, LIU M, TIAN X H, GU W Y. Relationship between properties of sweet potato starch and qualities of sweet potato starch noodles. Transactions of the Chinese Society of Agricultural Engineering, 2009, 25(4): 286-292. (in Chinese)
[6] ZHU F, WANG S N. Physicochemical properties, molecular structure, and uses of sweetpotato starch. Trends in Food Science and Technology, 2014, 36(2): 68-78.
[7] NODA T, KOBAYASHI T, SUDA I. Effect of soil temperature on starch properties of sweet potatoes. Carbohydrate Polymer, 2001, 44(3): 239-246.
[8] 唐忠厚, 李洪民, 张爱君, 史新敏, 徐飞, 孙健. 施钾对甘薯常规品质性状及其淀粉RVA特性的影响. 浙江农业学报, 2011, 23(1): 46-51. doi: 10.3969/j.issn.1004-1524.2011.01.009.
TANG Z H, LI H M, ZHANG A J, SHI X M, XU F, SUN J. Effect of potassium fertilizer application on main quality traits and starch RVA characters of sweetpotato. Acta Agriculturae Zhejiangensis, 2011, 23(1): 46-51. doi: 10.3969/j.issn.1004-1524.2011.01.009. (in Chinese)
[9] 柳洪鹃, 姚海兰, 史春余, 张立明. 施钾时期对甘薯济徐23块根淀粉积累与品质的影响及酶学生理机制. 中国农业科学, 2014, 47(1): 43-52. doi: 10.3864/j.issn.0578-1752.2014.01.005.
LIU H J, YAO H L, SHI C Y, ZHANG L M. Effect of potassium application time on starch accumulation and related enzyme activities of sweet potato variety Jixu 23. Scientia Agricultura Sinica, 2014, 47(1): 43-52. doi: 10.3864/j.issn.0578-1752.2014.01. 005. (in Chinese)
[10] 唐忠厚, 张爱君, 陈晓光, 靳容, 刘明, 李洪民, 丁艳锋. 低钾胁迫对甘薯块根淀粉理化特性的影响及其基因型差异. 中国农业科学, 2017, 50(3): 513-525.
TANG Z H, ZHANG A J, CHEN X G, JIN R, LIU M, LI H M, DING Y F. Starch physico-chemical properties and their difference in three sweetpotato ((L.) lam) genotypes under low potassium stress. Scientia Agricultura Sinica, 2017, 50(3): 513-525. (in Chinese)
[11] 解则义, 李洪民, 马代夫, 陈天娇, 韩永华, 李宗芸. 低温胁迫影响甘薯贮藏的研究进展. 植物生理学报, 2017, 53(5): 758-767.
XIE Z Y, LI H M, MA D F, CHEN T J, HAN Y H, LI Z Y. Research progress of the effects of low temperature stress on the sweetpotato during storage. Plant Physiology Journal, 2017, 53(5): 758-767. (in Chinese)
[12] LI X, YANG H Q, LU G Q. Low-temperature conditioning combined with cold storage inducing rapid sweetening of sweetpotato tuberous roots ((L.) Lam) while inhibiting chilling injury. Postharvest Biology and Technology, 2018, 142: 1-9.
[13] CHAUDHARY P R, JAYAPRAKASHA G K, PORAT R, PATIL B S. Low temperature conditioning reduces chilling injury while maintaining quality and certain bioactive compounds of ‘Star Ruby’ grapefruit. Food Chemistry, 2014, 153: 243-249. doi: 10.1016/j. foodchem.2013.12.043.
[14] JIN P, ZHANG Y, SHAN T, HUANG Y, XU J, ZHENG Y. Low-temperature conditioning alleviates chilling injury in loquat fruit and regulates glycine betaine content and energy status. Journal of Agricultural and Food Chemistry, 2015, 63(14): 3654-3659. doi: 10.1021/acs.jafc.5b00605.
[15] 江凌峰, 周淑倩, 潘靖禹, 杨虎清, 陆国权, 李永新. 不同贮藏时间及温度对新鲜甘薯淀粉特性的影响. 中国粮油学报. https://kns.cnki.net/kcms/detail/11.2864.TS.20210609.1743.014. html.
JIANG L F, ZHOU S Q, PAN J Y, YANG H Q, LU G Q, LI Y X. Effect of different storage time and temperature on starch properties of fresh sweet potato. Journal of the Chinese Cereals and Oils Association. https://kns.cnki.net/kcms/detail/11.2864.TS.20210609. 1743.014.html. (in Chinese)
[16] SHIMADA T, OTANI M, HAMADA T, KIM S H. Increase of amylose content of sweetpotato starch by RNA interference of the starch branching enzyme II gene (IbSBEII). Plant Biotechnology, 2006, 23(1): 85-90.
[17] 唐忠厚, 朱晓倩, 李强, 李洪民, 徐飞. 不同基因型甘薯直链淀粉含量差异研究. 食品工业科技, 2011, 32(11): 108-110.
TANG Z H, ZHU X Q, LI Q, LI H M, XU F. Genotype variation in amylose content of sweetpotato. Science and Technology of Food Industry, 2011, 32(11): 108-110. (in Chinese)
[18] RASPER V. Investigations on starches from major starch crops grown in Ghana: III.-Particle size and particle size distribution. Journal of the Science of Food and Agriculture, 1971, 22(11): 572-580.
[19] YI J, KERR W L, JOHNSON J W. Effects of waxy wheat flour and water on frozen dough and bread properties. Journal of Food Science, 2009, 74(5): E278-E284. doi: 10.1111/j.1750-3841.2009. 01180.x.
[20] SILVAS-GARCIA M I, RAMIREZ-WONG B, TORRES-CHAVEZ P I, BELLO P, LUIS A, CARVAJAL M, Elizabeth, BARRON H, JESUS M, RODRIGUEZ G, MARIO E, VASQUEZ L, VAZQUEZ-LARA F, QUINTERO-RAMOS A. Effect of freezing rate and storage on the rheological, thermal and structural properties of frozen wheat dough starch. Starch-Stärke, 2016, 68(11/12): 1103-1110.
[21] 史春余, 姚海兰, 张立明, 柳洪鹃, 张超, 刘桂玲. 不同类型甘薯品种块根淀粉粒粒度的分布特征. 中国农业科学, 2011, 44(21): 4537-4543.
SHI C Y, YAO H L, ZHANG L M, LIU H J, ZHANG C, LIU G L. Starch Granule size distribution in storage roots of different types of sweetpotato cultivars. Scientia Agricultura Sinica, 2011, 44(21): 4537-4543. (in Chinese)
[22] PYCIA K, JUSZCZSK L, GALKOWSKA D, witczak m. Physicochemical properties of starches obtained from Polish potato cultivars. Starch-Starke, 2012, 64(2): 105-114.
[23] BHASKAR P B, WU L, BUSSE J S, WHITTY B R, HAMERNIK A J, JANSKY S H, BUELL C R, BETHKE P C, JIANG J. Suppression of the vacuolar invertase gene prevents cold-induced sweetening in potato. Plant Physiology, 2010, 154(2): 939-948. doi:10.1104/pp.110. 162545.
[24] CHARLES M T, MAKHLOUF J, ARUL J. Physiological basis of UV-C induced resistance to Botrytis cinereal in tomato fruit: II. Modification of fruit surface and changes in fungal colonization. Postharvest Biology and Technology, 2008, 47(1): 21-26.
[25] COLEBROOK E H, THOMAS S G, PHILLIPS A L, HEDDEN P. The role of gibberellin signalling in plant responses to abiotic stress. The Journal of Experimental Biology, 2014, 217(1): 67-75. doi: 10.1242/ jeb.089938.
[26] COOLS K, ALAMAR M D C, TERRY L A. Controlling sprouting in potato tubers using ultraviolet-irradiance. Postharvest Biology and Technology, 2014, 98(1): 106-114.
[27] PESHEV D, VAN DEN ENDE W. Sugars as antioxidants in plants// Crop Improvement Under Adverse Conditions. Springer-Verlag, Berlin, Heidelberg, Germany, 2013: 285-308.
[28] VAN DEN ENDE W, VALLURU R. Sucrose, sucrosyl oligosaccharides,and oxidative stress: Scavenging and salvaging? Journal of Experimental Botany, 2008, 60(1): 9-18. doi: 10.1093/jxb/ern297.
[29] BOLOURI-MOGHADDAM M R, LE ROY K, XIANG L, ROLLAND F, VAN DEN ENDE W. Sugar signalling and antioxidant network connections in plant cells. The FEBS Journal, 2010, 277(9): 2022-2037. doi: 10.1111/j.1742-4658.2010.07633.x.
[30] KEUNEN E, PESHEV D, VANGRONSVELD J, VAN DEN ENDE W, CUYPERS A. Plant sugars are crucial players in the oxidative challenge during abiotic stress: Extending the traditional concept. Plant, Cell & Environment, 2013, 36(7): 1242-1255. doi: 10.1111/pce. 12061.
[31] SPERDOULI I, MOUSTAKAS M. Interaction of proline, sugars, and anthocyanins during photosynthetic acclimation ofto drought stress. Journal of Plant Physiology, 2012, 169(6): 577-585. doi: 10.1016/j.jplph.2011.12.015.
[32] CUI P, LI Y, CUI C, HUO Y, LU G, YANG H. Proteomic and metabolic profile analysis of low-temperature storage responses inbatata Lam. tuberous roots. BMC Plant Biology, 2020, 20(1): 435. doi: 10.1186/s12870-020-02642-7.
Starch Physicochemical Properties and Expression Levels of Anabolism Key Genes in Sweetpotato Under Low Temperature

1College of Advanced Agricultural Sciences, Zhejiang Agriculture and Forest University, Hangzhou 311300;2Management Service Center of Binzhou National Agricultural Science and Technology Park, Binzhou 256600, Shandong;3College of Food and Health, Zhejiang Agriculture and Forest University, Hangzhou 311300
【Objective】Starch is the main component of sweetpotatoe, and the main use of tuberous roots is directly determined by the physicochemical properties of starch. Sweetpotato is a typical temperature-preferred tropical crop and sensitive to the storage temperature. Therefore, it is very important to study the effects of low temperature on starch physicochemical properties for the safe storage of sweetpotato. 【Method】The starch average granule size and distribution, heat enthalpy, gelatinization properties, moisture absorption and swelling power were investigated in an experiment conducted by using Yanshu 25 and Shangshu 19 with storage of 13℃ (CK) and 4℃ (Low temperature, LT) for 14 days. 【Result】The results demonstrated that the significant differences were observed in amylose/amylopectin content between the two sweetpotato varieties. The amylose content of Shangshu 19 (31.47%) was significantly higher than that of Yanshu 25 (25.86%), while the amylopectin content showed an opposite trend. The average particle size, volume and surface area of Yanshu 25 and Shangshu 19 ranged from ≤2.50 μm, 2.50-5.00 μm to 5.00-25.00 μm, respectively. The average particle size, volume and surface area of starch particles, moisture absorption and swelling power were decreased under LT stress. The starch initial temperature (T0), peak temperature (Tp) and heat thermal value (△H) of Yanshu 25 and Shangshu 19 during gelatinization process were decreased significantly as compared with CK. The change in starch △H of Yanshu 25 was higher than that of Shangshu 19, which indicated that the effect of low temperature on thermal properties of Yanshu 25 starch was more serious than that of Shangshu 19. Under low temperature storage conditions, the peak viscosity (PKV), disintegration value (BDV) and recovery value (CSV) of Yanshu 25 and Shangshu 19 were decreased significantly, while the gelatinization temperature (PT) was not significantly affected by temperature. The differences between the two varieties were significant. The expression levels of,,andgenes were decreased significantly under LT condition, whileandincreased significantly. 【Conclusion】In conclusion, the temperature played an important role in the starch physicochemical properties of sweetpotato, and the change of which was closely related to the storage temperature.
sweetpotato; low temperature stress; starch; physicochemical properties; gene

10.3864/j.issn.0578-1752.2022.19.012
2021-12-20;
2022-02-15
国家自然科学基金(32101650)、国家现代农业产业技术体系建设专项(CARS-10-B19)
崔鹏,E-mail:cuipeng626@163.com。赵逸人,E-mail:545127259@qq.com。崔鹏和赵逸人为同等贡献作者。通信作者陆国权,E-mail:lugq10@zju.edu.cn
(责任编辑 赵伶俐)
