脂肪间充质干细胞外泌体通过miR-145抑制小鼠增生性瘢痕血管生成及纤维增生
2022-10-29阿丽米热伊力哈木卡米力江买买提明美尔瓦提李朝阳
阿丽米热·伊力哈木,卡米力江·买买提明,美尔瓦提,李朝阳
(1.新疆维吾尔自治区人民医院整形外科,新疆 乌鲁木齐 830001;2.新疆维吾尔自治区人民医院颌面外科,新疆 乌鲁木齐 830001;3.新疆维吾尔自治区人民医院临床心理科,新疆 乌鲁木齐 830001)
增生性瘢痕(hypertrophic scar,HS)形成是一种皮肤纤维增生性疾病,多发生在手术或严重烧伤引起的损伤后,会导致疼痛、瘙痒、关节活动受限、关节挛缩和畸形等,严重影响患者的身心健康[1]。目前HS形成的具体机制尚不清楚,其主要表现为成纤维细胞增殖、胶原蛋白过度产生及细胞外基质过度沉积[2]。迄今为止,临床已经有了许多抑制HS形成的方法,如手术切除、放射疗法、冷冻疗法、内皮质类固醇注射以及激光疗法等,但由于治疗周期长、个体差异大及复发率高等情况,仍未能取得满意的治疗效果[3-4]。因此,临床亟需寻找一种高效、方便、成本低、副作用小的治疗方式。
近年来,干细胞治疗已成为皮肤创面愈合的研究热点。脂肪间充质干细胞(adipose-derived mesenchymal stem cells,ADSCs)是广泛使用的成体干细胞之一,能够促进皮肤伤口愈合,减少瘢痕形成[5]。ADSCs通过旁分泌细胞因子、外泌体(exosomes,Exo)和一些其他生物活性物质发挥其生物学功能。其中,Exo是由细胞分泌的具有双层磷脂膜结构的颗粒物,直径40~150 nm,含有蛋白质、脂质、mRNA和microRNA(miRNA)等物质[6]。Exo作为干细胞旁分泌途径中的重要成分,在促进皮肤创面修复和再生方面具有很高的应用前景,与直接使用干细胞进行组织修复相比,Exo具有安全性更高、易于储存、快速高效、来源广泛等优点[7]。
miRNA是一种长度为21~23个核苷酸的非编码RNA,能够同时影响多个基因网络以协调生物反应。miRNA可以通过与靶mRNA的3’非翻译区、编码区或5’非翻译区结合来抑制靶基因的表达,从而阻断mRNA翻译或降解,参与细胞增殖、分化、迁移、代谢和凋亡等过程[8]。此外,miRNA是皮肤形态发生改变和伤口愈合中的关键调节剂,其在HS形成中也起着重要作用。有研究表明,miR-145与HS的发生、发展有关,在HS组织中miR-145的表达明显降低,而miR-145能够抑制成纤维细胞增殖和侵袭,并促进成纤维细胞凋亡[9],这提示miR-145是抑制HS形成的潜在靶点。但ADSCs来源的Exo是否可以通过将外源性miR-145递送至伤口部位,进一步发挥抑制瘢痕形成的作用目前仍有待进一步研究,本研究旨在探究富含miR-145的ADSCs来源Exo在HS形成中的作用,以期为临床治疗HS提供参考。
1 材料与方法
1.1 实验动物与试剂
SPF级健康雄性C57/BL6小鼠40只,8周龄,体质量20~25 g,由新疆医科大学动物实验中心提供[生产许可证号:SCXK(新)2021-000],饲养条件:温度22~25 ℃,相对湿度45%~55%,给予周期性光照/黑暗12 h循环,期间自由进食、饮水。适应性饲养1周后进行实验。
胎牛血清(杭州四季青),青—链霉素双抗液、DMEM培养基、成脂分化诱导培养基及成骨分化诱导培养基(美国Corning公司),油红O染色液和茜素红染色液(北京伊塔生物科技有限公司),Exo提取试剂盒(上海宇玫博生物公司),miRNA反转录试剂盒与荧光定量检测试剂盒(美国GeneCopoeia公司),HE染色试剂盒(北京索莱宝科技公司),Masson染色试剂盒(上海贝博生物公司),RIPA裂解液、BCA蛋白测定试剂盒、DAB显色试剂盒及ECL超敏发光液(上海碧云天生物研究所)。FITC标记的CD29、CD34、CD45、CD90和CD105抗体,Alix,Tsg101,CD81,α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA),转化生长因子-β1(transforming growth factor-β1,TGF-β1),Ⅰ型胶原蛋白(Collagen Ⅰ)及Ⅲ型胶原蛋白(CollagenⅢ)抗体(英国Abcam公司);辣根过氧化物酶偶联的山羊抗兔和GAPDH抗体(北京中杉金桥生物公司)。含miR-145的慢病毒及阴性对照miR-NC慢病毒的载体构建、包装、滴度测定均由上海生工生物工程有限公司完成。
1.2 ADSCs分离与鉴定
收集志愿者进行抽脂术时抽取的脂肪组织,将脂肪组织剪碎,PBS清洗,添加1 mg/mL Ⅰ型胶原酶消化,过滤器过滤,以300 ×g低温离心5 min,弃去上清液,留沉淀,加含10%胎牛血清、1%青—链霉素双抗液的DMEM培养基重悬细胞,置于37 ℃、5%CO2培养箱中扩大培养,期间每3 d换液1次,倒置显微镜下观察细胞生长状态及形态。取第3~5代细胞,PBS清洗后重悬,调整细胞密度为1×106/mL,取100 μL悬液后依次加入10 μL FITC标记的CD29、CD34、CD45、CD90和CD105单抗,室温避光孵育30 min,PBS洗涤并重悬,通过流式细胞仪检测分析。将分离的细胞分别使用成脂分化诱导培养基孵育2周或成骨分化诱导培养基孵育3周后,4%多聚甲醛固定,利用油红O染色或茜素红染色检测诱导结果,测定细胞成脂、成骨分化能力,在光学显微镜下观察并拍摄图像。
1.3 ADSCs转染
将ADSCs以1×105个/孔的密度接种于6孔板中,置于37 ℃、5% CO2培养箱中培养24 h,分别添加含miR-145过表达的慢病毒及阴性对照miR-NC慢病毒进行转染,感染复数为50∶1,以正常培养未经转染的ADSCs作为对照,培养4 h后,弃原液,更换新鲜培养液培养,用1 mg/L嘌呤霉素筛选,以构建稳定过表达miR-145的ADSCs。
1.4 Exo提取与鉴定
收集转染后的ADSCs上清液,差速超速离心,从上清液中分离ADSCs来源的Exo。在4 ℃下以300 ×g离心10 min,去沉淀,保留上清;于4 ℃下以2 000×g离心10 min,去除碎片和凋亡小体,保留上清;再于4 ℃下以10 000×g离心30 min,保留上清,0.22 μm滤膜过滤,添加Exo提取试剂液,4 ℃下静置12 h后再以10 000×g离心60 min,弃上清,留沉淀,加入保存液吹打混匀,于-80 ℃保存备用。透射电镜观察颗粒物的形态,纳米颗粒跟踪分析仪分析粒径大小,Western blot检测Exo表面标志性蛋白Alix、Tsg101和CD81的表达。
1.5 实时荧光定量PCR
利用Exo提取试剂盒提取总RNA,参照miRNA反转录试剂盒说明书将总RNA逆转录合成模板cDNA。设计miR-145和内参基因U6的上游引物和下游引物:miR-145上游引物5’-GTCCAGTTTTCCCAGG-3’,下游引物5’-GAGCAGGCTGGAGAA-3’;U6上游引物5’-CTCGCTTCGGCAGCACA-3’,下游引物5’-AACGCTTCACGAATTTGCGT-3’。通过实时荧光定量PCR测定系统检测miR-145表达,参照试剂盒说明书配制扩增体系,程序设置为:95 ℃ 3 min,循环1次;95 ℃ 12 s、62 ℃ 40 s、95 ℃ 15 s,循环45次。扩增结束后,采用2-△△Ct法计算miR-145的相对表达量。
1.6 HS动物模型建立与分组处理
参考文献[10]制作小鼠HS模型,1%戊巴比妥钠麻醉小鼠,无菌环境下常规备皮,在其背中线处作切口,长度为2 cm,纵向切开全层皮肤,再以6-0尼龙线缝合,继续饲养小鼠,在第4天后移除缝合线,机械牵拉装置拉伸伤口,牵拉距离为2 mm,后每隔1 d牵拉4 mm,持续至第14天,构建HS模型。
将40只小鼠按照随机数字表法分为对照组、模型组、Exo组和miR-145-Exo组,每组10只,除对照组外,其余3组小鼠均构建HS模型。在第1次拉伸和第5次拉伸后,Exo组和miR-145-Exo组小鼠分别在背部伤口处皮下注射100 μL Exo和转染miR-145的Exo,对照组和模型组注射等体积PBS,14 d后处死各组小鼠并切取瘢痕组织,一部分固定于4%多聚甲醛中用于组织学分析,另一部分置于液氮迅速冷冻后于-80 ℃保存。
1.7 HE染色
瘢痕组织经4%多聚甲醛固定24 h后,梯度乙醇脱水,石蜡包埋,制备5 μm厚的切片,置于37 ℃烘箱过夜,烤干后保存。进行HE染色,洗涤后自然晾干,滴加中性树胶封片,光学显微镜下观察各组小鼠皮肤组织病理学变化,拍摄图像,并用病理图像分析系统测量真皮层厚度。
1.8 Masson染色
取瘢痕组织石蜡切片,经过脱蜡脱水处理后进行Masson染色,洗涤干净,自然晾干,滴加中性树胶封片,光学显微镜下观察各组小鼠皮肤胶原沉积情况,并拍摄图像。
1.9 免疫组化染色
取瘢痕组织石蜡切片,经脱蜡脱水后浸入3%过氧化氢中,加入5%山羊血清封闭组织切片15 min。在切片上滴加抗血管内皮生长因子(vascular endothelial growth factor,VEGF)单克隆抗体(1∶200),4 ℃孵育过夜;PBS清洗后,滴加辣根过氧化物酶偶联的山羊抗兔抗体(1∶1 000),室温孵育60 min;PBS清洗,DAB显色,苏木精染核,脱水、透明,自然晾干,滴加中性树胶封片,使用光学显微镜观察各组小鼠皮肤组织染色情况,随机取6个视野并拍摄,Image J软件分析VEGF平均光密度值,以反映VEGF蛋白表达水平。
1.10 Western blot
将瘢痕组织于无菌环境下剪碎,研磨匀浆,加入RIPA裂解液裂解,随后4 ℃下以10 000×g离心10 min,提取上清液,BCA法测定蛋白浓度。配制浓缩胶与分离胶,在样孔内加入等量的各蛋白样品上样,电泳分离蛋白,80 V恒压电泳20 min,随后将电压调为110 V电泳60 min,再以恒压100 V,冰上转2 h至PVDF膜上,经5%脱脂奶粉室温封闭2 h,滴加α-SMA、TGF-β1、Collagen Ⅰ及CollagenⅢ抗体(均1∶1 000),4 ℃孵育过夜。TBST洗膜后,再滴加辣根过氧化物酶偶联的山羊抗兔抗体(1∶5 000),室温孵育1 h,TBST漂洗,ECL显影及曝光,EPSON扫描仪扫描胶片,摄取蛋白图像,以GAPDH为内参,Image J软件分析各目标条带的蛋白灰度值,以目的蛋白与GAPDH的灰度值之比作为目的蛋白的相对表达量。
1.11 统计学分析
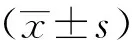
2 结果
2.1 ADSCs鉴定
倒置显微镜下观察到分离的细胞表现出明显的纤维细胞样形态(图1a),具有多种分化潜能;经茜素红染色可见细胞内沉积钙盐,形成明显的红色结节(图1b);油红O染色可见细胞中有明显脂滴形成,呈橘红色(图1c)。流式细胞术测定显示,CD105(99.95%)、CD90(99.72%)和CD29(98.82%)呈阳性表达,CD34(1.15%)和CD45(0.08%)呈阴性表达(图1d),表明成功分离获得ADSCs。
a:倒置显微镜下观察ADSCs的形态;b:茜素红染色检测ADSCs成骨分化能力;c:油红O染色检测ADSCs成脂分化能力;d:流式细胞术检测ADSCs表面标志物表达
2.2 ADSCs来源Exo及转染效果鉴定
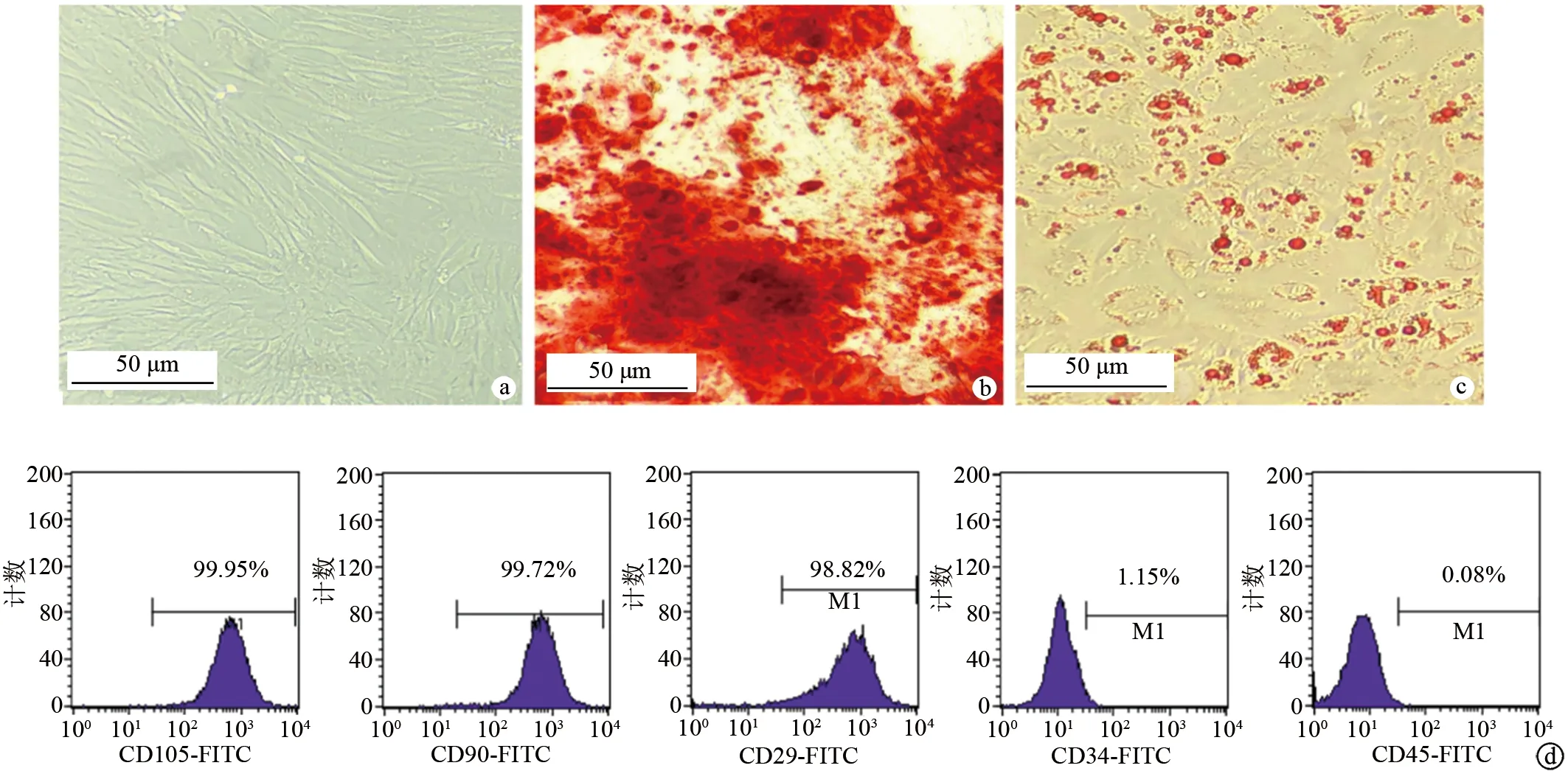
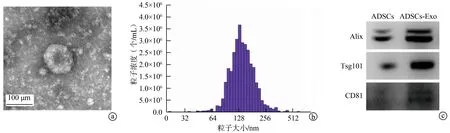
透射电镜观察到分离的颗粒物呈明显的球形囊泡,粒径峰值约为128 nm(图2a、b)。Western blot检测结果显示,该颗粒物中Exo标志性蛋白Alix、Tsg101和CD81均呈阳性表达(图2c),说明该颗粒物为Exo。转染miR-145的ADSCs来源Exo中miR-145相对表达水平显著高于未经转染的ADSCs来源Exo及转染miR-NC的ADSCs来源Exo(P<0.05),见图3。
a:透射电镜观察Exo形态;b:纳米颗粒跟踪分析仪测定Exo粒径峰值;c:Western blot检测Exo标志性蛋白的表达
*:与Exo比较,P<0.05;#:与miR-NC-Exo比较,P<0.05
2.3 各组小鼠皮肤组织形态学观察
HE染色观察到对照组小鼠皮肤结构完整,真皮层较薄,皮下可见脂肪组织,成纤维细胞排列整齐,毛囊结构明显;模型组小鼠可见HS组织,真皮层较对照组显著增厚(P<0.05),成纤维细胞排列不规则,血管分布较为密集;Exo组和miR-145-Exo组小鼠中成纤维细胞恢复平行且规则排列,真皮层较模型组明显变薄(P<0.05),有毛囊结构,HS区域减少;miR-145-Exo组对HS的组织病理学表现的改善作用较Exo组更加明显,真皮层显著变薄(P<0.05),见图4。

a:HE染色和Masson染色(×100);b:真皮层厚度 *:与对照组比较,P<0.05;#:与模型组比较,P<0.05;△:与Exo组比较,P<0.05
Masson染色发现,相较于对照组,模型组皮肤组织内出现大量致密的深染区域,胶原沉积明显,组织表现为纤维化;与模型组比较,Exo组和miR-145-Exo组染色强度下降,染色区域减少,胶原沉积减少,组织纤维化得到缓解;与Exo组比较,miR-145-Exo组染色区域减少,染色强度下降,胶原沉积减少,纤维化程度更低,见图4。
2.4 各组小鼠皮肤组织VEGF表达比较
免疫组织化学染色结果显示,相较于对照组,模型组小鼠皮肤组织内着色细胞增多,染色加深,VEGF阳性表达率显著升高(P<0.05);与模型组比较,Exo组和miR-145-Exo组中着色细胞减少,VEGF阳性表达率显著降低(P<0.05);miR-145-Exo组中VEGF阳性表达率显著低于Exo组(P<0.05),见图5。
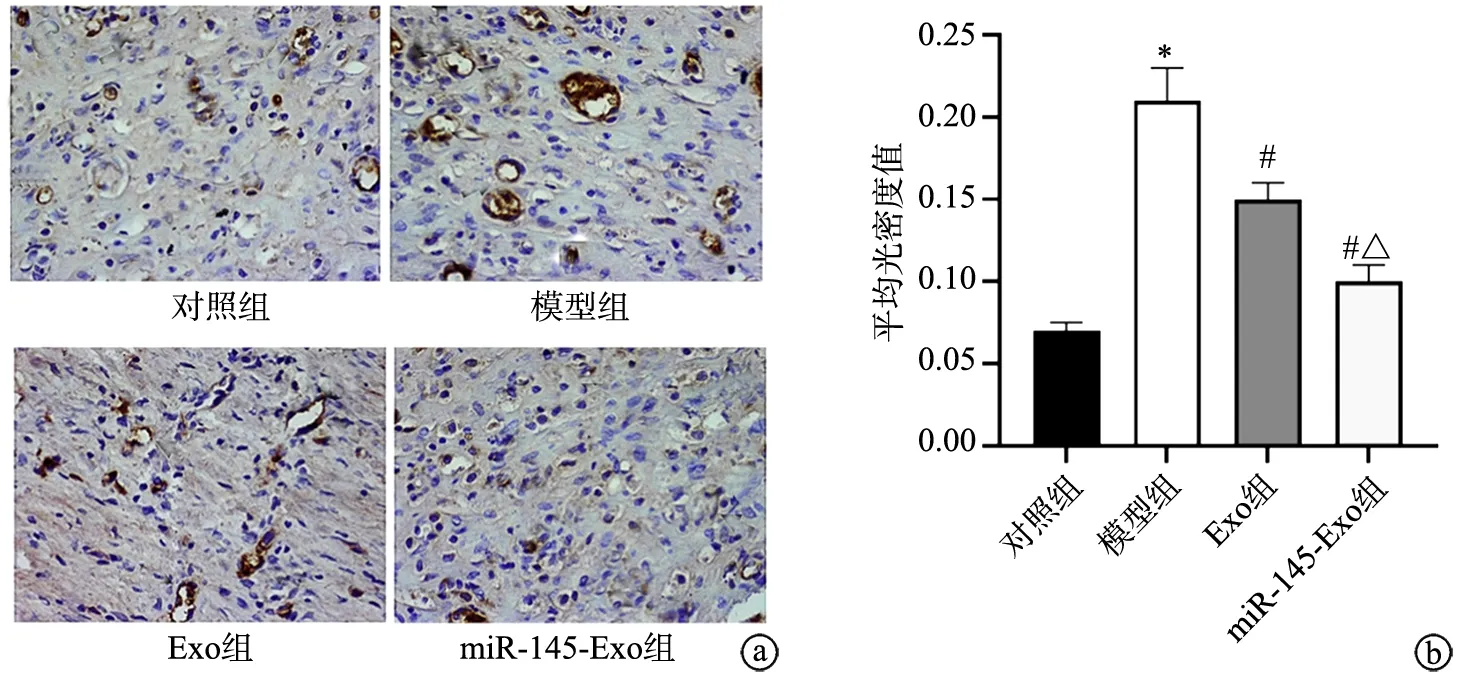
a:免疫组化染色(×400);b:VEGF阳性表达率比较 *:与对照组比较,P<0.05;#:与模型组比较,P<0.05;△:与Exo组比较,P<0.05
2.5 各组小鼠皮肤组织TGF-β1、α-SMA、Collagen Ⅰ及Collagen Ⅲ蛋白表达
模型组小鼠皮肤组织TGF-β1、α-SMA、Collagen Ⅰ及Collagen Ⅲ蛋白表达水平均显著高于对照组(P<0.05);与模型组比较,Exo组和miR-145-Exo组TGF-β1、α-SMA、CollagenⅠ及CollagenⅢ蛋白表达水平均显著下调(P<0.05);与Exo组比较,miR-145-Exo组TGF-β1、α-SMA、CollagenⅠ及CollagenⅢ蛋白表达水平均下调更明显(P<0.05),见图6。
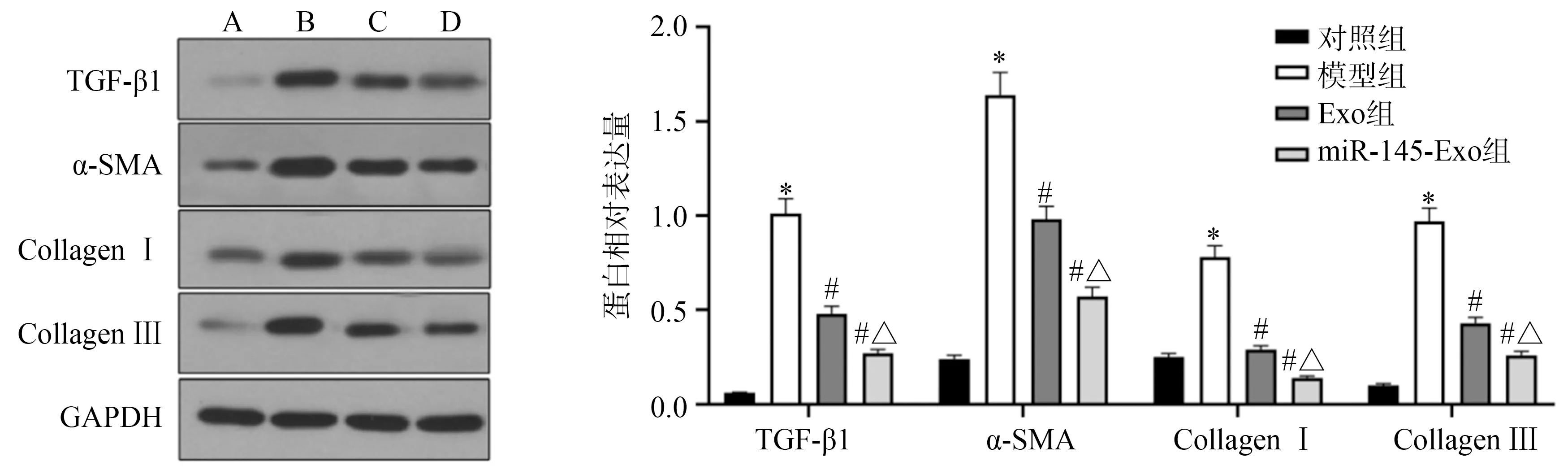
A:对照组;B:模型组;C:Exo组;D:miR-145-Exo组 *:与对照组比较,P<0.05;#:与模型组比较,P<0.05;△:与Exo组比较,P<0.05
3 讨论
手术、外伤、烧伤、烫伤等都会造成皮肤外伤,皮肤伤口的快速有效修复是保证皮肤屏障功能的关键。皮肤伤口的愈合过程是一个复杂的再生反应,涉及止血、炎症反应、细胞增殖和组织重建4个阶段,在这个动态过程中,过度的胶原蛋白沉积和成纤维细胞增殖会导致病理性瘢痕(包括HS和瘢痕疙瘩)的形成,该机制复杂多样,涉及多种细胞和因子的多阶段协同作用[2,11]。皮肤伤口无瘢痕愈合是瘢痕预防策略的最终目标。因此,揭示病理性瘢痕形成与增生机制中的关键细胞和分子之间的因果关系,从而为无瘢痕愈合提供新的治疗靶点,是医学整形外科领域的热门课题之一,具有重要的临床意义。
近年来,干细胞治疗和组织工程的不断进步使得更多替代疗法成为可能,通过各种药物和生长因子对生物材料进行功能化加工,为治疗HS提供了一种可控且有效的方法。ADSCs是具有自我更新和多向分化能力的多能干细胞,在伤口愈合过程中,ADSCs可以直接分化为创伤修复所需的细胞系,如表皮细胞、成纤维细胞、内皮细胞,并分泌细胞因子和生长因子,以促进健康组织再生,防止受伤区域瘢痕形成[12]。研究表明,干细胞的组织修复功能只有一小部分涉及受损区域干细胞的增殖和分化,而大部分则通过旁分泌信号传导发挥作用[13-14]。ADSCs通过旁分泌生物活性因子调节免疫细胞促进炎症反应,从而抑制瘢痕增生,其中,Exo携带复杂的生物信息并将其释放到靶细胞中,作为旁分泌介质存在于间充质干细胞和靶细胞之间,可调节细胞增殖、细胞迁移、骨再生和胶原蛋白合成。ADSCs来源Exo在伤口愈合的不同阶段均发挥着重要作用,包括减少炎症、调节血管生成和重塑基质,并抑制组织纤维化及HS形成[7]。本研究结果显示,经过ADSCs来源Exo处理的HS小鼠瘢痕区域与胶原沉积均减少,真皮层变薄,减轻了由机械牵拉造成的瘢痕形成程度。
miRNA在再生医学中具有显著作用,可在皮肤愈合、骨再生、肝再生、肾再生和心肌再生等过程中调节多种组织生长。Exo中所含的miRNA是细胞间通讯的重要介质,Exo进入靶细胞后,受到降解和重新表达的调节,从而改变靶细胞的基因表达。Exo内部还载有母细胞中所含的mRNA、蛋白质、胆固醇等特异性生物学物质[15],由此可见,不同细胞来源的Exo可能具有不同的生物学特性。先前研究表明,携带miR-21、miR-23a和miR-125b的脐带间充质干细胞来源Exo可抑制TGF-β2/Smad2信号通路,从而抑制肌成纤维细胞的形成并防止瘢痕形成[16];ADSCs来源Exo可通过传递外源性miR-29a抑制烫伤小鼠的病理性瘢痕形成,从而减少组织中的胶原沉积[17]。本研究结果显示,携带miR-145的ADSCs来源Exo能够抑制HS小鼠的瘢痕形成,并减少组织纤维化,这提示miR-145在ADSCs来源Exo抑制HS形成中起到了积极作用。
VEGF可诱导血管生成并促进血管再生,血管生成在促进创面愈合及瘢痕增生方面均具有重要作用;然而,异常的血管生成可能是导致瘢痕组织增生的关键因素[18],提示靶向抑制血管生成是预防或减少瘢痕形成的主要手段之一,降低VEGF表达可减少HS形成。本研究结果显示,经携带miR-145的ADSCs来源Exo作用的HS小鼠皮肤组织中VEGF阳性表达率显著降低,提示携带miR-145的ADSCs来源Exo能够抑制创面血管异常生成。已知瘢痕形成的特征包括胶原受体的重排、表达α-SMA的肌成纤维细胞的激活以及受影响组织中高水平TGF-β1的产生与分泌[19]。高表达的TGF-β1会刺激成纤维细胞的增殖和胶原蛋白产生,并抑制基质降解,最终导致HS形成[20];α-SMA作为成纤维细胞标志物,其表达异常增高表明成纤维细胞过度增殖;Collagen Ⅰ与Collagen Ⅲ是主要的间质胶原蛋白,在细胞外基质的结构组成中具有重要作用,也与肌成纤维细胞表型和纤维化进展密切相关,Collagen Ⅰ与Collagen Ⅲ的过度沉积也会促进HS形成[21]。本研究结果显示,经携带miR-145的ADSCs来源Exo作用的HS小鼠皮肤组织内TGF-β1、α-SMA、Collagen Ⅰ及Collagen Ⅲ蛋白表达水平均显著下调,提示携带miR-145的ADSCs来源Exo能够明显抑制小鼠皮肤组织HS形成。
综上,本研究结果表明外源性miR-145能够促进ADSCs来源Exo对小鼠HS形成的抑制作用,这种作用与抑制瘢痕血管生成与纤维增生以及相关因子TGF-β1、α-SMA、CollagenⅠ及CollagenⅢ的表达有关,提示miR-145修饰的ADSCs来源Exo可能是皮肤伤口愈合和病理性瘢痕的潜在治疗方法。但关于miR-145的下游靶标及具体作用机制有待后续进一步探究。
