内皮素-1 B型受体拮抗剂通过抑制NLRP3/IL-1β炎症小体通路缓解ApoE-/-小鼠的动脉粥样硬化
2022-10-29杜彦挺杜光勇夏志强赵振伟
杜彦挺,杜光勇,夏志强,张 伟,赵振伟
(榆林市第二医院神经外科二病区,陕西 榆林 719000)
急性冠状动脉综合征(acute coronary syndrome,ACS)是致心血管疾病患者残疾和死亡的主要原因,动脉粥样硬化是其病理基础[1-2]。动脉粥样硬化是一种涉及大中型动脉的慢性全身性炎症性疾病,发病机制与免疫细胞激活、胆固醇积累及年龄增长等因素密切相关[3]。动脉粥样硬化斑块的特征是具有一个坏死核心,其上覆盖薄的纤维帽[4]。早期动脉粥样硬化起始于吞噬了脂质的巨噬细胞形成泡沫细胞并经历自噬,但在中晚期动脉粥样硬化中,这种泡沫细胞的自噬功能失调,凋亡细胞也不能通过正常自噬过程有效降解,从而导致炎症和斑块坏死核心的形成[5]。
动脉粥样硬化的高危因素包括动脉高血压、吸烟、糖尿病和肥胖,这些因素均会增强血管收缩,增加组织内皮素-1(endothelin-1,ET-1)的水平[6]。ET-1是内皮素肽家族的主要成员,是一种内皮细胞衍生的血管收缩肽。目前认为ET-1是一种多功能肽,具有细胞因子样活性,参与几乎所有的生理过程[7]。限制内皮细胞过表达ET-1将导致内皮损伤,促进动脉粥样硬化进展并显著加重病变程度[8]。而使用ET-1 A型受体拮抗剂达鲁生坦治疗7个月,可改善内皮依赖性血管舒张并减缓实验性动脉粥样硬化的进展[9]。因此,使用ET-1受体拮抗剂(包括ET-1 A型受体和B型受体的拮抗剂)治疗动脉粥样硬化已发展为一种新兴疗法[7],但其作用的具体分子机制还有待深入研究。
一项抗炎性血栓形成的临床研究结果表明,抗IL-1β抗体可以减少二级预防中的复发性心血管事件,从中和IL-1β到抑制IL-6分泌的途径是一个值得深入研究和临床开发的治疗靶标[10]。Caspase-1是IL-1β的转化酶,也是NLRP3炎症小体的组成成分之一[11]。许多与动脉粥样硬化相关的刺激物(如胆固醇结晶和缺氧)均可激活NLRP3炎症小体[12]。NLRP3炎症小体激活后Caspase-1酶活性增强,将促炎细胞因子IL-1β从无活性的前体加工为成熟的活性形式,并分泌至胞外,从而触发炎症反应。有报道显示ET-1 B型受体拮抗剂BQ-123能够显著改善因脑血管痉挛导致的蛛网膜下腔出血后模型动物脑部微循环灌注,降低血管炎症反应[13]。因此,我们猜测ET-1受体拮抗剂也有可能通过抑制血管内皮细胞NLRP3/IL-1β炎症小体的活性发挥药效。现本研究拟使用ET-1 B型受体拮抗剂BQ-788治疗ApoE-/-小鼠晚期动脉粥样硬化,研究其对血管内皮细胞NLRP3/IL-1β炎症小体活性的影响,深入探讨ET-1 B型受体拮抗剂的药物作用机理,为其在临床的大规模应用奠定理论基础。
1 材料与方法
1.1 主要实验材料
24只6~7周龄SPF级雄性ApoE-/-小鼠,体质量(20.0±3.5)g,遗传背景为C57BL/6小鼠,实验动物购自西安交通大学实验动物中心,生产许可证号为SCXK(陕)2003-0007。基础饲料和高脂饲料均购自北京科奥协力饲料有限公司。BQ-788(批号B00797882)、牛血清白蛋白(bovine serum albumin,BSA;批号A00130384)、叠氮化钠(批号S00003536)、蛋白酶抑制剂混合物粉末(批号P00753839)、磷酸酶抑制剂混合物(批号P00765737)购自Sigma-Aldrich公司(美国)。ECL化学发光底物(批号W00429053)购自Merck-Millipore公司(美国)。兔单抗Caspase-1 p20(批号P091799)、兔单抗Caspase-1 p45(批号P272322)、兔单抗NLRP3(批号P150107)、兔单抗IL-1β(批号P137040)、山羊抗兔IgG(H+L)HRP二抗(批号S354028)购自CST公司(美国)。RIPA裂解液(批号17-10-2900)购自Thermo Fisher公司(美国)。油红O染色液、HE染色液套装、Masson染色液套装购自北京国药集团。IL-1β(批号04-0634)、IL-6(批号04-2639)和TNF-α(批号04-7441)的ELISA检测试剂盒购自武汉华美生物工程有限公司。酶标仪(美国BioTek,型号Synergy LX)、流式细胞仪(美国Thermo Fisher,型号Attune NxT),光学显微镜(日本Nikon,型号Ni-E)。
1.2 晚期动脉粥样硬化小鼠模型构建
24只6~7周龄SPF级雄性ApoE-/-小鼠饲养于恒温(22~25 ℃)、恒湿(相对湿度60%)、12 h/12 h明暗周期的SPF级鼠房,自由进食、饮水。将小鼠随机分为饲喂常规啮齿类动物基础饲料的正常饮食(CHOW)组、饲喂高脂饮食(high-fat diet,HFD)饲料的HFD组和饲喂HFD饲料并给予BQ-788治疗的HFD+BQ-788组,每组8只。每4只小鼠一笼,不同分组的小鼠分别饲养于不同鼠笼。HFD饲料含有21%的脂肪、0.25%的胆固醇、78.75%的基础饲料。小鼠适应性饲养至第8周龄第1天开始造模:①CHOW组小鼠从第8周龄第1天开始喂食基础饲料,并于同一天开始每隔24 h腹腔注射一次0.5 mL无菌生理盐水;②HFD组小鼠从第8周龄第1天开始连续喂食16周HFD饲料,构建晚期动脉粥样硬化小鼠模型,并于同一天开始每隔24 h腹腔注射一次0.5 mL无菌生理盐水;③HFD+BQ-788组小鼠从第8周龄第1天开始,在连续喂食16周HFD饲料的同时,于同一天开始每隔24 h腹腔注射一次BQ-788,每次3 nmol。所有鼠笼、小鼠器具和饮用水均经高压灭菌处理,基础饲料和HFD饲料均经60Coγ照射灭菌处理。
1.3 流式细胞术检测
在造模开始后第16周的第7天,从3组小鼠眼眶取血并加入枸橼酸钠,温和混匀数次。然后将抗CD16/32抗体加入抗凝全血中,室温避光孵育10 min,以阻断Fc-受体。接着进行如下处理:①加抗小鼠IgG-FITC和抗小鼠CD115-APC;然后加抗小鼠CD115-APC和抗小鼠Ly6C-percpcy5.5,温和混匀,室温避光孵育20 min;②加入含1.5%甲醛的OptiLyse溶血剂,温和混匀,室温避光放置10 min;③加入FACS缓冲液(含0.1%BSA、0.01%叠氮化钠的PBS,pH 7.4),混匀,300×g离心5 min,弃上清,再加入适量FACS缓冲液重悬细胞沉淀,然后立即上机流式细胞仪检测。以CD115-APC标记单核细胞,以Ly6C阳性标记单核细胞的炎症状态。
1.4 ELISA检测
从3组小鼠眼眶取血,然后使用IL-1β、IL-6和TNF-α的ELISA检测试剂盒,按照试剂盒说明书进行ELISA测定。使用酶标仪在450 nm处检测吸光值。
1.5 小鼠胸主动脉的采集
采用CO2对小鼠实施安乐死。然后将小鼠腹部向上,固定小鼠前后肢,用手术剪从小鼠腹底部到胸顶部剪开皮肤,打开双侧胸腔,直至暴露胸腺和肺,然后移除食管和肺以暴露心脏,使用冰预冷的PBS对心脏进行灌注。用镊子夹住与胸主动脉末端相连的横膈膜,切开主动脉与胸腔肌壁之间的结缔组织,露出主动脉弓,切断左右颈动脉和左锁骨下动脉,以便分离心脏和主动脉。分离胸主动脉后将其置于解剖盘中,滴加PBS始终保持胸主动脉湿润,然后用小镊子小心地拉出外膜脂肪并丢弃,注意避免过度操作破坏胸主动脉血管组织。切断并丢弃胸主动脉的分支血管,将胸主动脉血管浸没于新鲜制备的10%中性福尔马林溶液中,于4 ℃固定48 h。
1.6 Western blot检测
向小鼠胸主动脉血管组织中加入含有蛋白酶抑制剂混合物和磷酸酶抑制剂混合物的RIPA裂解液,然后在液氮中研磨组织,制备组织匀浆。使用BCA蛋白定量试剂盒定量总蛋白浓度。每个样本取30 μg总蛋白进行SDS-PAGE凝胶电泳,电泳条件为150 mA恒流跑积层胶,100 mA恒流跑分离胶。然后于4 ℃以80 mA恒流将PAGE胶中的蛋白通过半干转印法转印至PVDF膜上。使用含10%脱脂奶粉的TBS-T缓冲液于室温封闭PVDF膜1 h。于4 ℃孵育一抗过夜,抗体工作浓度如下:Caspase-1 p20(1∶500稀释),Caspase-1 p45(1∶1 000稀释),NLRP3(1∶500稀释),IL-1β(1∶1 000稀释)。次日加入山羊抗兔IgG(H+L)HRP二抗(1∶3 000稀释),于37 ℃孵育1 h。然后用TBS-T缓冲液洗膜;滴加ECL发光底物进行目的条带的化学发光。
1.7 油红O染色
将固定好的小鼠胸主动脉放入1.5 mL的EP管中,每管1个胸主动脉。向每管中加入1 mL新鲜配制的78%甲醇溶液,室温孵育5 min,更换新鲜甲醇溶液,重复1次。弃甲醇溶液,加入1 mL新鲜的油红O染色液,于室温孵育60 min。弃油红O染色液,加入1 mL 78%甲醇溶液清洗,室温孵育5 min,弃甲醇溶液,重复1次。随后可加入1 mL PBS,将装有胸主动脉的EP管置于4 ℃冰箱中等待观察;也可直接对动脉粥样硬化斑块进行观察。将胸主动脉置于解剖盘中,用手术剪从主动脉的升弓到左锁骨下动脉切开主动脉弓的外曲率,并纵向剖开胸主动脉;使用钢制小针将纵向剖开的胸主动脉固定,并观察、拍照,使用Image J v1.8.0进行动脉粥样硬化斑块面积的计算。动脉粥样硬化斑块面积占比(%)=动脉粥样硬化斑块面积/胸主动脉总面积×100%。
1.8 HE染色和Masson染色
将新鲜采集的小鼠胸主动脉血管浸没于新鲜制备的10%中性福尔马林溶液中,于4 ℃固定48 h,然后进行石蜡包埋并切片(5 μm)。切片经二甲苯脱蜡,重复1次;再经梯度乙醇水化。HE染色:先使用苏木精染色液对细胞核染色5 min,使用1%盐酸乙醇分化3 s,再对切片进行复蓝3 s;然后用85%和95%乙醇脱水,每次4 min;接着对切片进行伊红染色5 min;使用无水乙醇脱水5 min,重复2次;二甲苯透明化 2 min,重复1次;最后,使用中性树胶封片。Masson染色:使用Masson染色液套装进行染色,操作步骤按照套装中的说明书进行,中性树胶封片。在Nikon光学显微镜(型号Ni-E)下观察并拍照。
1.9 统计学分析
2 结果
2.1 BQ-788能够抑制血管内皮细胞NLRP3/IL1β炎症小体通路的活化
ELISA测定小鼠血清炎症因子IL-1β、IL-6、TNF-α的水平,结果显示,与CHOW组小鼠相比,HFD组小鼠上述3种炎症因子的水平均显著上升(P<0.01);与HFD组小鼠相比,HFD+BQ-788组小鼠上述3种炎症因子的水平均明显回落(P<0.05),见图1a。采用Western blot测定小鼠血管内皮细胞中炎症小体的活化水平,结果显示,与CHOW组小鼠相比,HFD组小鼠Caspase-1 p20(Caspase-1的活性形式)、NLRP3和IL-1β蛋白的表达水平显著上调(P<0.01);与HFD组小鼠相比,HFD+BQ-788组小鼠上述3种蛋白的表达水平显著下调(P<0.01);Caspase-1 p45(Caspase-1的无活性形式)在CHOW组、HFD组和HFD+BQ-788组小鼠血管内皮中的表达差异无统计学意义(P>0.05),见图1b、c。

a:ELISA测定小鼠血清炎症因子IL-1β、IL-6、TNF-α的水平;b、c:Western blot测定小鼠血管内皮细胞中Caspase-1 p20、Caspase-1 p45、NLRP3和IL-1β蛋白的表达水平 *:与CHOW组比较,P<0.05;**:与CHOW组比较,P<0.01;#:与HFD组比较,P<0.05;##:与HFD组比较,P<0.01
2.2 BQ-788能够减少促炎单核细胞数量
与CHOW组相比,HFD组小鼠全血中的单核细胞数量显著增加(P<0.01);与HFD组小鼠相比,HFD+BQ-788组小鼠全血中的单核细胞数量显著减少(P<0.01),见图2a。与CHOW组相比,HFD组小鼠全血中的促炎单核细胞Ly6Chigh数量显著增加(P<0.01),抗炎单核细胞Ly6Clow数量显著减少(P<0.01);与HFD组小鼠相比,HFD+BQ-788组小鼠全血中的Ly6Chigh数量显著回落(P<0.01),Ly6Clow数量显著增加(P<0.01),见图2b。
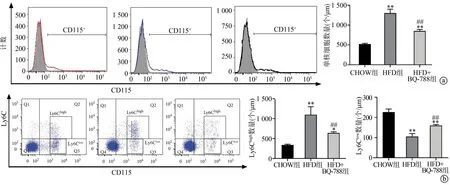
a:小鼠全血中单核细胞计数结果;b:小鼠全血中促炎和抗炎单核细胞计数结果 *:与CHOW组比较,P<0.05;**:与CHOW组比较,P<0.01;##:与HFD组比较,P<0.01
2.3 BQ-788能够缓解动脉粥样硬化斑块进展
油红O染色结果显示,CHOW组小鼠胸主动脉血管无油红O染色阳性着色区域;HFD组小鼠胸主动脉血管油红O阳性着色面积占比超过30%,与CHOW组相比显著增高(P<0.01);而HFD+BQ-788组小鼠胸主动脉血管的油红O阳性着色面积占比低于20%,显著低于HFD组(P<0.01),见图3。

a:小鼠胸主动脉血管油红O染色结果;b:油红O染色阳性着色区域统计结果 *:与CHOW组比较,P<0.05;**:与CHOW组比较,P<0.01;##:与HFD组比较,P<0.01
HE染色结果显示,CHOW组小鼠无动脉粥样硬化斑块“帽”;HFD组小鼠动脉粥样硬化斑块“帽”的平均厚度>15 μm,与CHOW组相比显著增厚(P<0.01);而HFD+BQ-788组小鼠动脉粥样硬化斑块“帽”的平均厚度<10 μm,显著小于HFD组(P<0.01),见图4。
Masson染色结果显示,CHOW组小鼠动脉血管内壁无蓝色(胶原)着色;HFD组小鼠动脉粥样硬化斑块有较大范围的蓝色(胶原)着色,与CHOW组比较显著增大;HFD+BQ-788组斑块的蓝色(胶原)着色区域范围明显缩小,见图4。

a:小鼠胸主动脉血管HE染色及Masson染色结果;b:动脉粥样硬化斑块“帽”的厚度测定结果 *:与CHOW组比较,P<0.05;**:与CHOW组比较,P<0.01;##:与HFD组比较,P<0.01
3 讨论
NLRP3与Caspase-1及接头蛋白共同组成了NLRP3炎症小体。研究证明,胆固醇晶体可诱导激活人类巨噬细胞中的NLRP3炎症小体[14]。使用ApoE-/-/Caspase-1-/-双基因敲除小鼠模型的研究表明,Caspase-1的激活在血管炎症和动脉粥样硬化斑块形成中起着关键作用,能增强病变部位的炎症水平,进而加速动脉粥样硬化的形成和恶化;而与ApoE+/+/Caspase-1+/+野生型相比,ApoE-/-/Caspase-1-/-双基因敲除小鼠的斑块面积显著减少,血清炎症细胞因子IL-1β、CCL2和TNF-α的水平明显降低[15]。一项LoDoCo研究将广泛用于治疗炎症的秋水仙碱用于ACS的二级预防,每天剂量为0.5 mg,在为期3年的随访中发现,秋水仙碱显著减少了复发性心血管事件的发生[16]。还有研究表明,秋水仙碱可抑制NLRP3炎症小体的激活[17]。miR-99a-5p通过靶向mTOR抑制NLRP3炎症小体活化,从而减轻动脉粥样硬化[18]。新型Caspase-1抑制剂VX765能够通过抑制NLRP3炎症小体的组装减轻线粒体损伤,从而抑制动脉粥样硬化斑块的形成[19]。Thioredoxin-1缓解动脉粥样硬化也是通过抑制NLRP3炎症小体的活性水平实现的[20]。本研究结果显示,ET-1 B型受体拮抗剂BQ-788也能够抑制HFD组小鼠胸主动脉的NLRP3炎症小体的活化水平,并能降低HFD组小鼠血清IL-1β、IL-6和TNF-α的水平。
此外,本研究还观察到HFD组小鼠循环系统中单核细胞亚群的显著变化。已知Ly6Chigh单核细胞是在炎症因子驱动下迁移到受伤或感染部位参与炎症反应的细胞亚群;而Ly6Clow单核细胞则是在静息脉管系统中巡逻并参与炎症消退的细胞亚群[21]。由于Ly6Chigh单核细胞将分化为类似于M1型巨噬细胞(促炎)的亚型,而Ly6Clow单核细胞将分化为类似于M2型巨噬细胞(抗炎)的亚型,这可能导致动脉粥样硬化斑块内出现不同的巨噬细胞亚型[22-23]。已知制瘤素M在动脉粥样硬化发展的多个阶段中发挥促进作用。最近研究发现,当暴露于氧化低密度脂蛋白后,制瘤素M以剂量依赖性方式在THP-1巨噬细胞表面被诱导高表达,并促进THP-1巨噬细胞活化为M1表型,加速动脉粥样硬化斑块的形成[24]。使用长链3-酮酰基辅酶A硫解酶曲美他嗪抑制脂肪酸氧化能够抑制巨噬细胞NLRP3的活化,减缓动脉粥样硬化的进展[25]。目前NLRP3炎症小体影响循环系统中单核细胞亚群的机制尚不清楚,但本研究结果显示,BQ-788在抑制NLRP3炎症小体的同时,也能够抑制单核细胞的增殖及向Ly6Chigh亚型的分化;与HFD组相比,HFD+BQ-788组小鼠全血单核细胞及Ly6Chigh亚型细胞数量明显减少,且Ly6Clow亚型细胞数量显著增加,进一步说明BQ-788具有显著的抗炎效果。随后本研究的油红O染色、HE染色和Masson染色结果明确了BQ-788治疗ApoE-/-小鼠晚期动脉粥样硬化的疗效,与HFD组相比,HFD+BQ-788组小鼠动脉粥样硬化斑块面积显著减少,斑块“帽”的厚度显著减小,斑块内胶原沉积也明显减少。这也进一步说明,炎症及炎症驱动激活的Ly6Chigh亚型单核细胞在动脉粥样硬化形成过程中的确扮演着重要的角色,以Ly6Chigh亚型单核细胞为治疗靶点或许能够探索一条减缓动脉粥样硬化进展的预防和治疗新策略。
本研究仅使用ApoE-/-小鼠构建晚期动脉粥样硬化模型这一种方式对BQ-788缓解动脉粥样硬化的疗效进行了评估,而未使用其他方式构建动脉粥样硬化模型,如使用Ldlr-/-小鼠或Ldlr-/-合并糖尿病小鼠等造模在多个动物模型上对BQ-788的疗效进行综合评估,获得的关于BQ-788治疗动脉粥样硬化的疗效评价结论具有一定的局限性[5,26]。但本研究发现,使用ET-1 B型受体拮抗剂BQ-788治疗动脉粥样硬化是通过抑制NLRP3炎症小体的激活水平和降低IL-1β的分泌发挥功效的,这为临床上广泛使用ET-1 B型受体拮抗剂类药物进行ACS的二级预防提供了临床前研究证据。
