湿酒糟中乙醇等九种成分分析及其体外拮抗物质的筛选
2022-10-28李前勇张芝金罗怡茜郭灵君张德志张余蓬
李前勇,张芝金,罗怡茜,郭灵君,张德志,张余蓬,朱 瑞
(1.西南大学动物医学院,重庆 荣昌 402460;2.重庆市兽医工程技术研究中心,重庆 荣昌 402460;3.重庆市肉牛工程技术研究中心,重庆 荣昌 402460)
酒糟(DG)是利用谷类进行酿酒发酵、蒸馏处理后的副产物,白酒、啤酒的酿造及燃料乙醇的生产均可产生酒糟[1]。我国白酒酿造历史悠久,啤酒等各类酒精饮料产业兴旺发达,也是世界上第三大燃料乙醇的生产和消费国[2],每年可产出各类酒糟1 亿吨以上[3]。因酒糟中各类营养物质较为丰富,用于动物饲料比较普遍。然而,酒糟中不仅含有可利用的营养素,还含有乙醇、乙酸、甲醛等对动物健康有一定伤害的物质,可能引发的动物酒糟中毒[4-5]。
鉴于此,本研究采用气相色谱、高效液相色谱技术测定了国产湿酒糟(白酒糟、啤酒糟)中乙醇、乙酸、乳酸、甲醛等9种物质的含量,分析其存储过程中的变动规律,并针对酒糟中乙醇、甲醛等含量较高的物质开展拮抗物质的体外筛选,以期获得国产酒糟中常见毒性成分的具体含量数据,为预防畜禽生产中湿酒糟引发的动物中毒提供参考。
1 材料与方法
1.1 酒糟样品的采集 随机采集川渝地区大酒厂、小酒厂鲜高梁型白酒糟(高粱渣占95%左右,糠壳及发酵菌残体等占5%)及啤酒厂新鲜啤酒糟各35 kg,置于洁净塑料袋内运回。随机采取每种类型酒厂的酒糟10份,200 g/份,置洁净采样袋内,做好标记后-80 ℃保存备用。另外,随机采取每种类型酒厂的酒糟15份,2000g/份,置洁净小型塑料桶内,随机分为三组,5 份/组,按照酒糟的塑料袋存储法,将酒糟装入干净的专用塑料袋内,压实后密封,1、2、3 组分别于室温下避光保存7、15、30 d,勿使样品霉败;再于各保存时间点按150 g/份随机采样10份,-80 ℃保存备用。
1.2 主要仪器及药品 气相色谱仪(GC-6280),高效液相色谱分析仪(Agilent-1100),0.45 μm 滤膜(HVLP-1450),超纯水系统(Mili-Q),电子天平(Secura125-1CN),无菌均质器(Scientz-IIL),超声振荡器(KQ5200B);磷酸(GR 级),甲醇(色谱纯)、乙醇(色谱纯)、戊醇(色谱纯)、正丙醇(色谱纯)、异戊醇(色谱纯)、异丁醇(分析纯)、甲醛(分析纯)、乳酸(分析纯)、乙酸(分析纯),碳酸氢钠(分析纯)、氧化镁(分析纯)、氧化钙(分析纯)、膨润土、腐植酸钠(精制)、蒙脱石(K-10)、分子筛(ZSM-5)。
1.3 试验方法
1.3.1 酒糟中甲醇、乙醇、戊醇、正丙醇、异戊醇、异丁醇、甲醛含量的测定 精确称取酒糟样品10 g,加超纯水15 mL,然后均质粉碎,振荡混匀后置冰水溶液中60% P(P=400 W)超声提取1 h;再定容至20 mL,密封,4 ℃下冷浸过夜萃取,最后10 000 r/min 离心10 min,取上清过0.45 μm 滤膜,留滤液待测。
样品中甲醇、乙醇等7 种成分均采用GC-6280 气相色谱仪检测,检测器为FID,色谱柱为DB-FFAP(30 m×0.25 mm,膜厚0.25 μm)。升温程序为:初始柱温35 ℃保持8 min;8~12 min,以5 ℃/min 升至60 ℃;12~20.5 min,以20 ℃/min升温至230 ℃;保持2 min。进样口温度为230 ℃,检测器温度为250 ℃;载气为高纯氮气,流量为2.0 mL/min;进样口分流比为15∶1,进样体积为1 μL。
取甲醇、乙醇、正丙醇、异戊醇、异丁醇标准品,均用超纯水稀释、定容至2.5、5、10、25、50、100 μg/mL 浓度,戊醇标准品稀释、定容至3、6、12、30、60 μg/mL 浓度,甲醛标准品稀释、定容至0.012、0.06、0.12、0.24、0.3、0.6 μg/mL 浓度,上机检测,以峰面积为横坐标、标准测定液浓度为纵坐标绘制标准曲线,运用Excel 中的Linest 函数计算其斜率、截距、相关系数、截距标准误,并 利用公式“检测限(LOD)=3.3 δ/S,定量限(LOQ)=10δ/S”计算各标准物质的LOD、LOQ。参照文献[6]进行甲醇、乙醇、正丙醇、戊醇、异戊醇、异丁醇、甲醛的精密度、回收率试验。将样品组分测得的峰面积代入标准曲线公式,计算出待测液中相应组分的浓度。
1.3.2 酒糟中乙酸、乳酸含量的测定 精确称取酒糟样品10 g,均质机捣碎,转移至20 mL 容量瓶内,加入超纯水15 mL,室温避光60% P(P=400 W)超声提取30 min;取出,用超纯水定容至20 mL,混匀,然后取上清液过0.45 μm滤膜,留滤液待测。
样品中乙酸、乳酸均采用Agilent-1100 高效液相色谱分析仪检测,方法参照文献[7]。色谱柱为TSKgel ODS-100V(4.6 mm×250 mm×5.0 μm),流动相为0.1%磷酸水溶液,流速为1 mL/min;紫外检测器,检测波长为210 nm;柱温为40 ℃,进样体积20μL。
取乙酸、乳酸标准品,均精确配制4、20、32、40、64、80 μg/mL 浓度梯度,上机检测,以峰面积为横坐标、标准测定液浓度为纵坐标绘制标准曲线,按“1.3.1”方法计算相关系数、标准物质的LOD、LOQ。参照文献[8]进行乙酸、乳酸测定的精密度、回收率试验。将样品组分测得的峰面积代入标准曲线公式,计算出待测液中乙酸、乳酸的浓度。
1.3.3 酒糟中主要毒性成分体外拮抗物质的筛选 取储存7 d 未发霉符合质量要求的白酒糟(湿,小厂)随机分为18 组,第1~17 组为试验组,第18 组为对照组(500 g/组)。试验组分别在酒糟中加入1.5%碳酸氢钠、3%膨润土,0.5%、1%、1.5%氧化镁,1%、3%、5%腐植酸钠,1%、3%、5%氧化钙,1%、3%、5%蒙脱石,1%、3%、5%分子筛,混匀后室温作用2 h,再采集酒糟试样(30 g/份,每个添加比例组10 个重复),置洁净样品袋内,同时采集对照组样品,-80 ℃下保存备用。依照“1.3.1”和“1.3.2”方法测定样品中乙醇、乙酸、乳酸、甲醛四种毒性成分的含量。
1.3.4 酒糟中水分的测定 精确称取白酒糟、啤酒糟样品各10份,50 g/份,采用GB 5009.3-2016《食品中水分的测定》方法测定样品中的水分含量。
1.3.5 数据统计 试验所得数据经Excel 2016软件整理,计算平均值xˉ和标准偏差SD,数据以xˉ±SD表示;用SPSS 19.0 软件的单因素方差分析、LSD 多重比较法分析试验组间及组内不同物质间平均含量的差异,P<0.05表示差异显著。
2 结果
2.1 各标准物质的保留时间、线性方程、相关系数 由图1~图3可知,9种标准物质均得到良好的分离,且峰形较好;表1 显示,各种标准物质的相关系数均大于0.998,表明9种物质在相应的检测方法下有良好的线性关系,可以很好地对6 种醇、甲醛、2 种酸进行定量检测;检测限和定量限均能满足试验要求。

表1 9种物质的保留时间、线性回归方程、相关系数、检测限和定量限
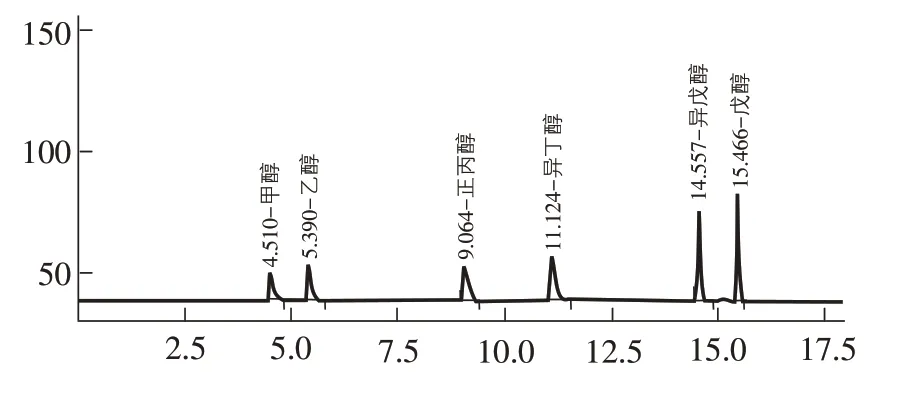
图1 6种醇标准物质的气相色谱图

图2 标准物质甲醛的气相色谱图

图3 标准物质乙酸、乳酸的HPLC图
2.2 精密度、回收率试验 试验测得9种物质的RSD(相对偏差)范围为0.17%~0.48%,表明试验所用方法有良好的精密度。
取小酒厂鲜白酒糟,分别测定甲醇等9 种物质的本底值,再在样品中添加2 个浓度水平的标准物质进行回收率试验,结果见表2。由表2 可知,9 种物质两种不同添加量的回收率在93%~102.5%之间,表明试验所用方法的回收率高,符合要求。
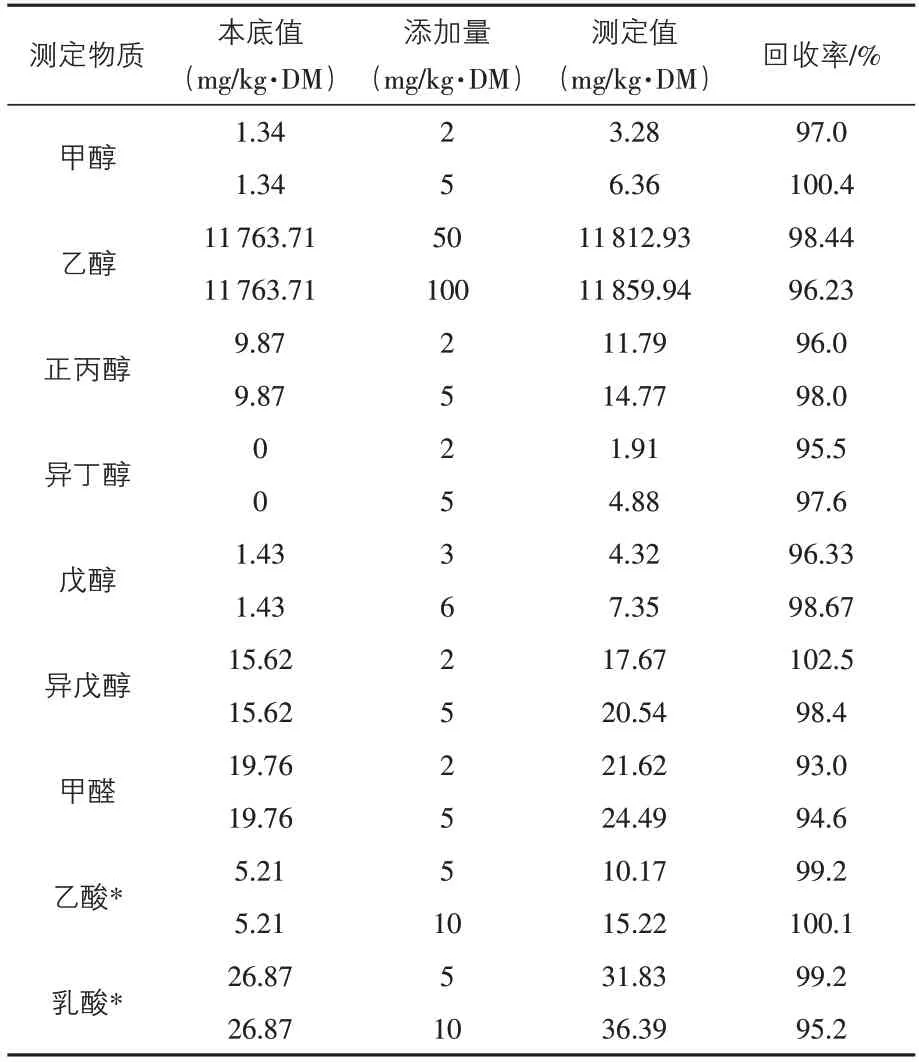
表2 9种物质回收率的测定
2.3 鲜酒糟中9 种成分的含量 参试酒糟样品中水分的测定结果:大厂白酒糟为67.34%±5.71%,小厂白酒糟为71.61%±7.83%,啤酒糟为83.75%±6.72%。该结果用于后续试验计算干酒糟各测定物质的含量。由表3 可知,几种鲜酒糟中9种物质的含量各不相同,大厂的白酒糟、啤酒糟中乳酸>乙酸>乙醇>甲醛(P<0.05),甲醇和异戊醇含量均最低,正丙醇、异丁醇、戊醇均未检出;小厂白酒糟中乳酸>乙醇>乙酸(P<0.05),甲醛、异戊醇、正丙醇含量两两间无显著差异(P>0.05),但三者含量均显著低于乙酸(P<0.05),戊醇、甲醇含量最低(P<0.05),异丁醇未检出。同种物质在不同类型酒糟中的含量也不同,甲醇以啤酒糟中含量最高(P<0.05),乙醇为小酒厂酒糟>大酒厂酒糟>啤酒糟(P<0.05),正丙醇、戊醇以小厂白酒糟的含量最高(P<0.05),其余未检出;异戊醇为小厂白酒糟>大厂白酒糟>啤酒糟(P<0.05),甲醛为白酒糟>啤酒糟(P<0.05),乙酸为大厂白酒糟>小厂白酒糟>啤酒糟(P<0.01),大厂白酒糟的乳酸显著高于其他两种类型酒糟(P<0.05)。所有酒糟中乙酸、乳酸、乙醇、甲醛的含量相对较高,乙醇含量范围为299.64~11 667.45 mg/kg·DM,乙酸含量范围为1.80~7.11 g/kg·DM,乳酸含量为25.41~92.90 g/kg·DM,甲醛含量为9.64~18.79 mg/kg·DM。
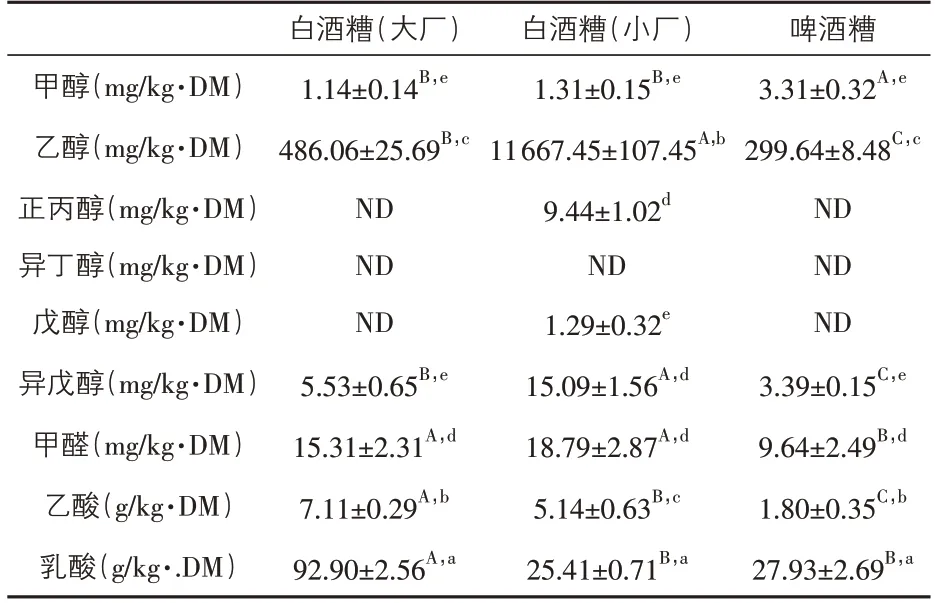
表3 鲜酒糟样品中9种物质的含量
2.4 储存酒糟中8 种物质含量的变化规律 三类酒糟中同一种物质在不同存储时间的含量变化见图4~图11。由图可知,酒糟中甲醇含量随着储存时间延长呈现显著的增加,以啤酒糟最为明显,储存30 d 达到26.78±1.93 mg/kg·DM;大厂白酒糟和啤酒糟中的乙醇含量随储存时间延长呈现显著的增加,储存30d分别达到5331.53±138.48、7 362.26±93.99 mg/kg·DM,但小厂白酒糟中的乙醇含量在储存15 d后有显著下降;啤酒糟中正丙醇含量随储存时间延长显著增加,小厂白酒糟只是在储存7 d 时有显著增加;小厂白酒糟中的戊醇含量在存储15 d后呈现显著下降;大厂白酒糟和啤酒糟中的异戊醇含量在储存7、15 d 时显著增加,小厂白酒糟的异戊醇含量在储存7 d 及以后显著增加。

图4 储存酒糟中甲醇的含量变化

图5 储存酒糟中的乙醇含量变化
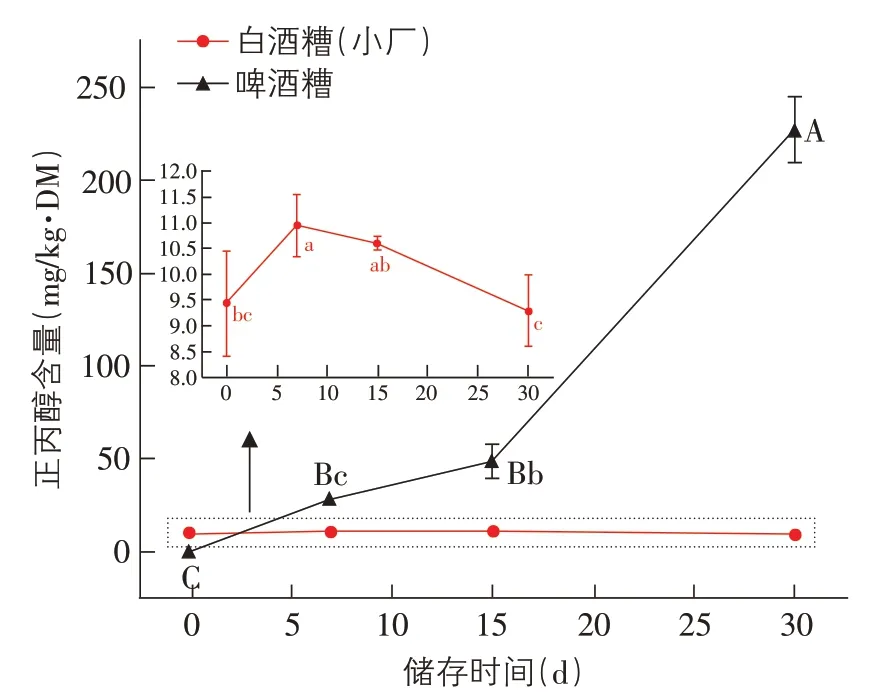
图6 储存酒糟中正丙醇的含量变化

图7 储存酒糟中异戊醇的含量变化

图8 储存酒糟中戊醇的含量变化
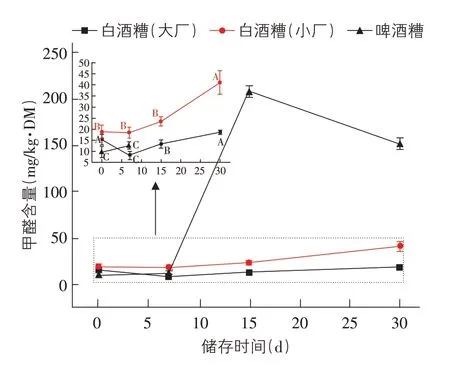
图9 储存酒糟中甲醛的含量变化

图10 储存酒糟中乙酸的含量变化

图11 储存酒糟中乳酸的含量变化
小厂白酒糟和啤酒糟中的甲醛含量随储存时间延长而增加,以啤酒糟储存15d时达到最高值(208.62±5.87 mg/kg·DM),大厂白酒糟在储存7、15d时甲醛含量显著降低。大厂白酒糟和啤酒糟中的乙酸含量随储存时间延长而增加,以大厂白酒糟储存15d时达到最高值(12.73±0.13g/kg·DM),小厂白酒糟中的乙酸含量随储存时间延长而降低。三种类型酒糟中的乳酸含量均随储存时间延长而出现显著下降,以啤酒糟储存30 d 时含量最低(1.98±0.42 g/kg·DM)。
2.5 酒糟中主要毒性成分体外拮抗物质的筛选 本试验以酒糟中乙醇、乙酸、乳酸、甲醛四种主要毒性成分为检测对象,研究了碳酸氢钠、膨润土、氧化镁等7种物质对其体外拮抗的作用(表4)。结果显示,与对照组中的乙醇含量比较,酒糟经7种物质不同浓度处理后乙醇含量均极显著降低(P<0.01),其中,用1%蒙脱石和1%氧化钙处理后乙醇的检出量最低,其次是0.5%、1%氧化镁,而1.5%碳酸氢钠、5%氧化钙和1%、3%分子筛的作用最差。除5%氧化钙外,酒糟经7种物质不同浓度处理后乙酸含量均显著降低(P<0.05),其中,用1.5%碳酸氢钠和1%、5%蒙脱石以及1.5%氧化镁处理后乙酸的检出量最低,其次是3%膨润土、3%蒙脱石和0.5%、1%氧化镁、1%腐植酸钠,3%、5%氧化钙的作用最差。除3%蒙脱石、1%和5%分子筛外,用7 种物质其他浓度处理后的酒糟,其乳酸含量均极显著降低(P<0.01),其中,用1.5%氧化镁处理后乳酸的检出量最低,其次是1%氧化镁和3%、5%氧化钙,1%、5%的分子筛和3%、5%蒙脱石的作用最弱。用不同浓度氧化镁、氧化钙、蒙脱石、分子筛处理后的酒糟,其甲醛含量均极显著降低(P<0.01),其中,3%、5%分子筛和3%、5%氧化钙处理后甲醛的检出量最低,其次为1%、1.5%氧化镁、1%氧化钙及1%分子筛,各浓度腐植酸钠、1.5%碳酸氢钠及3%膨润土的作用最弱。

表4 不同浓度的7种物质对酒糟中4种主要毒性成分的处理效果
3 讨论
本试验基于我国白酒、啤酒的现行生产工艺,以兽医内科教材记载的酒糟中的主要毒性成分为依据,检测和分析了鲜湿高粱型白酒糟、储存高粱型白酒糟及啤酒糟中9 种成分的含量。结果表明,鲜啤酒糟、不同类型酒厂的白酒糟中9 种成分的含量各不相同,但所有酒糟中乙醇、乙酸、乳酸、甲醛的含量相对较高,异戊醇在三种酒糟中均能很好的检出;储存试验期内,啤酒糟、大厂白酒糟中的乙醇、乙酸含量随储存时间延长而显著增加,小厂白酒糟则呈现显著下降;三种酒糟中的乳酸含量均随储存时间延长而出现显著下降;啤酒糟和小厂白酒糟中的甲醛含量随储存时间延长而增加,大厂白酒糟在储存15 d 后显著降低。需要说明的是,我国幅员辽阔,各地酿造白酒的原料、工艺等差别较大,本试验所得结果并不能完全反映各地酒糟中已测成分的含量,还需作进一步的研究。
Thokozani 等[9]研究指出,常人若每天摄入乙醇69.9~373.4 mL,则有发生乙醇中毒的高风险;而当意外摄入4.74 mg的甲醇,则会造成人的中毒死亡[10]。动物鲜酒糟可引起以乙酸中毒为主的症状;长期大量摄入乳酸,可降低胃肠道内容物的酸度,影响微生物区系,降低消化机能和钙的吸收。在酒糟中加入1%~1.5%碳酸氢钠或0.1%~1%生石灰,是目前预防动物酒糟中毒的常见策略[10],但尚未相关的试验报道。膨润土是一种极性吸附剂,依靠其静电引力和热运动的平衡作用可实现物理吸附作用,通过水合作用、离子和分子的相互作用及共价键和氢键结合等还可实现化学吸附作用[11]。氧化镁为碱性氧化物,有吸附作用,作为反刍动物饲料的无机镁源,近年来以饲料添加剂的形式广泛应用于奶牛饲养中[12]。提纯的腐植酸钠呈碱性(pH值在8~11之间),有较强的吸附和螯合作用,在畜牧兽医上主要用于动物的饲料添加剂,发挥增进食欲、提高抗病力、促进生长等作用[13]。蒙脱石的主要成分为硅铝酸盐,表面有大量微孔,有强力的吸附作用,具备吸附重金属、霉菌毒素、病原菌、细菌毒素和维护胃肠道黏膜及防治腹泻等功效,已广泛应用于动物生产中[14]。分子筛具有丰富的孔道结构、良好的稳定性及极好的选择性吸附作用,在环境保护、食品及化妆品加工、精细化工等方面应用广泛[15]。氧化钙为碱性氧化物,用其处理反刍动物粗饲料,可促进粗饲料细胞壁水解,提高消化率[16]。
本试验选择上述具有吸附、中和酒糟中酸类、醇类作用的物质,研究其体外拮抗酒糟中主要毒性成分的效果,结果显示:对乙醇拮抗作用最强的是1%蒙脱石和1%氧化钙,对乙酸拮抗作用最强的是1.5%碳酸氢钠和1%、5%蒙脱石以及1.5%氧化镁,对乳酸拮抗作用最强的是1.5%氧化镁,对甲醛拮抗作用最强的有3%、5%分子筛和3%、5%氧化钙。总的来看,对4种毒性成分综合拮抗作用最好的是1%氧化镁,而1%氧化钙、1%蒙脱石也可发挥一定的拮抗作用。
4 结论
本试验对来自川渝地区大、小白酒厂的高粱型白酒糟、啤酒糟中乙醇等9 种物质进行了测定分析,结果得出乙醇、乙酸、乳酸、甲醛的检出量较高,按干物质计算,乙酸、乳酸及乙醇含量可达克级水平;储存30 d 内,啤酒糟中的乙醇、乙酸、甲醛含量均呈显著上升,大酒厂酒糟中的乙醇、乙酸含量呈显著上升,而小酒厂鲜糟中的乙醇、乙酸、甲醛含量随储存时间延长而显著下降,三类酒糟中的乳酸含量均在储存过程中显著下降,但均高于其他几种物质的含量。在对酒糟主要毒性成分体外拮抗物质的筛选中,以1%氧化镁效果最好,考虑动物摄入镁过多的风险,结合试验中0.5%~1%氧化镁均可有效降低酒糟中乙醇、乙酸、乳酸、甲醛检出量的结果,建议生产中选择适当的氧化镁浓度。
