低聚木糖复配冻干保护剂的优化及其对双歧杆菌微胶囊性能的影响
2022-10-27张传伟朱慧霞柴佳太彭洪草姚日生
张传伟,朱慧霞,柴佳太,彭洪草,姚日生
(合肥工业大学食品与生物工程学院,安徽合肥 230009)
低聚木糖(Xylo-oligosaccharide,XOS,又称木寡糖,是由2~6个木糖以-1,4糖苷键连接形成的低聚物,其中木二糖含量越高,产品质量越好。低聚木糖具有多种生物学功能,被誉为“超强益生元”,可以有效刺激肠道益生菌的生长,促进短链脂肪酸的产生,从而改善肠道微生物种群,增强机体肠道健康。同时,低聚木糖还具有促进钙的吸收、预防龋齿和降低血糖、胆固醇等生理功能。有研究表明,在益生菌的冻干过程中,添加适量的低聚木糖可以有效提高益生菌的冻干存活率,达到冻干保护和益生的双重作用。
传统的益生菌产品在加工和宿主胃肠道递送过程中,活菌量会显著下降,难以发挥益生作用。而通过微囊化技术将益生菌包埋在微囊壁材中,可以有效抵抗外界的不良环境,提高益生菌的存活率。益生菌微胶囊的制备方法主要包括挤出、乳化、凝聚等。冷冻干燥是微胶囊干燥脱水的最适宜技术,但需要加入适宜的冻干保护剂来减少菌体死亡。糖类是常用的冻干保护剂,且常以蛋白质、氨基酸和多羟基醇等与其复配。大量研究表明,功能性低聚糖在益生菌微胶囊中具有不错的应用前景。邹盈等研究发现,低聚异麦芽糖在副干酪乳杆菌微胶囊中具有良好的冷冻保护效果。何荣军等报道中表明,在微胶囊壁材中添加黑木耳低聚糖能够明显增加嗜酸乳杆菌微胶囊的活菌载量以及对不良环境的抗性。同样,Rajam等发现在乳清蛋白壁材中加入低聚果糖,可以有效提高植物乳杆菌冻干过程中的细胞活力。低聚木糖作为新型功能性益生元,具有良好的抗冻性能,但以其复配的冻干保护剂在微胶囊中的应用国内外研究较少。另外,微胶囊保护剂的研究通常局限于益生菌的包埋和冻干保护方面,而在胃液耐受、肠液释放以及储藏等方面研究尚为不足。
基于此,本文以人体重要益生菌双歧杆菌()为菌株,进行微胶囊包埋处理,探讨了低聚木糖对双歧杆菌微胶囊的包埋效果和冻干保护影响。在此基础上,选用低聚木糖、谷氨酸钠和甘油进行复配,以最终活菌负载率为指标,通过正交试验确定最优保护剂配比,同时还评估了添加最优复配保护剂对微胶囊的性能影响。本研究可以解决益生菌微胶囊在生产和使用过程中活菌损失等问题,具有广泛的应用价值。
1 材料与方法
1.1 材料与仪器
双歧杆菌(,CGMCC 1.5029)中国普通微生物菌种保藏管理中心;MRS培养基北京索莱宝科技有限公司;低聚木糖(纯度为78%)
参照何欢方法制备;乳清蛋白、壳聚糖、胃蛋白酶(250 U/mg)、胰蛋白酶(2500 U/mg) 上海源叶生物股份有限公司;盐酸、氯化钙、海藻酸钠、磷酸氢二钾、磷酸二氢钾、甘油、谷氨酸钠 国药集团化学试剂有限公司。
EYQX-II厌氧培养箱 上海智诚分析仪器制造有限公司;YXQ-LS-70A立式高压灭菌锅 上海申安医疗器械厂;TF-FD冷冻干燥机 上海田枫实业有限公司;JSM-6490LV扫描电子显微镜 日本电子制造有限公司;D-37520冷冻高速离心机 德国Sigma公司。
1.2 实验方法
1.2.1 微胶囊的制备 参照周莉等的方法并略作改动,以海藻酸钠、乳清蛋白为壁材,采用挤压法制备微胶囊,具体方法如下:
将双歧杆菌接种MRS液体培养基,于37 ℃厌氧培养24 h,连续活化3次后,离心(5000 r/min,5 min)收集菌泥,用0.9%生理盐水洗涤两次后,重悬于生理盐水中,使得浓缩菌液维持在10CFU/mL,采用倾注平板法对浓缩菌液进行计数。
取一定量的浓缩菌液,加入冻干保护剂,与2%海藻酸钠和10%的乳清蛋白按1:1:1比例混匀成菌悬液,磁力搅拌30 min。采用1 mL注射器逐滴加入2%的氯化钙中,静置30 min,生理盐水洗涤3次,得湿胶囊,将样品在-80 ℃中预冻1 h后,于冷冻干燥机中冻干24 h,得冻干微胶囊。在浓缩菌液中,加入等量保护剂直接冷冻干燥后,得冻干菌粉。
1.2.2 含低聚木糖复配冻干保护剂的设计
1.2.2.1 单因素实验 低聚木糖添加量的筛选:分别按照浓缩菌液的 0%、2.0%、4.0%、6.0%、8.0%、10.0%加入低聚木糖,充分混匀后进行制备冻干微胶囊,并测定其包埋率、冻干存活率和最终活菌载率。
甘油添加量的筛选:在最佳低聚木糖含量的基础上,分别加入0%、1.0%、2.0%、3.0%、4.0%、5.0%的甘油于浓缩菌液中,充分混匀后制备微胶囊,并测定其包埋率、冻干存活率和最终活菌载率。
谷氨酸钠添加量的筛选:在最佳低聚木糖含量的基础上,分别加入0%、1.0%、2.0%、3.0%、4.0%、5.0%的谷氨酸钠于浓缩菌液中,充分混匀后制备微胶囊,并测定其包埋率、冻干存活率和最终活菌载率。
1.2.2.2 正交试验 在单因素实验的基础上,按表1进行正交试验,以双歧杆菌最终活菌载率为考察指标,确定复配保护剂的最佳配比。

表1 正交试验因素水平表Table 1 Factors and levels of orthogonal experiment
1.2.3 包埋率、冻干存活率和最终活菌载率计算取1 g湿(冻干)微胶囊于锥形瓶中,加入10 mL无菌 PBS缓冲液(pH=7.4),于37 ℃ 振荡1 h,用 0.9%灭菌生理盐水进行梯度稀释,使用倾注平板法进行精确计数。包埋率、冻干存活率以及最终活菌载率计算公式如下:
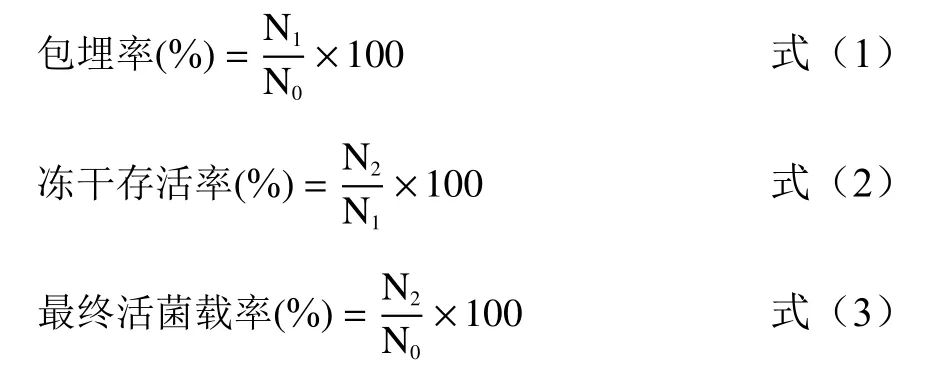
式中 N:原菌悬液总的活菌数(CFU);N:湿胶囊中总的活菌数(CFU),每克湿胶囊中的活菌量乘以总的湿胶囊质量;N:冻干微胶囊中总的活菌数(CFU),每克冻干胶囊中的活菌量乘以总的冻干胶囊质量。
1.2.4 微胶囊的扫描电子显微镜分析 用JSM-6490LV仪器拍摄双歧杆菌微胶囊扫描电子显微照片,以未添加复配保护剂的微胶囊为对照。
1.2.5 微胶囊在模拟胃液中的耐酸试验 模拟胃液配制:参照Dehkordi等的方法,将8.5 g的NaCl和3.0 g的胃蛋白酶悬浮在 7.0 mL的浓HCl中,并用蒸馏水稀释至1 L,使得溶液pH为2.0。分别取1 g添加保护剂和未添加保护剂的微胶囊置于锥形瓶中,并加入10 mL的模拟胃液,于37 ℃下振荡2 h,分别在 0、10、30 min,1、2 h取样离心(5000 r/min,5 min)收集微胶囊,并加入10 mL的无菌PBS缓冲液(pH=7.4),于37 ℃下振荡1 h,使用倾注平板法进行精确计数,以初始微胶囊中的活菌数为基准,计算其存活率,其中以双歧杆菌冻干菌粉为对照。
1.2.6 微胶囊在模拟肠液中的释放试验 模拟肠液的配制:参照 Shafizadeh等的方法,取6.8 g的KHPO和10 g的胰蛋白酶溶于适量的蒸馏水中,用1 mol/L NaOH将pH调至7.5±0.1后,稀释至1 L备用。分别取 1 g添加及未添加冷冻保护剂的微胶囊置于锥形瓶中,随后加入10 mL的模拟肠液,于37 ℃恒温振荡器中振荡培养3 h,依次在20、40 min,1、2、3 h取样,使用倾注平板法进行精确计数,以最大活菌释放量为基准,计算其释放率,其中以双歧杆菌冻干菌粉为对照。
1.2.7 微胶囊贮存稳定性试验 将添加及未添加保护剂的冻干微胶囊分别在4和25 ℃下避光贮存35 d,每隔7 d取1 g样品,加入10 mL的无菌PBS缓冲液,于37 ℃下振荡1 h,使用倾注平板法测定双歧杆菌活菌数,其中以双歧杆菌冻干菌粉为对照。
1.3 数据处理
所有试验均进行3组平行试验,结果以平均值±标准差表示,采用SPSS 20.0软件进行显著性分析。
2 结果与分析
2.1 单因素实验结果
2.1.1 低聚木糖添加量对冻干微胶囊活菌载率的影响 添加不同质量分数的低聚木糖对冻干微胶囊活菌载率的影响如图1所示,在一定范围内,低聚木糖可以显著提高微胶囊的活菌载率,在质量分数为4%时,达到最大,为63.4%。低聚木糖可以增加微胶囊壁材的黏度,减小了孔径并形成了更加紧密的网络,从而减少了益生菌的损失。同时,功能性低聚糖还可以替代水分子与细胞膜磷酸基团发生氢键作用,从而在避免冻干过程中细胞脱水造成细胞膜破损,降低菌体死亡。因此,如图1所示,适量的低聚木糖加入可以同时提高微胶囊的包埋效果和双歧杆菌的抗冻性。而当低聚木糖添加量超过4%时,微胶囊的最终活菌载率逐渐降低,这是由于低聚糖含量过高,会增加微相分离,产生较大的孔径,使得菌体流失,从而降低微胶囊的包埋率。综上,选择2%~6%的低聚木糖添加量进行后续正交试验。
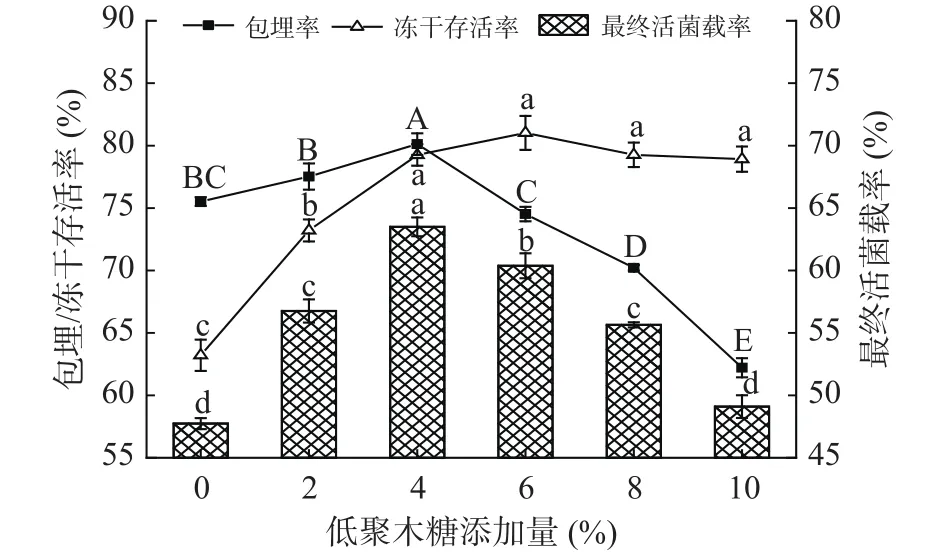
图1 低聚木糖添加量对微胶囊的包埋率、冻干存活率和最终活菌载率的影响Fig.1 Effects of XOS content on embedding rate, freeze-drying survival rate and final active bacteria loading rate of microcapsules
2.1.2 甘油添加量对冻干微胶囊活菌载率的影响保持低聚木糖添加量为4%,甘油添加量对冻干微胶囊的活菌载率影响如图2所示。随着甘油量的增加,微胶囊的活菌载率先增高后降低,在添加量为2%时,达到最大值,为67.5%。主要原因是甘油作为优良的冻干保护剂,不仅可以减少冷冻过程中的冰晶产生,还可以与细胞膜上的蛋白质结合,从而维持细胞结构的完整性,减少菌体死亡。但过多甘油加入,会使得微胶囊的包埋效果降低,从而减少微胶囊的最终活菌载率。综上,选择1%~3%的甘油添加量进行后续正交试验。
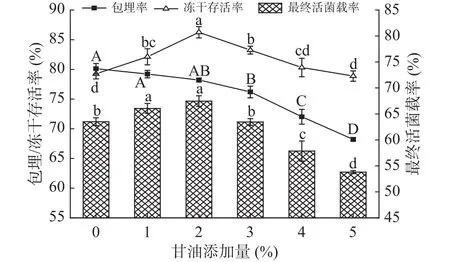
图2 甘油添加量对微胶囊的包埋率、冻干存活率和最终活菌载率的影响Fig.2 Effects of glycerol content on embedding rate, freezedrying survival rate and final active bacteria loading rate of microcapsules
2.1.3 谷氨酸钠添加量对冻干微胶囊活菌载率的影响 保持低聚木糖添加量为4%,谷氨酸钠添加量对微胶囊的活菌载率影响如图3所示,当谷氨酸钠添加量为1%时,谷氨酸钠可以显著增强微胶囊的活菌载率。由于谷氨酸钠具有还原性,可以延展乳清蛋白的结构,使得菌体更好与壁材接触,从而提高微胶囊的包埋效果,而且谷氨酸钠还可以防止冻干过程中细胞内蛋白质的变性,增强益生菌的抗冻性能。但过多的谷氨酸钠会导致单位质量微胶囊中菌含量减少,降低微胶囊的包埋率,同时谷氨酸钠浓度过高也会造成胞内渗透压增加,不利于低温保存。因此,当继续增加谷氨酸钠时,微胶囊的最终活菌载率逐渐降低。综上,为进一步研究谷氨酸钠在复配保护剂中的协同效果,选择1%~3%的谷氨酸钠添加量进行后续正交试验。
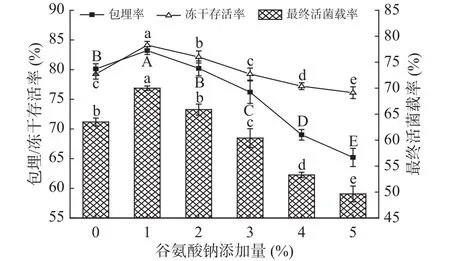
图3 谷氨酸钠添加量对微胶囊的包埋率、冻干存活率和最终活菌载率的影响Fig.3 Effects of sodium glutamate content on embedding rate,freeze-drying survival rate and final active bacteria loading rate of microcapsules
2.2 正交试验结果
在单因素实验的基础上,进行正交试验,以最终活菌载率为基准,确定低聚木糖、甘油、谷氨酸钠3种保护剂的复配浓度,试验结果和方差分析见表2、表3。
由表2、表3可知,影响微胶囊最终活菌量的因素主要次序是低聚木糖>谷氨酸钠>甘油,其中低聚木糖的值小于0.05,说明低聚木糖含量对微胶囊的最终活菌载量具有显著性影响。根据K值,确定最佳配方为ABC,即低聚木糖4.0%,甘油2.0%,谷氨酸钠1.0%。经验证,最佳配方下的双歧杆菌微胶囊包埋率为81.5%±0.7%,冻干存活率为88.1%±0.3%。此时微胶囊的最终活菌负载率为71.8%±0.2%,优于正交试验表中的结果,因此认为正交试验优化结果有效。

表2 正交试验结果Table 2 Results of orthogonal test
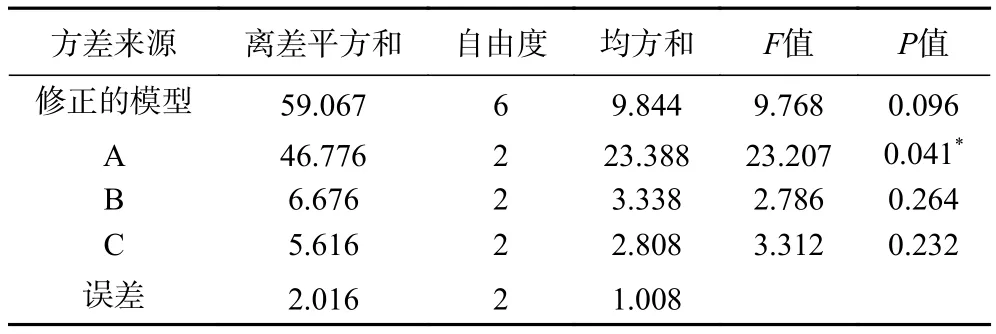
表3 正交试验方差分析Table 3 The variance analysis of orthogonal experiment
2.3 微胶囊的表观形态分析
冻干微胶囊的扫描电镜观察结果如图4所示。微胶囊粒径大小约为1 mm左右,表面呈皱缩塌陷,凹凸不平的现象,这是由于冷冻干燥过程中脱水造成的。添加4%低聚木糖保护剂的微胶囊(图b)相对于对照组(图a),表面孔径较少,没有明显的裂缝。低聚木糖具有低分子量的短链结构,能够填充于由海藻酸钠与乳清蛋白相互作用产生的分子空间,产生更具凝聚力的结构,从而提高包埋效果。由于复配保护剂的冻干保护效果更佳,可以更有效地减缓冻干过程中冰晶的升华,因此,添加复配保护剂的微胶囊(图c)更加圆润包满,且表面平整致密。

图4 双歧杆菌微胶囊的扫描电镜观察结果Fig.4 SEM results of Bifidobacterium microcapsules
2.4 微胶囊在模拟胃液中的耐酸性能
如图5所示,未包埋的益生菌粉经模拟胃液处理2 h后,菌体几乎全部死亡,而经包埋的益生菌存活率下降了49.4%,说明益生菌微胶囊化可以有效抵抗胃酸等不良环境。此外,添加复配保护剂的微胶囊经模拟胃液处理2 h后,其活菌数只下降了34.1%,说明保护剂可以提高双歧杆菌微胶囊的耐酸性,一方面低聚木糖的加入使得微胶囊结构更加致密,减少酸的渗入,另一方面,低聚木糖与低聚果糖的性能类似,与乳清蛋白形成的壁材具有一定缓冲能力,在抗酸方面也发挥了重要作用。此外,谷氨酸钠的添加也会诱导某些与菌体生物膜及信号转导有关的蛋白表达发生改变,从而有利于其在酸性环境中生存。
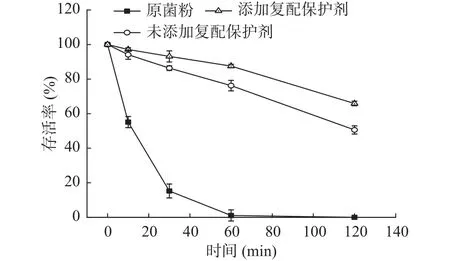
图5 原菌粉和微胶囊在模拟胃液中的存活率Fig.5 Survival rate of Bifidobacterium powders and microcapsules in SGF
2.5 微胶囊在模拟肠液中的释放性能
微胶囊在模拟肠液中的释放性能如图6所示,经包埋的益生菌微胶囊具有一定缓释作用,在60 min几乎全部释放,其活菌数约10CFU/mL,其中添加含低聚木糖复配保护剂的微胶囊在前60 min的释放量高于未添加的微胶囊。原因可能是添加复配保护剂的微胶囊,活菌载量更高,而且低聚木糖作为功能性益生元,可以充当营养物质刺激促进双歧杆菌的生长。因此,添加复配保护剂的微胶囊能够较好地在人工肠液中崩解,并且达到益生元和益生菌的协同作用。

图6 原菌粉和微胶囊在模拟肠液中的释放率Fig.6 Release rate of Bifidobacterium powders and microcapsules in SIF
2.6 微胶囊的储存性能
由图7、图8可知,在4 ℃和25 ℃贮藏一定时间后,经微胶囊化的益生菌存活率显著高于冻干菌粉(<0.05),说明微胶囊技术提高了双歧杆菌的储存稳定性。微胶囊壁材可以作为物理屏障,阻隔空气中氧和水分等不良因素,增强双歧杆菌的抵抗能力。添加低聚木糖复配剂的微胶囊,在4 ℃和25 ℃下贮藏35 d后,活菌量分别为8.1和7.0 lg CFU/g,相对未添加保护剂的微胶囊储藏性更好,且符合《益生菌类保健食品申报与审评规定(试行)》,原因可能是复配保护剂中低聚木糖和谷氨酸钠具有一定还原性,可以更有效减少菌体细胞膜脂质的氧化,维持双歧杆菌的稳定性。
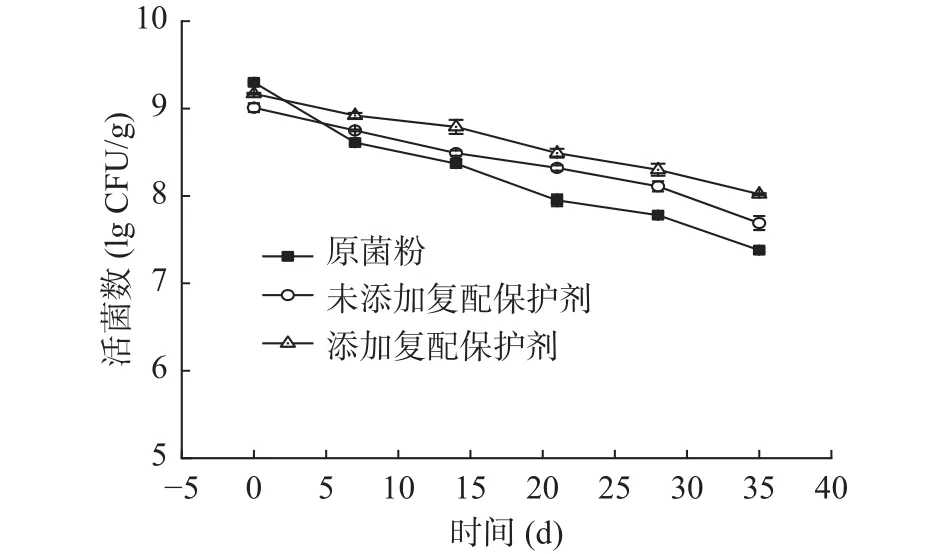
图7 双歧杆菌菌粉和微胶囊在4 ℃的稳定性Fig.7 Stability of Bifidobacterium powders and microcapsules at 4 ℃
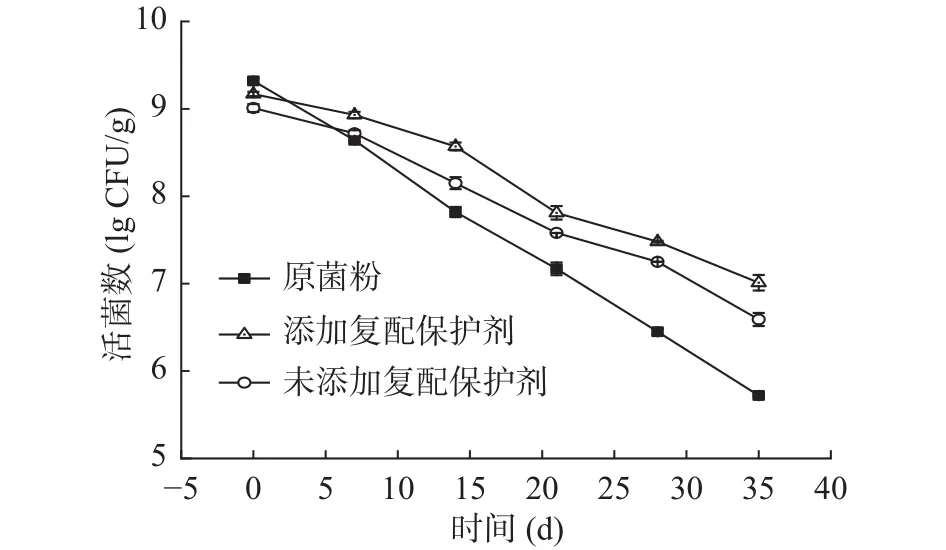
图8 双歧杆菌菌粉和微胶囊在25 ℃的稳定性Fig.8 Stability of Bifidobacterium powders and microcapsules at 25 ℃
3 结论
本研究表明在以海藻酸钠和乳清蛋白为壁材制备的双歧杆菌微胶囊中,添加以低聚木糖复配的冻干保护剂可以提高冻干微胶囊的活菌载率,最佳配方为低聚木糖4.0%、甘油2.0%、谷氨酸钠1.0%,此时微胶囊的活菌载率为71.8%±0.2%,与未添加组相比提高了约21.6%;添加以低聚木糖复配保护剂的微胶囊表面更佳平整致密,经模拟胃液处理2 h后,活菌量相对于对照组提高约15.3%,同时在肠液中前60 min的释放率也明显高于未添加组。经4 ℃和25 ℃储藏35 d后,加入保护剂的微胶囊活菌量相比与未添加组分别提高了约0.41 lg CFU/g和0.42 lg CFU/g。因此,低聚木糖复配保护剂可以提高双歧杆菌微胶囊的胃液耐酸性、肠液释放性和储藏稳定性。本研究结果不仅为低聚木糖作为保护剂在益生菌冻干制剂的应用奠定了良好的基础,同时也为双歧杆菌冻干微胶囊的制备提供理论和实践意义。
