基于HPLC-QAMS及化学计量学的利胆石颗粒质量评价研究
2022-10-14刘艳芬
刘艳芬,段 芳,张 翘,郭 丹*
基于HPLC-QAMS及化学计量学的利胆石颗粒质量评价研究
刘艳芬1,段 芳1,张 翘2,郭 丹1*
1. 南方医科大学南方医院 药学部,广东 广州 510515 2. 广东食品药品职业学院中药学院,广东 广州 510520
建立HPLC一测多评法(quantitative analysis of multi-components by single-marker,QAMS)法联合化学计量学对利胆石颗粒质量控制的方法。采用HPLC-QAMS对3个厂家的10批利胆石颗粒中双去甲氧基姜黄素、去甲氧基姜黄素、姜黄素、柚皮芸香苷、橙皮苷、川陈皮素、3,5,6,7,8,3′,4′-七甲氧基黄酮、橘红素、香附烯酮、圆柚酮和α-香附酮含量进行同时检测;再利用SPSS 26.0、SIMCA 14.1软件对上述指标的QAMS法计算数据进行层次聚类分析(hierarchical cluster analysis,HCA)、主成分分析(principal component analysis,PCA)及偏最小二乘-判别分析(partial least squares-discriminant analysis,PLS-DA),综合评价利胆石颗粒质量及标志性成分。11种成分分别各自范围内线性关系良好(>0.999 3);平均加样回收率在96.87%~100.08%,RSD在0.66%~1.56%;HPLC-QAMS法所测结果与外标法(ESM)无显著性差异;通过化学计量学分析,10批利胆石颗粒聚为3类,同一厂家聚为一类,不同厂家的质量存在一定的差异,柚皮芸香苷(VIP=1.745)、橙皮苷(VIP=1.470)、香附烯酮(VIP=1.350)和姜黄素(VIP=1.188)可能是影响利胆石颗粒产品质量差异的标志物。所建立的HPLC-QAMS法多指标成分定量控制及化学计量学模式识别专属性强,可用于利胆石颗粒质量控制和综合评价。
利胆石颗粒;一测多评法;偏最小二乘-判别分析;化学计量学;质量评价;双去甲氧基姜黄素;去甲氧基姜黄素;姜黄素;柚皮芸香苷;橙皮苷;川陈皮素;3,5,6,7,8,3′,4′-七甲氧基黄酮;橘红素;香附烯酮;圆柚酮;α-香附酮;层次聚类分析;主成分分析
中医药是中华民族智慧的结晶,在预防与治疗疾病方面发挥了重要的作用。但目前中药复方制剂质量评价标准不完善、均一性差一直是行业发展的首要问题,中药制剂由多种药味根据中医药配伍理论组方,中药材本身受基原多、品种多、产地广、成分繁杂、作用复杂(或制约或协同)的影响,质量和疗效的一致性不能保证。
利胆石颗粒具有疏肝利胆、和胃健脾的功效,由郁金、陈皮、青皮、枳壳、香附、神曲、茵陈、紫苏梗等15味中药材加工而成,主要用于胆囊结石、胆道感染、胆道术后综合症的治疗。其处方源于卫生部药品标准中药成方制剂第十二册[1],质量标准未制定含量测定项,相关文献报道[2]仅对橙皮苷进行定量控制。对于由15味中药材组方的制剂来说,仅测定单一成分难以准确评价其综合质量,也不能从根本上保证产品质量,更不能保证疗效和安全性。但中药成分对照品不易提纯、不稳定、价高也造成多指标多成分质量控制模式难以推广,一测多评法(quantitative analysis of multi-components by single-marker,QAMS)是采用一种相对易得、价廉的内参比物质对照品,实现对多个成分的同时测定;化学计量学应用数学、统计学与计算机科学的工具和手段及其最新成果进行设计或选择最优测量方法,主要包括层次聚类分析(hierarchical cluster analysis,HCA)、主成分分析(principal component analysis,PCA)、判别分析(discriminant analysis,DA)和人工神经网络。可以根据多变量数值分析把同类与异类中药材区别开,近年来,HPLC-QAMS法[3-4]及化学计量学[5]越来越多地应用于中成药复方制剂质控研究中。
本实验参考中药质量标志物[6-7]确认依据,以君药香附和陈皮为首选,同时兼顾臣药青皮、郁金和神曲及佐药枳壳,选取它们所含主要成分进行分析,其中香附疏肝解郁、理气宽中,主要药效成分为香附烯酮、圆柚酮和α-香附酮等[8],陈皮、青皮和枳壳理气健脾、宽中行滞、疏肝,主要含黄酮苷类成分柚皮芸香苷、橙皮苷、川陈皮素、3,5,6,7,8,3′,4′-七甲氧基黄酮(3,5,6,7,8,3′,4′-heptamethoxyflavone,HMOF)和橘红素[9],郁金利胆退黄、行气解郁、清心凉血,主要含姜黄素类成分双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素[10],综合考虑,最终选取质稳价廉的橙皮苷为内参比物质,采用HPLC- QAMS法并结合化学计量学对利胆石颗粒中双去甲氧基姜黄素、去甲氧基姜黄素、姜黄素、柚皮芸香苷、橙皮苷、川陈皮素、HMOF、橘红素、香附烯酮、圆柚酮和α-香附酮含量进行同时检测及评价分析,以期完善该制剂的控制手段,确保产品质量稳定和临床疗效的一致性。
1 仪器与材料
1.1 仪器
Thermo Ultimate 3000型高效液相色谱仪,美国Thermo Fisher公司;Waters e2695型高效液相色谱仪,美国Waters公司;Venusil XBP C18柱,博纳艾杰尔公司;Cosmosil C18柱,Nacalai Tesque公司;Kromasil 100-5-C18柱,Akzo-Nobel公司,规格均为250 mm×4.6 mm,5 μm;Sartorius CP225D型电子天平,赛多利斯科学仪器有限公司。
1.2 试药
对照品双去甲氧基姜黄素(批号112004- 201501,质量分数95.0%)、去甲氧基姜黄素(批号112003-201501,质量分数98.5%)、姜黄素(批号110823-202107,质量分数98.1%)、橙皮苷(批号110721-202019,质量分数95.3%)、川陈皮素(批号112055-202102,质量分数99.7%)和α-香附酮(批号110748-201815,质量分数99.7%)购于中国食品药品检定研究院;对照品柚皮芸香苷(批号PRF9062802,质量分数99.8%)、HMOF(批号PRF10032041,质量分数99.7%)、橘红素(批号PRF8063048,质量分数98.7%)、香附烯酮(批号PRF20073022,质量分数98.0%)和圆柚酮(批号PRF8072622,质量分数97.4%)购于成都普瑞法科技开发有限公司。
阴性试验所用中药材来源于安国市神禾中药材饮片有限责任公司,经广东食品药品职业学院中药学院张翘教授鉴定为正品,郁金(批号20210802,产地浙江)为姜科姜黄属植物温郁金Y. H. Chen et C. Ling的干燥块根,陈皮(批号20201203,产地湖北)为芸香科柑橘属植物橘Blanco及其栽培变种的干燥成熟果皮,青皮(批号20210801,产地江西)为芸香科柑橘属植物橘及其栽培变种的干燥幼果或未成熟果实的果皮,枳壳(批号20200704,产地湖南)为芸香科柑橘属植物酸橙L.及其栽培变种的干燥未成熟果实,香附(批号20210103,产地辽宁)为莎草科莎草属植物莎草L.的干燥根茎,茵陈(批号20201201,产地陕西)为菊科艾属植物滨蒿Waldst. et Kit.的干燥地上部分,紫苏梗(批号20191103,产地湖北)为唇形科紫苏属植物紫苏(L.) Britt.的干燥茎,山楂(批号20200901,产地山东)为蔷薇科山楂属植物山楂Bge.的干燥成熟果实,川楝子(批号20211001,产地甘肃)为楝科楝属植物川楝Sieb. et Zucc.的干燥成熟果实,麦芽(批号20200903,产地河南)为禾本科大麦属植物大麦L.的成熟果实经发芽干燥的炮制加工品,稻芽(批号20210901,产地江苏)为禾本科稻属植物稻谷L.的成熟果实经发芽干燥的炮制加工品,莱菔子(批号20210203,产地河南)为十字花科萝卜属植物萝卜L.的干燥成熟种子,法半夏(批号20200601,产地四川)为天南星科半夏属植物半夏(Thunb.) Breit.的干燥块茎的炮制加工品,皂荚(批号20211003,产地河北)为豆科皂荚属植物皂荚Lam.的干燥成熟果实。
乙腈和甲酸均选用色谱纯级别,其余试剂为分析纯;利胆石颗粒(规格:每袋装25 g),分别购于云南云龙制药股份有限公司,批号20200905、20210207、20210211、20210309,编号S1~S4;华润三九医药股份有限公司,批号2102138D、2103072D、2103094D,编号依次为S5~S7;江西保利制药有限公司,批号200901、201102、210203,编号依次为S8~S10。
2 方法与结果
2.1 混合对照品溶液的制备
取双去甲氧基姜黄素、去甲氧基姜黄素、姜黄素、柚皮芸香苷、橙皮苷、川陈皮素、HMOF、橘红素、香附烯酮、圆柚酮和α-香附酮对照品适量,用甲醇制成0.126、0.142、0.258、0.976、1.210、0.392、0.178、0.156、0.480、0.094、0.212 mg/mL的混合储备液。将混合储备液用甲醇稀释20倍得混合对照品溶液(双去甲氧基姜黄素6.3 µg/mL、去甲氧基姜黄素7.1 µg/mL、姜黄素12.9 µg/mL、柚皮芸香苷48.8 µg/mL、橙皮苷60.5 µg/mL、川陈皮素19.6 µg/mL、HMOF 8.9 µg/mL、橘红素7.8 µg/mL、香附烯酮24.0 µg/mL、圆柚酮4.7 µg/mL和α-香附酮 10.6 µg/mL)。
2.2 供试品溶液的制备
取利胆石颗粒适量,研细,精密称定约2 g,置具塞锥形瓶中,精密加甲醇25 mL,称定质量,加热回流处理30 min,放冷,补足减失的质量,摇匀,滤过,即得利胆石颗粒供试品溶液。
取按处方和制法制备的缺郁金和神曲阴性样品、缺陈皮、枳壳、青皮和神曲阴性样品、缺香附和神曲阴性样品各适量,按上述方法制得3种阴性供试品溶液。
2.3 色谱条件
Venusil XBP C18(250 mm×4.6 mm,5 μm)色谱柱,柱温30 ℃;检测波长分别为420 nm(0~24 min检测双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素)[11-15]、300 nm(24~47 min检测柚皮芸香苷、橙皮苷、川陈皮素、HMOF和橘红素)[16-19]和242 nm(47~75 min检测香附烯酮、圆柚酮和α-香附酮)[20-22];流动相为乙腈-0.1%甲酸水溶液,梯度洗脱:0~12 min,17.0%乙腈;12~24 min,17.0%~46.0%乙腈;24~47 min,46.0%~61.0%乙腈;47~67 min,61.0%~68.0%乙腈;67~75 min,68.0%~17.0%乙腈;体积流量1.0 mL/min;进样量10 µL。理论板数按各成分色谱峰计均≥5500。
2.4 方法学验证
2.4.1 专属性试验 依法进样“2.1”项下混合对照品溶液及“2.2”项供试品溶液,记录色谱图(图1)。结果表明,利胆石颗粒供试品溶液中11种成分与相邻色谱峰分离良好(分离度均≥1.5);阴性样品不干扰检测。
2.4.2 线性关系考察 精密吸取“2.1”项下储备液0.1、0.2、0.5、1.0、2.0、5.0 mL,置不同的20 mL量瓶中,用甲醇定容得6个混合对照品溶液,依法进样,以双去甲氧基姜黄素、去甲氧基姜黄素、姜黄素、柚皮芸香苷、橙皮苷、川陈皮素、HMOF、橘红素、香附烯酮、圆柚酮和α-香附酮质量浓度对峰面积进行线性回归,得回归方程、线性范围及相关系数分别为双去甲氧基姜黄素=7.088 2×105-506.90,=0.999 6,线性范围0.63~31.50 μg/mL;去甲氧基姜黄素=9.162 8×105+1 454.6,=0.999 3,线性范围0.71~35.50 μg/mL;姜黄素=1.813 4×106-217.70,=0.999 7,线性范围1.29~64.50 μg/mL;柚皮芸香苷=1.652 5×106-960.10,=0.999 4,线性范围4.88~244.00 μg/mL;橙皮苷=1.537 1×106+1 242.10,=0.999 6,线性范围6.05~302.50 μg/mL;川陈皮素=2.076 8× 106+641.60,=0.999 3,线性范围1.96~98.00 μg/mL;HMOF=1.439 3×106+1 061.80,=0.999 4,线性范围0.89~44.50 μg/mL;橘红素=1.213 3×106-744.90,=0.999 6,线性范围0.78~39.00 μg/mL;香附烯酮=2.456 4×106+972.80,=0.999 3,线性范围2.40~120.00 μg/mL;圆柚酮=4.939 9×105+139.50,=0.999 5,线性范围0.47~23.50 μg/mL;α-香附酮=1.565 2×106+645.30,=0.999 4,线性范围1.06~53.00 μg/mL。
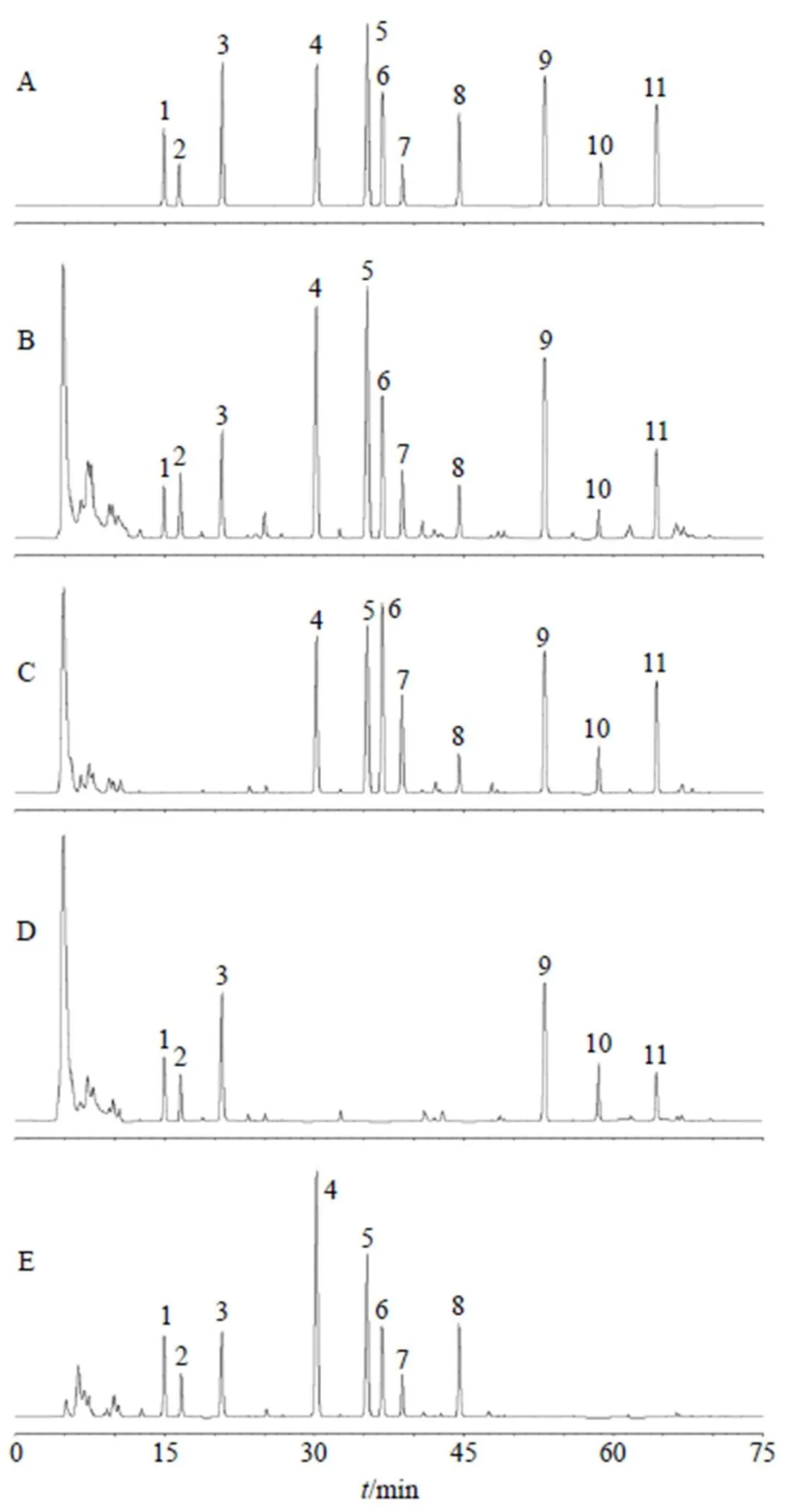
1-双去甲氧基姜黄素 2-去甲氧基姜黄素 3-姜黄素 4-柚皮芸香苷 5-橙皮苷 6-川陈皮素 7-HMOF 8-橘红素 9-香附烯酮 10-圆柚酮 11-α-香附酮
2.4.3 精密度试验 依法重复进样利胆石颗粒(编号S1)供试品溶液6次,每次10 µL,得双去甲氧基姜黄素、去甲氧基姜黄素、姜黄素、柚皮芸香苷、橙皮苷、川陈皮素、HMOF、橘红素、香附烯酮、圆柚酮和α-香附酮峰面积的RSD值依次为1.35%、1.18%、1.12%、0.77%、0.59%、1.06%、1.20%、1.26%、0.81%、1.42%、1.30%,表明精密度良好(RSD小于2.0%)。
2.4.4 重复性试验 依法制备6份利胆石颗粒(编号S1)供试品溶液,进样10 µL检测分析,用外标法计算含量,得双去甲氧基姜黄素、去甲氧基姜黄素、姜黄素、柚皮芸香苷、橙皮苷、川陈皮素、HMOF、橘红素、香附烯酮、圆柚酮和α-香附酮质量分数的RSD值依次为1.79%、1.66%、1.58%、1.05%、0.93%、1.28%、1.32%、1.45%、1.11%、1.85%、1.63%,表明重复性良好(RSD小于2.0%)。
2.4.5 稳定性试验 取利胆石颗粒(编号S1)供试品溶液,于制备后0、2、5、9、16、24 h依法进样10 µL,得双去甲氧基姜黄素、去甲氧基姜黄素、姜黄素、柚皮芸香苷、橙皮苷、川陈皮素、HMOF、橘红素、香附烯酮、圆柚酮和α-香附酮峰面积的RSD值依次为1.31%、1.14%、1.09%、0.80%、0.61%、1.04%、1.18%、1.29%、0.84%、1.43%、1.27%,表明利胆石颗粒供试品溶液24 h内稳定(RSD小于2.0%)。
2.4.6 加样回收率试验 取已知待测成分含量的利胆石颗粒(编号S1),研成细粉,精密称定1.0 g,精密加入混合对照品溶液(双去甲氧基姜黄素0.067 mg/mL、去甲氧基姜黄素0.082 mg/mL、姜黄素0.174 mg/mL、柚皮芸香苷0.749 mg/mL、橙皮苷0.886 mg/mL、川陈皮素0.218 mg/mL、HMOF 0.117 mg/mL、橘红素0.091 mg/mL、香附烯酮0.343 mg/mL、圆柚酮0.051 mg/mL和α-香附酮0.149 mg/mL)0.8、1.0、1.2 mL,每个质量浓度制备3份,再按“2.2”项方法制成加样供试品溶液,依法检测,得上述11种成分的平均加样回收率及RSD分别为97.28%(1.28%)、98.03%(1.56%)、98.18%(0.91%)、99.82%(0.84%)、100.08%(0.70%)、97.32%(1.07%)、97.43%(1.36%)、99.00%(1.19%)、100.01%(0.66%)、96.95%(0.88%)、96.87%(1.16%)。
2.5 HPLC-QAMS的建立
2.5.1 相对校正因子(k/s)的计算 依法进样“2.4.2”项6个混合对照品溶液各10 µL,用对照品质量浓度与峰面积之比计算各成分k/s,即k/s=k/s=(k/k)/(W/A)=(kA)/(WAk)(其中、、、k和依次代表、质量浓度、峰面积、内参物和其他待测成分)。以橙皮苷为内参物,分别计算其他10种成分的(表1)。
2.5.2 仪器及色谱柱对k/s的影响 分别选用仪器(Thermo Ultimate 3000型和e2695型高效液相色谱仪)和色谱柱(Venusil XBP C18柱、Cosmosil C18柱和Kromasil 100-5-C18柱),进样“2.1”项下混合对照品溶液10 µL,结果(表2)测得各成分k/s的RSD在0.79%~1.97%,表明仪器与色谱柱对所建立的k/s无影响。
2.5.3 体积流量对k/s的影响 在体积流量0.8、1.0、1.2 mL/min条件下,依法进样“2.1”项下对照品溶液10 µL,结果(表3)测得各成分k/s的RSD在0.85%~1.92%,表明体积流量对所建立的k/s无影响。
2.5.4 柱温对k/s的影响 在柱温25、30、35 ℃条件下,依法进样“2.1”项下对照品溶液10 µL,结果(表4)测得各成分k/s的RSD在0.68%~1.94%,表明柱温对所建立的k/s无影响。
2.5.5 色谱峰定位 依法进样“2.1”项下对照品溶液10 µL,采用相对保留时间值法对待测成分色谱峰进行定位,考察仪器(Thermo Ultimate 3000型和e2695型高效液相色谱仪)和色谱柱(Venusil XBP C18柱、Cosmosil C18柱和Kromasil 100-5-C18柱)对相对保留时间值()的影响,结果(表5)测得双去甲氧基姜黄素、去甲氧基姜黄素、姜黄素、柚皮芸香苷、川陈皮素、HMOF、橘红素、香附烯酮、圆柚酮、α-香附酮和橙皮苷相对保留时间值()的RSD在0.84%~1.72%,表明采用相对保留时间值法可以对目标化合物色谱峰进行准确定位。
表1 利胆石颗粒中11种成分的fk/s
Table1 fk/s of 11 component in Lidanshi Granules
混合对照品溶液f橙皮苷/双去甲氧基姜黄素f橙皮苷/去甲氧基姜黄素f橙皮苷/姜黄素f橙皮苷/柚皮芸香苷f橙皮苷/川陈皮素f橙皮苷/HMOFf橙皮苷/橘红素f橙皮苷/香附烯酮f橙皮苷/圆柚酮f橙皮苷/α-香附酮 12.175 41.637 40.862 50.920 40.724 01.055 11.291 50.618 53.090 50.972 2 22.169 31.634 00.838 00.920 20.726 01.055 31.254 40.609 83.089 30.972 4 32.198 81.638 60.862 00.924 10.725 51.057 81.264 50.610 53.099 40.965 3 42.172 01.649 30.847 80.917 30.731 61.056 31.262 70.617 83.079 40.968 0 52.164 31.713 40.843 00.945 90.756 61.081 51.274 30.641 43.141 31.001 1 62.169 71.672 70.848 30.928 50.738 21.066 31.266 40.624 03.108 20.979 9 平均值2.174 91.657 60.850 30.926 10.733 71.062 01.269 00.620 33.101 30.976 5 RSD/%0.561.861.181.121.690.981.011.870.711.33
表2 仪器及色谱柱对fk/s的影响
Table 2 Effects of instruments and columns on fk/s
仪器色谱柱f橙皮苷/双去甲氧基姜黄素f橙皮苷/去甲氧基姜黄素f橙皮苷/姜黄素f橙皮苷/柚皮芸香苷f橙皮苷/川陈皮素f橙皮苷/HMOFf橙皮苷/橘红素f橙皮苷/香附烯酮f橙皮苷/圆柚酮f橙皮苷/α-香附酮 Thermo Ultimate 3000Venusil XBP C182.172 01.654 30.847 60.924 20.731 91.060 51.267 20.618 53.100 10.974 3 Cosmosil C182.140 51.617 90.825 30.907 70.718 01.038 21.240 10.604 33.070 60.950 6 Kromasil 100-5-C182.189 21.708 60.856 90.941 30.750 61.084 71.287 50.635 93.143 90.998 0 e2695Venusil XBP C182.166 91.632 80.841 50.919 00.724 41.055 01.253 90.614 03.0954 0.967 4 Cosmosil C182.155 71.650 10.837 20.915 60.720 81.047 91.254 80.606 73.088 20.958 1 Kromasil 100-5-C182.178 31.679 50.848 10.936 40.743 21.072 61.271 00.625 23.129 70.982 7 平均值2.167 11.657 20.842 80.924 00.731 51.059 81.262 40.617 43.104 70.971 9 RSD/%0.791.971.291.381.781.591.301.920.881.76
表3 体积流量对fk/s的影响
Table 3 Effects of flow velocitys on fk/s
体积流量/(mL∙min−1)f橙皮苷/双去甲氧基姜黄素f橙皮苷/去甲氧基姜黄素f橙皮苷/姜黄素f橙皮苷/柚皮芸香苷f橙皮苷/川陈皮素f橙皮苷/HMOFf橙皮苷/橘红素f橙皮苷/香附烯酮f橙皮苷/圆柚酮f橙皮苷/α-香附酮 0.82.195 81.696 30.870 20.935 60.751 01.072 61.290 90.637 83.141 90.991 2 1.02.176 31.659 00.851 50.928 80.736 11.064 31.271 50.622 23.103 60.978 4 1.22.159 01.632 70.848 10.912 30.724 51.050 91.256 70.614 33.076 20.956 7 平均值2.177 01.662 70.856 60.925 60.737 21.062 61.273 00.624 83.107 20.975 4 RSD/%0.851.921.391.291.801.031.351.911.061.79
表4 柱温对fk/s的影响
Table 4 Effects of column temperature on fk/s
柱温/℃f橙皮苷/双去甲氧基姜黄素f橙皮苷/去甲氧基姜黄素f橙皮苷/姜黄素f橙皮苷/柚皮芸香苷f橙皮苷/川陈皮素f橙皮苷/HMOFf橙皮苷/橘红素f橙皮苷/香附烯酮f橙皮苷/圆柚酮f橙皮苷/α-香附酮 252.160 91.620 90.831 50.910 30.718 91.051 51.246 20.600 13.070 40.957 2 302.172 61.655 80.848 00.924 70.731 61.060 31.267 50.618 93.099 50.974 0 352.185 21.683 50.857 20.938 20.747 31.074 71.283 90.621 03.123 80.991 6 平均值2.171 21.653 40.845 60.924 40.732 61.062 21.265 90.613 33.097 90.974 3 RSD/%0.681.901.541.511.941.101.491.880.861.77
2.6 含量测定
为验证所建立的QAMS法的准确性及可行性,取10批利胆石颗粒,依法制备利胆石颗粒供试品溶液,再依法进样分析,分别运用外标法和HPLC QAMS法计算利胆石颗粒中各成分的含量,比较2种方法检测结果的差异。结果(表6)2种方法无显著差异(>0.05),表明HPLC QAMS法可用于利胆石颗粒中11种成分的含量测定。
3 利胆石颗粒的化学计量学质量分析
3.1 HCA
将10批利胆石颗粒中双去甲氧基姜黄素、去甲氧基姜黄素、姜黄素、柚皮芸香苷、橙皮苷、川陈皮素、HMOF、橘红素、香附烯酮、圆柚酮和α-香附酮HPLC-QAMS法含量测定结果导入SPSS 26.0统计软件进行聚类模式识别分析(分类:系统聚类;聚类方法:组间联接;测量区间:Euclidean距离),得图2。结果显示,当间距为15时,10批利胆石颗粒供试品聚为3类,S5、S6和S7为第I类,S1、S3、S2和S4为第II类,S8、S9和S10为第III类,从聚类结果可以看出,同一厂家的产品聚成一类。
3.2 PCA
PCA通过降维处理对指标进行简化,将10批利胆石颗粒中双去甲氧基姜黄素、去甲氧基姜黄素、姜黄素、柚皮芸香苷、橙皮苷、川陈皮素、HMOF、橘红素、香附烯酮、圆柚酮和α-香附酮HPLC-QAMS法含量测定结果导入SPSS 26.0统计软件及统计软件SIMCA 14.1对主成分进行提取,得各主成分特征值和方差贡献率,结果见表7、8和图3。由表7可知前2个主成分特征值大于1,即7.463和2.227,对方差的贡献率分别为67.848%、20.248%,累积方差贡献率为88.096%,大于85%,表明选取前2个主成分即可代表利胆石颗粒88.096%的信息量。表8主成分矩阵可以看出第1主成分的信息来自双去甲氧基姜黄素、去甲氧基姜黄素、橙皮苷、川陈皮素、HMOF、橘红素、香附烯酮、圆柚酮等成分的综合,第2主成分的信息来自姜黄素、柚皮芸香苷的信息。从图3可以看出,S8~S10、S1~S4以及S5~S7分别呈现一定关联性,与“3.1”项聚类分析结果一致。
表5 仪器及色谱柱对ts/k的影响
Table 5 Effects of instruments and chromatographic columns on ts/k
仪器色谱柱t双去甲氧基姜黄素/橙皮苷t去甲氧基姜黄素/橙皮苷t姜黄素/橙皮苷t柚皮芸香苷/橙皮苷t川陈皮素/橙皮苷tHMOF/橙皮苷t橘红素/橙皮苷t香附烯酮/橙皮苷t圆柚酮/橙皮苷tα-香附酮/橙皮苷 Thermo Ultimate 3000Venusil XBP C180.422 40.465 60.587 40.854 61.041 31.098 21.259 31.502 91.660 11.819 3 Cosmosil C180.420 80.451 10.581 60.842 11.029 61.071 91.230 51.483 21.642 81.796 6 Kromasil 100-5-C180.429 50.472 80.594 80.868 91.055 11.111 51.277 01.530 71.687 51.835 7 e2695Venusil XBP C180.417 70.460 30.582 60.850 21.035 91.080 41.241 81.489 61.653 91.802 8 Cosmosil C180.423 60.455 90.585 10.851 81.036 21.083 71.245 61.497 01.632 61.804 1 Kromasil 100-5-C180.425 00.467 40.590 70.857 31.048 01.092 21.262 11.514 51.671 21.825 9 平均值0.423 20.462 20.587 00.854 21.041 01.089 71.252 71.503 01.658 01.814 1 RSD/%0.941.720.861.040.891.291.331.161.190.84
表6 利胆石颗粒中11种成分含量测定结果(n = 3)
Table 6 Determination results of 11 components in Lidanshi Granules (n = 3)
样品双去甲氧基姜黄素/(mg∙g−1)去甲氧基姜黄素/(mg∙g−1)姜黄素/(mg∙g−1)柚皮芸香苷/(mg∙g−1)川陈皮素/(mg∙g−1)橙皮苷/(mg∙g−1) 外标法QAMS外标法QAMS外标法QAMS外标法QAMS外标法QAMS外标法 S10.0690.0680.0810.0800.1720.1740.7560.7680.2170.2190.891 S20.0700.0720.1220.1250.2420.2480.8380.8560.2730.2740.953 S30.0570.0560.0870.0880.1760.1800.7360.7310.2320.2260.844 S40.0760.0780.1110.1130.2150.2090.8370.8150.2690.2660.974 S50.0700.0690.1090.1110.1520.1530.7260.7450.2130.2120.766 S60.0650.0640.1290.1320.1100.1090.7070.7020.1940.1970.709 S70.0600.0590.1190.1160.1020.1000.6590.6730.1860.1890.695 S80.0890.0870.0770.0780.1640.1600.6230.6380.3090.3051.073 S90.1050.1080.0680.0670.1890.1940.5900.6020.2990.2971.120 S100.0900.0920.0990.0970.1330.1360.5570.5660.3280.3251.142 P值0.9780.9590.9680.8750.964− 样品HMOF/(mg∙g−1)橘红素/(mg∙g−1)香附烯酮/(mg∙g−1)圆柚酮/(mg∙g−1)α-香附酮/(mg∙g−1) 外标法QAMS外标法QAMS外标法QAMS外标法QAMS外标法QAMS S10.1190.1180.0920.0930.3470.3450.0520.0510.1450.146 S20.1250.1270.1200.1220.2630.2700.0330.0340.1930.188 S30.1210.1240.0900.092 0.3590.3640.0410.0420.1310.132 S40.1120.1110.1190.1170.3130.3080.0380.0390.1820.183 S50.1020.1030.0830.0820.2010.1990.0340.0330.1040.103 S60.0950.0940.0760.0770.1810.1800.0280.0270.1150.113 S70.0960.0970.0790.0800.1640.1600.0300.0310.0870.086 S80.1530.1510.1510.1480.5350.5280.0560.0570.1630.160 S90.1580.1600.1350.1370.5010.5140.0610.0600.1250.123 S100.1480.1450.1400.1420.4820.4910.0640.0630.1760.171 P值0.9920.9680.9830.9860.920
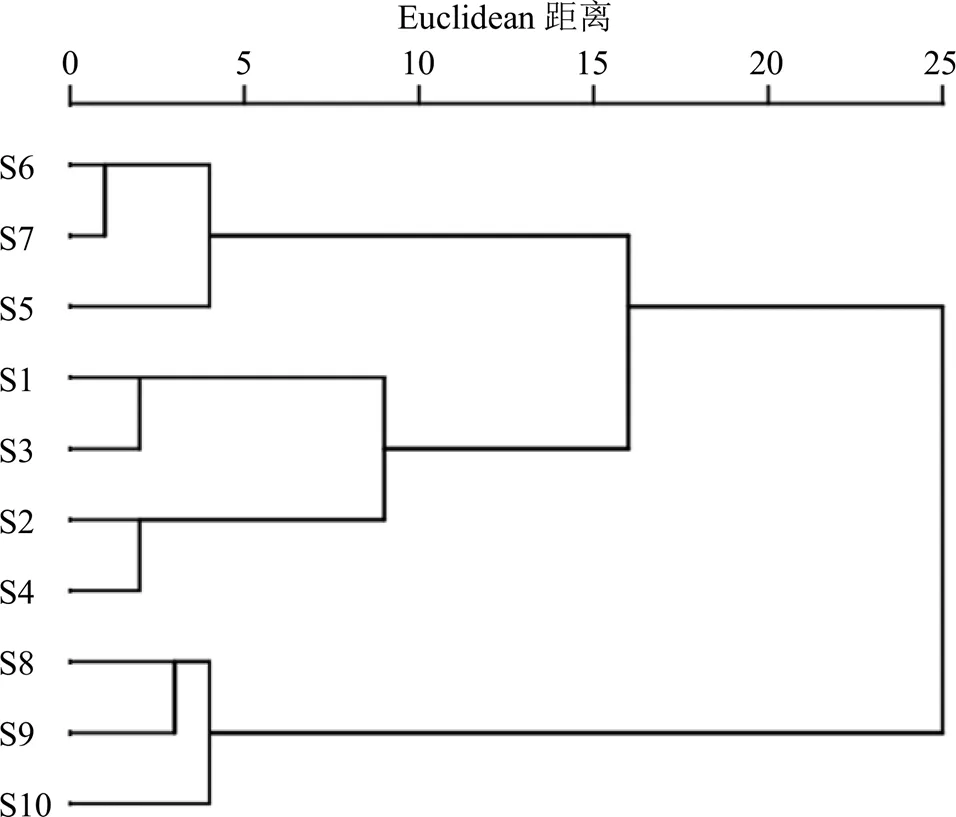
图2 10批样品聚类树状图
表7 利胆石颗粒中主成分特征值和贡献率
Table 7 Eigenvalue and contribution rate of principal components in Lidanshi Granules
主成分初始特征值提取载荷平方和 特征值方差贡献率/%累积方差贡献率/%特征值方差贡献率/%累积方差贡献率/% 17.46367.84867.8487.46367.84867.848 22.22720.24888.0962.22720.24888.096 30.7546.85294.949 40.3383.07798.026 50.1301.18399.209 60.0450.41399.622 70.0230.20699.828 80.0140.12699.954 90.0050.046100.000
表8 11种成分的成分矩阵
Table 8 Composition matrix of 11 components in Lidanshi Granules
成分主成分成分主成分1212 双去甲氧基姜黄素0.877−0.167HMOF0.967−0.046 去甲氧基姜黄素−0.7200.334橘红素0.9480.161 姜黄素0.3740.833香附烯酮0.967−0.123 柚皮芸香苷−0.4950.826圆柚酮0.929−0.244 橙皮苷0.9810.143α-香附酮0.5530.746 川陈皮素0.9420.179
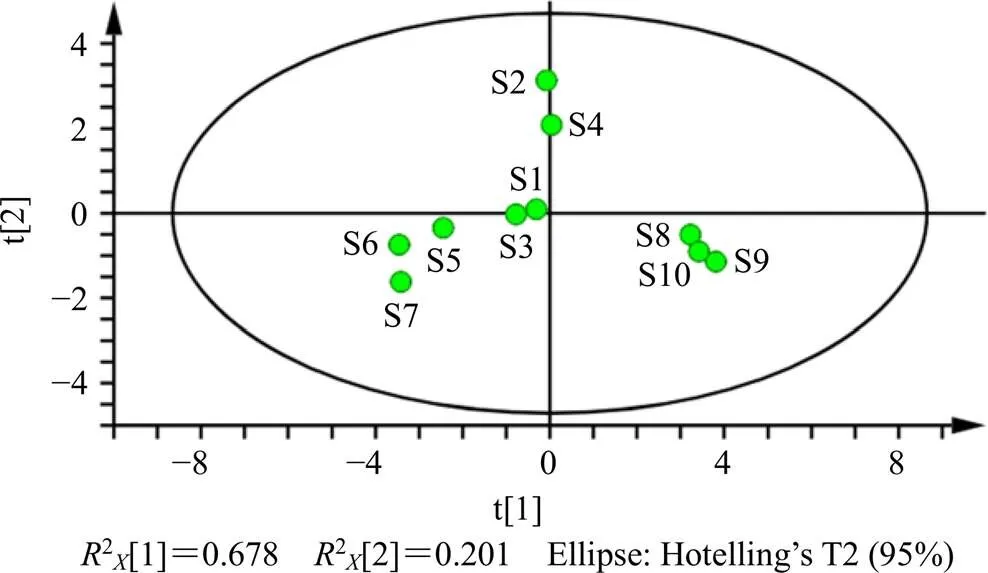
图3 PCA得分图
3.3 PLS-DA
PLS-DA通过对数据的分析,能够查找出引起产品质量差异的特征成分,将10批利胆石颗粒中双去甲氧基姜黄素、去甲氧基姜黄素、姜黄素、柚皮芸香苷、橙皮苷、川陈皮素、HMOF、橘红素、香附烯酮、圆柚酮和α-香附酮的QAMS法含量数据导入SIMCA 14.1统计软件,进行PLS-DA分析,绘制PLS-DA模型得分图(图4),结果累积解释能力参数(2、2)分别为0.927和0.848,预测能力参数2为0.757,均大于0.5,说明表明所建立的模型稳定可靠、预测能力强,可用于区分不同批次的利胆石颗粒。
由图4可以看出10批利胆石颗粒的含量数据点均落在95%置信区间内,根据分布可分为3类,与聚类分析和主成分分析结果一致。
对建立的PLS-DA模型进行200次置换检验(图5),结果显示2拟合直线轴截距为0.133,小于0.3,表明所建立的模型结果可靠;2拟合直线轴截距为−0.275,小于0.05,表明所建立的模型不存在过度拟合,可有效判别分析10批利胆石颗粒的质量差异。
根据变量重要性投影(variable importance in projection,VIP)值筛选影响药物炮制前后组方利胆石颗粒化学成分差异的标志性成分(图6),结果VIP>1的有4个成分,即柚皮芸香苷(VIP=1.745)、橙皮苷(VIP=1.470)、香附烯酮(VIP=1.350)和姜黄素(VIP=1.188)对利胆石颗粒样品质量的影响较大,可能是影响利胆石颗粒产品质量的主要潜在标志物。
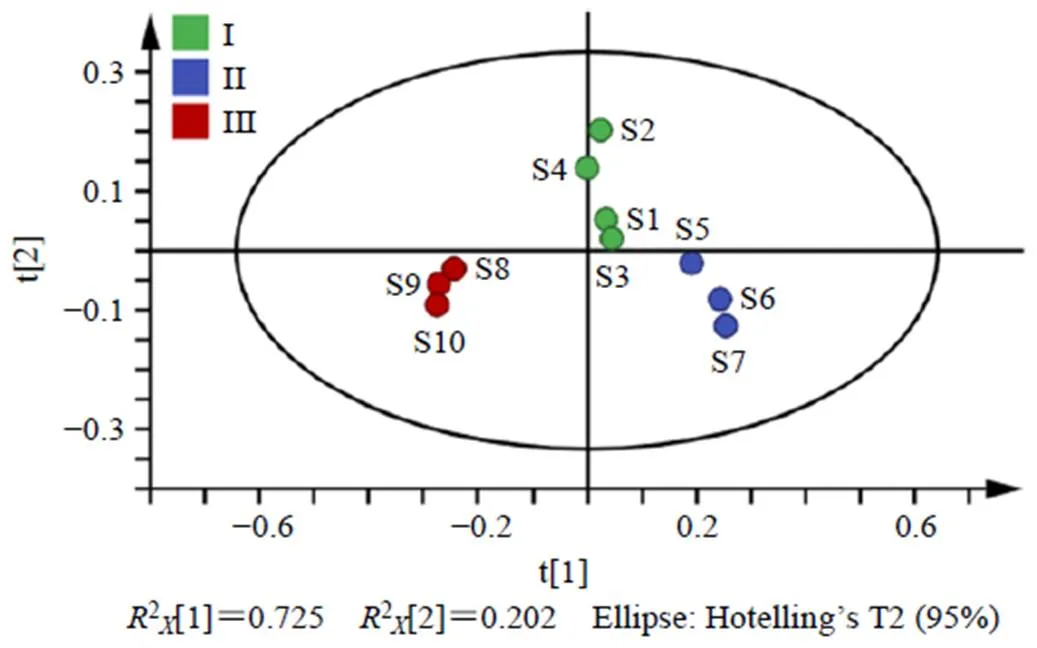
图4 10批利胆石颗粒样品的PLS-DA模型得分图

图5 PLS-DA置换检测图
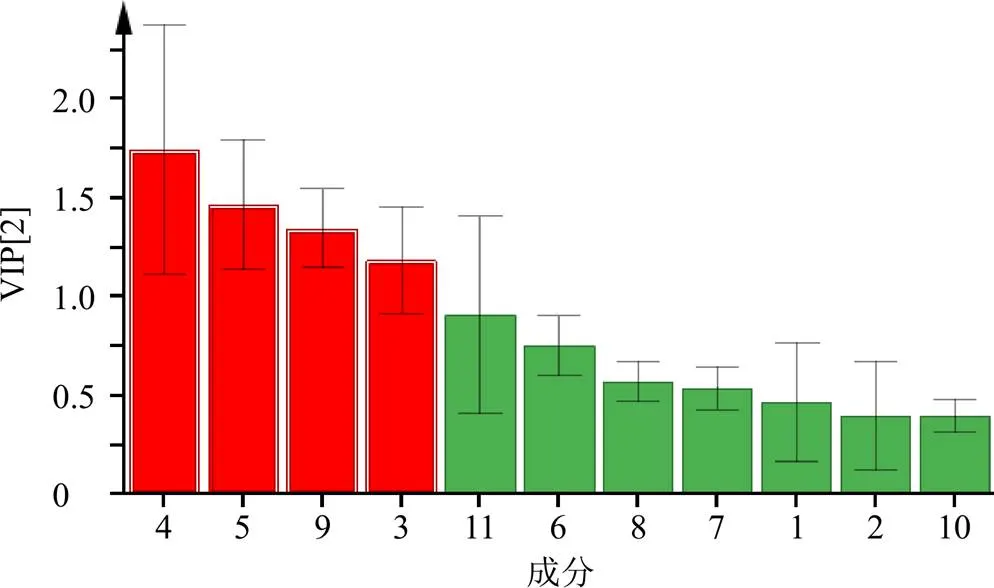
图6 10批利胆石颗粒样品的PLS-DA模型中共有峰的VIP值
4 讨论
4.1 供试品处理方式的确定
本实验在制备供试品溶液,以双去甲氧基姜黄素、去甲氧基姜黄素、姜黄素、柚皮芸香苷、橙皮苷、川陈皮素、HMOF、橘红素、香附烯酮、圆柚酮和α-香附酮的提取效率为指标,结合杂质干扰情况,首先考察了溶剂水、甲醇和乙醇,分别采用超声[12-15]、回流[17]、索氏[11]提取时11种成分的提取效率。结果发现,水作溶剂时,圆柚酮和α-香附酮几乎未提取出,乙醇为溶剂时,橘红素和圆柚酮基本未检出,只有甲醇采用回流提取时,各成分提取效率较高,同时杂质干扰最少,进而对甲醇体积分数(50%[19]、70%[15]、85%[11]、100%[20-22])和提取时间(20、30、40、50 min)进行了筛选对比,发现甲醇加热回流时11种提取率随提取时间的延长有降低趋势,但杂质却在逐渐增加,综合考虑确定以甲醇加热回流提取30 min为最佳提取方式。
4.2 流动相系统的确定
本实验在筛选流动相时,通过对乙腈-水、甲 醇-水的运行,筛选出乙腈-水系统优于甲醇-水系统,但有个别色谱峰出现了拖尾现象,进而对乙腈-0.4%磷酸水溶液[15]、乙腈-0.1%甲酸水溶液[17-18]、乙腈- 3%甲酸水溶液[11]、乙腈-1%冰醋酸水溶液[12]为流动相系统进行检测利胆石颗粒供试品溶液,对比双去甲氧基姜黄素、去甲氧基姜黄素、姜黄素、柚皮芸香苷、橙皮苷、川陈皮素、HMOF、橘红素、香附烯酮、圆柚酮和α-香附酮色谱峰的峰形及分离效果,结果乙腈-0.1%甲酸水溶液条件下可达到基线分离,峰形较好,因此,选择乙腈-0.1%甲酸水溶液为流动相梯度洗脱对利胆石颗粒中11种成分含量进行同时检测。
4.3 多指标成分定量控制及化学计量学结果评价
HPLC-QAMS法测定利胆石颗粒中双去甲氧基姜黄素、去甲氧基姜黄素、姜黄素、柚皮芸香苷、橙皮苷、川陈皮素、HMOF、橘红素、香附烯酮、圆柚酮和α-香附酮的含量,从检测结果可以看出HPLC-QAMS法结果与外标法实测值无明显差异,表明所建立的HPLC-QAMS法结果准确,但各批次利胆石颗粒中11种成分含量存在一定的批间差异,表明建立多指标检测的重要性。
分析含量差异的原因可能是厂家不同所导致,从HCA和PCA结果可以看出,10批利胆石颗粒聚为3类,同一厂家的样品聚为一类,聚类结果与生产厂家具有一定关联性,这可能与厂家生产工艺不尽相同,生产所用设备、原药材也不相同有关,这也迫切要求有一个高水平的全面监控的产品质量标准来严格监管产品质量,从而实现质量均一性和疗效一致性。PLS-DA方法筛选出4个差异性标志物,即柚皮芸香苷、橙皮苷、香附烯酮和姜黄素是对利胆石颗粒样品质量的影响较大的成分,与HCA、PCA相比,PLS-DA的预测能力更强,能够更准确地进行利胆石颗粒的质量评价,也为后续生产厂家提升产品质量指明了方向。
本实验以橙皮苷为内参物,建立了HPLC- QAMS法同时测定利胆石颗粒中双去甲氧基姜黄素、去甲氧基姜黄素、姜黄素、柚皮芸香苷、橙皮苷、川陈皮素、HMOF、橘红素、香附烯酮、圆柚酮和α-香附酮的含量,方法简便,结果准确、专属性强,可多方位较全面地反映利胆石颗粒中化学成分信息,同时结合HCA、PCA、PLS-DA等化学计量学识别模式对含量检测结果进行综合分析,为完善利胆石颗粒控制方法,提升控制水平,为确保产品质量均一性和临床疗效一致性提供科学依据。利胆石颗粒方中君药陈皮、臣药青皮和佐药枳壳均含有橙皮苷等成分,橙皮苷质量稳定,价廉易得,可作为该制剂多指标成分QAMS法内参物,《中国药典》2020年版一部中陈皮和青皮均采用橙皮苷作为其定量控制指标成分,枳壳采用柚皮苷和新橙皮苷作为其定量控制成分,建议药品生产企业建立枳壳中橙皮苷含量的内控标准,稳定该制剂的产品质量,以便于该制剂的临床合理应用。
利益冲突 所有作者均声明不存在利益冲突
[1] 国家食品药品监督管理局国家药品标准WS3-B-2330- 97 [S]. 1997: 67.
[2] 杨炜峰, 陈茂如, 刘学华. HPLC法测定利胆石颗粒中橙皮苷含量 [J]. 首都医药, 2008, 15(24): 38-39.
[3] 梁颖欣, 朱旦, 黄舒婷, 等. 一测多评法测定钩藤中7种生物碱类成分的含量 [J]. 中药材, 2019, 42(8): 1820-1823.
[4] Wang Z Q, Shen J, Li P,. Research on quality markers of: Quality evaluation and quality standards of[J]., 2017, 9(4): 307-320
[5] 高森, 王苹, 唐铖, 等. 基于HPLC指纹图谱、多指标成分含量测定及化学计量学的湿热痹片质量评价 [J]. 中草药, 2020, 51(21): 5454-5461.
[6] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
[7] 刘昌孝. 中药质量标志物(Q-Marker)研究发展的5年回顾 [J]. 中草药, 2021, 52(9): 2511-2518.
[8] Mohamed-Ibrahim S R, Mohamed G A, Abdullah Khayat M T,. Anti-inflammatory terpenoids fromrhizomes [J]., 2018, 31(4 Suppl): 1449-1456.
[9] Chen H F, Zhang W G, Yuan J B,. Simultaneous quantification of polymethoxylated flavones and coumarins inandusing HPLC-ESI-MS/MS [J]., 2012, 59: 90-95.
[10] An Y W, Hu G, Yin G P,. Quantitative analysis and discrimination of steamed and non-steamed rhizomes ofby GC-MS and HPLC [J]., 2014, 52(9): 961-970.
[11] 周秋明, 王文华, 夏平, 等. HPLC法测定不同贮藏条件下莪术中6种化学成分的含量 [J]. 中国药师, 2020, 23(8): 1669-1673.
[12] 高天慧, 廖婉, 傅超美, 等. 基于pH值动态变化的川产道地药材蓬莪术醋制前后化学成分差异研究 [J]. 中草药, 2017, 48(24): 5174-5178.
[13] 靳雅惠. 桂郁金种质资源姜黄素类化学成分分析 [J]. 陕西农业科学, 2021, 67(9): 61-64.
[14] 高红宁, 殷奕, 毛春芹, 等. HPLC法测定不同产地醋莪术饮片中姜黄素、双去甲氧基姜黄素和去甲氧基姜黄素的含量 [J]. 中国医药科学, 2021, 11(3): 67-70.
[15] 臧远芳, 许丽丽, 刘洪超, 等. HPLC波长切换法测定莪术中8个主要有效成分的含量 [J]. 中国现代应用药学, 2021, 38(18): 2227-2233.
[16] 邱烺, 吴晓玲, 谢子婷, 等. 浊点萃取-HPLC法测定陈皮中橙皮苷和川陈皮素的含量 [J]. 中药材, 2017, 40(9): 2125-2127.
[17] 封宇飞, 张宏武, 邹忠梅, 等. HPLC法同时测定陈皮饮片中5种黄酮类化合物的含量 [J]. 药物分析杂志, 2009, 29(1): 10-15.
[18] 李影, 尚尔雨, 孙爽, 等. 陈皮HPLC指纹图谱色谱条件优化 [J]. 黑龙江科学, 2021, 12(10): 8-10.
[19] 涂奇军, 徐玲, 聂晶, 等. 蛇胆陈皮制剂中陈皮UPLC指纹图谱 [J]. 中成药, 2018, 40(10): 2233-2237.
[20] 王世宇, 李文兵, 卢君蓉, 等. HPLC法同时测定不同产地香附药材中香附烯酮、圆柚酮和α-香附酮 [J]. 中成药, 2015, 37(3): 588-591.
[21] 卢君蓉, 李文兵, 王世宇, 等. 香附醋制前后香附烯酮、圆柚酮和α-香附酮的含量比较 [J]. 中国实验方剂学杂志, 2014, 20(20): 24-27.
[22] 乔璐, 张园园, 王若晨, 等. 不同炮制方法对香附中香附烯酮和α-香附酮的影响 [J]. 中华中医药学刊, 2022, 40(1): 49-53.
Quality evaluation of Lidanshi Granules based on HPLC-QAMS and chemometrics
LIU Yan-fen1, DUAN Fang1, ZHANG Qiao2, GUO Dan1
1. Department of Pharmacy, Southern Hospital of Southern Medical University, Guangzhou 510515, China 2. College of Traditional Chinese Medicine, Guangdong Food and Drug Vocational College, Guangzhou 510520, China
To establish a method for quality control of Lidanshi Granules (利胆石颗粒, LG) by HPLC-quantitative analysis of multi-components by single-marker (QAMS) combined with chemometrics.HPLC-QAMS was used to simultaneously detect the contents of bisdemethoxycurcumin, demethoxycurcumin, curcumin, narirutin, hesperidin, nobiletin, 3,5,6,7,8,3′,4′-heptamethoxyflavone, tangeretin, cyperenone, nootkatone and α-cyperone in 10 batches of LG from three manufacturers. SPSS 26.0 and SIMCA 14.1 software were used to conduct hierarchical cluster analysis (HCA), principal component analysis (PCA) and partial least squares-discriminant analysis (PLS-DA) on the QAMS calculation data of the above indexes, so as to comprehensively evaluate the quality and symbolic components of LG.The linear ranges of 11 components were good (> 0.999 3). The average recoveries were 96.87%—100.08%, RSDs were 0.66%—1.56%. There was no significant difference between HPLC-QAMS and external standard method (ESM). Through chemometrics analysis, 10 batches of LG were clustered into three categories, and the same manufacturer was clustered into one category. There was certain difference in the quality of different manufacturers, narirutin (VIP = 1.745), hesperidin (VIP = 1.470), cyperenone (VIP = 1.350) and curcumin (VIP = 1.188) might be the differential markers affecting the quality of LG.Establishment of HPLC-QAMS multi-index component quantitative control and application of chemometric pattern recognition are specific, which can be used for quality control and comprehensive evaluation of LG.
Lidanshi Granules; QAMS; discriminant analysis of partial least squares; chemometrics; quality evaluation; bisdemethoxycurcumin; demethoxycurcumin; curcumin; narirutin; hesperidin; nobiletin; 3,5,6,7,8,3′,4′-heptamethoxyflavone; tangeretin; cyperenone; nootkatone; α-cyperone; hierarchical cluster analysis; principal component analysis
R286.02
A
0253 - 2670(2022)19 - 6044 - 10
10.7501/j.issn.0253-2670.2022.19.011
2022-04-13
全国中药特色技术传承人才培训项目(国中医药人教函[2019]43号T20194828003)
刘艳芬,女,本科,主管药师,主要从事药物质量控制及医院药学研究工作。E-mail: 757428953@qq.com
郭 丹,男,博士,主任药师,主要从事药物质量控制及抗肿瘤药理研究工作。E-mail: wzaetn@163.com
[责任编辑 郑礼胜]
