银杏二萜内酯葡胺对氯胺酮麻醉幼鼠认知功能的影响Δ
2022-10-12张振忠排日罕艾尔肯陈淑萍
张振忠,苏 娟,排日罕·艾尔肯,陈淑萍
(1.新疆医科大学第七附属医院麻醉科,乌鲁木齐 830000;2.新疆医科大学第二附属医院麻醉科,乌鲁木齐 830000;3.上海市第六人民医院重症医学科,上海 200233)
每年有数百万的幼儿在全身麻醉下接受影像学检查、外科手术。氯胺酮以其卓越的镇痛、镇静优势,在儿科全身麻醉手术中广泛应用[1]。然而,由于幼儿的各项发育不成熟,对麻醉药的敏感性较高。随着全身麻醉案例数量增加,幼儿出现近期或远期认知功能障碍并发症的案例也日渐增多[2]。如何减轻幼儿经历氯胺酮全身麻醉后出现认知功能障碍症状是当前研究的重点。银杏二萜内酯(diterpene ginkgolides,DG)为银杏叶提取物中众多银杏内酯单体混合物。DG具有较好的抗血小板聚集、抗炎和心脑血管活性保护作用[3-4]。目前,DG已被广泛应用于脑血管疾病,尤其是急性缺血性脑卒中的临床治疗。已有研究结果显示,脑卒中患者常出现的血管性痴呆在DG的治疗下显著改善[5]。然而,DG在术后认知功能障碍中的应用尚处于前期探索阶段。因此,进一步探究DG在术后认知功能障碍中的作用和机制具有重大意义。
1 材料与方法
1.1 实验动物
50只SD大鼠幼仔,2~3周龄,SPF级,体重30~50 g,由新疆医科大学动物实验中心提供。所有大鼠饲养于SPF级动物房中,饲养室温度维持在22~24 ℃,12 h/12 h昼夜节律,保证所有幼鼠食物水源充足且自由摄取。本研究中所有涉及动物的实验方案均遵循实验动物护理和使用指南规定,且本研究实验方案已获得新疆医科大学第二附属医院伦理委员会的批准,批准号:XJMU-SAH202004300301。
1.2 仪器
SA201型Morris水迷宫(江苏赛昂斯生物技术公司);VHX-7000型共聚焦显微镜(日本Keyence公司);MultiClamp 700B型、MultiClamp 1550B型膜片钳放大器系统(瑞士Axon公司);Mini-PROTEAN Tetra型电泳仪(美国Bio-rad公司);1600/1600R型凝胶成像显影仪(上海天能科技有限公司)。
1.3 药品与试剂
银杏二萜内酯葡胺注射液[江苏康缘药业股份有限公司,批准文号为国药准字Z20120024,批号为000409,规格为每支装5 mL(含银杏二萜内酯25 mg) ];盐酸氯胺酮注射液(江苏恒瑞医药公司,批准文号为国药准字H32022820,批号为190826,规格为2 mL∶ 0.1 g);Hito Golgi-Cox Optimstain Kit高尔基染色试剂盒(美国Hitobiotec公司);切片缓冲液[爱必信(上海)生物科技有限公司];人工脑脊液(ACSF,北京酷来搏生物技术公司);RIPA裂解液、BCA试剂盒以及β-actin抗体、HRP标记山羊抗鼠/兔二抗(上海碧云天生物技术有限公司);Anti-脑源性神经营养因子(BDNF)抗体、Anti-酪氨酸激酶受体B(TrkB)抗体和Anti-突触后密度蛋白95(PSD-95)抗体(北京博奥森生物技术有限公司);Anti-活化的半胱氨酸蛋白酶-3(cleaved-caspase-3)抗体、Anti-半胱氨酸蛋白酶-3(caspase-3)抗体、Anti-Bcl-2相关X蛋白(Bax)和Anti-B细胞淋巴瘤2(Bcl-2)抗体(美国Proteintech公司);超高敏发光液(上海天能科技有限公司)。
1.4 方法
将所有幼鼠随机分为对照组(Con)、氯胺酮组(Ket)、银杏二萜内酯葡胺低剂量组(DG-L,2.5 mg/kg)、银杏二萜内酯葡胺中剂量组(DG-M,5 mg/kg)和银杏二萜内酯葡胺高剂量组(DG-H,10 mg/kg),每组10只。所有幼鼠分组后,分别腹腔注射DG溶液或0.9%氯化钠溶液,1日1次,连续注射7 d。开始水迷宫训练与测试,共5 d。水迷宫测试结束后,所有幼鼠禁食12 h,对照组幼鼠腹腔注射0.9%氯化钠溶液,其他各组幼鼠腹腔注射氯胺酮注射液,总剂量100 mg/kg。具体方案:每隔90 min注射1次,1次注射20 mg/kg,共5次。麻醉过程中持续供氧1.5 L/min,以恒温毯维持幼鼠体温在37~38 ℃。隔3 d后,再次开展水迷宫训练与测试,水迷宫期间持续给予银杏二萜内酯进行治疗或0.9%氯化钠溶液作为对照。DG给药时间共21 d。水迷宫结束后,以CO2处死幼鼠,部分幼鼠心脏灌流后,取脑组织切片后用于长时程电位测试,高尔基染色。部分幼鼠直接取海马组织,提取蛋白后用于蛋白质印迹法检测。
1.4.1 Morris水迷宫测试:Morris水迷宫装置是一个直径1.2 m,深0.5 m的圆形水池。Morris水迷宫软件将水面分为4个象限,第I象限设置1个低于水面1 cm,直径12 cm的圆形平台,水池壁四周贴有不同图形以帮助幼鼠定位平台位置。圆形水池正上方固定1个摄像机用于收集幼鼠游泳路径,摄像机连接电脑,信号输入后以软件分析幼鼠在水池各个象限中运行线路与时间。训练期间,将幼鼠依次投入各个象限中,当幼鼠寻找并登上平台,记录该时间为逃避潜伏期,若幼鼠90 s内未找到平台,则引导至平台并记录逃避潜伏期为90 s。训练4 d后,撤去平台,将幼鼠投入第Ⅲ象限中,记录90 s内幼鼠运行轨迹,使用软件分析获得幼鼠平均游泳速率、首次到达平台时间、穿越平台次数和第Ⅰ象限停留时间。
1.4.2 高尔基染色:根据试剂盒说明书中操作流程开展高尔基染色。将幼鼠以CO2处死,以预冷的PBS心脏灌流,再使用4%多聚甲醛固定。取完整脑组织浸泡于试剂盒中的溶液1和溶液2混合液中,4 ℃避光储存14 d。取出脑组织浸入溶液3中,4 ℃避光储存48 h后,期间更换1次溶液3。将脑组织放入预冷的异戊烷中冷冻,擦去组织表面异戊烷。冷冻组织块后,使用冰冻切片机切成约10 μm的切片,转移至载玻片上贴片,滴加溶液3浸润切片。将切片放入溶液4和溶液5混合液中反应30 min,以蒸馏水冲洗玻片。将切片放入50%、75%、95%乙醇中脱水,再分别经二甲苯Ⅰ与二甲苯Ⅱ透化,使用中性树胶封片。显微镜下捕获突触图像,采用NeuroExplorer软件进行树突棘密度和长度统计。
1.4.3 长时程电位测试:将幼鼠以CO2处死,立即用预冷的氧饱和高糖切片缓冲液心脏灌流,取出脑组织,以冷冻包埋液包埋组织后固定于切片机上,沿冠状面对脑组织切片,厚度约10 μm。将切片转移至32 ℃的氧饱和ACSF中备用。取出切片,自穿质通路(MPP)插入刺激电极,在海马 DG区插入记录电极,充灌ACSF作为记录电极内液。电极连接MultiClamp 700B型放大器,记录MPP-DG通路兴奋性突触后电位(EPSP);沿穿质通路不断调整刺激强度和记录电极的位置、深度,以0.033 Hz的刺激频率诱发场电位(fEPSP)直到记录典型的场电位波形,然后固定电极与刺激强度。在基线稳定记录20 min后,应用高频刺激诱发长时程增强(LTP),连续20串高频脉冲,每串包含200个脉冲,频率为200 Hz,波宽200 μs,串间隔30 s,高频刺激连续记录60 min。
1.4.4 蛋白质印迹法:幼鼠以CO2处死,取海马组织称重,以体积∶ 质量=4∶ 1加入含PMSF的RIPA裂解液,研磨成细胞悬液,静置30 min使蛋白完全裂解。离心(12 000 r/min,20 min)后取上清液,以BCA试剂盒检测蛋白浓度,加入5×上样缓冲液。取十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶,每个样品孔中加入约10 μg各组蛋白样品与5 μL的预染蛋白Marker,开始SDS-PAGE凝胶电泳,条件为恒压60 V/30 min,120 V/60 min,0 ℃冰水浴。当上样缓冲液到达凝胶底部时,终止电泳,根据预染蛋白Marker截取目标蛋白条带。以湿法转膜法将凝胶上蛋白转移至PVDF膜上,条件为恒流2 mA/60 min,0 ℃冰水浴。当转膜结束,以4%脱脂牛奶封闭PVDF膜,避免抗体非特异性结合。PBST清洗条带后,再以目标蛋白抗体(1∶ 1 000)稀释液孵育PVDF膜,4 ℃过夜。次日,取出PVDF膜,PBST清洗条带后,使用HRP-IgG二抗稀释液室温(25 ℃)孵育2 h。PBST清洗条带后,将超高敏发光液滴加的PVDF膜上,在凝胶成像显影仪下显影获得目的蛋白条带。
1.5 统计学方法
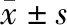
2 结果
2.1 银杏二萜内酯葡胺对氯胺酮麻醉后幼鼠认知功能的影响
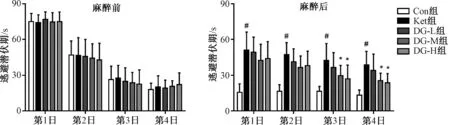
Morris水迷宫测试显示,麻醉前,如图1所示,训练期间,各组小鼠逃避潜伏期随着训练次数的增加而逐渐缩短,测试期间,各组小鼠游泳速率、首次达到平台时间、第Ⅰ象限停留时间占比和穿越平台次数没有差异。麻醉后,如图2所示,训练期间,与Con组相比,Ket组幼鼠逃避潜伏期显著延长;与Ket组相比,DG-M与DG-H组小鼠在第3、4日逃避潜伏期显著缩短,差异均有统计学意义(P<0.05)。测试期间,各组幼鼠的游泳速率无差异;然而,与Con组相比,Ket组幼鼠首次达到平台时间显著延长,第Ⅰ象限停留时间占比显著减少,穿越平台次数显著减少,差异均有统计学意义(P<0.05);与Ket组相比,DG-M与DG-H组幼鼠首次达到平台时间显著缩短,第Ⅰ象限停留时间占比显著增加,穿越平台次数显著增加,差异均有统计学意义(P<0.05)。
与Con组相比,#P<0.05;与Ket组相比,*P<0.05vs. the Con group,#P<0.05;vs. the Ket group,*P<0.05图1 五组幼鼠麻醉前后水迷宫训练期逃避潜伏期比较(n=10)Fig 1 Comparison of escape latency of 5 groups of immature rats in the water maze training period before and after anesthesia (n=10)
与Con组相比,#P<0.05;与Ket组相比,*P<0.05vs. the Con group,#P<0.05;vs. the Ket group,*P<0.05图2 五组幼鼠麻醉前后水迷宫测试期游泳速率、首次到达平台时间、第Ⅰ象限时间占比和穿越平台时间比较(n=10)Fig 2 Comparison of swimming speed,duration to reach the platform,time spend in the first quadrant,and time of platform crossing in each group of 5 groups of immature rats before and after anesthesia in the water maze test period (n=10)
2.2 银杏二萜内酯葡胺对氯胺酮麻醉后幼鼠海马神经元树突棘的影响
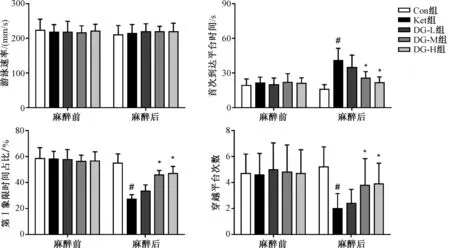
幼鼠脑组织海马区树突棘结构的高尔基染色结果与量化统计见图3。结果显示,Con组幼鼠海马区神经元树突棘密集;与Con组相比,Ket组幼鼠海马区神经元树突棘密度和树突棘长度降低,差异有统计学意义(P<0.05);与Ket组相比,DG-L组幼鼠海马区神经元树突棘密度和长度没有改变,而DG-L组幼鼠海马区神经元树突棘密度和长度显著增加,差异有统计学意义(P<0.05)。
与Con组相比,#P<0.05;与Ket组相比,*P<0.05vs. the Con group,#P<0.05;vs. the Ket group,*P<0.05图3 五组幼鼠树突棘密度和长度比较(n=3)Fig 3 Comparison of density and length of mediated dendritic spines of 5 groups of immature rats (n=3)
2.3 银杏二萜内酯葡胺对氯胺酮麻醉后幼鼠海马区神经元fEPSP的影响
长时程电位检测结果见图4。结果显示,与Con组相比,Ket组幼鼠大脑MPP-DG通路的fEPSP斜率显著降低,差异有统计学意义(P<0.05);与Ket组相比,DG-L组幼鼠fEPSP斜率没有改变,而DG-M与DG-H组幼鼠fEPSP斜率显著升高,差异均有统计学意义(P<0.05)。
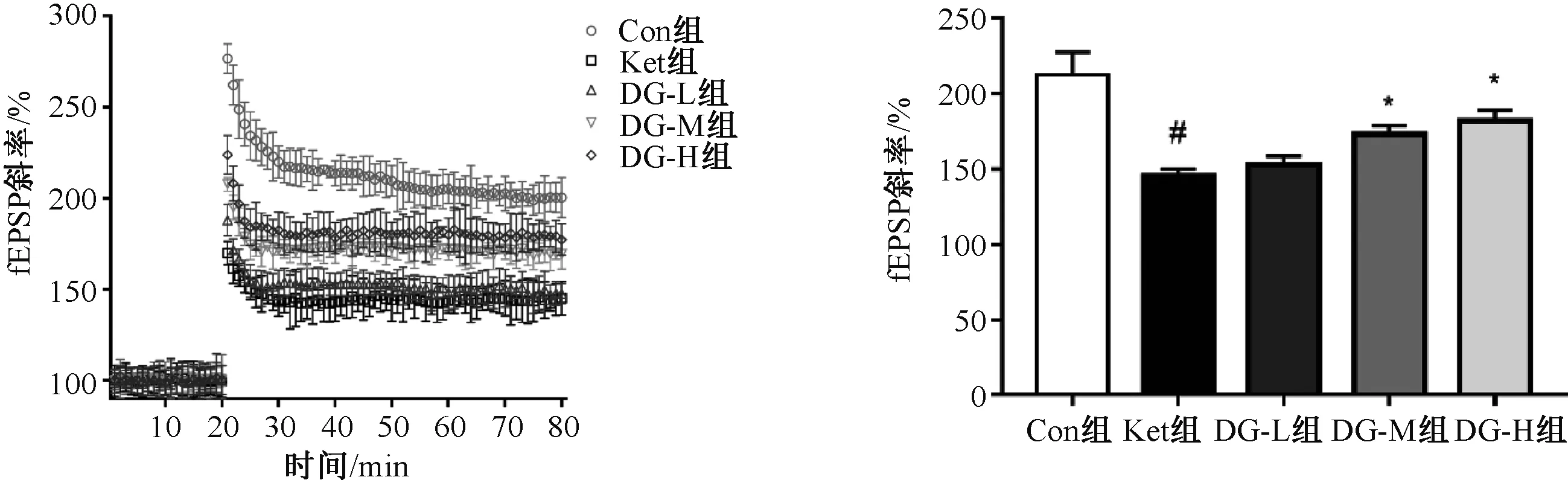
与Con组相比,#P<0.05;与Ket组相比,*P<0.05vs. the Con group,#P<0.05;vs. the Ket group,*P<0.05图4 五组幼鼠海马区神经元fEPSP水平比较(n=3)Fig 4 Comparison of fEPSP levels in hippocampal neurons of of 5 groups of immature rats (n=3)
2.4 银杏二萜内酯葡胺对氯胺酮麻醉后幼鼠海马中BDNF、TrkB和PSD-95的影响
蛋白质印迹法结果见图5。结果显示,与Con组相比,Ket组幼鼠海马组织中BDNF、TrkB和PSD-95表达显著降低,差异均有统计学意义(P<0.05);与Ket组相比,DG-L组幼鼠海马组织中BDNF、TrkB和PSD-95表达没有改变,而DG-M、DG-H组幼鼠海马组织中BDNF、TrkB和PSD-95表达显著升高,差异均有统计学意义(P<0.05)。
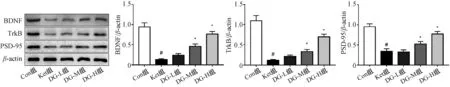
与Con组相比,#P<0.05;与Ket组相比,*P<0.05vs. the Con group,#P<0.05;vs. the Ket group,*P<0.05图5 五组幼鼠海马中BDNF、TrkB和PSD-95表达比较(n=3)Fig 5 Comparison of expression of BDNF,TrkB and PSD-95 in the hippocampus of 5 groups of immature rats (n=3)
2.5 银杏二萜内酯葡胺对氯胺酮麻醉后幼鼠海马中caspase-3、Bax和Bcl-2的影响
蛋白质印迹法结果见图6。结果显示,与Con组相比,Ket组幼鼠海马组织中cleaved-caspase-3和Bax表达显著升高,而Bcl-2表达显著降低,差异均有统计学意义(P<0.05);与Ket组相比,DG-L组幼鼠海马组织中cleaved-caspase-3和Bax表达降低,但差异无统计学意义(P>0.05),且Bcl-2没有改变;与Ket组相比,DG-M与DG-H组幼鼠海马组织中cleaved-caspase-3和Bax表达显著降低,而Bcl-2表达显著升高,差异均有统计学意义(P<0.05)。
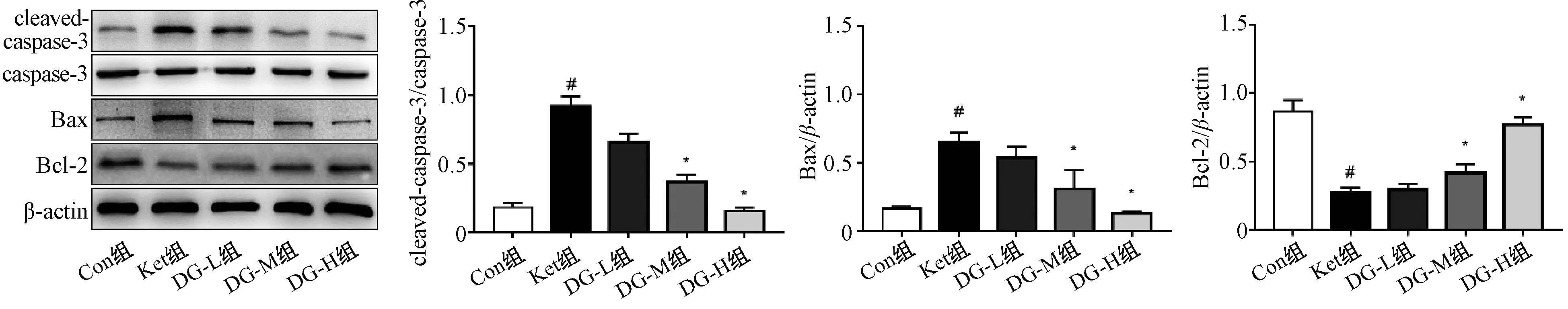
与Con组相比,#P<0.05;与Ket组相比,*P<0.05vs. the Con group,#P<0.05;vs. the Ket group,*P<0.05图6 五组幼鼠海马中caspase-3、Bax和Bcl-2表达比较(n=3)Fig 6 Comparison of expression of caspase-3,Bax and Bcl-2 in the hippocampus of 5 groups of immature rats (n=3)
3 讨论
Morris水迷宫是利用啮齿类动物会游泳且厌水的特征作为驱动力,强迫其找到隐藏在水下的逃生平台,从而逃离水环境并形成稳定的记忆[6]。由于幼鼠入水时位置与平台位置并无关联,必须通过多次训练寻找水面下的隐藏平台,从而强化记忆。后期的空间探索测试中,撤去逃生平台,记录幼鼠利用外周环境寻找逃生平台的行为,评价幼鼠空间记忆的牢固程度。本研究结果显示,对照组幼鼠逃避潜伏期的不断缩短,穿越平台次数的增加,代表幼鼠逐渐牢固的空间记忆,反映了较优的认知功能[7]。然而,氯胺酮麻醉造成幼鼠逃避潜伏期延长,穿越平台次数减少,提示氯胺酮诱导中枢神经系统毒性,导致幼鼠出现不同程度的认知功能障碍。中、高剂量DG治疗则有效地改善了幼鼠的认知功能。
突触可塑性指突触基于树突棘结构产生的不断变化的传递效能,与个体的学习和记忆能力相关,树突棘数量、密度和长度的变化可直观反映突触可塑性变化[8]。哺乳动物中枢神经系统中多数兴奋性突触位于树突棘上,树突棘负责接收来自兴奋性突触的输入,对于记忆的形成和储存至关重要[9]。在多数老龄阿尔兹海默病模型大鼠脑中,都可见明显的树突棘萎缩[10]。而新生幼鼠中则可见不断丰满与增殖的树突棘结构[11]。本研究结果显示,氯胺酮造成幼鼠海马区神经元树突棘的密度、长度较Con组显著减少。此外,本研究结果显示,与Ket组相比,中剂量和高剂量DG干预的幼鼠神经元树突棘密度增加,且神经元长度显著增长。fEPSP反映了突触后神经信号传递的强度变化,被视为形成学习和记忆的神经元基础的潜在功能机制[12]。本研究,fEPSP结果与幼鼠树突棘密度和长度变化呈正相关,且反映了幼鼠Morris水迷宫结果。
海马是涉及空间学习与记忆的关键结构[13]。BDNF与其高亲和力受体TrkB在海马内有着较高的表达,与神经发育、突触发生和学习记忆紧密相关[14]。BDNF在发育中的啮齿动物脑中与麻醉剂引起的神经毒性或神经元凋亡有关[15]。在发育阶段或成年期大鼠脑中以基因技术编码降低BDNF表达可能导致突触功能障碍,降低神经可塑性,并损害记忆形成[16]。而BDNF表达升高则有助于增加兴奋性突触的数量,调节轴突形态,直接促进突触形成,参与LTP,与学习和记忆有关[17]。在反复应激诱导的抑郁样行为大鼠脑中,可见明显BDNF、TrkB的mRNA和蛋白表达水平降低,造成大鼠记忆功能损伤[18]。另外,PSD-95是一种兴奋性突触后信号传导和整合的关键分子,是位于中枢神经系统突触后膜的特殊结构[19]。本研究中,PSD-95的表达降低与突触数量减少或突触丢失相关,反映了突触信号传递的阻滞,影响到fEPSP水平[20]。当氯胺酮全身麻醉时,幼鼠海马组织中BDNF、TrkB和PSD-95蛋白表达水平显著降低,且cleaved-caspase-3和Bax表达升高,而Bcl-2表达降低。因此,氯胺酮会引起神经毒性,损害神经元发育并影响幼鼠海马体的突触形成,最终导致幼鼠认知功能受损。而中、高剂量DG的给药能够显著上调幼鼠脑组织中BDNF、TrkB和PSD-95蛋白表达水平,抑制cleaved-caspase-3和Bax表达,促进突触的形成。
综上所述,在与认知功能密切相关的突触结构中,给予DG能够逆转氯胺酮造成的损伤。其可能机制为通过上调BDNF、TrkB和PSD-95表达,抑制cleaved-caspase-3和Bax表达,维持树突棘的状态,促进突触的形成,最终改善幼鼠的认知功能。
