戈舍瑞林与比卡鲁胺不同给药方式对晚期老年前列腺癌患者血清PSA、生长因子水平及免疫功能的影响
2022-10-10杜志龙
杜 志 龙
(新密市第一人民医院肿瘤科 新密 452370)
前列腺癌是临床上较为常见的男性生殖系统恶性肿瘤的一种,其是因患者机体前列腺上皮细胞增殖、增生所生成的恶性肿瘤;近些年来随着我国人口老龄化程度的不断加重,我国前列腺癌患病率呈逐年上升趋势[1]。由于前列腺癌患者在早期无显著性临床症状,我国也没有针对前列腺癌疾病的早期筛查项目,使大部分患者一经确诊即已发展为晚期前列腺癌,错过了最佳手术根治时机,而内分泌治疗方案在临床上取得了良好的效果,可延长患者生存期。戈舍瑞林属于促性腺激素释放激素的一种激动剂,可经下丘脑-垂体-性腺轴降低睾酮的生成;比卡鲁胺是雄性激素受体抑制剂,可有效抑制恶性前列腺细胞的生长;但两种药物联合长时间持续使用可诱发患者出现性欲和智力下降,降低其生活质量[2]。鉴于此,本文旨在对比观察戈舍瑞林联合比卡鲁胺持续性、间歇性给药对晚期老年前列腺癌患者的治疗效果。分享如下。
1 资料与方法
1.1 一般资料
选取我科2019年5月至2021年5月期间125例晚期老年前列腺癌患者以随机数字表法分为两组。常规组62例,年龄在60-82岁之间,平均(71.02±5.45)岁,病程4个月-2年,平均(1.17±0.63)年,临床分期:ⅣA期40例,ⅣB期22例。研究组63例,年龄在61-82岁之间,平均(71.53±5.68)岁,病程6个月-2年,平均(1.25±0.50)年,临床分期:ⅣA期42例,ⅣB期21例。纳入标准:所有患者经临床检查确诊为前列腺癌[3],预计生存期大于12个月,伴有骨痛、尿频、排尿困难等症状,患者及家属知情。排除标准:伴有未能有效控制糖尿病、其他恶性肿瘤疾病,存在造血功能障碍、免疫系统疾病,对本研究中药物存在过敏现象。两组患者一般资料对比,无统计学意义(P>0.05)。
1.2 方法
常规组给予戈舍瑞林与比卡鲁胺持续治疗,醋酸戈舍瑞林缓释植入剂(AstraZenecaUKLimited,H20040447,规格:3.6mg)皮下注射,3.6mg/次,1次/4周;比卡鲁胺片(浙江海正药业股份有限公司,H20073877,规格:50mg)口服,50mg/次,1次/d,连续性给药。
研究组给予戈舍瑞林与比卡鲁胺间歇性给药,戈舍瑞林、比卡鲁胺两种药物生产厂家、服用方式、剂量与常规组相同,并每个月对患者进行PSA检测,当PSA<0.2ng/mL时暂停用药,当PSA>4ng/mL时继续用药。两组患者均治疗1年。
1.3 观察指标
(1)前列腺癌相关因子水平:抽取患者空腹静脉血,分离血清,检测血清前列腺特异抗原(PSA)、游离PSA(F-PSA)水平、血管内皮生长因子(VEGF)、胰岛素样生长因子-1(IGF-1)水平。
(2)免疫功能指标:采集患者静脉血3ml,采用贝克曼CytoFLEX型 流 式 细 胞 仪 检 测CD3+、CD4+、CD8+及CD4+/CD8+水平。
(3)治疗效果:利用扩展性前列腺癌复合指数量表(EPIC)评估,包含肠道功能、激素功能性功能、泌尿功能4个维度,每个维度总分为100分,分数越高表示生活质量越好。
(4)不良反应:观察并记录两组患者发生肝功能异常、骨质疏松、胃肠道反应、勃起障碍不良反应及发生率。
1.4 统计学方法
采用SPSS23.0统计软件分析,计数资料以(%)表示,χ2值检验,计量资料以(±s)表示,t检验,P<0.05有统计学意义。
2 结果
2.1 两组患者治疗前后前列腺癌相关因子水平对比
治疗后两组PSA、F-PSA、VEGF、IGF-1水平均低于治疗前(P<0.05);而治疗后两组患者PSA、F-PSA、VEGF、IGF-1水平无统计学意义(P>0.05)。见表1。
表1 前列腺癌相关因子水平对比(±s)
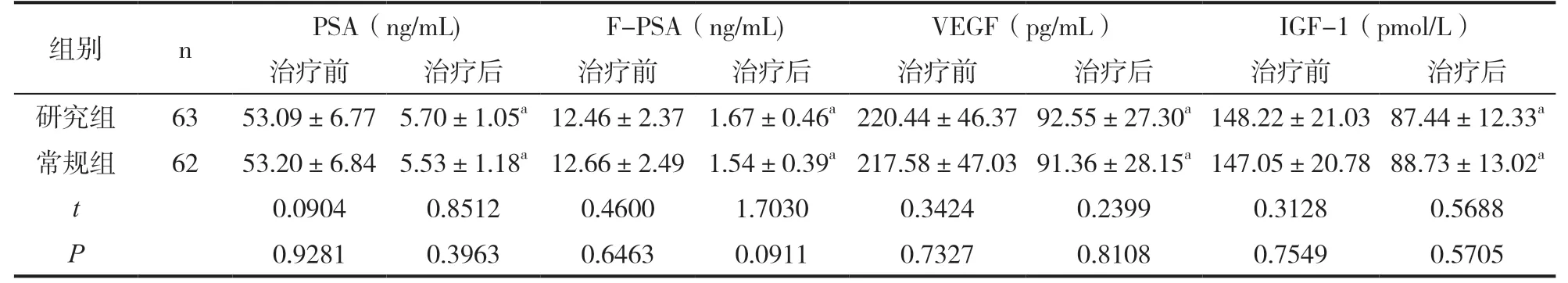
表1 前列腺癌相关因子水平对比(±s)
注:与治疗前比较,aP<0.05。
组别 n PSA(ng/mL) F-PSA(ng/mL) VEGF(pg/mL) IGF-1(pmol/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后研究组 63 53.09±6.77 5.70±1.05a 12.46±2.37 1.67±0.46a 220.44±46.37 92.55±27.30a 148.22±21.03 87.44±12.33a常规组 62 53.20±6.84 5.53±1.18a 12.66±2.49 1.54±0.39a 217.58±47.03 91.36±28.15a 147.05±20.78 88.73±13.02a t 0.0904 0.8512 0.4600 1.7030 0.3424 0.2399 0.3128 0.5688 P 0.9281 0.3963 0.6463 0.0911 0.7327 0.8108 0.7549 0.5705
2.2 两组患者治疗前后免疫功能指标对比
治疗后两组CD3+、CD4+、CD4+/CD8+水平高于治疗前,CD8+低于治疗前(P<0.05);而治疗后两组患者CD3+、CD4+、CD8+、CD4+/CD8+水平无统计学意义(P>0.05)。见表2。
表2 免疫功能指标对比(±s)
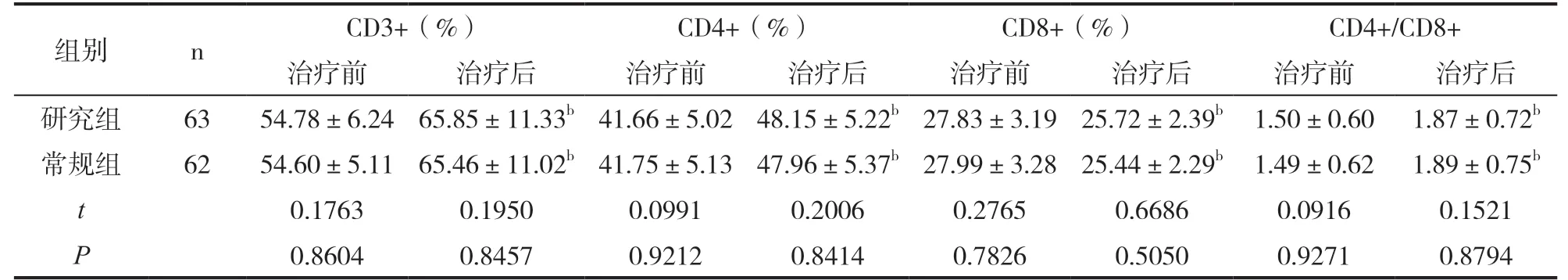
表2 免疫功能指标对比(±s)
注:与治疗前比较,bP<0.05。
组别 n CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后研究组 63 54.78±6.24 65.85±11.33b 41.66±5.02 48.15±5.22b 27.83±3.19 25.72±2.39b 1.50±0.60 1.87±0.72b常规组 62 54.60±5.11 65.46±11.02b 41.75±5.13 47.96±5.37b 27.99±3.28 25.44±2.29b 1.49±0.62 1.89±0.75b t 0.1763 0.1950 0.0991 0.2006 0.2765 0.6686 0.0916 0.1521 P 0.8604 0.8457 0.9212 0.8414 0.7826 0.5050 0.9271 0.8794
2.3 两组患者治疗前后生活质量对比
治疗后研究组泌尿功能、肠道功能、激素功能、性功能评分高于常规组(P<0.05)。见表3。
表3 EPIC各项评分对比(±s,分)
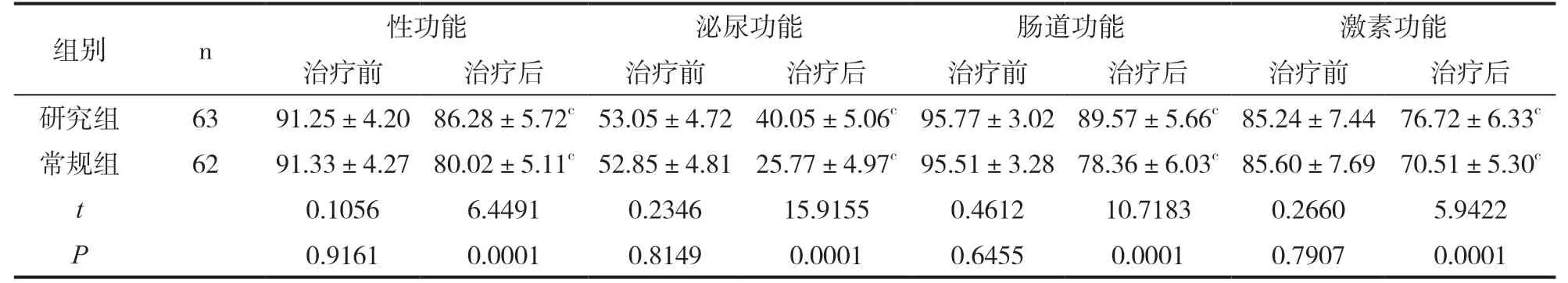
表3 EPIC各项评分对比(±s,分)
注:与治疗前比较,cP<0.05。
组别 n 性功能 泌尿功能 肠道功能 激素功能治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后研究组 63 91.25±4.20 86.28±5.72c 53.05±4.72 40.05±5.06c 95.77±3.02 89.57±5.66c 85.24±7.44 76.72±6.33c常规组 62 91.33±4.27 80.02±5.11c 52.85±4.81 25.77±4.97c 95.51±3.28 78.36±6.03c 85.60±7.69 70.51±5.30c t 0.1056 6.4491 0.2346 15.9155 0.4612 10.7183 0.2660 5.9422 P 0.9161 0.0001 0.8149 0.0001 0.6455 0.0001 0.7907 0.0001
2.4 两组患者不良反应情况对比
研究组不良反应发生率3.17%低于常规组14.52%,有统计学意义(χ2=5.0083,P=0.0252<0.05),见图1。
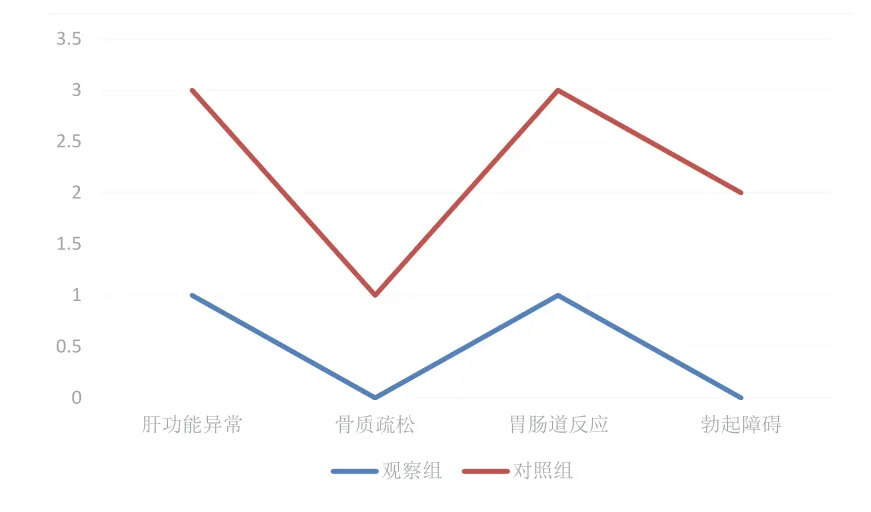
图1 不良反应发生情况对比
3 讨论
前列腺作为雄性激素依赖性器官,双氢睾酮是大多数前列腺癌病变细胞有效维持生存需求的活性雄激素,前列腺组织内的双氢睾酮60%源自于睾丸,40%来自于肾上腺分泌的雄激素前体,其通过组织转化成雄性激素,并与雄性激素受体相结合后,对前列腺细胞无序化生长进行刺激继而发生癌变[4]。前列腺癌疾病在欧美国家患病率较高,其仅次于肺癌;而近些年来我国男性前列腺恶性肿瘤疾病患病率逐步上升,尤其是在70岁以上年龄的老年人群中,严重影响其生活质量。该病早期症状不明显,发病较为隐匿,大多表现为尿急、尿频、夜尿增多等症状,与前列腺增生疾病较为相似,当出现明显症状时,疾病已经发展至晚期阶段[5]。目前临床上给予患者持续性治疗或间歇性治疗仍存在较大争议,故应寻求合理有效的给药方式对改善患者免疫功能、预后效果具有重要意义。
本研究显示,相较于治疗前,两组患者治疗后PSA、F-PSA、VEGF、IGF-1、CD3+、CD4+、CD8+、CD4+/CD8+水平均有显著性改善,但治疗后两组上述指标无明显差异,提示经戈舍瑞林联合比卡鲁胺持续性或间歇性给药对改善晚期前列腺癌患者免疫功能、抗肿瘤效果相当。戈舍瑞林联合比卡鲁胺两种药物是治疗晚期前列腺癌疾病主要的内分泌方案,戈舍瑞林是治疗前列腺癌的基础,其经下丘脑-垂体-性腺轴系统可降低机体内血清睾酮水平,并发挥抑制前列腺癌细胞生殖发育作用;其还可在机体内进行生物降解过程,可充分抑制脑垂体分泌的促黄体生成素合成,进而降低患者血清PSA、F-PSA水平[6-7]。比卡鲁胺能够与雄性激素受体结合,促使二氢睾酮失去自身作用,可对肿瘤细胞生长产生抑制作用;其还可抑制睾酮转变成有活性二氢睾酮的过程,使雄性激素对前列腺癌细胞的生长刺激效果降低,并抑制恶性肿瘤细胞DNA的合成,发挥抗肿瘤作用[8]。两种药物联合使用可拮抗雄激素生物学作用,并对前列腺组织内血管新生产生抑制效果,使微血管密度、免疫逃逸、免疫功能异常反应得以降低,进而有效纠正患者机体内免疫功能紊乱现象,两种药物无药动学、药效学互相影响,持续性和间歇性使用均可充分抑制肿瘤细胞扩散,降低肿瘤负荷程度,进而降低PSA、F-PSA、VEGF、IGF-1水平,改善患者免疫功能[9]。
本研究显示,研究组EPIC各项评分、不良反应发生率均优于常规组,提示经戈舍瑞林与比卡鲁胺间歇性给药治疗可有效改善老年晚期前列腺癌患者生活质量,安全性高。前列腺癌患者对激素具有一定程度的依赖性,但在接受持续性戈舍瑞林与比卡鲁胺治疗后会对药物产生耐受,继而发展成为激素非依赖性前列腺癌;在持续性治疗过程中,患者会出现骨质疏松、肝功能异常等不良反应,通过长时间用药会使患者骨质生成减低和骨质吸收量增加,造成骨质丢失和骨质疏松,其中股骨颈和腰椎最为显著;而药物主要是在肝脏内代谢转化,会发生暂时性、中等程度的转氨酶升高,进而造成患者肝功异常;勃起障碍是因两种抗雄激素药物在下丘脑阻滞了雄激素受体,对下丘脑、睾丸的反馈机制产生干扰作用,造成黄体生长激素、雌激素水平增高,最终导致勃起障碍不良反应增多;而持续性治疗方案费用也相当高昂,并不会对前列腺癌进展至雄激素非依赖阶段发挥延迟作用[10]。戈舍瑞林联合比卡鲁胺间歇性给药方案的生物学基础是经雄激素对生存的肿瘤细胞进行间歇性抑制,可有效延迟前列腺癌进展至雄激素非依赖性阶段,进而改善患者泌尿功能、肠道等功能,延长生存期,提高其生活质量;间歇性治疗通过减低药物次数和剂量可有效降低肝功能异常、骨质疏松等不良反应发生风险,安全性高。
综上所述,间歇性方案通过延迟前列腺癌进展至雄激素非依赖性阶段和拮抗雄激素生物学对老年晚期前列腺癌患者治疗,能够提高机体免疫功能生活质量,增强抗肿瘤效果,安全性高。
