miR-132对新生小鼠认知功能障碍的预防作用及其机制
2022-10-09韩玉琴苏凤龙关海飞缪凡
韩玉琴,苏凤龙,关海飞,缪凡
1 承德市妇幼保健院麻醉科,河北 承德 067000;2 承德医学院附属第二医院麻醉科
七氟醚是一种手术麻醉中常用的挥发性麻醉剂,其特点是起效快、气道刺激性低、血液/气体分配系数低,因此临床上广泛应用于婴幼儿及儿童麻醉[1]。既往研究[2-4]证据表明,婴幼及儿童长时间接触七氟醚会对中枢神经系统有一定的毒性作用,产生神经认知功能障碍,影响其空间记忆以及学习能力。但目前关于七氟醚造成婴幼儿及儿童神经认知功能障碍的机制尚不完全清楚,并且缺乏有效的干预方法。微小RNA(miRNA)是一类小分子非编码RNA,由22~25个核苷酸组成,在机体细胞生命活动中起着重要的调控作用[5]。miRNA在神经系统中表达丰富,在调控神经认知功能障碍中起重要作用[6-7]。miR-132是在哺乳动物脑组织,尤其是海马区组织高表达的miRNA之一,参与神经元生长、树突生长调控过程,与神经认知功能具有相关性[8]。miR-132对七氟醚诱导的新生小鼠神经认知功能障碍是否有影响尚未可知。本研究通过观察七氟醚诱导的新生小鼠海马区miR-132的表达,探讨miR-132对七氟醚诱导的新生小鼠神经认知功能障碍的预防作用及其可能的机制,为儿童神经认知功能障碍机制的研究提供新的思路。
1 材料与方法
1.1 动物、试剂、仪器6日龄SPF级健康雄性C57BL/6小鼠64只,体质量3~5 g,购自北京维通利华实验动物公司。七氟醚购自上海恒瑞医药公司;TRIzol mRNA提取试剂购自美国Invitrogen公司;逆转录试剂盒、qRT-PCR试剂盒购自大连宝生物公司;所有PCR引物、miRNA模拟物阴性对照agomir-NC和miR-132模拟物agomir-132购自上海吉玛制药公司;谷胱甘肽过氧化物酶(GSH-PX)、丙二醛(MDA)、超氧化物歧化酶(SOD)检测试剂盒购自南京建成生物工程研究所;白细胞介素(IL)-1β、肿瘤坏死因子(TNF)-α和IL-6检测试剂盒购自上海酶联生物公司;一抗高迁移率族蛋白B1(HMGB1)、Bax、Bcl-2、GAPDH抗体购自美国Santa Cruz公司;二抗购自英国Abcam公司。麻醉机、气体监测仪购自德国Draeger公司;PCR仪购自美国Thermo Fisher Scientific公司;Morris水迷宫购自北京智鼠多宝生物科技公司;电泳仪、转膜仪购自美国Bio-Rad公司。
1.2 动物分组及干预措施所有小鼠采用数字表法随机分为4组:正常对照组(A组)、七氟醚组(B组)、七氟醚+agomir-NC组(C组)、七氟醚+agomir-132组(D组),每组16只。A组小鼠给予吸入30%氧气和空气的混合气体共4 h,其他三组小鼠给予4%七氟醚和30%氧气共4 h。C组和D组在造模前分别给予侧脑室注射agomir-NC(100 nmol)和agomir-132(100 nmol),A组和B组给予侧脑室注射注射等体积生理盐水。待七氟醚诱导麻醉干预结束24 h后,在各组小鼠中随机选择8只处死,冰上取得海马组织,-80℃冰箱保存待检。
1.3 小鼠海马组织中miR-132的检测采用qRTPCR法检测。利用TRIzol试剂提取小鼠海马组织中的总RNA,逆转录成cDNA。加入PCR引物,进行qPCR扩增反应。反应中所需引物的系列:miR-132上 游引 物5′-GCGCGTAACAGTCTACAGCCA-3′,下游引物5′-AGTGCAGGGTCCGAGGTATT-3′;U6上游引 物5′-CTCGCTTCGGCAGCACATA-3′,下 游 引 物5′-AACGATTCACGAATTTGCGT-3′。反 应 条 件:94℃、10 min,94℃、30 s,55℃、30 s,72℃、2 min,共35个循环,用2-ΔΔCt法计算海马组织中miR-132的相对表达量。
1.4 小鼠海马组织中HMGB1、Bax、Bcl-2蛋白的检测采用Western blotting法。用RIPA裂解液提取小鼠海马组织总蛋白,BCA法定量蛋白。各组取50 μg蛋白样本行10% SDS-PAGE,将凝胶蛋白半干法转移至PVDF膜上,5%脱脂奶粉封闭2.5 h,分别加入 一抗(HMGB1稀 释度1∶500,Bax稀 释度1∶1 000,Bcl-2稀释度1∶1 000,GAPDH稀释度1∶2 000),室温摇晃2 h,4℃冰箱孵育过夜,TBST液洗膜3次,加入二抗后室温摇晃2 h,TBST液洗膜3次,ECL发光,Image-lab图像分析系统分析条带灰度,计算目标蛋白相对表达水平。
1.5 小鼠海马组织IL-1β、IL-6、TNF-α水平的检测采用ELISA法检测。取小鼠海马组织,应用匀浆器研磨成浆,4℃、12 000 r/min离心15 min收集上清液,应用ELISA检测试剂盒测定上清液IL-1β、TNF-α和IL-6。
1.6 小鼠海马组织SOD、MDA及GSH-PX等氧化应激指标的检测取小鼠海马组织,加入预冷的PBS匀浆,4℃、12 000 r/min离心15 min收集上清液,应用SOD、MDA及GSH-PX检测试剂盒测定上清液SOD、MDA及GSH-PX。
1.7 小鼠神经认知功能的检测采用Morris水迷宫实验检测。每组8只小鼠于七氟醚诱导麻醉干预结束后继续培养至出生后第60天(性成熟期)行Morris水迷宫实验。取性成熟期(出生后第60 d)的各组剩余小鼠进行Morris水迷宫实验,Morris水迷宫为水池底面直径150 cm,高30 cm的黑色圆柱形水池,将直径10 cm,高25 cm的可移动圆形平台置入水池底第I象限,向水池内注入室温水,加入氧化钛使水变成不透明的乳白色,控制水位高于圆形平台1 cm。实验分为学习能力检测(定位航行实验)和记忆能力检测(空间探索实验)。①定位航行实验:在水池不同象限的中点将小鼠面向池壁放入水池,让小鼠自由游泳,检测时间为60 s,记录小鼠自入水找到平台并爬上平台所需时间作为逃避潜伏期(如小鼠入水后一直未能找到平台或未能爬上平台,则记录逃避潜伏期为60 s)以及在此时间内小鼠游泳活动的距离作为游泳距离。每只小鼠进行连续5 d的实验,每天实验4次;②空间探索实验:定位航行实验结束后的第2天,撤去隐藏在水面下方可移动圆形平台,任选1个入水点将小鼠面向池壁放入水池,记录小鼠120 s时间内穿越原平台位置的次数及在原平台所在象限的停留时间。
1.8 统计学方法采用SPSS20.0统计软件,符合正态分布计量数据采用±s表示,比较应用单因素方差分析,进一步两两比较采用SNK-q法。以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠脑海马组织中miR-132相对表达量比较A组、B组、C组和D组脑海马组织miR-132相对表 达量 分 别为1.05±0.09、0.45±0.16、0.49±0.18、0.72±0.12。与A组相比,B、C、D组脑海马组织miR-132相对表达量均降低(P均<0.05),B、C组脑海马组织miR-132相对表达量比较,P>0.05,与B、C组相比,D组脑海马组织miR-132相对表达量升高(P均<0.05)。
2.2 小鼠认知功能的比较 与A组相比,B组、C组和D组逃避潜伏期和游泳距离均明显增加(P均<0.05),在原平台象限的停留时间和穿越原平台位置的次数均减少(P均<0.05)。B组和C组在逃避潜伏期、游泳距离、原平台象限的停留时间及穿越原平台位置的次数等方面比较,P>0.05。与B组和C组相比,D组逃避潜伏期和游泳距离明显缩短(P均<0.05),在原平台象限的停留时间和穿越原平台位置的次数均明显增多(P均<0.05)。见表1。
表1 各组小鼠认知功能的比较(±s)
注:与A组比较,△P<0.05;与B组比较,&P<0.05;与C组比较,#P<0.05。
组别A组B组C组D组n 8 8 8 8逃避潜伏期(s)35.3±2.9 57.2±5.8△56.2±4.9△43.1±3.2△&#游泳距离(cm)116.3±9.7 289.6±22.1△285.2±23.4△165.7±11.6△&#穿越原平台位置次数6.0±1.3 1.9±1.2△1.8±1.0△3.7±1.3△&#原平台象限停留时间(s)38.0±4.8 19.2±5.7△20.2±5.1△27.6±5.9△&#
2.3 小鼠脑海马组织促炎因子HMGB1蛋白表达及炎性因子水平比较 与A组相比,B组、C组和D组脑海马组织HMGB1蛋白、IL-1β、TNF-α、IL-6等炎性因子水平均升高(P均<0.05)。B组和C组脑海马组织HMGB1蛋白、IL-1β、TNF-α、IL-6等炎性因子水平比较,P均>0.05。与B组和C组相比,D组脑海马组织HMGB1蛋白表达、IL-1β、TNF-α、IL-6等炎性因子水平降低(P均<0.05)。详见表2。
表2 各组小鼠脑海马组织炎性因子水平比较(±s)

表2 各组小鼠脑海马组织炎性因子水平比较(±s)
注:与A组比较,△P<0.05;与B组比较,&P<0.05;与C组比较,#P<0.05。
组别A组B组C组D组n 8 8 8 8 HMGB1 0.14±0.06 0.82±0.17 0.88±0.14 0.29±0.13 IL-1β(ng/g)2.36±0.82 6.22±1.87△6.30±2.03△4.11±0.93△&#TNF-α(ng/g)5.87±2.01 14.99±4.97△14.37±5.14△9.16±3.19△&#IL-6(ng/g)3.78±1.56 11.32±2.89△11.79±3.03△6.77±2.01△&#
2.4 小鼠脑海马组织氧化应激指标(SOD、GSHPX、MDA)及细胞凋亡指标(Bax和Bcl-2蛋白)比较与A组相比,B组、C组和D组脑海马组织SOD、GSH-PX水平及Bcl-2蛋白表达水平降低(P均<0.05),而MDA水平及Bax蛋白表达水平升高(P均<0.05)。B组和C组脑海马组织SOD、GSH-PX、MDA水 平 及Bax和Bcl-2表 达 水 平 比 较,P均>0.05。与B组和C组相比,D组脑海马组织SOD、GSH-PX水平及Bcl-2蛋白表达水平升高(P均<0.05),而MDA水平及Bax蛋白表达水平降低(P均<0.05)。详见表3。
表3 各组小鼠脑海马组织氧化应激水平及细胞凋亡水平比较(±s)
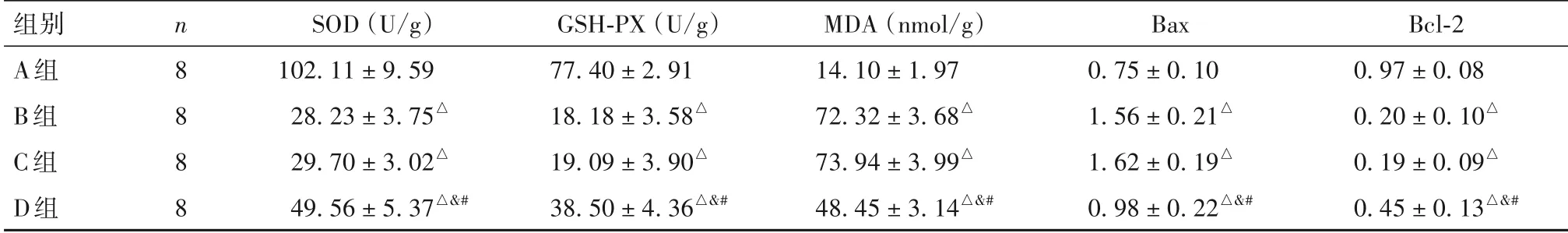
表3 各组小鼠脑海马组织氧化应激水平及细胞凋亡水平比较(±s)
注:与A组比较,△P<0.05;与B组比较,&P<0.05;与C组比较,#P<0.05。
组别A组B组C组D组n 8 8 8 8 SOD(U/g)102.11±9.59 28.23±3.75△29.70±3.02△49.56±5.37△&#GSH-PX(U/g)77.40±2.91 18.18±3.58△19.09±3.90△38.50±4.36△&#MDA(nmol/g)14.10±1.97 72.32±3.68△73.94±3.99△48.45±3.14△&#Bax 0.75±0.10 1.56±0.21△1.62±0.19△0.98±0.22△&#Bcl-2 0.97±0.08 0.20±0.10△0.19±0.09△0.45±0.13△&#
3 讨论
近年来,麻醉药物在胎儿和儿童应用中的安全性和风险性引起了各国学者的关注。动物研究[9-10]表明,各种全身麻醉剂均可能对发育期大脑产生神经毒性,引发神经元的凋亡性退变。七氟醚是广泛应用于儿科麻醉的吸入性麻醉剂。研究[11-12]发现,胎儿或婴幼儿早期暴露于高浓度的七氟醚可能导致神经炎症、神经元凋亡以及神经传导抑制,影响学习记忆,从而造成神经认知功能障碍。海马区是参与认知记忆功能的重要脑区,研究[13]显示,吸入性七氟醚造成的小鼠海马区有关基因的改变是其造成发育期小鼠大脑神经认知障碍的重要原因。
miRNA是一种小的、内源性的非编码RNA分子(长度为19~25 bp),通过特异性调节靶基因表达,控制一系列包括细胞增殖、凋亡、分化等细胞活动过程。研究[14]发现七氟醚诱导的认知障碍新生小鼠海马区脑组织有较多miRNA的异常改变。miR-132定位于染色体17p13.3,是高度保守的miRNA之一,其在神经系统尤其是海马区中高表达,具有明显的组织特异性,参与神经元细胞的增殖、分化、迁移以及轴突生长。动物实验[15]证实在小鼠出生后7~21 d,其海马组织中miR-132表达水平逐渐升高,与神经突触的活跃期明显相关。研究认为,海马区脑组织miR-132表达水平是确保正常学习和记忆的重要因素,其表达缺失能够导致认知功能障碍。在对阻塞性睡眠呼吸暂停伴认知障碍和缺血性脑卒中后认知障碍的研究[15]中均发现miR-132表达异常。但至今miR-132对七氟醚诱导的新生小鼠神经认知障碍的影响及机制尚不清楚。本研究中,Morris水迷宫实验结果显示七氟醚组小鼠逃避潜伏期和游泳距离均明显增加,在原平台象限的停留时间和穿越原平台位置的次数均明显减少,提示七氟醚诱导造成新生小鼠的认知功能障碍。进一步qRT-PCR结果显示七氟醚组小鼠脑海马组织miR-132的表达水平明显降低,提示七氟醚诱导的新生小鼠神经认知功能障碍可能与其海马区脑组织miR-132表达异常降低有关。
七氟醚吸入诱导的新生小鼠认知功能障碍的作用机制复杂。目前研究认为其可能与七氟醚诱导造成的炎性因子过度释放、组织氧化应激从而造成神经元细胞凋亡有关。组织氧化应激水平升高,氧自由基增多可造成神经元细胞膜损伤,从而引起神经系统功能障碍。本研究发现,七氟醚吸入诱导的新生小鼠脑海马组织IL-1β、TNF-α和IL-6等炎性因子水平明显增高,氧化应激相关指标GSH-PX、SOD水平明显降低,MDA水平明显升高,凋亡促进因子Bax蛋白水平升高,凋亡抑制因子Bcl-2蛋白水平降低,提示七氟醚吸入诱导的新生小鼠脑海马组织炎性因子释放增多、氧化应激水平升高以及细胞凋亡增多。为了证实海马区脑组织miR-132表达水平对七氟醚吸入诱导的新生小鼠认知功能障碍的影响,本研究别给予小鼠侧脑室注射miR-132模拟物agomir-132,成功升高了七氟醚吸入诱导的新生小鼠脑海马组织中miR-132的表达水平,结果显示小鼠逃避潜伏期和游泳距离均明显减少,在原平台象限的停留时间和穿越原平台位置的次数均明显增多,提示agomir-132能够减轻七氟醚诱导造成新生小鼠的认知功能障碍。并且研究进一步发现,升高七氟醚诱导新生小鼠脑海马组织miR-132水平后,其IL-1β、TNF-α和IL-6等炎性因子水平明显降低,Bax蛋白表达水平降低,Bcl-2蛋白表达水平升高,脑海马组织MDA水 平 降 低,GSH-PX和SOD水 平 升 高,提 示agomir-132减轻七氟醚诱导造成新生小鼠的认知功能障碍的作用机制可能与其减轻炎性因子释放、氧化应激以及细胞凋亡有关。
HMGB1是目前发现的一种重要的促炎因子,胞外HMGB1能与细胞膜上Toll样受体特异性结合,导致IL-1β、TNF-α和IL-6等炎性因子大量释放,而这些炎性因子又能够激活单核巨噬细胞分泌HMGB1形成正反馈,从而诱发炎性细胞因子风暴,出现严重的炎性反应,加重氧化应激损伤,造成相关器官功能障碍。在动物实验中已经发现麻醉可引起认知功能障碍,并伴随HMGB1表达的增加,抑制HMGB1表达能够减轻麻醉后小鼠认知功能障碍。近期研究[16]发现,miR-132能够靶向调控HMGB1参加机体细胞生命活动。本研究发现七氟醚诱导新生小鼠脑海马组织HMGB1蛋白的表达明显升高,但miR-132能够明显降低七氟醚诱导新生小鼠脑海马组织HMGB1蛋白的表达水平,提示miR-132对七氟醚诱导新生小鼠认知功能障碍的影响可能与其对HMGB1蛋白的调控有关。
综述所述,miR-132在七氟醚诱导的认知功能障碍小鼠脑海马组织中升高。miR-132能够减轻七氟醚诱导的新生小鼠的认知功能障碍,其机制可能与miR-132抑制HMGB1基因的表达,从而抑制炎症反应、应激反应及神经元凋亡有关。
