柱前衍生化高效液相色谱法测定生物样本中短链脂肪酸及乳酸含量
2022-10-09王国盼黄伟健霍金洪颜毛毛吴少辉郝占西魏远安
王国盼,黄伟健,霍金洪,颜毛毛,吴少辉,郝占西,魏远安
(量子高科(广东)生物有限公司,广东 江门 529081)
肠道菌群与多种疾病的发生发展密切相关,包括慢性胃肠疾病、神经系统疾病及全身性疾病。在代谢综合症发生及发展过程中,肠道菌群组成发生特征性的改变,这可以通过益生元、膳食纤维等营养调节从而维持并改善肠道菌群的结构与功能,以促进健康、减少发病率。肠道菌群影响宿主生理的途径之一是由其代谢产物短链脂肪酸(short-chain fatty acids,SCFAs)介导的。SCFAs是指碳原子数为1~6的有机脂肪酸,主要包括乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸和己酸,其中乙酸、丙酸和丁酸的含量之和占肠道SCFAs总量的90%~95%。SCFAs在调节宿主健康方面起重要作用。SCFAs可作为肠道上皮细胞的能源物质,维护肠道形态及功能,并对结肠炎等肠道疾病具有一定的治疗作用;部分SCFAs从肠腔转移至远端器官(如肝脏),作为底物或信号分子调节脂肪积累与食欲,参与糖异生代谢,维持宿主葡萄糖稳态。越来越多的证据显示SCFAs与多种疾病的发生发展密切相关。
在肠道菌群以膳食纤维为来源合成乙酸、丙酸和丁酸的代谢途径中,乳酸是生成丙酸的底物之一,也可经糖酵解生成丙酮酸后,合成其他代谢产物。乳酸在有机体中参与生理功能的角色主要有3 个:能量来源、糖异生作用的前体、代谢信号分子。因此,对肠内容物及血清样本中乳酸和SCFAs同时进行定性和定量测定,可极大地增进我们对饮食、肠道菌群和宿主代谢稳态之间复杂相互作用关系的理解。
目前,生物样品中的SCFAs的定量方法包括气相色谱(gas chromatography,GC)法、气相色谱-质谱(GC-mass spectrometry,GC-MS)联用法、液相色谱(liquid chromatography,LC)法、液相色谱-质谱(LC-MS)联用等方法,其中GC及GC-MS是最常用的测定方法。然而,目前很少有研究同时关注肠道及血清中乳酸及SCFAs含量的变化。本研究使用GC、高效LC(high performance LC,HPLC)、柱前衍生化HPLC(pre-column derivatization HPLC,PCD-HPLC)检测小鼠粪便中SCFAs及乳酸含量并其进行对比,对建立的PCD-HPLC进行方法学验证;本研究旨在建立一种适用于生物肠内容物与血清样品的,且能同时、精准测定其SCFAs及乳酸含量的方法,为更好地开展益生元与膳食纤维等新型营养素调节肠道菌群进而影响机体代谢生理的关联研究奠定基础。
1 材料与方法
1.1 材料与试剂
实验小鼠为BALB/c雌性小鼠,SPF级,小鼠体质量18~22 g,购自广东省医学实验动物中心。
粪便、盲肠及血清样本来源于实验小鼠。
乙酸、丙酸、丁酸、异丁酸、戊酸、乳酸标准品(均为色谱级)、EDC·HCl、NPH·HCl 西格玛奥德里奇(上海)贸易有限公司;浓盐酸、乙醚、乙酸乙酯、氢氧化钠、氢氧化钾,浓硫酸(均为分析纯) 广州化学试剂厂;吡啶(分析纯) 阿拉丁试剂(上海)有限公司;甲醇(色谱纯) 美国Labscience公司。
1.2 仪器与设备
U3000 HPLC仪(紫外检测器) 赛默飞世尔科技(中国)有限公司;GC-2014C GC仪 日本岛津公司;数显恒温水浴锅 上海博讯实业有限公司医疗设备厂;TGL-16MS台式高速冷冻离心机 上海卢湘仪离心机仪器有限公司;通风橱 广州市半宙实验室设备有限公司;QIMO-DCY-24Y水浴氮吹仪 琪摩(上海)电子科技有限公司。
1.3 方法
1.3.1 GC分析粪便样品
称取约0.1 g粪便样品,加入0.2 mL质量分数50%的硫酸溶液酸化,再加入2 mL乙醚萃取20 min,12 000 r/min离心10 min后取上层有机相进样分析。
GC条件:DB-FFAP毛细柱(30 m×0.25mm,0.25 μm);进样口、氢火焰离子化检测器温度为240 ℃;载气为氮气,载气流速24 mL/min;柱流量2 mL/min;分流比10∶1;尾吹30 mL/min;氢气流速40 mL/min;空气流速400 mL/min;升温程序:100 ℃保持1 min,以5 ℃/min升温至150 ℃,随后150 ℃保持5 min;进样量2.0 μL。
1.3.2 HPLC分析粪便样品
称取约0.3 g粪便样品,加入1 mL去离子水后振荡混匀,12 000×离心10 min收集粪便上清液。加入100 μL 12.1 mol/L浓盐酸酸化,混匀后加入5 mL乙醚萃取20 min,3 500 r/min离心10 min后取上层有机相转移至另一管中。加入500 μL 1 mol/L NaOH溶液反萃取20 min,3 500 r/min离心10 min,收集下层水相。加入100 μL 12.1 mol/L浓盐酸再酸化,所得样品用0.22 μm滤膜过滤后进样分析。
HPLC色谱条件:YMC-Pack Pro C色谱柱(250 mm×4.6 mm,0.5 μm);柱温30 ℃;流动相:A为水,用质量分数为8.5%的磷酸溶液调节pH值至2.8;B为乙腈;A∶B=95∶5(/);采用等度洗脱;流速1.0 mL/min;检测波长210 nm;进样量20 μL。
1.3.3 PCD-HPLC分析粪便及血清样品
1.3.3.1 粪便样品前处理
称取不小于50 mg粪便样品,加入4~5 倍体积的水振荡混匀,12 000×离心10 min后收集上清液。
1.3.3.2 柱前衍生化
取100 μL粪便上清液或100 μL血清样品,按顺序加入200 μL 200 mmol/L NPH·HCl溶液,200 μL 120 mmol/L EDC·HCl溶液,200 μL 6%吡啶溶液(/)。混合均匀后于60 ℃恒温水浴锅中衍生化反应20 min,加入100 μL 15% KOH溶液(g/mL)-甲醇溶液(80∶20,/),混合均匀后于60 ℃恒温水浴锅20 min终止衍生化反应。
衍生化反应结束后,加入2 mL质量分数为42.5%磷酸溶液酸化,再加入4 mL乙醚萃取两次,每次10 min,收集上层有机相。合并两次萃取的有机相,水洗一遍后氮吹干燥。最终固体残留物用200 μL甲醇溶解,所得溶液用0.22 μm滤膜过滤后进样分析。
1.3.3.3 色谱条件
Hypersil GOLD HPLC C色谱柱(250 mm×4.6 mm,0.5 μm);柱温40 ℃;流动相:A为乙腈;B为超纯水,用质量分数为8.5%磷酸溶液调节pH值为2.8~3.0;采用梯度洗脱程序洗脱5 种SCFAs组分及乳酸(表1)。在230 nm波长处进行紫外检测,采用混合标准品溶液进行外标法定量。

表1 5 种SCFAs及乳酸衍生产物梯度洗脱条件Table 1 Gradient elution conditions for separation of five SCFAs and lactate derivatives
1.3.4 PCD-HPLC的方法学评价
1.3.4.1 线性关系分析
根据小鼠粪便及血清样品中乳酸及各SCFAs组分的浓度范围,配制含各组分的不同混合标准溶液母液。按照2 倍梯度稀释的方法分别得到7 个梯度标准溶液。各质量浓度的梯度标准溶液经过1.3.3.2节柱前衍生化和1.3.3.3节HPLC分析后,用目标化合物峰面积()与相对应的质量浓度()绘制标准曲线。继续稀释低浓度的标准溶液,直到目标化合物的峰面积比不再呈线性降低(标准曲线的相关系数()小于0.99),此时的质量浓度为线性范围的最小值。
1.3.4.2 准确度和精密度分析
通过计算在粪便上清液中目标化合物的加标回收率评价方法准确度。选用一个已测定SCFAs及乳酸含量的样品,加入其质量分数80%、100%的标准品,加标后样品按照1.3.3.2节处理和1.3.3.3节HPLC检测含量,重复6 次,计算回收率。
采用100%加标样品,考察日内、日间检测的变异系数(coefficient of variation,CV)以评价方法的精密度。同一日内不同时间检测5 次,计算日内CV,评价日内精密度;连续5 d对样品进行检测,计算日间CV,评价日间精密度。
1.3.5 小鼠实验
将BALB/c雌性小鼠随机分为5 组,每组10 只,体质量为(20±2) g。纤维素及各益生元均按30%添加量(/)预加入低纤饲料中。对照组小鼠摄食含纤维素的饲料,4 组实验组小鼠分别含摄食菊粉、低聚果糖(fructooligosaccharide ,FOS)、低聚半乳糖(galactooligosaccharide,GOS)、低聚甘露糖(mannooligosaccharides,MOS)的饲料。小鼠自由采食、饮水,每周计算其摄食量。连续喂养6 周后,收集两份每只小鼠的粪便样品,处死小鼠后收集两份盲肠内容物,这些样品用于检测肠道菌群、肠菌代谢产物SCFAs及乳酸;同时以断尾取血方式采集血液,静置后3 000 r/min离心10 min收集上清液,用于检测血清中SCFAs及乳酸含量。
1.3.6 PCD-HPLC测定粪便、盲肠内容物、血清中SCFAs及乳酸含量
按照1.3.3节处理对应样品并检测待测样品中SCFAs及乳酸含量。
1.4 数据处理
采用GraphPad Prism 6软件进行数据分析,采用检验比较组间差异。
2 结果与分析
2.1 3 种检测方法的比较

图1 GC(A)、HPLC(B)、PCD-HPLC(C)得到的标准品与粪便样品色谱图比较Fig. 1 Chromatograms of standards and fecal sample in GC (A) ,HPLC (B) and PCD-HPLC (C)
如图1所示,GC和PCD-HPLC能很好地分离样品中乙酸、丙酸、丁酸、戊酸。HPLC虽能较好分离标准样品中乙酸、丙酸、丁酸,但不能较好分离丁酸与异丁酸(图中未显示);且样品杂峰多、目标峰值响应度低。在粪便样品SCFAs含量的检测中,空白样品(水)经1.3.2节HPLC法检测后在乙酸出峰处仍有吸收峰(图中未显示),所以HPLC法检测乙酸含量误差大、准确度低。此外,GC法虽能快速分析几种SCFAs的含量,但不能同时测定乳酸含量。乳酸挥发性低,直接进样GC分析无目标峰出现,须经柱前衍生化生成乳酸甲酯后进行检测。由于羧基极性强,在GC柱中容易产生吸附作用会导致峰形拖尾,酸在柱上的保留会降低连续进样分析过程中填充柱的精确度和准确度。相反地,PCD-HPLC法同时可很好分离检测样品中乳酸、戊酸、异丁酸的含量。因此,PCD-HPLC法更适用于检测肠内容物及血清中乳酸及SCFAs含量,后续研究集中在PCD-HPLC的方法学评价及其应用。
2.2 PCD-HPLC的方法学评价
2.2.1 乳酸及SCFAs各组分的线性范围
如表2、图2所示,在SCFAs各组分及乳酸标准品浓度的线性范围内,标准曲线的高,均在0.999 4以上。

表2 5 种SCFAs及乳酸的线性范围和相关系数Table 2 Linear ranges of and correlation coefficients for five SCFAs and lactic acid

图2 乳酸、乙酸、丙酸标准品线性拟合曲线Fig. 2 Linear fitting curves for lactic acid, acetic acid and propionic acid
2.2.2 准确度与精密度评价
由表3可知,采用PCD-HPLC测定粪便样品中5 种SCFAs及乳酸含量,各组分的加标回收率均在80%~120%范围内,方法准确度较高。在该方法下,SCFAs各组分及乳酸含量测定的日内CV不高于5.21%,日间CV不高于8.87%,表明该方法重复性及重复性良好。

表3 乳酸及SCFAs检测稳定性及回收率Table 3 Stability and recoveries of PCD-HPLC for determination of lactatic and SCFAs%
2.3 PCD-HPLC测定饲养小鼠的粪便、盲肠内容物、血清中SCFAs各组分及乳酸含量分析
2.3.1 SCFAs各组分及乳酸在小鼠不同部位的含量变化
如图3所示,在粪便及盲肠内容物SCFAs中,乙酸含量最高,约占总SCFAs的70%~85.5%;其次是丁酸和丙酸;这3 种SCFAs含量占总SCFAs比例超过90%,与众多研究结果一致。粪便和盲肠内容物中乳酸的含量约为10 μmol/g。对比粪便和盲肠内容物(分别对应于远端结肠和近端结肠)发现,盲肠内容物中的乙酸、丙酸、丁酸含量均比粪便中含量高,结果与Cummings和Hernández等的报道一致。此外,观察到小鼠血清样品中乳酸含量最高,SCFAs中乙酸含量最高,其余SCFAs组分含量较少。值得注意的是,血清中丁酸含量极低。
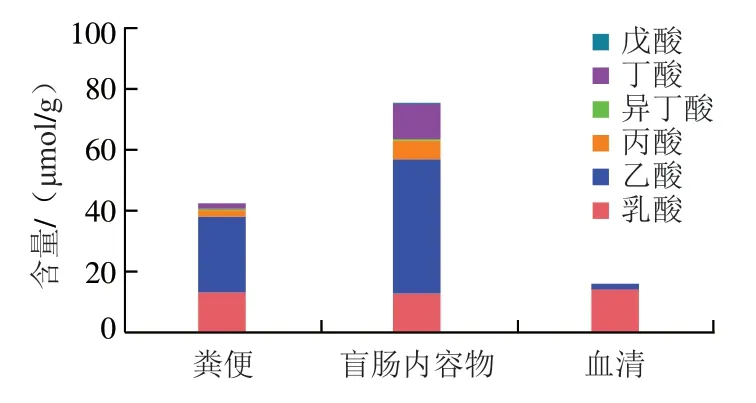
图3 饲养小鼠的粪便、盲肠内容物、血清中5 种SCFAs及乳酸含量比较Fig. 3 Comparison of contents of five SCFAs and lactic acid in feces,cecum contents and serum of mice
2.3.2 小鼠肠道中乳酸与丙酸的含量变化

图4 饲养小鼠粪便(A)、盲肠内容物(B)中乳酸与丙酸的含量变化Fig. 4 Changes in lactic acid and propionic acid contents in feces (A) and cecum contents (B) of mice
由图4可知,在粪便、盲肠内容物中,乳酸含量与丙酸含量变化趋势相反,乳酸含量相对较高的益生元组的丙酸含量相对较低。然而有趣的是,在血清中乳酸含量相对于SCFAs含量更高(图3),未见乳酸与丙酸之间的含量变化相反趋势。此外,图4也显示不同益生元对肠道代谢产物的影响存在差异,FOS、GOS对乳酸及丙酸含量的影响相似,两组小鼠肠道中的乳酸、丙酸含量没有显著差异(>0.05)。与FOS和GOS组相比,MOS和菊粉明显增加了小鼠肠道(粪便、盲肠内容物)中乳酸含量,降低了丙酸含量;其中MOS组的差异更大,小鼠摄入MOS后,肠道(粪便、盲肠内容物)中丙酸含量极显著低于其他3 个实验组(<0.01)。
3 讨论与结论
肠道菌群利用膳食纤维合成SCFAs分为多种途径(图5)。然而当肠道中可发酵膳食纤维供应不足时,菌群转向利用其他能源物质,如膳食来源氨基酸、内源蛋白质或膳食脂肪,进而代谢生成支链脂肪酸如异丁酸、2-甲基丁酸、异戊酸。乳酸在肠道中的合成代谢途径研究较少,更多关注在血液中的代谢。图5显示,乳酸是肠道菌群利用膳食纤维或益生元合成SCFAs的重要中间代谢产物,可以作为底物经丙烯酸盐途径直接生成丙酸,这可能是本研究发现肠道中乳酸与丙酸含量变化趋势相反的原因之一,机体随着肠道环境的变化或功能需求产生不同含量的乳酸及丙酸。目前的结果未发现肠道中乳酸与其他SCFAs含量之间存在显著关联。此外,本研究未发现血清中乳酸含量与丙酸或其他SCFAs之间存在相互联系;血清中乳酸含量最高,分析可能乳酸的代谢途径在血液中与肠道中存在差异,在血液中乳酸的来源主要为葡萄糖和丙氨酸,通过乳酸脱氢酶催化氧化还原反应生成或消除乳酸。

图5 肠道菌群以膳食纤维为来源合成乙酸、丙酸、丁酸的途径Fig. 5 The synthesis pathway of acetic acid, propionic acid and butyric acid by intestinal bacteria from dietary fiber
婴儿在出生0~6 个月期间,食物来源主要是母乳。母乳中第3大营养物质——母乳低聚糖,为婴儿肠道菌群提供生长所需的营养。肠菌代谢产生的SCFAs及乳酸使肠道环境酸化,进一步产生对婴儿生长发育有益的功能。在本课题组的另一项探究母乳低聚糖与婴幼儿肠道菌群之间联系的研究中发现,在0~6 个月龄的婴幼儿肠道中,乳酸及乙酸的含量最高,肠菌组成多为双歧杆菌及乳酸杆菌。结果显示了肠道产生乳酸对机体健康的有益影响,可能是作为能源物质为机体细胞提供能量,也可能是与SCFAs类似,作为信号分子参与一系列代谢反应。
此外,小鼠摄入同样剂量不同益生元或不同剂量同一益生元后,肠道中乳酸与SCFAs含量变化程度不同。例如:图4B显示,摄入MOS后,盲肠内容物中乳酸含量在所有益生元组中最高,对应丙酸含量最低;图4显示,摄入FOS与GOS的两组小鼠肠道中的乳酸、丙酸含量没有显著差异(>0.05)。此结果表明不同结构、不同链长的益生元对肠道菌群组成及其代谢产物的影响存在差异。肠腔中丁酸浓度在盲肠中最大,由于被肠黏膜吸收,可发酵底物的减少,使越到远端肠道丁酸浓度越低。丁酸作为结肠上皮细胞的能量来源,且结肠上皮细胞代谢丁酸速率快,因此在门静脉及外周血中丁酸含量极低,门静脉丁酸浓度比结肠肠腔中浓度低1 000 倍,外周循环血中丁酸浓度为几μmol/mL。这些研究结果与本实验结果相似。肠道炎症性疾病更大概率发生在远端结肠,原因可能是远端结肠可发酵碳水化合物含量少,产生的SCFAs含量少,不能很好地保护肠道上皮。
综上,在研究微生态营养干预对机体健康调节作用时,除了监测肠道菌群组成变化外,建立准确、有效的方法同时检测肠道及外周血中乳酸及SCFAs含量很有必要。在同一个样本中同时快速、准确地分析乳酸及SCFAs含量变化,可作为观察肠道菌群组成与机体健康生理变化之间联系的纽带和有效指标,用于评估肠道炎症性疾病发展的可能,此外也可指导饮食精准营养干预方案,例如,增加摄入不易被消化的可发酵碳水化物提高远端结肠SCFAs含量,尤其是丁酸。
本研究使用GC、HPLC、PCD-HPLC这3 种方法检测粪便中乳酸及SCFAs含量并对其进行对比。结果显示:GC可快速分析具有挥发特性的SCFAs含量,但不能同时分析无挥发特性的乳酸;由于脂肪酸分子结构中缺乏具有紫外吸收的荧光的基团,HPLC检测的准确度低;PCD-HPLC填补了前两种检测方法的不足,可同时精确测定粪便中乳酸及5 种SCFAs含量,且此方法同样适用于盲肠内容物及血清样本的检测。目前已报道的SCFAs测定方法中,称取粪便质量均不小于100 mg,然而在实际小鼠实验中,收集不小于100 mg的粪便用于测定乳酸及SCFAs较困难(两粒小鼠粪便质量约为60 mg)。本研究建立的PCD-HPLC所需样本量小,其中肠内容物样品不小于50 mg,血清样品量不小于100 μL。因此,为更好地开展益生元与膳食纤维等新型营养素调节肠道菌群进而影响机体代谢生理的关联研究,PCD-HPLC测定方法是一个很好的选择,具有适用范围广、重复性良好、准确度高等特点。
