纳米鱼骨在肌球蛋白胶凝过程中钙赋存形态的变化及分布
2022-10-09张梦玲熊善柏
高 霞,张梦玲,熊善柏,胡 杨,尹 涛,刘 茹
(华中农业大学食品科学技术学院,国家大宗淡水鱼加工技术研发分中心(武汉),长江经济带大宗水生生物产业绿色发展教育部工程研究中心,湖北 武汉 430070)
肌球蛋白是鱼糜胶凝过程中最重要的功能性蛋白,对形成具有良好质地的鱼糜制品至关重要。鱼糜热诱导胶凝过程中,在较低温度(5~40 ℃)下的凝胶化行为与内源性转谷氨酰胺酶(fish endogenous transglutaminase,FTGase)密切相关,FTGase通过催化蛋白质分子间或分子内的谷氨酸与赖氨酸残基之间发生交联反应,生成ε-(γ-Glu)-Lys异肽键,促进蛋白质分子聚集形成三维网络结构。研究表明,FTGase具有Ca依赖性,生产过程中常需要添加钙盐以提高其催化活性进而改善鱼糜的凝胶性能。近年来,有学者比较研究了氯化钙、碳酸钙、乳酸钙等化合钙对鱼糜凝胶性能的影响,发现溶解性越好的化合钙对鱼糜凝胶性能的提升作用越大。但是,化合钙添加量过多会产生苦味,对鱼糜制品的风味产生不良影响。
鱼骨是鱼糜加工过程中产生的主要固体副产物,约占整条鱼的10%~15%。鱼骨中富含钙、磷等元素,且钙磷比利于人体吸收,具有较高的生物利用度,是天然的优质钙源。目前,工业生产中大都将鱼骨加工成饲料或直接当作下脚料丢弃,利用率极低,易造成资源浪费甚至引发环境污染问题,将其开发为新型钙源,对副产物的高效利用具有重要意义。鱼骨中的钙大都以羟基磷灰石的形式存在,溶解度较低。前期实验室研究发现,鱼骨中钙的生物利用度随着鱼骨尺寸的减小而升高,纳米鱼骨(nano fish bone,NFB)中钙的溶解性较微米鱼骨显著提高。相较于CaCl,NFB中仅有少部分钙以游离态存在,其对FTGase的激活作用弱于CaCl,但是NFB对鱼糜凝胶的提升作用强于CaCl,这可能与NFB中钙的不同赋存形态有关。然而,关于NFB在肌球蛋白胶凝过程中钙的赋存形态如何转化鲜有报道。
本实验以鲢鱼骨为原料制备NFB,将其加入肌球蛋白中,研究肌球蛋白胶凝过程中钙赋存形态和表面元素的变化,进一步采用激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)观察肌球蛋白凝胶的微观形貌,结合低场核磁分析肌球蛋白样品水分分布状况,探讨NFB在肌球蛋白胶凝过程中钙的赋存形态变化与分布,为探讨NFB提升鱼糜凝胶性能的作用机理提供数据支撑。
1 材料与方法
1.1 材料与试剂
鲢(Hyophthalmichthys molitrix),每尾质量约1.5 kg,购自华中农业大学菜市场。将鲜活鲢鱼置于盛满水的塑料袋中迅速运往实验室,去头、去内脏后分别取背脊部肉和鱼骨用于提取肌球蛋白和制备NFB,其他样品置于4 ℃冰箱存放。
茜素红染液(分析纯) 武汉谷歌生物技术有限公司;考马斯亮蓝R-250(分析纯) 美国Amresco公司;氯化镧及其余试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
AA-6300c原子吸收分光光度计 日本Shimadzu公司;Nikon Eclipase CI光学显微镜 日本尼康公司;X-Max 50能量光谱仪 英国Oxford公司;Minispec核磁共振分析仪 德国Bruker公司。
1.3 方法
1.3.1 肌球蛋白的提取
参考高霞等的方法提取肌球蛋白,纯化的肌球蛋白用含有NaCl的Tris-HCl(pH 7.5)缓冲液溶解,使其盐离子浓度为0.5 mol/L。采用Lowry法测定肌球蛋白质量浓度。
1.3.2 NFB的制备
参考Yin Tao等的方法,并稍作修改。将鱼脊骨切成长约3~5 mm的小段,加水漂洗除去血污和部分脂肪。然后,加入3 倍体积水将鱼骨浸没,在120 ℃(反压蒸煮)下蒸煮1 h,去掉水煮液以脱除油脂,加清水漂洗数次沥干。沥干的鱼骨用筛板孔径为3 mm的绞肉机进行粗破碎,之后加入1 倍体积冰水,用骨泥机细磨进行微粒化处理,条件为:磨盘转速3 000 r/min,磨盘间隙0.3 mm,研磨次数2 次。进一步将得到的鱼骨加去离子水制备成5%的骨液,并用湿法高能球磨机进行球磨。球磨条件为磨盘转速3 000 r/min,磨球填充率85%,磨球直径0.5 mm,球磨时间6 h,得到的样品即为NFB(粒径~280 nm)。样品中的总钙含量参考GB 5009.92—2016《食品中钙的测定》方法测定。
1.3.3 不同加热方式肌球蛋白样品的制备
研究NFB对肌球蛋白胶凝过程中原子吸收光谱的影响时,用0.5 mol/L NaCl-20 mmol/L Tris-HCl缓冲液(pH 7.5)将肌球蛋白质量浓度调整为1.0 mg/mL,将NFB加入肌球蛋白中至总钙浓度为40 mmol/L,同时控制整体的盐离子浓度为0.5 mol/L。制备好的肌球蛋白样品立即进行加热处理,加热条件分别为:不加热、一段式加热(在40 ℃加热60 min,记为S)、二段式加热(先在40 ℃加热60 min,再迅速转移至90 ℃加热30 min,记为S+K)。结束后,将肌球蛋白样品用流动水冷却至室温,转移至4 ℃冰箱保存待用,30 min内立即进行相关指标的测量。
1.3.4 钙赋存形态测定
参考邢尚军等的方法测定。取肌球蛋白凝胶样品5 g,加入8 倍体积去离子水,均质,37 ℃恒温水浴振荡60 min,8 000 r/min离心10 min,保留沉淀,倾出上清液,将其定容至100 mL,用原子吸收法测定提取液中的钙含量(A)。取30 mL 0.5 mol/L NaCl溶液加入上一步骤保留的沉淀中,均质,37 ℃恒温水浴振荡60 min,8 000 r/min离心10 min,保留上清液并将其定容至100 mL,用原子吸收法测定提取液中的钙含量(B)。样品中总钙含量(C)的测定参考GB 5009.92—2016《食品中钙的测定》。离子钙的含量=A-B;螯合钙的含量=B;不溶性钙的含量=C-A。
1.3.5 表面元素测定
参考Grehn等的方法,使用能量光谱仪测定肌球蛋白凝胶的表面元素。样品的处理步骤同扫描电镜样品。将干燥后的肌球蛋白凝胶粘于样品台,设置加速电压为15 kV进行面扫描,获得样品表面元素组成及钙离子分布图像。
1.3.6 光学显微镜分析
将肌球蛋白凝胶进行冷冻切片处理,使用考马斯亮蓝R-250染色5 min,结束后用蒸馏水冲洗除去多余的染液,晾干。再用茜素红染液进行复染5 min,结束后用蒸馏水冲洗,并于烘箱中烘干。将切片置于二甲苯溶液中浸泡5 min,取出晾干,并用中性树脂封片。采用Nikon Eclipse CI光学显微镜观察肌球蛋白凝胶微观结构,放大倍数为200 倍。
1.3.7 激光共聚焦显微镜分析
参考高霞等的方法,采用激光共聚焦显微镜观察NFB添加前后肌球蛋白凝胶的微观结构,并稍作修改。将肌球蛋白凝胶进行冷冻切片处理,使用罗丹明B染料(浓度为10mol/L)对蛋白质进行标记,待测。
1.3.8 水分分布测定
参考Zhang Huimin等的方法测定肌球蛋白凝胶的低场核磁自旋-自旋弛豫时间。取5 g样品用核磁膜包裹后放入10 mm核磁管中,随后放入分析仪中。自旋-自旋弛豫时间T用Carr-Purcell-Mebiboom-Gill(CPMG)序列进行测量,参数设置为:扫描次数8 次,扫描迭代6 500 ms,回声1 200,τ值(90°脉冲和180°脉冲之间的时间)为10 ms。用仪器自带软件分析T弛豫时间。
1.4 数据处理
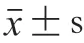
2 结果与分析
2.1 NFB-Ca在肌球蛋白胶凝过程中赋存形态的变化
NFB中,钙主要存在于羟基磷灰石与胶原交错互穿的结构中,大部分以不溶性钙形态存在。如表1所示,将NFB加入肌球蛋白后,样品中离子钙的含量在未加热条件下仅占1.65%,40 ℃加热处理显著提高离子钙含量(P<0.05),随后于90 ℃加热又使部分离子钙转变成为另外2 种形态的钙。螯合钙含量变化与离子钙呈现相反的趋势。此外,前期实验室研究发现,NFB中可溶性钙的含量约为8.88%~14.02%,本实验中添加NFB的肌球蛋白凝胶中可溶性钙(离子钙+螯合钙)质量分数低于8.88%,不溶性钙质量分数较高,推测NFB中部分可溶性钙以盐桥方式参与凝胶形成转变为不溶性钙。Jiang Yang等已证实加热会显著提高NFB中可溶性钙的含量。然而,本研究表明与未加热条件相比,一段式加热和二段式加热处理显著提高了添加NFB的肌球蛋白凝胶中不溶性钙的含量(P<0.05)。该结果说明,肌球蛋白胶凝过程中,NFB释放出的可溶性钙部分转变成不可溶性钙。前期研究发现,热胶凝过程中,肌球蛋白分子二级结构变得伸展,并暴露出带电基团(COO),Ca与带电基团(COO)之间形成盐桥,推测该钙桥的形成使Ca被包埋在肌球蛋白凝胶网络中,致使不溶性钙含量增多。

表1 NFB-Ca在肌球蛋白胶凝过程中赋存形态的变化Table 1 Changes in occurrence form of NFB-Ca during myosin gelation
2.2 NFB对肌球蛋白表面元素的影响
如表2所示,未加热条件下,NFB中矿物元素含量最多的是Ca(8.29±0.10)keV和P(5.25±0.25)keV,Na和Mg的含量相对较低。鱼骨的无机相主要由磷酸氢钙(CaHPO)和羟基磷灰石(Ca(PO)(OH))构成,这解释了NFB中Ca、P含量较高的原因。一段式加热和二段式加热处理显著提高了NFB表面Ca、P含量(P<0.05),推测这是由于加热处理破坏了NFB的晶体结构,促进了Ca、P向表面迁移。加热过程中,NFB中的Ca/P无显著变化(P>0.05)。
加热前,相较于肌球蛋白组,添加NFB的肌球蛋白样品组中Ca含量显著升高(P<0.05)。40 ℃加热后,添加NFB的肌球蛋白表面钙元素较未加热条件下增长了约51%,随后于90 ℃加热其表面钙元素进一步增多,与未加热相比提高了约85%。然而,加热过程中未添加NFB的肌球蛋白样品表面钙元素无显著变化(P>0.05)。该结果说明肌球蛋白胶凝过程中表面钙元素的增加主要来源于NFB的添加,且进一步反映加热可促进NFB中Ca的释放。
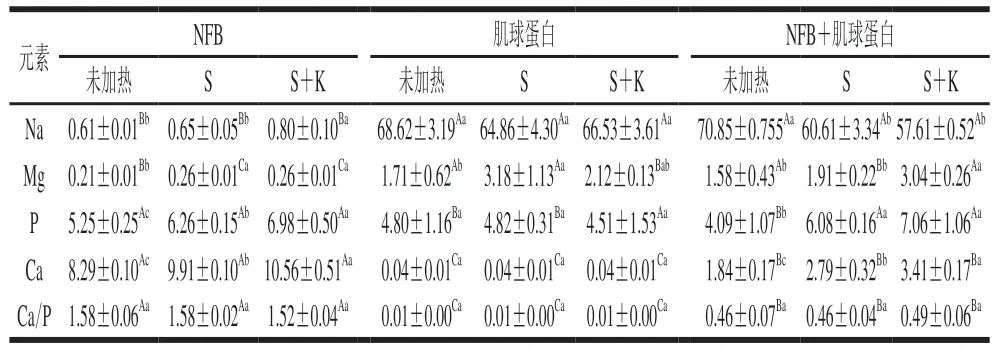
表2 NFB的添加对肌球蛋白表面元素的影响Table 2 Effect of NFB on surface elements of myosin keV
能谱结合电镜分析是一种监测样品中元素分布的有效手段。如图1所示,绿色圆点表示分布在肌球蛋白表面的钙元素。所有样品中均存在钙元素。未加热时,钙元素较少且分布不均匀,一段式加热和二段式加热处理后,肌球蛋白表面钙元素逐渐增多,分布的均匀性也有所提升,在加热过程中,NFB晶体结构被破坏,释放出部分钙,胶凝时肌球蛋白与钙形成盐桥,形成了较为均一的凝胶结构,使表面钙元素分布得更加均匀。
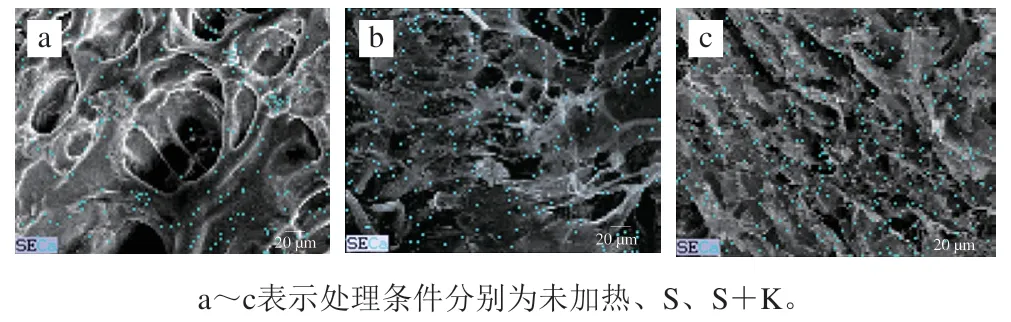
图1 添加NFB的肌球蛋白在胶凝过程中表面钙元素的分布状况Fig. 1 Calcium distribution on the surface of myosin with the addition of NFB during gelation
2.3 光学显微镜分析
茜素红可将钙盐染成玫红色,而考马斯亮蓝可将蛋白质染成亮蓝色,茜素红与考马斯亮蓝双染能够较好地表征热胶凝时肌球蛋白样品中钙盐的分布与凝胶的结构变化。如图2所示,空白组中(未加NFB),样品均被染成亮蓝色,未观察到玫红色,说明空白组中Ca含量较少;NFB加入后,样品中均观察到玫红色,表明样品中Ca含量明显增多,这与表面元素的结果(表2)一致。
未加热条件下,空白组与NFB组中肌球蛋白均以粗丝形式存在。40 ℃加热处理后,肌球蛋白样品形成凝胶网络结构,但是孔隙较大。相较于空白组,NFB组中的网络结构更为连续,二段式加热处理后,NFB组形成了更为致密的三维凝胶网络结构。Jia Dan等研究发现,Ca会诱导肌球蛋白的双螺旋结构变得伸展,在凝胶化及鱼糕化过程中伸展的肌球蛋白进一步通过疏水相互作用和二硫键发生聚集,形成致密的网络结构。
图2 经染色后的肌球蛋白样品的光学显微镜图Fig. 2 Optical microscopic images of stained myosin samples
2.4 CLSM结果
如图3所示,未加热条件下,相较于空白组,NFB组中肌球蛋白粗丝排列更为有序,粗丝间隙变小。本研究中蛋白体系pH值为7.5,高于pI 5.5,此时,肌球蛋白带净负电荷,根据Arfat等报道,推测NFB释放的Ca与肌球蛋白所带负电荷形成盐桥,促进了肌球蛋白粗丝之间发生交联,使粗丝间隙减小。一段式加热和二段式加热处理后,相较于空白组,NFB组凝胶网络结构更为均匀,粗糙程度有所改善。加热过程中,Ca诱导肌球蛋白构象改变,同时暴露疏水性氨基酸残基、巯基等功能性基团,这有利于蛋白质之间通过疏水相互作用、二硫键形成聚集体,进而形成均匀的网络结构。
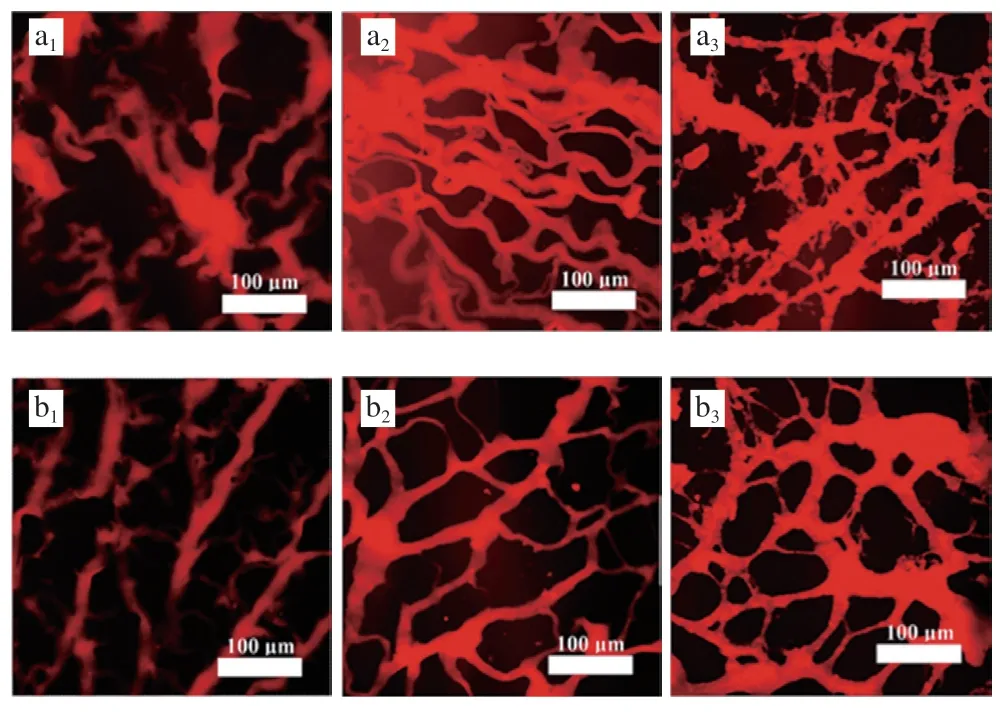
图3 NFB加入后肌球蛋白在不同加热方式下的激光共聚焦图像Fig. 3 CLSM images of myosin with the addition of NFB during gelation
2.5 NFB对肌球蛋白水分分布的影响
低场核磁技术是一种安全、非破坏性的检测手段,被广泛地用来监测食品中水分的分布与流动性。如图4所示,肌球蛋白胶凝过程中存在2 个水分分布峰,分别位于65.79~403.7 ms和464.16~1 873.82 ms附近。根据相关文献报道,这2 个峰分别对应不易流动水(T)和自由水(T)。表3为胶凝过程中肌球蛋白T弛豫时间的变化。空白组中,随着加热的进行,T向低弛豫时间移动,表明水分子的流动性降低,推测这是由于加热过程中形成的凝胶网络结构(图3)将水分子束缚其中。与空白组相比,加入NFB显著降低了T弛豫时间(P<0.05),表明自由水的流动性降低。根据Ahmad等报道,推测NFB释放的Ca与热处理使蛋白质构象发生变化,暴露出水分子结合位点,这有利于提高蛋白质的水合作用,降低自由水流动性;此外,加入NFB后形成更致密的微观结构(图2、3)也有利于增强对水分子的束缚能力,降低水分子流动性。
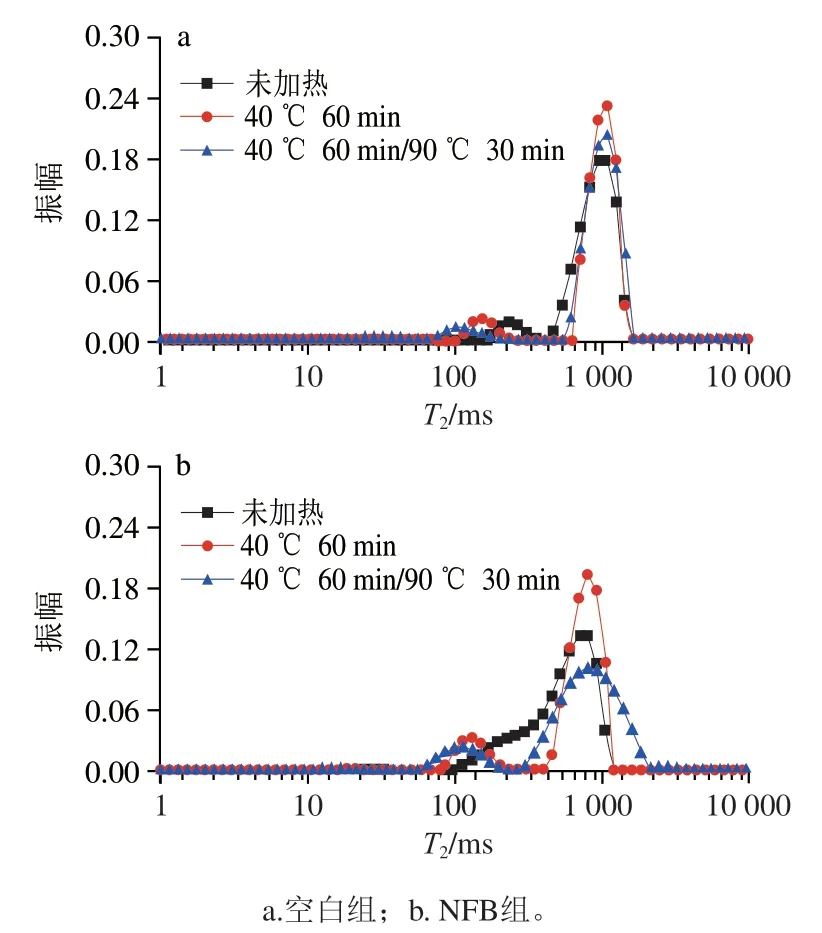
图4 NFB对肌球蛋白加热过程中水分分布的影响Fig. 4 Effect of NFB on LF-NMR spetrum of myosin under different heating conditions

表3 NFB对肌球蛋白T2弛豫时间的影响Table 3 Effect of NFB on T2 relaxation time of myosin
3 结 论
NFB中含有较多的Ca、P元素,加入肌球蛋白后,NFB-Ca仍以不溶性钙形态为主(>95%),加热处理促进了Ca元素向表面迁移。随着加热的进行,样品中部分可溶性钙以盐桥方式参与形成肌球蛋白凝胶,促进形成较为致密的凝胶结构,有利于增强对水分子的束缚,降低自由水的流动性,同时提高了表面Ca元素的分布均匀性。综上,肌球蛋白胶凝过程中NFB-Ca赋存形态发生改变,部分离子钙通过参与形成盐桥的形式转变为不溶性钙,促进肌球蛋白形成均匀致密的凝胶网络结构,增强了对水分子的束缚能力。
