人参-山茱萸化学成分分析及其对环磷酰胺所致小鼠骨髓抑制的影响
2022-10-02宋佳琪付正丰蔡恩博杨利民韩佳宏
宋佳琪,付正丰,陈 浩,蔡恩博*,杨利民,韩佳宏
(1.吉林农业大学中药材学院,吉林 长春 130118;2.重庆三峡医药高等专科学校,重庆 404020)
癌症是当今社会严重威胁人类身体健康和生命安全的疾病,2020年全球癌症数据显示:我国新发癌症病例457万例,占全球24%;死亡病例300万例,占全球30%[1]。化疗是目前临床治疗癌症的主要方法之一,但化疗在消灭癌细胞的同时对机体正常细胞也产生了极大的损坏。骨髓抑制是化疗中最为常见的毒副作用,因为在抑制或杀死肿瘤细胞的同时化疗药物也会对骨髓中的造血干细胞造成伤害,减弱造血干细胞的分化能力及其造血干性[2],从而导致血细胞降低,患者被迫减少药量甚至中止化疗,最终影响化疗效果[3]。因此,对众多恶性肿瘤患者来说,改善化疗所致的骨髓抑制至关重要,亟待解决。
中医药学历史悠久,在中华民族的繁衍昌盛中做出过巨大贡献,历代医家编纂的经典古籍和从临床实践中归纳总结的诊治方略更是无价之宝,对现今很多疑难杂症的治疗都具有指导意义。有大量研究表明,中药对化疗所引起的骨髓抑制具有显著的疗效,如杞萸六君汤[4]、生血汤[5]、加味六味地黄丸[6-7]等,而方中无不以人参-山茱萸组方。
经吉林省中医药科学院第一临床医院副主任医师孙恒宇根据人参与山茱萸的传统功效及临床治疗经验,给出如下方解:人参补气固本,得山茱萸更增收涩固脱之力,山茱萸虽味酸以固脱见长,但无人参滋补元气则不能久固。两者相须配伍,一补一固,则补益之力强而持久,补身体之正,抗化疗药物之偏,具有阴阳气血双补之效。结合实验室前期工作基础,选择人参-山茱萸(1∶1)为研究对象,以环磷酰胺诱导的小鼠骨髓抑制为模型,贞芪扶正颗粒[8-9]为阳性药,对人参-山茱萸改善骨髓抑制作用及其机制进行初步研究,并对人参-山茱萸配伍后人参中12种人参单体皂苷以及山茱萸中的莫诺苷、马钱苷进行定量分析。为人参-山茱萸开发创新药物提供理论基础,同时为含有人参-山茱萸复方的进一步研究提供理论参考。
1 材料与方法
1.1 试验药材及动物
人参药材购于吉林省长白县,经吉林农业大学中药材学院杨利民教授鉴定为5年生五加科(Araliaceae)人参属(Panax)植物人参(Panax ginsengC.A.Mey.)的干燥根及根茎。山茱萸药材(批号01421004,产地河南),来自河北仁心药业有限公司,经吉林农业大学中药材学院杨利民教授鉴定为山茱萸科(Cornaceae)山茱萸属(Cornus)植物山茱萸(Cornus officinalisSieb.et Zucc.)的干燥成熟果实。
SPF级雄性昆明小鼠(批号:210726210100485436,鼠龄6~8周),体重18~22 g,由辽宁长生生物技术股份有限公司提供,合格证号:NO.SCXK(辽)2020-0001。
1.2 材料与试剂
对照品:人参单体皂苷Rg1、Re、Rf、Rb1、Rc、Rb2、Rb3、Rd、Rk3、F2、20(S)-Rg3、20(R)-Rg3(吉林大学化学学院),纯度>98%。莫诺苷(批号:Z12O8B45504)、马钱苷(批号:P30M9F57637)购自上海源叶生物科技有限公司,纯度≥98%。色谱甲醇、色谱乙腈(美国飞世尔科学世界公司)。环磷酰胺(德国百特公司)。贞芪扶正颗粒(批号:210111,柳河长隆制药有限公司)。重组小鼠血小板生成素(批号:0331969-3481)、重组人红细胞生成素(批号:0331571)、重组小鼠白介素3(批号:0331505)购自近岸蛋白质科技有限公司,重组小鼠粒细胞巨噬细胞集落刺激因子(批号:0111103,美国派普泰克公司)。细胞周期与细胞凋亡检测试剂盒(批号:011821210512,上海碧云天生物技术有限公司)。小鼠粒细胞巨噬细胞集落刺激因子(Granulocyte macrophage colony stimulating factor,GM-CSF)酶联免疫吸附测定(Enzyme-linked immunosorbent assay,ELISA)试剂盒(批号:202105)、小鼠血小板生成素(Thrombopoietin,TPO)ELISA试剂盒(批 号:202105)、小鼠红细胞生成素(Erythropoietin,EPO)ELISA试剂盒(批号:202105)购自江苏酶免实业有限公司。
1.3 主要仪器
BSA224S分析天平[赛多利斯科学仪器(北京)有限公司]。安捷伦1200高效液相色谱仪(美国安捷伦科技公司)。PE-6800VET全自动动物血细胞分析仪(深圳市普康电子有限公司)。二氧化碳培养箱(武汉提沃克科技有限公司)。SpectraMax190型酶标仪(美国美谷分子公司)。
1.4 人参-山茱萸提取物的制备
人参、山茱萸药材按1∶1称取重量,10倍量水浸泡1 h,回流提取2 h,过滤,滤渣加8倍量水再次回流提取2 h,合并两次滤液,浓缩,冷冻干燥,研磨捣碎,于4℃冰箱保存备用。
1.5 动物分组及给药
60只小鼠适应性培养7天,随机分为6组(n=10):空白组、模型组、阳性药组、人参-山茱萸(1∶1)低、中、高剂量组。给药剂量以人体临床剂量为依据,成人标准体重按60 kg计,小鼠体重按25 g计,按“体表面积比”换算动物试验剂量作为临床等效剂量,阳性药组给予贞芪扶正颗粒4.5 g/kg(折合成生药量)。经过大量的临床数据分析,认为以人参10 g、山茱萸10 g的剂量治疗效果为最佳,人参-山茱萸(1∶1)低、中、高剂量组分别给予1.5、3.0、6.0 g/kg(折合成生药量),按原生药材计分别为0.5倍临床等效剂量、1倍临床等效剂量、2倍临床等效剂量。除空白组外,各组小鼠每天腹腔注射环磷酰胺(80 mg/kg)1次,连续3天,空白组腹腔注射生理盐水。第4天开始,空白组和模型组灌胃水,其余组灌胃贞芪扶正颗粒及人参-山茱萸(1∶1)低、中、高,每天1次,连续12天。
1.6 外周血象、集落刺激因子及骨髓有核细胞数的测定
给药完成后,禁食不禁水12 h,采集各组小鼠全血,一部分使用抗凝管收集,对白细胞、血小板进行检测;另一部分离心收集血清,利用ELISA试剂盒对小鼠血清中的粒细胞巨噬细胞集落刺激因子(Granulocyte macrophage colony stimulating factor,GM-CSF)、血小板生成素(Thrombopoietin,TPO)、红细胞生成素(Erythropoietin,EPO)含量进行测定。
取血后处死小鼠,取两侧股骨,剪去两端,反复冲洗骨髓腔中的骨髓细胞,移液枪反复吹打,制得小鼠骨髓单细胞悬液,离心,吸弃上清加0.5 mL红细胞裂解液重悬细胞,静置,离心,吸弃上清后反复清洗2次,重悬细胞,稀释,对骨髓有核细胞进行计数。
1.7 造血祖细胞集落的测定
将骨髓单细胞悬液收集在离心管中,按表1于6孔板中对造血祖细胞集落进行培养。红系集落培养3天,于第4天计数。粒-单核系集落、巨核系集落、红系爆式集落培养7天,于第8天计数。
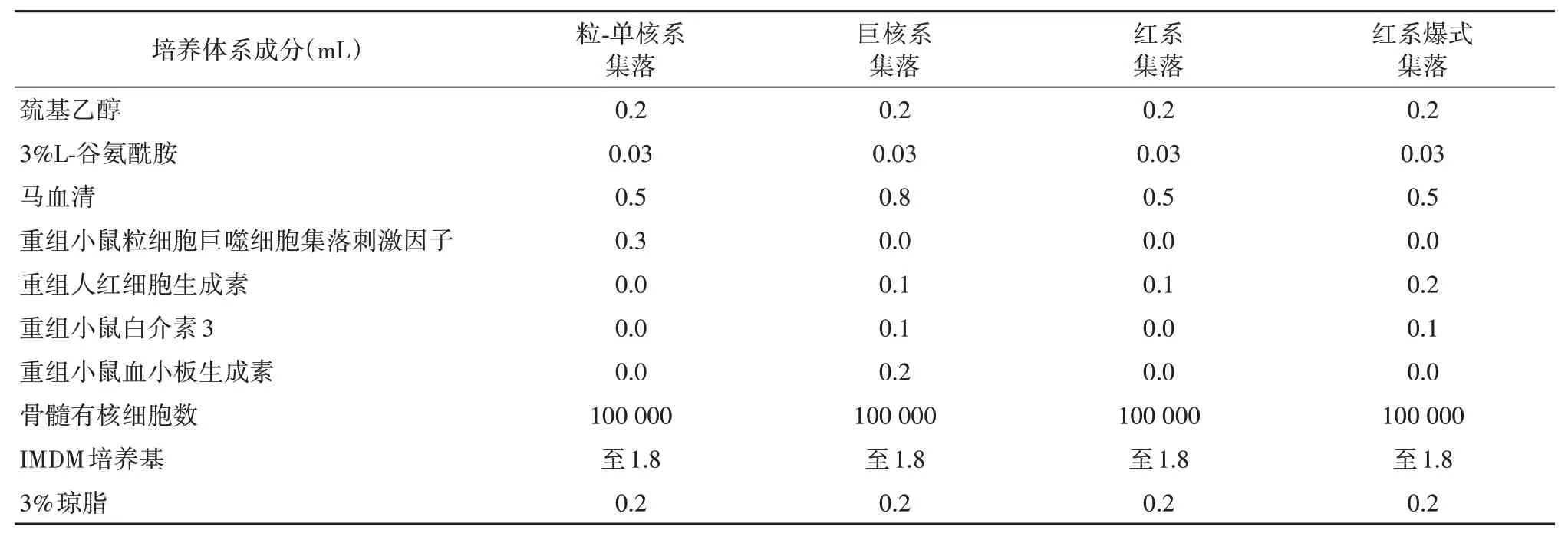
表1 造血祖细胞培养体系成分组成表Tab.1 Composition of hematopoietic progenitor cell culture system
1.8 骨髓有核细胞周期及凋亡的测定
将骨髓单细胞悬液收集在离心管中,离心,洗涤两次,然后在4℃下用70%的冷乙醇固定过夜。洗涤两次,加入10μL碘化丙啶染料溶液,4℃冰箱保存30 min,立即用流式细胞仪测定细胞周期。
将骨髓单细胞悬液收集在离心管中,离心,弃上清,加入500μL结合缓冲液重悬细胞,再加入5 μL异硫氰酸荧光素和10μL碘化丙啶,涡旋混匀,室温避光孵育,立即用流式细胞仪检测凋亡细胞,并计算骨髓有核细胞凋亡率。
1.9 人参-山茱萸供试品溶液及对照品溶液的制备
精密称定“1.4”项下的人参-山茱萸浸膏(取样量相当于人参原药材或山茱萸原药材1 g)放入100 mL锥形瓶中,加甲醇50 mL,记录其重量,放置过夜,补足重量后30℃超声1 h,滤过,用移液管移取25 mL滤液于蒸发皿中,水浴60℃蒸干,甲醇复溶,定容至10 mL容量瓶,摇匀,过0.22μm滤膜进样。
精密称取各人参单体皂苷对照品、莫诺苷、马钱苷适量,甲醇定容,配制成每1 mL含人参皂苷Rg12.0 mg、Re 2.0 mg、Rf 2.0 mg、Rb14.0 mg、Rc 4.0 mg、Rb22.0 mg、Rb32.0 mg、Rd 2.0 mg、Rk32.0 mg、F22.0 mg、20(S)-Rg31.0 mg、20(R)-Rg31.0 mg、莫诺苷4.0 mg、马钱苷2.0 mg,于4℃储藏,备用。
1.10 人参-山茱萸色谱条件
人参单体皂苷色谱条件:色谱柱为Agilent ZORBAX Eclipse XDB-C18(250 mm×4.6 mm,5 μm);流动相为乙腈(B):水(A),梯度洗脱程序如下:0~40 min,18%~21%(B);40~42 min,21%~26%(B);42~46 min,26%~32%(B);46~66 min,32%~33%(B);66~68 min,33%~34%(B);68~73 min,34%~38%(B);73~80 min,38%~49%(B);80~84 min,49%(B);84~85 min,49%~51%(B);85~90 min,51%~60%(B);90~92 min,60%~65%(B);92~99 min,65%(B);99~104 min,65%~85%(B);104~111 min,85%(B);111~115 min,85%~18%(B);115~122 min,18%(B);体积流量1.0 mL/min;检测波长203 nm;柱温30℃;进样量10μL;分析时间122 min。
莫诺苷、马钱苷色谱条件:色谱柱为Agilent ZORBAX Eclipse XDB-C18(250 mm×4.6 mm,5 μm);流动相为乙腈(B):水(A),梯度洗脱程序如下:0~16 min,10%~55%(B);16~21 min,55%~10%(B);体积流量1.0 mL/min;检测波长240 nm;柱温30℃;进样量10μL;分析时间21 min。
1.11 方法学考察
线性关系考察:将“1.9”项下各对照品溶液配制成A、B、C、D、E五个浓度混合对照品溶液以“1.10”项色谱条件分析。以对照品溶液浓度(x)为横坐标,峰面积(y)为纵坐标,进行线性回归。
精密度试验:按照“1.10”项下的色谱条件,取人参单体皂苷和莫诺苷、马钱苷混合对照品溶液B浓度连续进样6次。
稳定性试验:按照“1.10”项下的色谱条件,取人参-山茱萸1:1样品溶液分别在0、4、8、16、20、24 h时进样检测人参单体皂苷稳定性。分别在0、2、4、6、8、12 h时进样检测莫诺苷及马钱苷稳定性。
重复性试验:取“1.4”项下的人参-山茱萸(1∶1)浸膏6份,按“1.9”方法制备供试品溶液,按“1.9”项下的色谱条件进行测定。
加样回收率试验:取“1.4”项下的人参-山茱萸1:1浸膏6份,分别加入对照品适量,按“1.9”项下的方法制备供试品溶液,按“1.10”项下的色谱条件进行测定。
1.12 人参-山茱萸含量测定
取“1.4”项下的人参-山茱萸(1∶1)浸膏按“1.9”项下的方法制备供试品溶液,再按“1.10”项下的色谱条件进行定量分析,根据回归方程,计算人参-山茱萸中12种人参皂苷以及莫诺苷、马钱苷的含量。
1.13 统计学分析
使用IBM SPSS Statistics 25进行统计学分析,结果以平均数±标准差(x̅±s)表示,组间比较采用方差分析,P<0.05为差异有统计学意义,P<0.01为差异显著。
2 结果与分析
2.1 人参-山茱萸(1∶1)对骨髓抑制小鼠外周血细胞数及骨髓有核细胞计数的影响
如图1所示,与正常小鼠相比,模型组的白细胞、血小板计数明显降低(P<0.01)。阳性药组和人参-山茱萸(1∶1)各剂量组均能提高小鼠外周血中的白细胞和血小板(P<0.01)。
如图1所示。模型组的骨髓有核细胞计数显著低于空白组(P<0.01)。和模型组相比,阳性药组和人参-山茱萸(1∶1)各剂量组均能增加小鼠骨髓有核细胞(P<0.01或P<0.05);和人参-山茱萸(1∶1)低剂量组相比,中剂量组对骨髓抑制的改善作用优于低剂量组(P<0.05)。
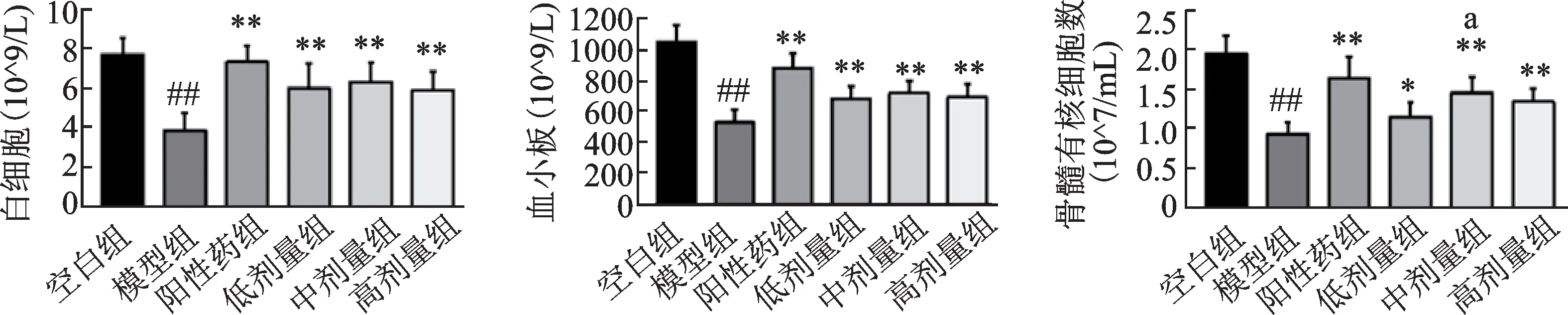
图1 人参-山茱萸(1∶1)对骨髓抑制小鼠外周血细胞及骨髓有核细胞计数的影响Fig.1 The effect of Panax ginseng C.A.Mey-Cornus officinalis Sieb.et Zucc(1∶1)on peripheral blood and bone marrow nucleated cells in myelosuppressed mice
2.2 人参-山茱萸(1∶1)对骨髓抑制小鼠血清集落刺激因子的影响
如图2所示,与正常组相比,模型组GM-CSF,EPO和TPO水平明显上升(P<0.01)。阳性药组和人参-山茱萸(1∶1)各剂量组均能降低GM-CSF,EPO和TPO水平(P<0.01或P<0.05),与低剂量组比较,中高剂量组调控GM-CSF和TPO效果更好(P<0.01或P<0.05)。
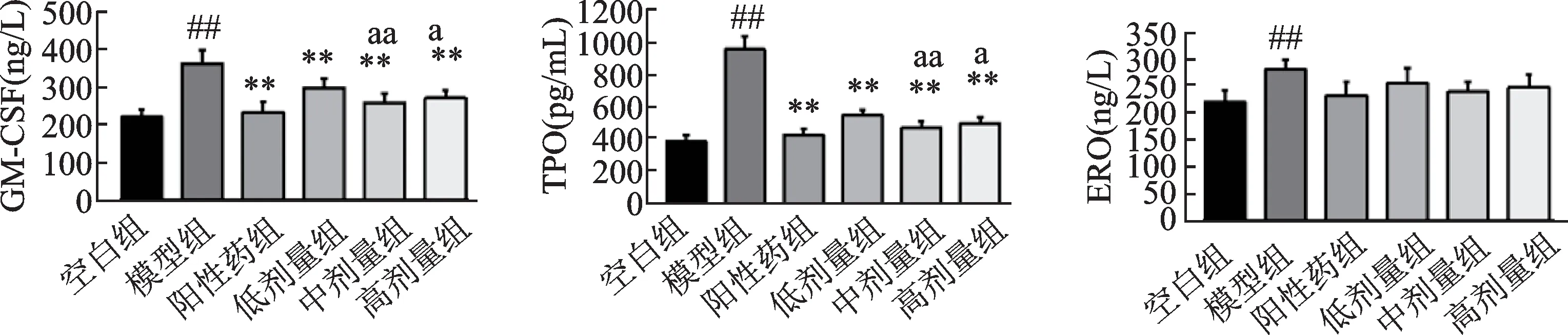
图2 人参-山茱萸(1∶1)对骨髓抑制小鼠血清集落刺激因子的影响Fig.2 The effect of Panax ginseng C.A.Mey-Cornus officinalis Sieb.et Zucc(1∶1)on colony stimulating factor in myelosuppressed mice
2.3 人参-山茱萸(1∶1)对骨髓抑制小鼠造血祖细胞集落的影响
如图3所示,与空白组相比,模型组造血祖细胞集落明显减少(P<0.01)。和模型组相比,阳性药组和人参-山茱萸(1∶1)各剂量组造血祖细胞集落数增加(P<0.01或P<0.05);和人参-山茱萸(1∶1)低剂量组相比,中剂量组对于骨髓造血功能的恢复较好(P<0.01或P<0.05)。
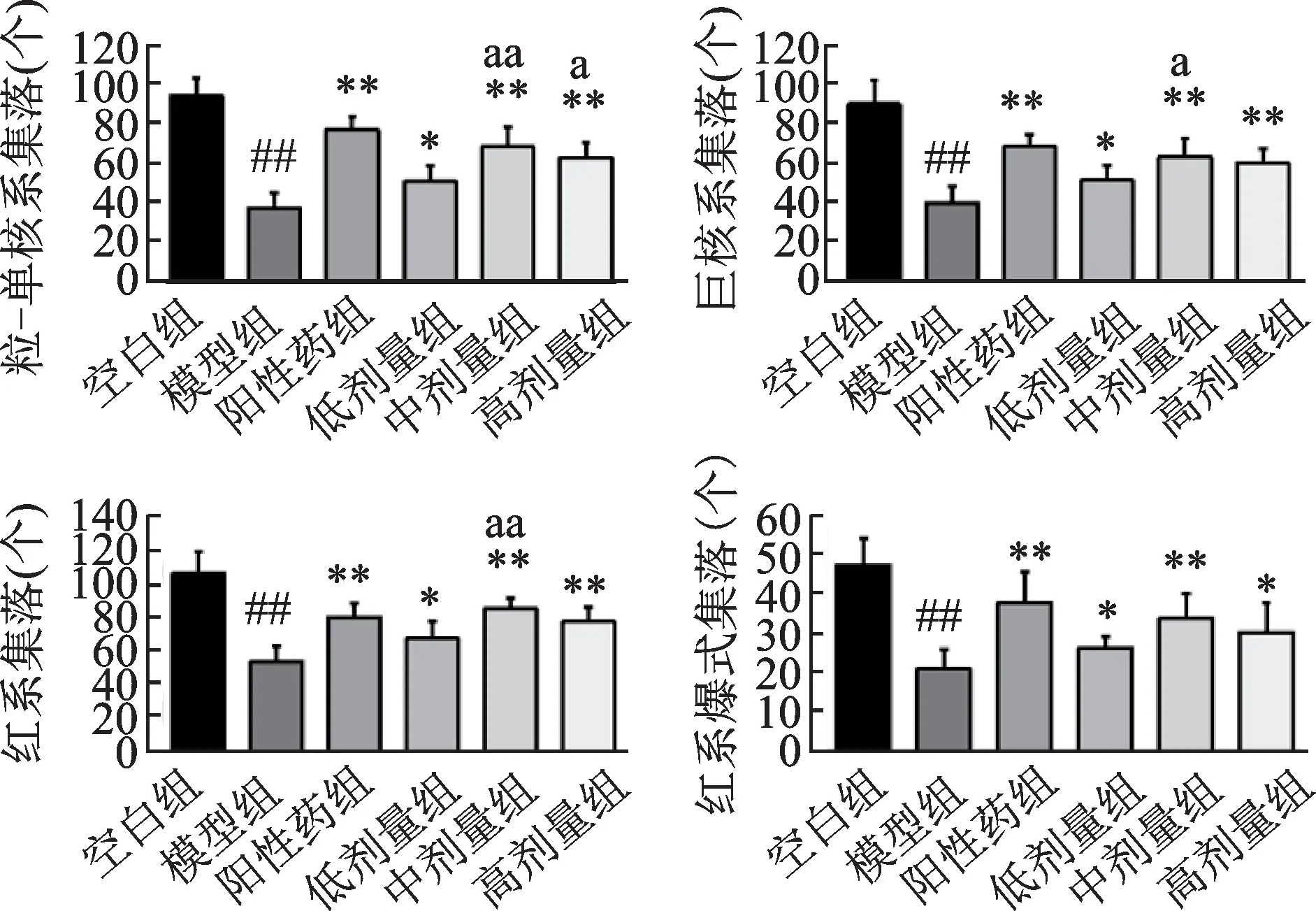
图3 人参-山茱萸1∶1对骨髓抑制小鼠造血祖细胞集落的影响Fig.3 The effects of Panax ginseng C.A.Mey-Cornus officinalis Sieb.et Zucc(1∶1)on hematopoietic progenitor cell colony in myelosuppressed mice
2.4 人参-山茱萸(1∶1)对骨髓抑制小鼠骨髓有核细胞周期的影响
如表2所示,模型组骨髓有核细胞的合成前期明显高于空白组(P<0.01),合成期明显降低(P<0.01)。和模型组相比,人参-山茱萸(1∶1)各剂量组均能降低合成前期比值(P<0.01),且中高剂量组可显著降低合成前期比值(P<0.01)增高合成期的值(P<0.01或P<0.05)
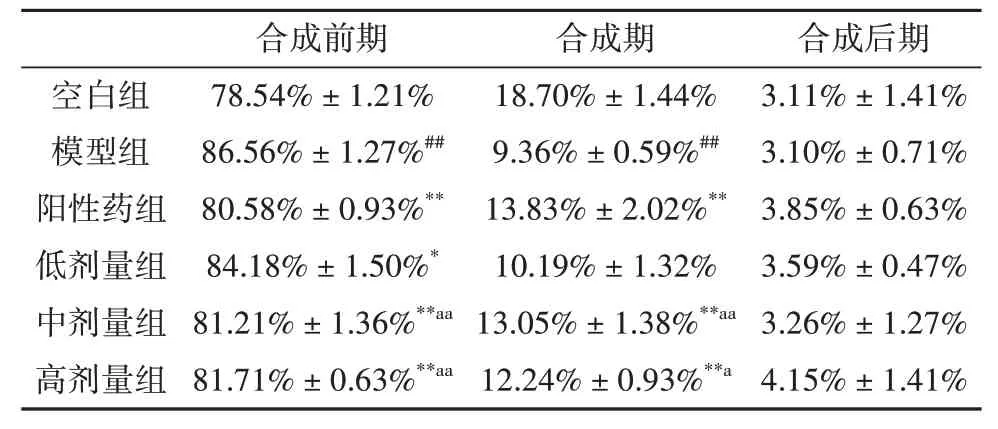
表2 人参-山茱萸(1∶1)对骨髓抑制小鼠骨髓有核细胞周期的影响Tab.2 The effects of Panax ginseng C.A.Mey-Cornus officinalis Sieb.et Zucc(1∶1)on bone marrow nucleated cells cycle in myelosuppressed mice
2.5 人参-山茱萸(1∶1)对骨髓抑制小鼠骨髓有核细胞凋亡的影响
如图4所示,模型组的凋亡率显著上升(P<0.01)。和模型组相比,人参-山茱萸(1∶1)各剂量组均可改善环磷酰胺所诱导的小鼠骨髓有核细胞凋亡,且中高剂量组对骨髓有核细胞抗凋亡的作用优于低剂量组(P<0.01)。
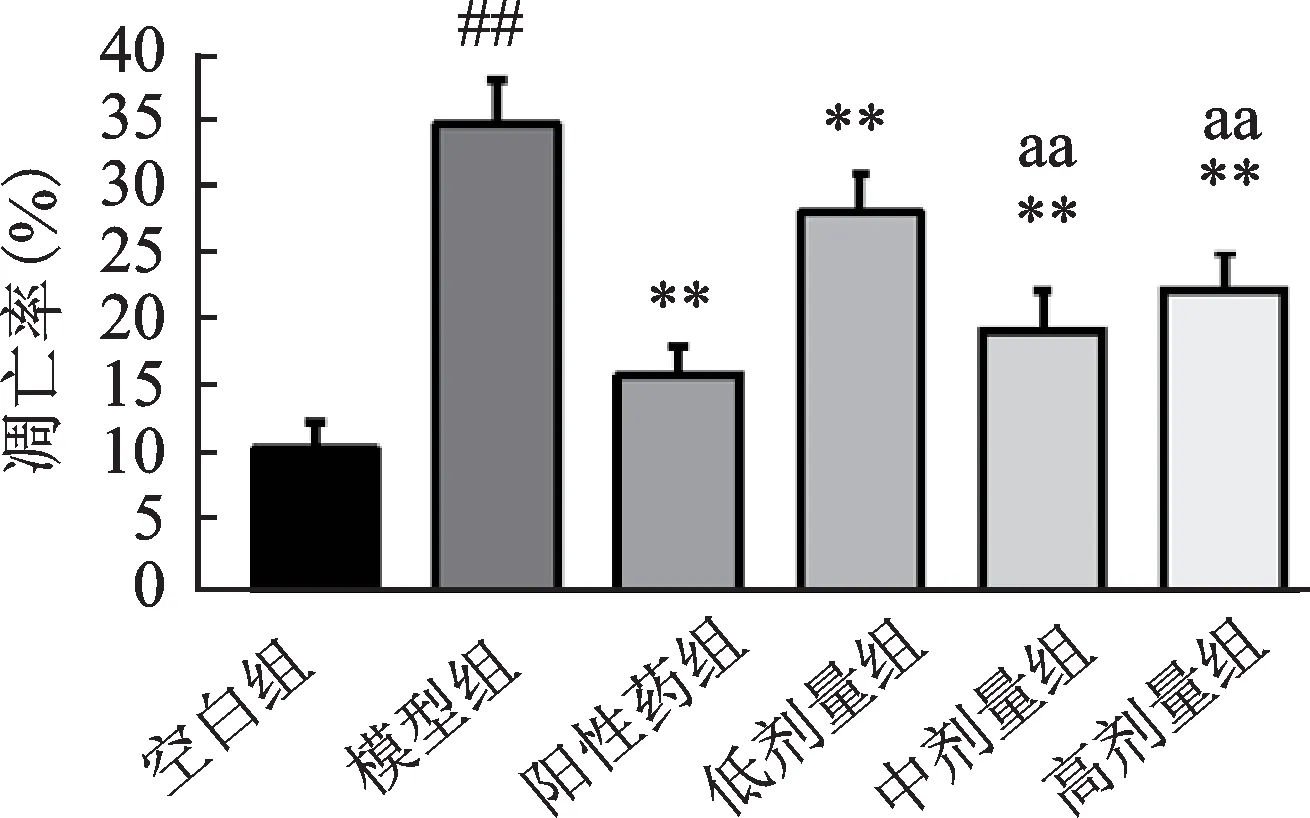
图4 人参-山茱萸(1∶1)对骨髓抑制小鼠骨髓有核细胞凋亡的影响Fig.4 The effects of Panax ginseng C.A.Mey-Cornus officinalis Sieb.et Zucc(1∶1)on bone marrow nucleated cells apoptosis in myelosuppressed mice
2.6 方法学考察结果
12种单体人参皂苷和莫诺苷、马钱苷回归方程、线性范围、相关系数见表3。
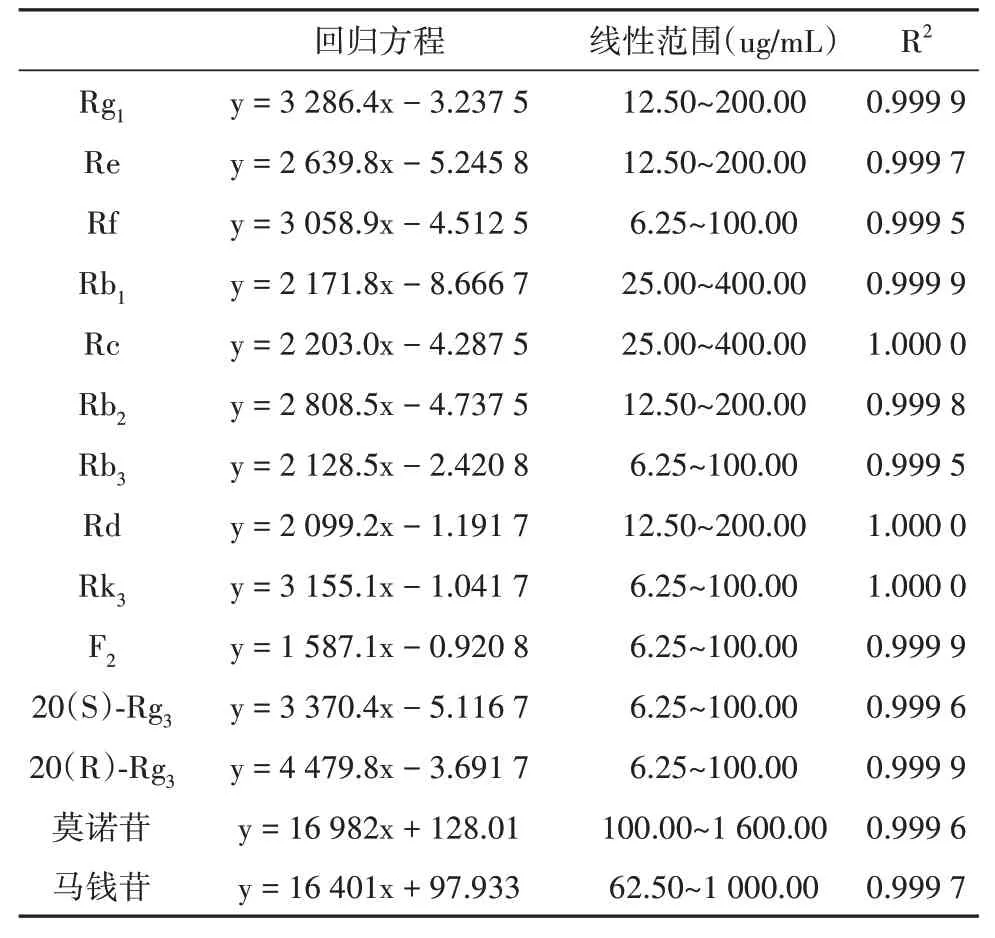
表3 回归方程、线性范围和相关系数Tab.3 Regression equation,linear range and correlation coefficient
12种单体人参皂苷和莫诺苷、马钱苷的精密度、重复性、稳定性的RSD值均小于2%,加样回收率 平 均 值 为97.61%~102.26%,RSD为0.68%~1.60%。
2.7 含量测定
高效液相色谱图见图5,人参-山茱萸(1∶1)中人参皂苷Rg1、Re、Rb3、Rd均无法检测到,人参皂苷Rf、Rb1、Rc、Rb2、Rk3、F2、S-Rg3、R-Rg3、莫诺苷以及马钱苷的含量(mg/g)分别为0.25、0.45、0.51、0.61、0.94、0.84、1.33、1.08、15.28、5.04。
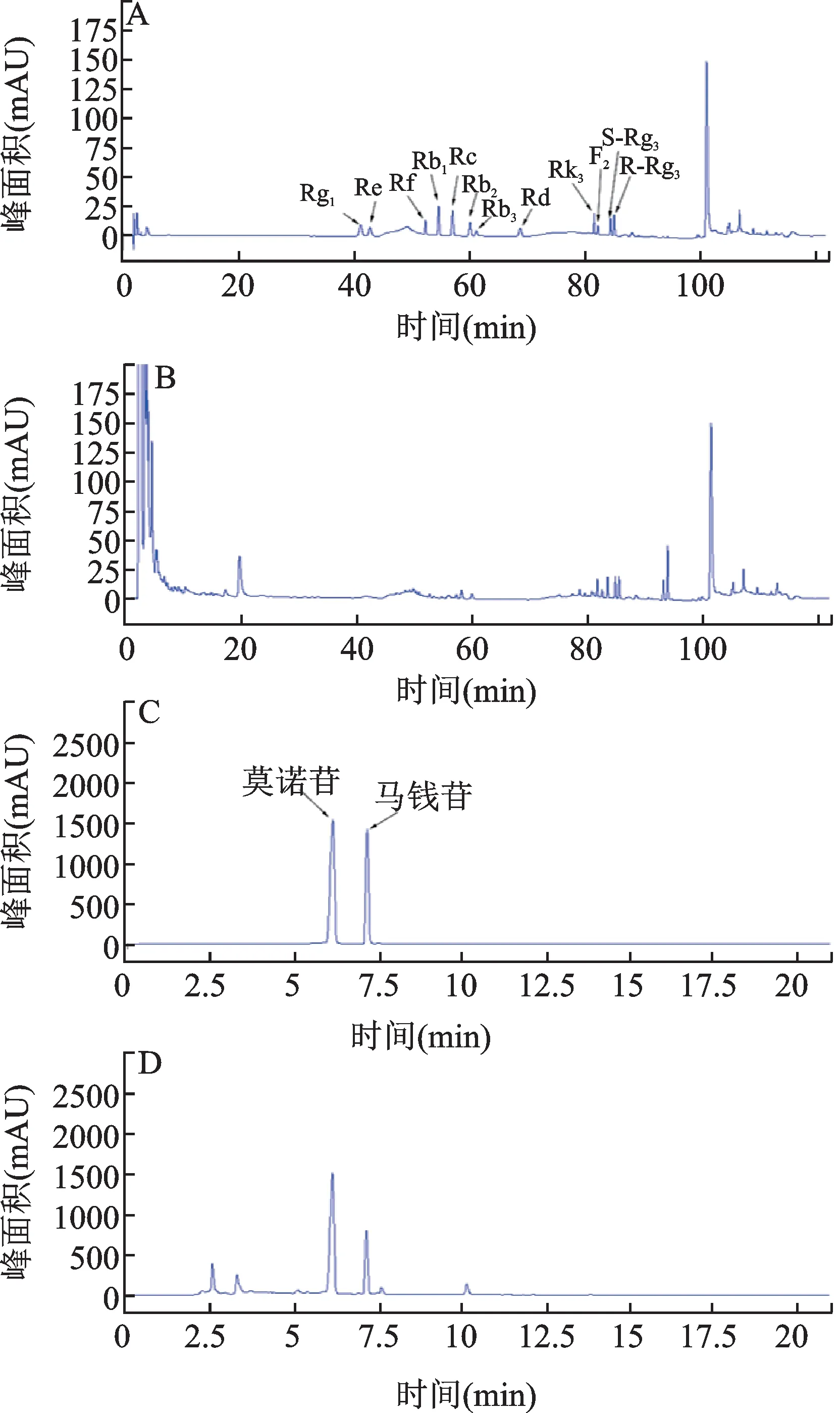
图5 高效液相色谱图Fig.5 HPLC chromatograms
3 讨论与结论
在化疗给药过程中,骨髓抑制是最常见的副作用之一,因为在抑制或杀死肿瘤细胞同时化疗药物也会对造血干细胞造成损害[10],而造血干细胞是所有血细胞的来源,因此,外周血细胞的检测可以间接反映骨髓的造血功能[11]。根据我们的研究,模型组白细胞、血小板明显减少,经人参-山茱萸(1∶1)给药后,白细胞和血小板均有改善。如果说外周血可以间接反映骨髓的造血功能,那么骨髓有核细胞的数量是骨髓损伤更敏感的指标,可以直接反映骨髓的造血功能。本研究中模型组骨髓有核细胞计数明显减少,表明环磷酰胺化疗后显著降低了骨髓有核细胞的数量,人参-山茱萸(1∶1)给药后,骨髓有核细胞的数量增加,其中中剂量改善效果更好。骨髓有核细胞包括粒细胞系、单核细胞系、巨细胞系及淋巴细胞系等,本研究采用造血祖细胞体外半固体琼脂培养法培养红系、粒系、巨核系集落,研究结果显示,环磷酰胺显著抑制造血祖细胞集落数,而人参-山茱萸1∶1可缓解环磷酰胺对造血祖细胞的抑制作用,促进造血祖细胞的功能的恢复。造血细胞的存活、增殖和分化受基质细胞分泌的细胞因子的调控,在没有细胞因子的情况下,造血细胞不仅停止增殖,还会发生凋亡[12]。GM-CSF是一种肽生长因子,在促进造血细胞的增殖和分化以及白细胞的产生中起重要作用[13]。TPO是一种糖蛋白激素,主要功能是刺激造血干细胞分化为巨核细胞,刺激巨核细胞成熟,进一步产生和释放血小板[14-15]。EPO也是一种对红系祖细胞有一定特异性的糖蛋白激素,它可以促进骨髓造血细胞的生长和分化[16]。正常情况下,骨髓基质中只有少量细胞因子,经过环磷酰胺造模后,细胞因子含量会应急性增加[17]。本研究中环磷酰胺增加了血清中集落刺激因子的水平,而人参-山茱萸可显著降低血清集落刺激因子水平。
骨髓有核细胞数量的维持取决于骨髓有核细胞中有分裂能力的细胞的增殖、凋亡及其成熟释放入外周血之间的动态平衡,化疗可引起细胞周期合成前期阻滞,抑制骨髓有核细胞的分裂增殖,而流式细胞仪可以获取骨髓有核细胞周期中各期所占的比例,有助于对骨髓有核细胞的分裂增殖情况进行分析,研究结果显示,模型组合成前期比例显著增加,合成期比例显著降低,不同剂量人参-山茱萸给药后,骨髓有核细胞合成前期比例降低,合成期比例增高,表明不同剂量人参-山茱萸均可解除合成前期阻滞,恢复骨髓有核细胞周期。除此之外,化疗还可诱导骨髓有核细胞异常凋亡,研究结果显示,模型组骨髓有核细胞凋亡率显著升高,而不同剂量人参-山茱萸可显著降低骨髓有核细胞凋亡率,由此可以看出,人参-山茱萸通过解除骨髓有核细胞周期阻滞,减少骨髓有核细胞凋亡,从而改善环磷酰胺所诱导的小鼠骨髓抑制。
进一步通过高效液相色谱法对人参配伍山茱萸后人参中12种人参皂苷以及山茱萸中的莫诺苷和马钱苷的含量进行分析,研究结果显示,在人参-山茱萸中莫诺苷具有较高的含量(15.28 mg/g),其次为马钱苷,含量为5.04 mg/g。而常见人参皂苷相比于稀有人参皂苷占比较少,且常见人参皂苷Rg1、Re、Rb3、Rd均无法检测到,人参皂苷Rk3、S-Rg3、RRg3分别达到0.94 mg/g、1.33 mg/g、1.08 mg/g。初步确认了10种化学成分,为人参-山茱萸的进一步研究提供参考依据。
