锂对盐角草异型性种子萌发特性的影响
2022-10-02拉兰艾尼瓦
司 雨,刘 畅,拉兰·艾尼瓦,姜 黎*
(1.中国科学院新疆生态与地理研究所荒漠与绿洲生态国家重点实验室,新疆 乌鲁木齐 830011;2.南京野生植物综合利用研究院,江苏 南京 211111;3.新疆师范大学,新疆 乌鲁木齐 830054)
锂(Li)作为化学活性高、重量最轻的碱金属,约占地壳的0.006%[1]。锂主要存在于土壤、地表水和海水中[2-3]。现在因锂的开采、工业应用和锂电池广泛应用,致使土壤和水体中锂污染[4-6]。虽然Li被认为是动物和人类必须的微量元素,但过多的锂可能引起多种慢性和急性的毒性效应[6],我国也同样存在着锂矿环境污染严重[7],尤其干旱区新疆锂矿带来污染引起广泛地关注[8-9],如何治理干旱区锂污染尤为重要。目前针对已经提出了修复锂污染的主要方法:在土壤中添加有机质、使用螯合剂或伴侣剂、土壤稳定固化等[3],而利用积累或超积累植物进行修复是一种相比较经济、环保的方法[10-11]。
当前,沿海滩涂和内陆盐碱地作为我国重要的后备土地资源,Li污染对这些后备土地开发利用和生产安全造成严重威胁,种植盐生植物修复污染盐土是最为经济有效的方法[10-11]。在200 mmol·L-1Li处理下,盐角草的生长未明显抑制,且地上部分Li浓度达到5 733 mg·kg-1DW。由于盐角草的高耐锂和富锂特征可被认为最合适修复沿海滩涂和内陆盐碱地Li污染的植物材料[11],然而有关盐角草在萌发时期对锂的响应鲜有报道。
盐角草是一种广泛分布的一年生真盐生植物,具有典型的种子异型性。盐角草的出穗状花序,每节有两个相对的三花的聚伞花序,每个聚伞花序有一个大的中心花(负责产生一个较大的种子)和两个较小的侧边花(负责产生两个较小的种子)[12];这一种有性繁殖并且产生大量在大小和植物位置上不同的异型性种子,中间较大的种子(带翅型)位于中心部分,而较小的种子(不带翅型)位于两侧。Ungar[13]表明中心大(带翅型)的种子耐盐性更强。基于盐角草具有富锂特征[11],且异型性种子对Na的响应具有显著的差异性[12-13],推测盐角草的异型性种子在萌发过程中可能具有较高的锂耐受性和对锂响应差异性。本文旨在探索盐角草异型性种子在萌发时期对Li处理下的响应。
1 材料与方法
1.1 盐角草种子采集
2018年10月,盐角草完全成熟的种子采集于新疆克拉玛依乌尔禾区。种子在室温下晾干后,用手清理干净。然后将清理干净的盐角草种子,分拣带翅的种子(A型)和不带翅的(B型)的种子,分别保存于种子袋中备用。
1.2 萌发试验
种子萌发试验:2张滤纸放入直径长为5 cm培养皿中,分别加入不同浓度锂(LiCl)溶液至滤纸饱和,每皿放入上述分A型和B型的25粒种子,4次重复。分别设5个Li处理:100、200、400、800和1 000 mmol·L-1,均以蒸馏水为对照(CK),再分别置于25℃/10℃、光照-黑暗交替12 h/12 h的培养箱中培养。每天补充蒸发掉的水分。测定指标:萌发过程中每天观察记录1次萌发情况,种子萌发以胚根露出种皮为准,连续观察记录10天,计算其萌发率、萌发指数和萌发率达到50%时间。
1.3 种子萌发过程中生理生化指标测定试验
种子萌发:在培养皿(直径长9 cm)中放入2张滤纸,加入LiCl溶液至滤纸饱和,每皿放入2 g种子,3次重复。分别设2个LiCl处理:100、200、400、800 mmol·L-1,以蒸馏水为对照(CK),置于25℃/10℃、光照-黑暗交替12 h/12 h的培养箱中培养。每天补充蒸发掉的水分。测定指标:萌发3天后取样测定阿尔法淀粉酶活力、丙二醛含量。
1.4 萌发参数测定
累积萌发率=每天统计萌发种子数/供试种子数×100%;萌发率=所有萌发种子数/供试种子数×100%;萌发指数=Σ(Gt/Dt)(Gt指在时间t日内的萌发数,Dt为相应的萌发天数)。
1.5 生理生化指标测定
分别称取0.2 g样品,加8 ml蒸馏水,研磨后所得匀浆在3 000 r/min下离心10 min,收集上清液,加蒸馏水定容至50 mL,摇匀,即为淀粉酶原液。吸取上述淀粉酶原液1.00 mL,用蒸馏水稀释并定容至50 mL,摇匀,即为淀粉酶稀释液。淀粉酶活性的测定,α-淀粉酶总活性的测定是将淀粉酶稀释液与1%淀粉溶液在40oC下保温10 min,然后用3,5-二硝基水杨酸法测定反应生成的还原糖。酶活力定义40oC,pH5.6的条件下,每分钟催化底物释放l mg麦芽糖的酶量为1个酶活力单位(U)。α-淀粉酶活力测定参考李合生[14]。
萌发3 d后分别称取0.2 g样品,加5% TCA 5 ml,研磨后所得匀浆在3 000 r/min下离心10 min。取上清液2 ml,加0.67% TBA 2 ml,混合后在100℃水浴上煮沸30 min,冷却后再离心一次。分别测定上清液在450 nm、532 nm和600 nm处的吸光度值。MDA含量测定参考李合生[14]。
1.6 数据分析
使用SPSS 16.0统计分析软件进行分析所有试验数据的平均值和标准误,并对所有试验数据进行差异显著,采用Ducan检验来比较处理间差异。
2 结果分析
2.1 锂对盐角草异型性种子萌发率的影响
由图1表明,不同Li浓度对盐角草种子的萌发具有显著的影响。如表1所示,随着Li浓度的升高,盐角草A型种子的萌发率与萌发指数先升高后降低,在200 mmol·L-1最高,分别为100%与89%,而B型种子呈现逐渐降低的趋势;在同一LiCl浓度处理下,除在100 mmol·L-1与1 000 mmol·L-1浓度下,A型种子的萌发率与萌发指数均显著大于B型种子,说明高浓度LiCl对盐角草种子萌发具有抑制作用;同时,A型种子萌发率达到50%时所需的天数,显著早于B型种子的所需天数(3天)。
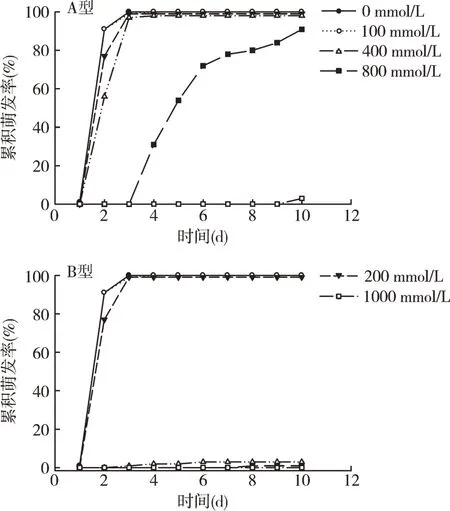
图1 Li对盐角草异型性种子累积萌发率的影响Fig.1 Effect of Li concentration on accumulative germination percentage of S.europaea dimorphic seeds
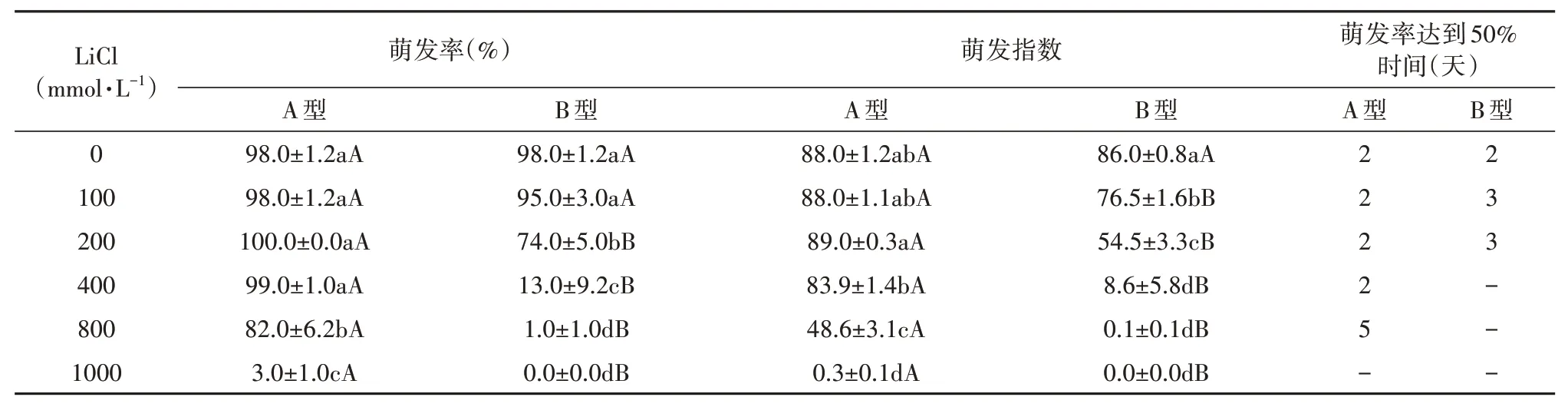
表1 Li对盐角草异型性种子萌发率、萌发指数与萌发率达到50%时间的影响Tab.1 Effects of Li concentration on germination percentage,germination index and time to 50%germination of S.europaea dimorphic seeds
2.2 锂对盐角草异型性种子α-淀粉酶活力的影响
如图2所示,通过测定培养3 d的盐角草两种种子α-淀粉酶活力发现,在相同浓度梯度下,盐角草A型种子α-淀粉酶活力曲线整体呈现缓和上升趋势,在LiCl浓度800 mmol·L-1时α-淀粉酶活力最高为0.23 mg(g·min)-1;B型种子α-淀粉酶活力随LiCl浓度升高先升高后降低,在LiCl浓度200 mmol·L-1时最高为0.20 mg(g·min)-1。
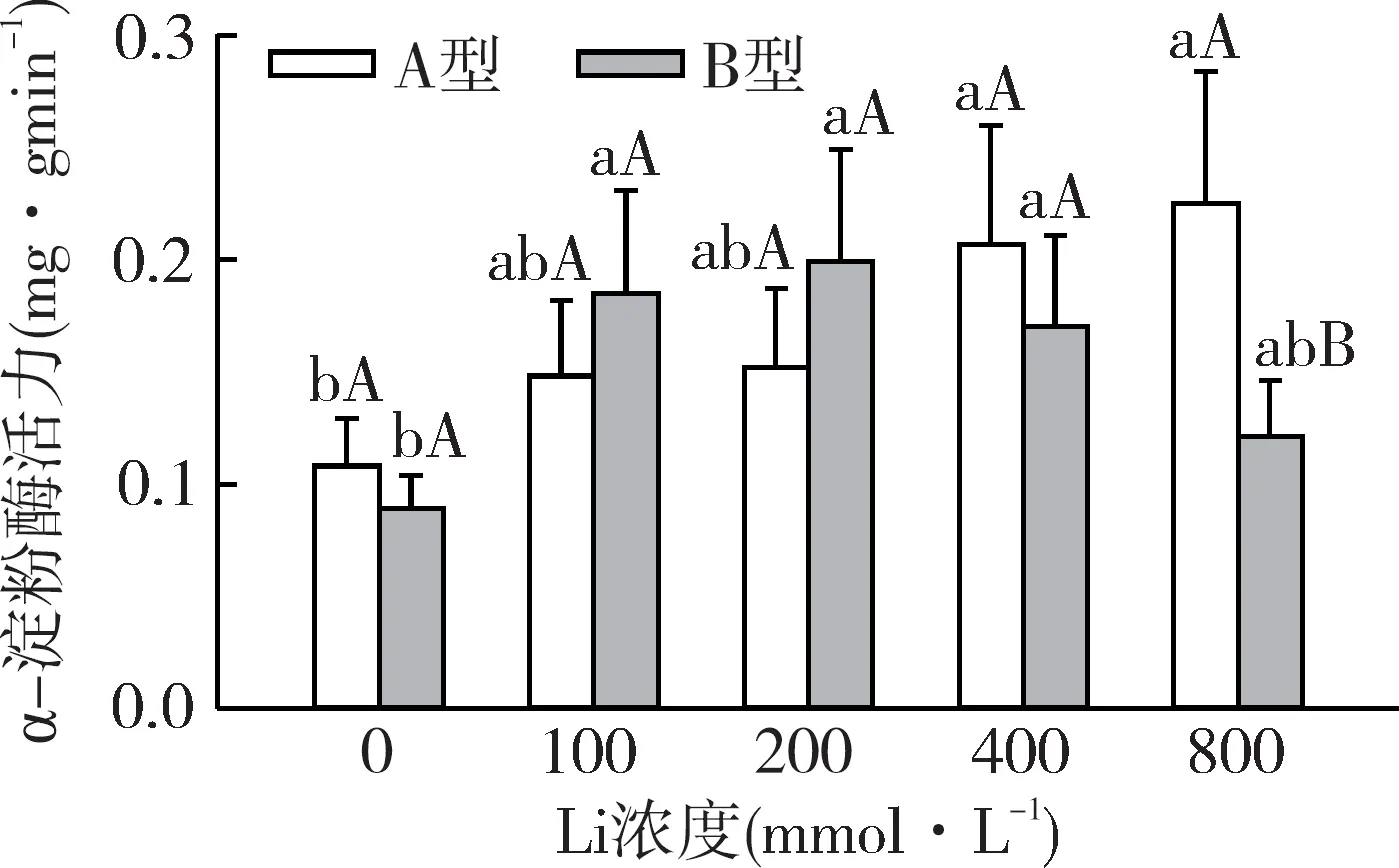
图2 Li对盐角草异型性种子α-淀粉酶活性的影响Fig.2 Effect of Li concentration onα-amylase enzymatic activity of S.europaea dimorphic seeds
2.3 锂对盐角草异型性种子MDA含量的影响
分析盐角草种子萌发过程中丙二醛(Malondialde-hyde,MDA)含量(3 d)结果表明,A型、B型种子对不同浓度锂的响应具有显著差异。如图3所示,随着LiCl浓度的升高,盐角草A型种子的丙二醛含量先升高后降低,在LiCl 100 mmol·L-1时达到最高为1.15μmol·L-1;对于B型种子,丙二醛含量一直处于下降趋势,在LiCl 800 mmol·L-1最低为0.39μmol·L-1。
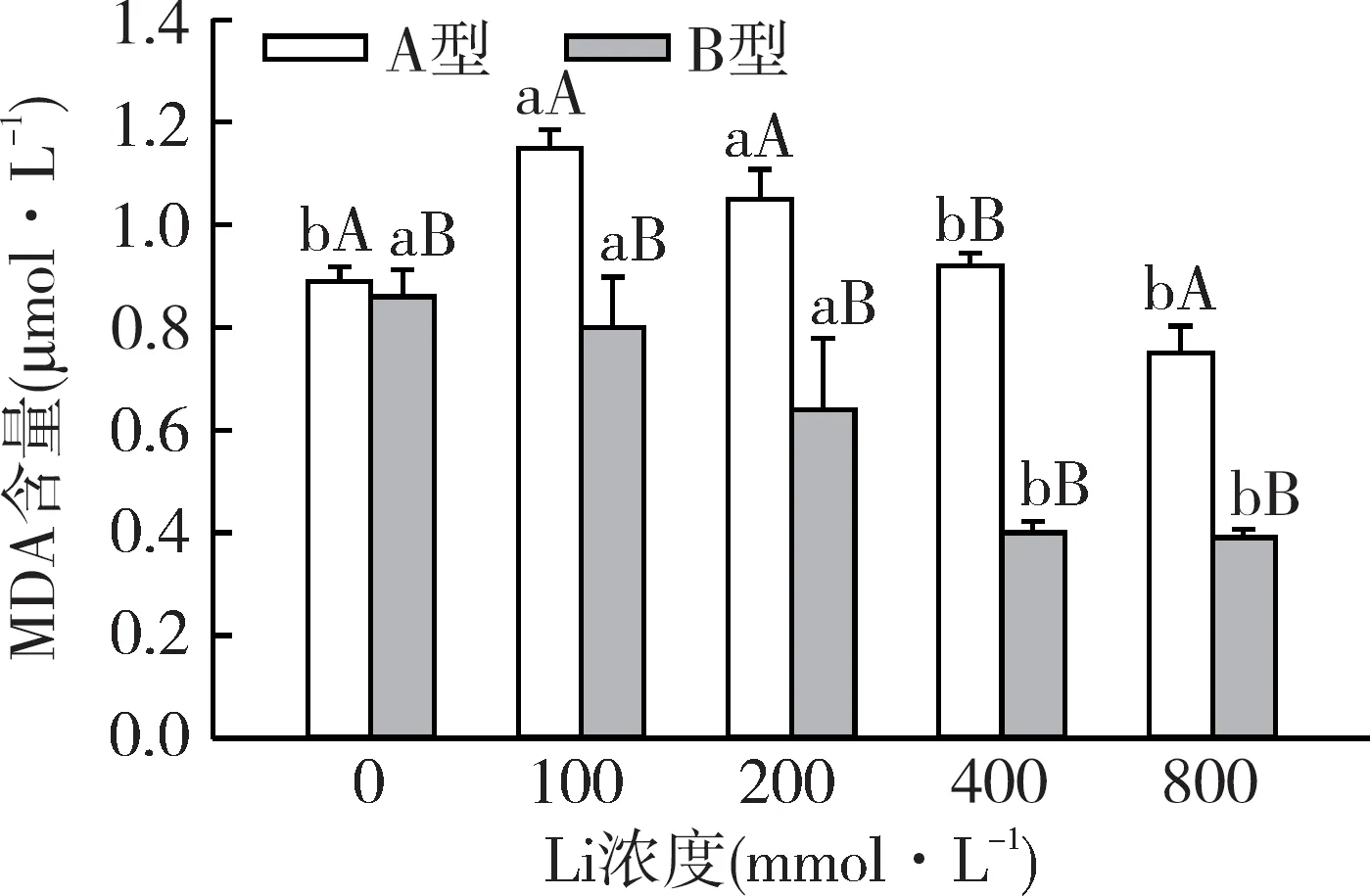
图3 Li对盐角草异型性种子丙二醛含量的影响Fig.3 Effect of Li concentration on MDA content of S.europaea dimorphic seeds
3 讨论
在萌发期,盐角草种子对锂具有较高的耐性。试验研究表明与对照相比,100 mmol·L-1Li对A型和B型种子萌发参数略有促进作用。研究表明,1 mmol·L-1溴化锂明显抑制玉米、大豆的萌发[15],1.89~4.72 mmol·L-1Li对蚕豆种子萌发具有抑制作用[16-17];盐生植物柽柳[18](Tamarix hispida)、富锂植物罗布红麻(Apocynum venetum)和白麻(A.pictum)在50 mmol·L-1Li处理下,它们的萌发率都受到抑制作用[10,19]。
盐角草异型性种子表现出不同的锂耐受性,带翅(A型)种子在萌发期具有较高的锂耐受性。Li浓度0 mmol·L-1至400 mmol·L-1范围内,对盐角草A型种子萌发具有明显促进作用,并随其浓度增加促进作用增 强;在800 mmol·L-1至1 000 mmol·L-1范围内,随Li浓度增加对盐角草A型种子萌发抑制作用明显增强,浓度为1 000 mmol·L-1时萌发率接近零。Li低浓度范围内对盐角草B型种子萌发具有一定的促进作用;200 mmol·L-1至1 000 mmol·L-1范围内,抑制萌发作用随Li浓度增加显著增强,当浓度增加至800 mmol·L-1时,盐角草B型种子已经完全不萌发。由此说明,低浓度Li对盐角草两类型种子萌发均有促进作用,但随浓度的升高抑制作用加强,且促进效果具有一定差异。同时,Li对盐角草的种子萌发作用是否存在“阈值”(促进到抑制的转折点),需要下一步的探究与分析。Ungar[10]表明中心大的种子耐盐性更强。基于盐角草在Na中具有较高的耐盐性,且具有与Na相似的化学特性,推测盐角草的二态种子在萌发过程中可能具有较高的锂耐受性。
种子萌发需要良好的外部环境使得种子的细胞保持完整性,细胞内各种酶的活性,细胞内物质的含量保持稳定。种子萌发过程中,α-淀粉酶活性与萌发呈正相关,MDA含量与其呈负相关。同一Li浓度下α-淀粉酶活性随天数增加逐渐降低,是因为种子萌发过程中α-淀粉酶活性增加,细胞内物质分解转化为能量供细胞生长,萌发种子的细胞可以进行如光合作用等其他途径获取能量[18],因此,α-淀粉酶随天数增加逐渐降低;另外,因为低浓度锂离子促进盐角草种子萌发,高浓度抑制其萌发,所以在同一天数下,随LiCl浓度增加α-淀粉酶活性曲线先升高后降低。随LiCl浓度增加MDA含量先增加后降低。其中,Li浓度在0 mmol·L-1至800 mmol·L-1范围内,同一天数中A型、B型种子MDA含量下降幅度逐渐减小;A型种子在Li浓度为800 mmol·L-1时MDA含量几乎不随天数增加有明显的变化,B型种子在Li浓度400 mmol·L-1时MDA含量就已经无太大变化。推测可能因为低浓度(100 mmol·L-1以下)的锂离子对盐角草萌发的细胞具有修复作用,缓解了细胞内发生的膜脂过氧化作用,保持细胞结构稳定性,得以维持细胞自身生长分裂。浓度逐渐升高的锂离子对盐角草种子产生胁迫,为应对这种逆境相应酶活性增加降过氧化作用导致MDA含量降低。A型、B型两种种子分别于Li浓度为800 mmol·L-1、400 mmol·L-1时萌发率几乎为零,种子细胞不分裂生长,因此,MDA含量变化不大。
综上所述,盐角草萌发时期具有较高的锂耐受性,直接播种可能是修复土壤锂污染的一种有效方法。锂浓度达到一定高水平时,异型性种子的萌发差异较大,因此,在重度锂污染土壤中,为了优化出苗,应选择较大的带翅(A型)种子。直接播种盐角草带翅种子可能是修复锂污染一种有效的方法。当然,这还需要进一步的研究探索锂污染土壤带翅(A型)种子萌发和生长特性。
