独一味对葡聚糖硫酸钠诱导UC小鼠保护作用及其机制
2022-10-02杜少波朱瑞清刘美玲董志强陈晓文谢惠春
杜少波,乔 枫,张 勐,朱瑞清,刘美玲,董志强,陈晓文,谢惠春*
(1.青海师范大学生命科学学院,青海 西宁 810008;2.青海省青藏高原药用动植物资源重点实验室,青海 西宁 810008)
溃疡性结肠炎(Ulcerative colitis,UC)是炎症型肠病中最常见的类型之一,以结肠黏膜慢性炎症为特征,主要累及直肠和结肠,临床表现为腹痛、腹泻、便血等,反复发作可导致体重下降,食欲不振等现象[1-4]。引起溃疡性结肠炎发病的主要原因有环境、遗传、感染等方面,但由于其发病机制尚不明确,尚未研究出完全适用于溃疡性结肠炎的方法[5-6]。目前的治疗手段主要包括5-氨基水杨酸制剂[7-8]、生物抑制剂[9]、免疫抑制剂[10]以及调节肠道菌群[11]等。但长期服用副作用大,可引起诸多不良反应。葡聚糖硫酸钠(Dextran sulfate sodium,DSS)可抑制肠上皮细胞的增殖,引起肠道菌群代谢紊乱,从而引发炎症[12]。通过DSS诱导的UC模型是最常用的化学性动物模型,也是使用最多的方法[13-14],对于新药开发和机制研究具有重要意义[15]。
独一味[LamioPhlomis rotata(Benth.)Kudo]是我国传统的中药材[16],具有镇痛、止血、抗菌、提高免疫功能及抗肿瘤等作用[17-18],且独一味中环烯醚萜苷类抗炎镇痛效果较好,是其主要药效成分[19]。独一味还具有很好的抗肠炎作用,可改善角叉菜胶[20]、内毒素[21]或者二甲苯[22]等诱导的炎症症状。其机制与抑制NF-κB因子的激活及炎症细胞因子释放、调节免疫反应以及调节肠道微生态等密切相关[23-27]。但独一味是否可以有效改善DSS诱导的UC症状,目前未见报道。
因此,本研究以DSS诱导建立UC小鼠模型,通过小鼠结肠炎症状的变化、血清中炎症因子的含量和NF-κB因子的表达水平,探讨独一味对UC小鼠的保护作用及机制,为该药用植物用于治疗炎症性肠道感染性疾病提供理论依据。
1 试验材料
1.1 药品及试剂
DSS(分子量36 000~50 000,美国MPBIO生物医学公司);独一味提取物冻干粉(实验室制备,用0.5% CMC-Na溶液配置成1 g/mL混悬液备用);柳氮磺吡啶肠溶片(Sulfasalazine,SSZ);0.5%Na-CMC溶液;4%多聚甲醛;磷酸盐缓冲液(Phosphate buffered saline,PBS);超纯水由Milli-Q超纯水仪制备;小鼠ELISA试剂盒:白细胞介素-1β(Interleukin-1β,1L-1β)、白细胞介素-6(Interleukin-6,1L-6)、肿瘤坏死因子-α(Tumor nercrosis factor-α,TNFα),均购自上海江莱生物科技有限公司;NF-κB引物和Actin引物由公司合成;TRIZOL总RNA提取试剂;反转录试剂盒;Loading buffer 6×;氯仿、异丙醇和75%乙醇均为分析纯。
1.2 试验仪器
VORTEX-2-涡旋振荡器、G05型PCR仪、DYCZ-24DH型双板垂直电泳仪(甘肃金博研生物有限公司);Secura513-1CN-精密天平(德国Sartorius公司);H1650R-低温离心机(湘仪离心机仪器有限公司);TSX50086V-超低温冰箱(日本Sanyo公司);Nano Drop2000-超微量分光光度计(北京凯慕生物技术有限公司)。
1.3 试验动物
采用SPF级C57雄性小鼠共36只,8周龄,体质量22 g左右,由江苏集萃药康生物科技有限公司提供,饲养于福建医科大学动物实验中心,许可证号SCXK(苏)2018-0008,动物饲养于干净舒适的环境,温度(22±2)℃;湿度(60±5)%。本论文中涉及到的所有试验操作步骤全部符合实验动物伦理委员会的相关规定。
2 方法
2.1 造模方法、试验分组及给药方案
将36只C57BL/6J雄性小鼠随机分为空白对照组(CON)、模型组(DSS)、柳氮磺吡啶阳性对照组(DSS+SSZ 0.6 g/kg)、独一味低(DSS+DYW 0.1 g/kg)、高剂量(DSS+DYW 0.2 g/kg)组、空白给药组(DYW 0.2 g/kg)6组,每组动物6只,各组小鼠在动物屏障中培养1周后,空白对照组及对照给药组给予正常饮用水。具体试验分组及给药方案如表1所示。
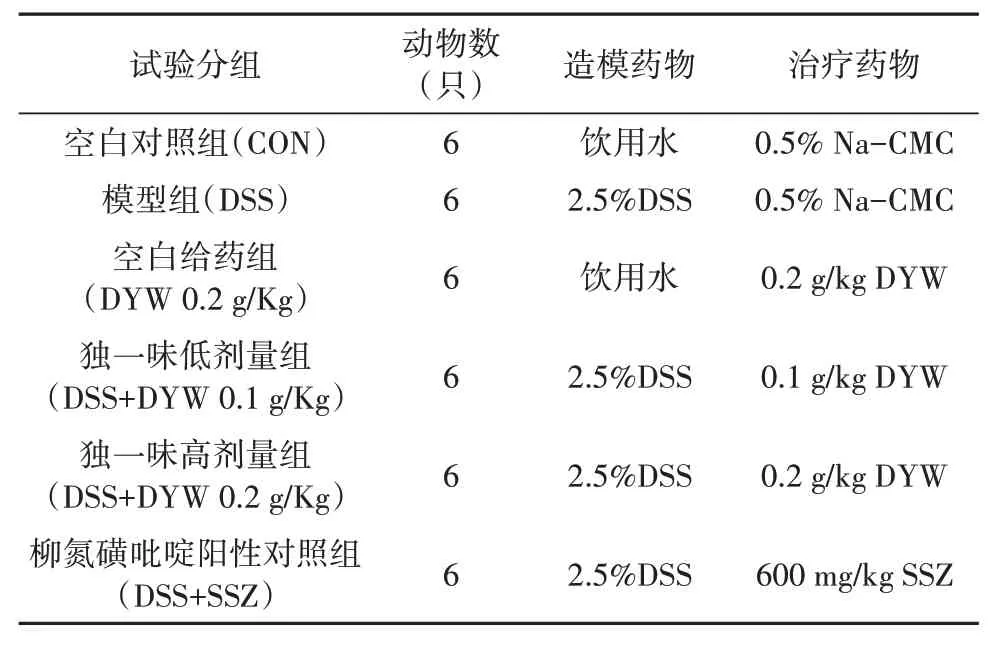
表1 试验分组及给药方案Tab.1 Trial grouping and administration scheme
模型组小鼠自由饮用2.5%DSS溶液10天。造模后,每天对小鼠进行称重,观察小鼠的行为状态及便血程度,对DSS诱导的溃疡性结肠炎小鼠进行初步给药效果研究。
2.2 样本采集及处理
造模及给药期间每日对动物进行检查并称重。连续给药至第11天将动物处死后,收集全结肠及脾脏器官,测量其长度和重量。全血样本于4℃、3 000 r/min离心10 min取血清,-80℃保存。脾脏称重,结肠肠断铺平测定其长度,纵向剪开,PBS洗净,切除远端结肠1 cm于4%多聚甲醛溶液中进行固定,剩余组织分为3份,置于EP管中,加入比例为1 mg:9 mL的PBS溶液进行冰上匀浆,4℃、3 000 r/min离心10 min,转移上清液至新的EP管中-80℃保存,待测。
2.3 结肠组织HE染色病理形态学分析
对石蜡组织块进行切片、脱蜡(二甲苯),脱水(不同梯度酒精)、染色(苏木精-伊红)等过程,具体试验过程参照HE染色试剂盒进行操作,最后在切片上滴一滴中性树胶然后封片、镜检。
2.4 血清中TNF-α、IL-6、IL-1β的含量测定
严格按照ELISA试剂盒中说明进行操作。
2.5 结肠组织中NF-κB的mRNA表达
2.5.1 结肠组织总RNA的提取
取出在-80℃中储存的结肠组织,按照100 mg:1 mL比例加入Trizol,冰上匀浆,室温裂解10 min,随后加入氯仿,震荡离心管10秒左右后静置5 min,12 000 r离心5 min。转移上清于新的离心管,按比例加入异丙醇,16 000 r离心10 min。弃上清,按比例加入75%乙醇,16 000 r离心5 min。弃上清,晾干后加入30μL DEPC水溶解。
RNA浓度检测:取少量溶解的RNA用TE Buffer稀释,再将该溶液在Nano Drop 2000超微量分光光度计中进行RNA纯度检测。
2.5.2 逆转录
总RNA为10μL的体系。逆转录反应体系如表2。

表2 逆转录反应体系Tab.2 Reverse transcription reaction system
2.5.3 qRT-PCR
对所提取的样本进行实时荧光定量PCR检测,引物序列及反应体系如表3及表4。

表3 NF-κB引物序列Tab.3 Primer sequence of NF-κB

表4 PCR反应体系Tab.4 PCR reaction system
循环模式:95℃,30 s;60℃,30 s;72℃,30 s,40个循环。利用溶解曲线判断产物的特异性,采用2-ΔΔCt相对定量法计算各个基因水平,以Actin为参照,对各个基因水平进行标化;把慢性炎症模型组的基因水平设为1,正常对照组和激动剂组的基因水平以相对于慢性炎症模型组表示。
2.6 统计学处理
使用SPSS 22.0统计软件,试验结果采用平均数±标准差表示,多组间比较采用单因素方差分析,两两比较用LSD检验,P<0.05被认为具有统计学意义。使用Microsoft Excel 2022软件生成图形。
3 结果
3.1 不同处理组小鼠的临床表现
本试验定期观察试验动物临床表现,试验记录发现,空白对照组及空白给药组小鼠摄食饮水正常,毛发干净且肛周无黏附血液,体重稳定。利用DSS造模后第3天出现腹泻,随后出现便血情况、行动迟缓、精神萎靡不振、毛发无光泽症状,第5天后,DSS诱导的模型组小鼠总体出现毛发脱落直立、体表无光泽等现象,小鼠运动量明显减少,常呈蜷缩状态,体重下降。独一味给药组和阳性药物对照组小鼠组出现便血情况,但症状均轻于模型组。
3.2 独一味对DSS诱导的UC小鼠体重及脾脏重量的影响
见图1,对照组及对照给药组小鼠体重保持稳定,没有明显升降变化,与对照组小鼠比较,模型组小鼠体重出现明显下降,其余各组小鼠经给药后体重均有所回升。模型组小鼠脾脏重量呈显著增加,由0.069 8±0.007 3 g显著升高至0.113 3±0.019 7 g(P<0.01),但各给药组脾脏重量与DSS模型组和空白给药组差异均不显著。
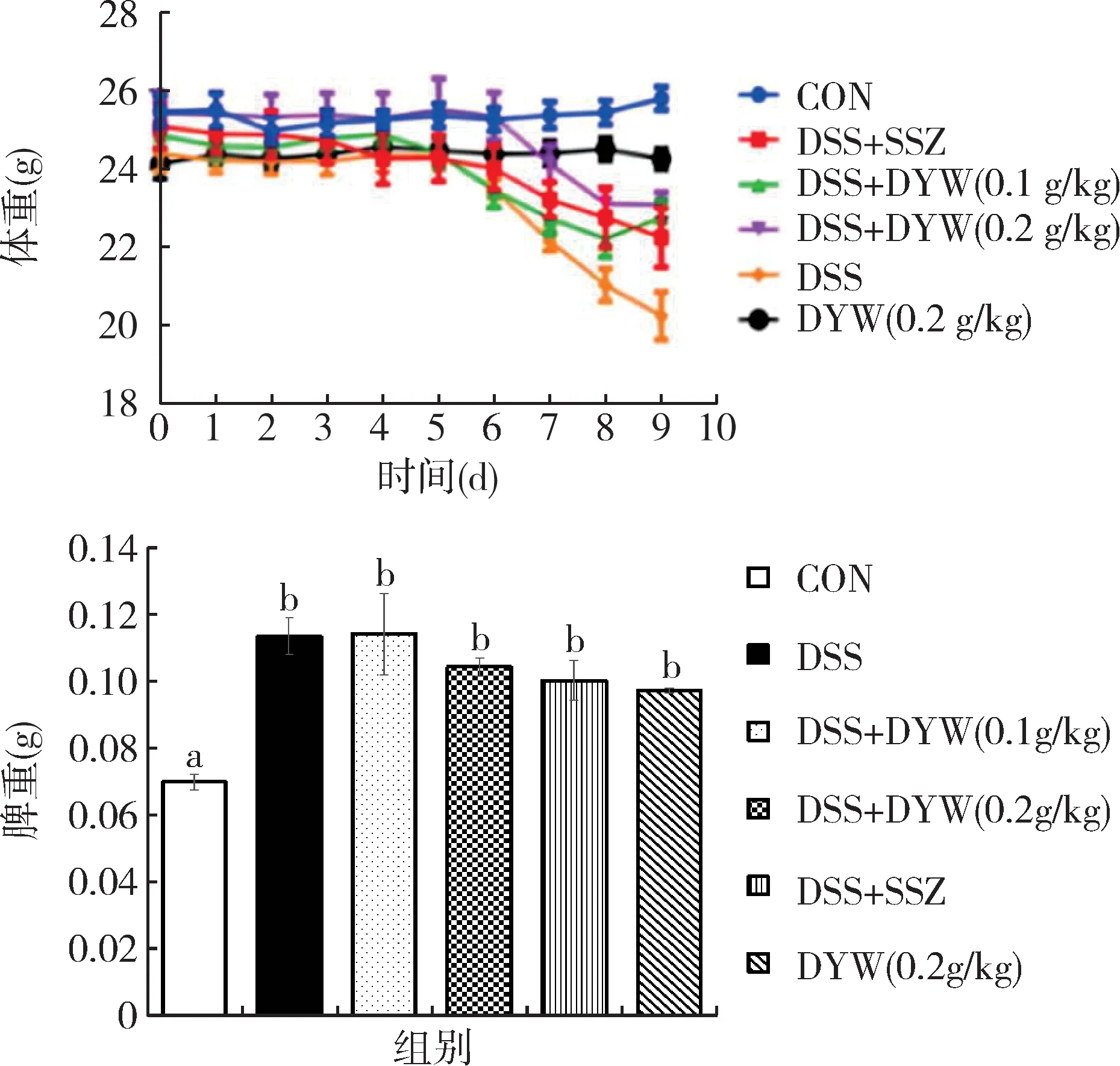
图1 不同组小鼠的体重和脾重Fig.1 Weight and spleen weight of mice in different groups
3.3 独一味对DSS诱导的UC小鼠结肠长度的影响
通过图2可看出,与空白对照组相比,DSS处理组小鼠结肠长度由7.767 0±0.496 7 cm明显缩短至4.775 0±0.442 5 cm(P<0.01)。与模型组比较,独一味低剂量组结肠长度回升到6.200 0±0.395 0 cm(P<0.01);独一味高剂量组结肠长度回升到6.291 7±0.080 1 cm(P<0.01),高于低剂量组但差异不显著;柳氮横吡啶阳性对照组无显著差异。
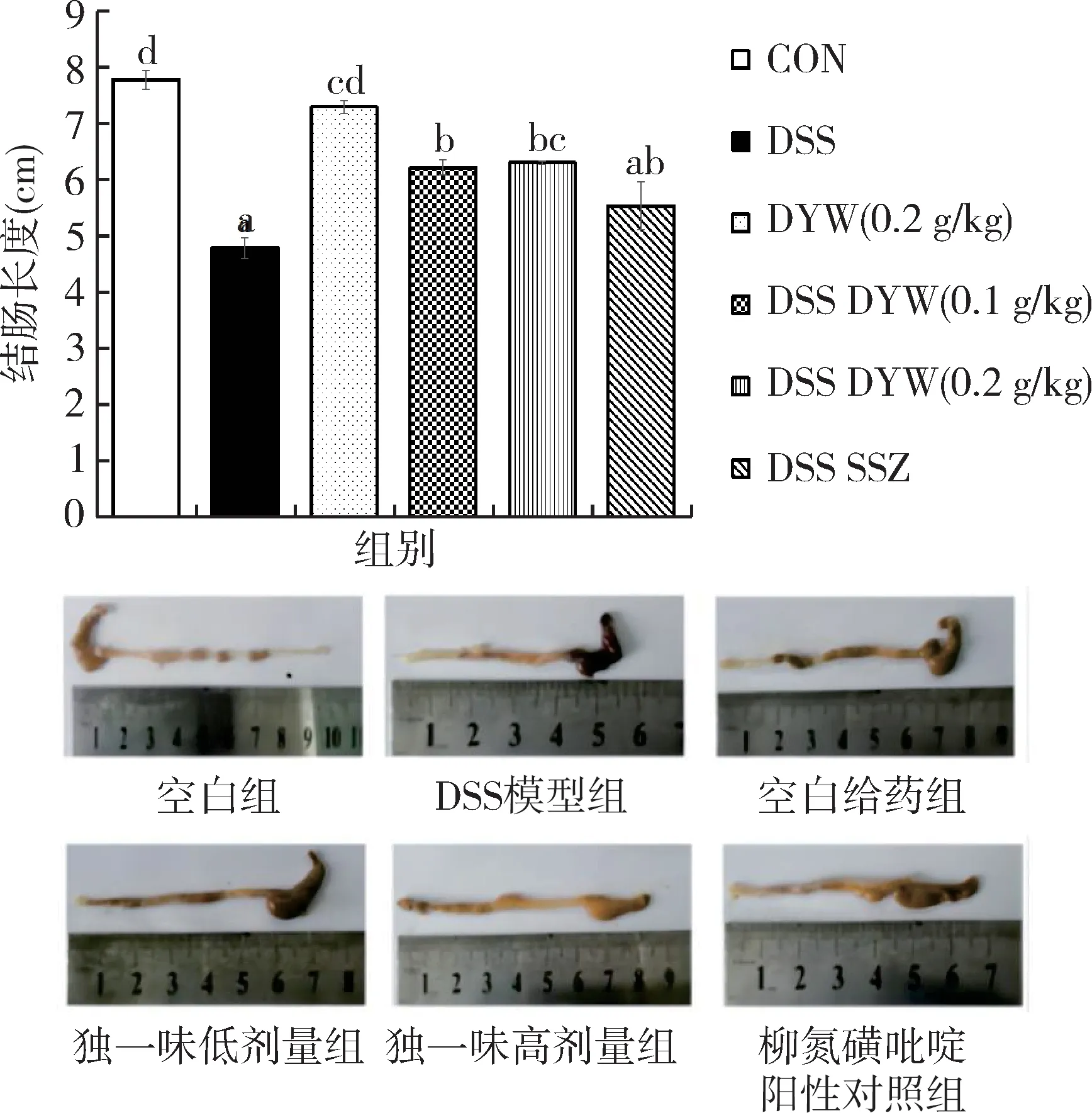
图2 不同组小鼠结肠长度(上)及外观(下)Fig.2 Colon length(upper)and appearance(lower)of mice in different groups
从结肠外观情况看,空白组及空白给药小鼠结肠组织状况良好,未出现充血溃烂等情况。而模型组小鼠结肠可明显看到出血情况,肠腔内粪便淤积,结肠明显缩短和扭曲,且模型组多数小鼠的结肠黏膜纹理破坏。各治疗组小鼠出现不同程度的肠黏膜充血,严重程度较模型组减轻,其中独一味高剂量组小鼠结肠恢复状况最好。
3.4 独一味对DSS诱导的UC小鼠结肠组织病理变化的影响
图3为小鼠结肠组织HE染色结果,可以发现对照组小鼠的结肠组织无损伤现象,结肠结构保持完整,没有出现炎症细胞的浸润;与对照组相比,模型组表现出典型的溃疡性结肠炎病理变化,出现黏膜损伤,大量中性粒细胞、淋巴细胞浸润腺上皮,独一味低剂量组、独一味高剂量组和柳氮磺吡啶阳性药组小鼠结肠组织中溃疡程度明显改善,炎性细胞浸润也显著减少。并且独一味高剂量组的炎性细胞浸润程度较轻于独一味低剂量组。
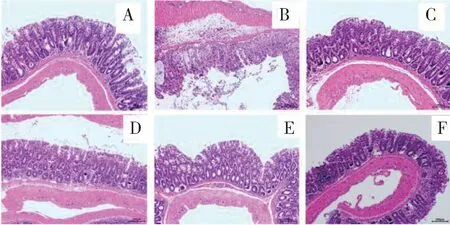
图3 小鼠结肠组织HE染色病理学变化Fig.3 Pathological changes of colon tissue in mice by HE staining
3.5 独一味对DSS诱导的UC小鼠中血清炎症因子的影响
采用ELISA法测定小鼠血清中TNF-α、IL-1β、IL-6炎症因子表达水平。结果如图4所示,与对照组相比,DSS组小鼠各炎症因子水平明显高于对照组,TNF-α水平由114.40±35.27显著升高至211.27±40.60,IL-1β水平由652.30±165.20显著升高至1 101.22±136.77,IL-6水平由295.75±56.15显著升高至471.12±42.37(差异均有统计学意义P<0.05)。与DSS组比较,独一味低、高给药组血清中TNF-α、IL-1β、IL-6水平显著降低,独一味低剂量组TNF-α水平显著下降到94.19±18.35,IL-1β水平显著下降至751.46±112.14,IL-6水平显著下降至299.46±42.37,独一味高剂量组TNF-α水平显著降低到108.64±43.28,IL-1β水平显著下降至573.61±131.88,IL-6水平显著下降至288.28±40.40(差异均有统计学意义P<0.05)。与DSS组比较,柳氮磺吡啶阳性药组各炎症因子表达水平均显著下降(P<0.05),和独一味低、高给药组差异不显著(P>0.05)。
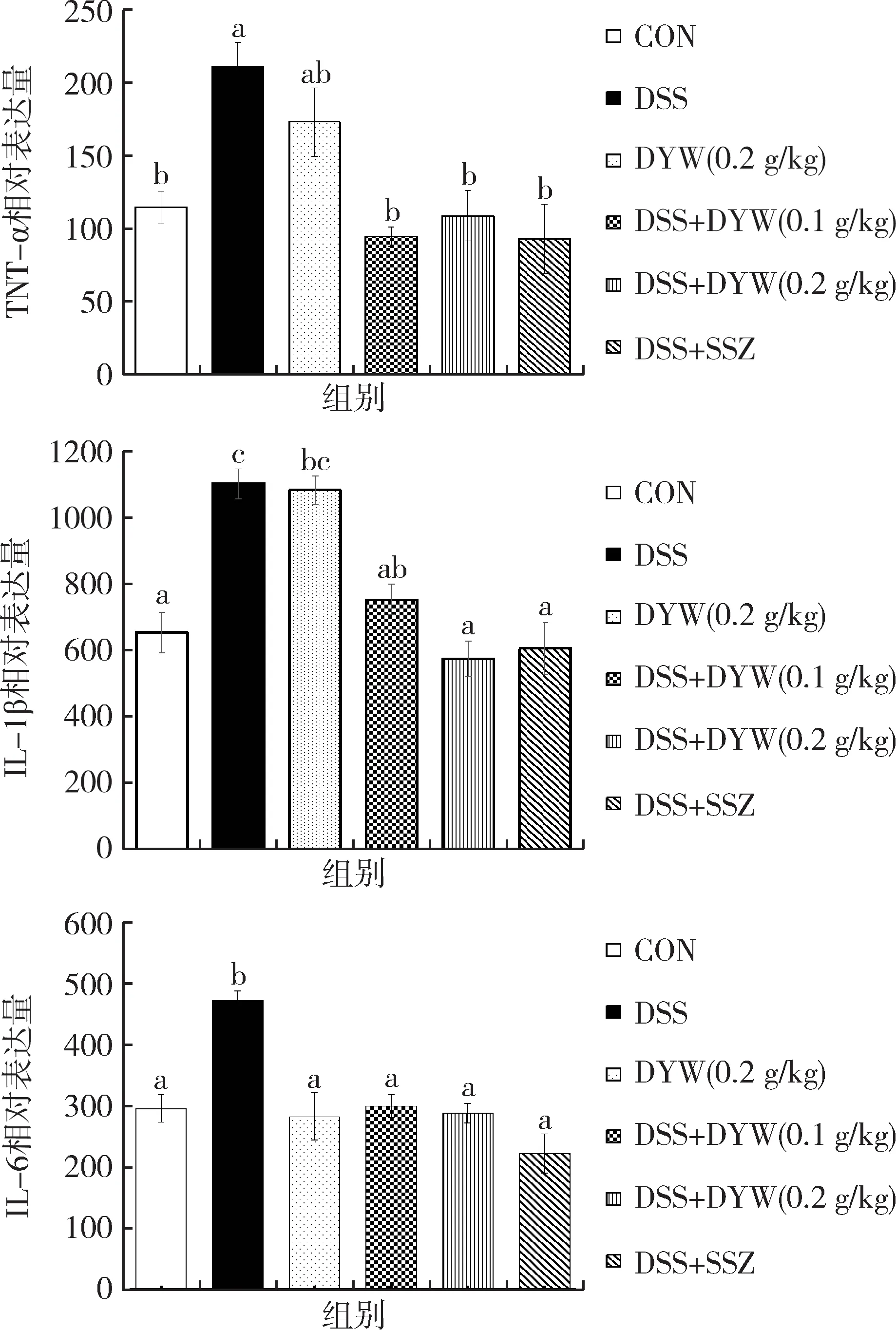
图4 不同组小鼠血清中TNF-α、IL-1β、IL-6相对表达量Fig.4 Relative expression of TNF-α、IL-1β、IL-6 in serum of different groups of mice
3.6 独一味对DSS诱导的UC小鼠结肠组织中NFκB mRNA表达的影响
利用qRT-PCR检测分析小鼠结肠组织中的NF-κBmRNA表达水平,结果如图5所示,与对照组比较,模型组小鼠结肠组织中NF-κBmRNA表达水平显著升高,模型组NF-κBmRNA表达水平由1.00 0±0.413 4显 著 升 高 至3.575 8±0.0.666 7(P<0.05);与模型组比较,独一味低剂量组、独一味高剂量组和阳性对照组NF-κB表达水平都显著降低,分别显著降低至1.754±0.498 6、1.664±0.491 3和2.026 4±0.269 0(P<0.05)。
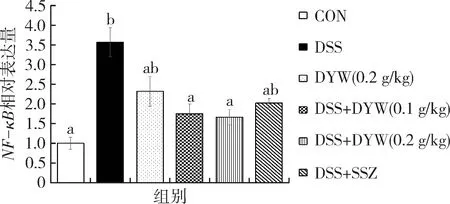
图5 不同组小鼠结肠组织中NF-κB mRNA相对表达量Fig.5 Relative expression of NF-κB mRNA in colon tissue of different groups of mice
4 讨论
4.1 柳氮磺吡啶阳性对照组的选择
抗溃疡性结肠炎试验中,增加柳氮磺吡啶阳性对照组,可以更明确所研究新药物的有效性。邓代霞等[28]在研究鱼腥草对溃疡性结肠炎的保护作用和机制试验中,以美沙拉嗪肠溶片作为阳性组,表现出较高的抗UC疗效。陈玉杰[29]在探讨蒲公英水提物对溃疡性结肠炎的治疗作用时,选择柳氮磺吡啶作为阳性组,同样表现出很高的抗UC疗效。柳氮磺吡啶属于5-氨基水杨酸制剂代表药物,在肠道微生物的作用下,可以分解为5-氨基水杨酸和磺胺吡啶,从而保护肠道微生物环境,抑制炎症因子的表达[30-31]。本试验中选择柳氮磺吡啶作为阳性药物,有效缓解了UC小鼠的体重下降、结肠长度缩短、结肠溃疡性程度加深及炎症因子表达水平的上升,通过本研究再次证明了其抗UC疗效。
4.2 溃疡性结肠炎模型小鼠的建立
研究药物对溃疡性结肠炎小鼠是否具有改善和保护作用,关键在于UC模型的成功建立。李曦等[32]采用对2,4-二硝基苯磺酸(2,4-Dinitrobenzene sulfonic acid,DNBS)成功诱导构建UC大鼠模型,诱导后的UC大鼠出现结肠水肿溃烂、炎症因子显著上调等症状。杨显娟等[33]通过2,4,6-三硝基苯磺酸(2,4,6-Trinitrobenzene sulfonilc acid,TNBS)也成功诱导了UC大鼠模型。本试验选择DSS诱导UC小鼠,其机制为首先破坏结肠组织上皮细胞,致使结肠组织上皮屏障破坏,导致结肠粘膜通透性增加,以允许抗原、肠腔内细菌、促炎物质等进入黏膜或黏膜下层,从而引发炎症[34]。试验结果发现,DSS诱导的UC模型组小鼠出现便血、腹泻、毛发脱落、体重下降等临床表现,这些症状与人类UC特征基本相似[35];结肠长度明显缩短,结肠组织表现出明显的黏膜损伤、大量中性粒细胞、淋巴细胞浸润腺上皮,都明显表现出UC症状。经研究表明,促炎因子表达量的增加是引发溃疡性结肠炎的主要因素[36-37]。而TNF-α、IL-1β、IL-6等炎症因子主要由NF-κB信号通路介导,细胞因子NF-κB被激活后可以诱导TNF-α、IL-1β、IL-6因子的大量表达,肠粘膜被破坏溃烂,引发炎症[38-40]。本试验中DSS模型小鼠血清中TNF-α、IL-6、IL-1β及NF-κBmRNA表达水平升高,再次表明本试验中DSS成功诱导了小鼠溃疡性结肠炎模型。利用DSS诱导的溃疡性结肠炎症状具有操作简便、成功率高及重复性强的优点,并且与人类UC的症状极为相似,可对于深入阐明UC的发病机制及寻找有效治疗药物具有重要的作用。
4.3 独一味对溃疡性结肠炎症状的改善及其机制研究
本试验中,UC小鼠在给予独一味治疗后,其小鼠体重的下降、结肠长度的缩短、结肠溃疡性程度等UC症状均有不同程度的改善,并且独一味高剂量组相较于低剂量组改善效果更好,可能独一味对UC的治疗作用具有一定的量效关系。但独一味治疗组小鼠脾重相较于模型组并未发生显著变化,同时与空白给药组和阳性对照组也无显著差异,这种现象可能是由于小鼠体重不同造成脾脏肥大也不同所造成的。独一味给药组还能显著降低DSS模型小鼠TNF-α、IL-1β、IL-6的含量及NF-κBmRNA的表达水平。证明独一味可以很好的改善UC症状,并且是通过抑制NF-κBmRNA表达,进而抑制促炎性细胞因子的分泌,达到改善溃疡性结肠炎症状,这与丁香[41]、苦豆子[42]等药材抗UC机制相似。本研究为独一味预防UC等相关药品的开发提供了理论基础,但独一味对治疗UC小鼠的适宜剂量还有待进一步研究。
5 结论
独一味可以改善UC小鼠的体重变化、抑制结肠缩短,降低结肠病理评分和炎症因子的分泌,其机制与抑制NF-κB信号通路有关。
