薄层色谱与QuEChERS-气相色谱-串联质谱法测定2种食根蔬菜中5种酰胺类除草剂残留量
2022-09-30方海仙耿慧春陈兴连普娅丽刘宏程
方海仙, 耿慧春, 陈兴连, 普娅丽, 刘宏程*
(1.云南省农业科学院质量标准与检测技术研究所,云南昆明 650205;2.农业农村部农产品质量监督检验测试中心(昆明),云南昆明 650205;3.元江县农产品质量安全检测站,云南元江 653300)
本课题组前期研究[1,2]中采集的26个土壤样品中酰胺类除草剂阳性样品比率为42%。洋葱和大蒜可食用部分生长在地下,该类蔬菜根系可能从土壤中吸收残留的农药[3]。这两种蔬菜富含蒜氨酸类物质,在完整的细胞中蒜氨酸以稳定的形式存在于细胞质中,能分解蒜氨酸的蒜酶存在于液泡中,有细胞膜作为屏障两者无法接触,但当细胞遭到粉碎等破坏时,蒜氨酸与蒜酶接触发生反应生成大量含硫化合物[4 - 6],因此,农药残留测定需要的粉碎均质样品含有大量含硫化合物,这类化合物性质与农药相近,且含量远远高于农药含量,在农药残留测定时造成很强的背景干扰。为了大蒜和洋葱质量控制,酰胺类除草剂残留测定方法的建立尤其重要。
目前,关于洋葱和大蒜中农药的多残留检测方法主要有气相色谱法(GC)、液相色谱法(LC)、气相色谱-质谱联用法(GC-MS)及气相色谱-串联质谱法(GC-MS/MS)等。其中,GC-MS/MS[7,8]具有快速、准确和灵敏等优点,适用于基质较复杂的痕量化合物分析。QuEChERS方法由美国农业部的Aanstassiades等人[9]提出,由于具有快速、简单、经济、高效、抗干扰和安全的优点,被广泛应用于水果、蔬菜及其他基质农药残留分析中。近年来新型碳纳米材料的开发与应用成为研究的热点,如石墨烯,多壁碳纳米管[10 - 15](Multiwalled carbon nanotubes,MWCNTs)。其中MWCNTs由于具有与众不同的机械性能、电子性能、化学性质和较大的比表面积的优点,引起众多科学研究领域的关注并得到了广泛的应用。MWCNTs对有机物具备优于其他吸附材料的吸附能力[16],在农药残留前处理过程中逐步得到应用。
本研究选用土壤中检出率较高的乙草胺、甲草胺、异丙甲草胺、丁草胺和丙草胺5种酰胺类除草剂为研究对象,建立其在洋葱和大蒜中残留分析方法。该方法结合薄层色谱显色,分析目标化合物测定的干扰物,对净化条件进行筛选,优化前处理和检测条件,建立QuEChERS-GC-MS/MS测定洋葱和大蒜中5种酰胺类除草剂的分析方法。
1 实验部分
1.1 主要仪器与试剂
TRACE 1310 TSQ 8000型气相色谱-三重四极杆质谱仪(配有电子轰击电离(EI)源和AL 1310型自动进样器)(美国,Thermo Scientific公司);HY-5A振荡器(金坛市科析仪器有限公司);旋转蒸发仪(德国,海道尔夫公司);电子天平(沈阳龙腾电子有限公司);水浴氮吹仪(美国,Organomation N-EVAP公司)。
标准品:乙草胺、甲草胺、异丙甲草胺、丁草胺和丙草胺(1 000 μg/mL,农业部天津环境保护科研监测所)。多壁碳纳米管(直径>50 nm,长度:0.5~2 μm,纯度>98%,中国科学院成都有机化学有限公司);乙二胺-N-丙基硅烷化硅胶(PSA)(40 μm,美国Varian公司);十八烷基硅烷键合硅胶(C18)(40 μm,美国Varian公司);石墨化碳黑(GCB)(40~120 μm,迪马科技);弗罗里矽(Florisil)固相萃取柱(1 g/6mL,美国Supelco公司);正己烷(色谱纯,美国J.T.Baker公司);乙腈(分析纯,国药集团化学试剂有限公司)。NaCl、无水Na2SO4(分析纯,国药集团化学试剂有限公司);乙腈-HAc(99∶1,V∶V):移取10 mL冰HAc加入990 mL乙腈中,混匀。
硅胶G板(20 cm×20 cm,青岛海洋化工),点样毛细管(100 mm×0.3 mm,华西医科大学仪器厂),薄层色谱展开缸(100 mm×200 mm)。改良碘化铋钾显色剂:(A)取碱式硝酸铋0.85 g,加冰HAc 10 mL与水40 mL溶解;(B)取KI 8 g,加水20 mL溶解。将A、B溶液混合,摇匀,即可。
1.2 样品前处理
称取10 g(精确至0.01 g)匀浆后的样品至50 mL带盖聚丙烯离心管中,洋葱样品加入10.0 mL HAc-乙腈,大蒜样品加入10.0 mL乙腈、2 g NaCl,涡旋振荡器涡旋10 s,振荡提取30 min,以5 000 r/min离心10 min,得到提取液。取6.0 mL洋葱提取液于预先加入150 mg PSA+12 mg MWCNTs+ 36 mg GCB填料的离心管中,取6.0 mL大蒜提取清液于预先加入270 mg PSA+24 mg MWCNTs+ 12 mg C18填料的离心管中,涡旋振荡器涡旋10 s,取上清液4.0 mL,置于烧杯中,水浴加热并通入氮气,吹干溶剂,加入2.0 mL丙酮溶解,在涡旋振荡器上涡旋10 s,过0.22 μm滤膜,待分析。
1.3 溶液的配制及标准曲线的绘制
1.3.1 标准储备溶液分别移取乙草胺、甲草胺、异丙甲草胺、丁草胺和丙草胺1.0 mL,用正己烷定容至25.0 mL,配制成单一标准储备溶液,贮存在-20 ℃冰箱中。准确吸取一定体积各单一标准储备液,用正己烷定容至25.0 mL,得到5种酰胺类除草剂的混合标准溶液,贮存在-4 ℃冰箱中备用。
1.3.2 标准曲线绘制取匀浆后的洋葱和大蒜样品,按“1.2”方法进行前处理,分别制得空白洋葱和大蒜基质溶液。将上述混合标准溶液用空白洋葱基质和空白大蒜基质溶液稀释成0.02、0.1、0.2、1.0、2.0 μg/mL的系列混合标准溶液。按“1.4”条件测定,采用外标法定量。以标准溶液的峰面积(Y)为纵坐标,质量浓度(X,μg/mL)为横坐标绘制工作曲线。
1.4 检测条件
1.4.1 色谱条件色谱柱:DB-17ms石英毛细管柱(30 m×0.25 mm×0.25 μm);载气:高纯氮气(纯度≥99.999%),恒流模式,柱流速为1.0 mL/min;进样量:1.00 μL,不分流进样,进样口温度:230 ℃;柱温升温程序:初始温度70 ℃,保持1 min,以15 ℃/min升至200 ℃,以5 ℃/min升至260 ℃,保持10 min。
1.4.2 质谱条件电离方式:EI源;离子源温度:300 ℃;质谱传输线温度:280 ℃;电离能量:70 eV;碰撞气:高纯氩气(纯度≥99.999%);扫描模式:选择离子扫描。
2 结果与讨论
2.1 薄层色谱鉴别
分别取40 μg/mL甲草胺、乙草胺、丙草胺、丁草胺、异丙甲草胺标准溶液2.5 mL,氮气吹干后,加入100 μL丙酮复溶,得到1.0 mg/mL供试标准品溶液。分别称取匀浆后大蒜样品和洋葱样品各10 g,加入20 mL乙腈,4 g NaCl,涡旋混匀1 min,振荡提取30 min后,5 000 r/min离心3 min,使乙腈相与水相分层,取2.0 mL上清液,氮气吹干,加入100 μL丙酮复溶,即得。
以正己烷-丙酮(4∶1)为展开剂,展开后,取出晾干。碘化铋钾显色(图1)。由图1a可知,5个化合物碘化铋钾,反应显红色,得到的斑点清晰,其中异丙甲草胺比移值Rf=0.46,甲草胺、乙草胺和丙草胺的为Rf=0.53,丁草胺为Rf=0.63,基于此,与样品对比时,选择乙草胺作为代表。
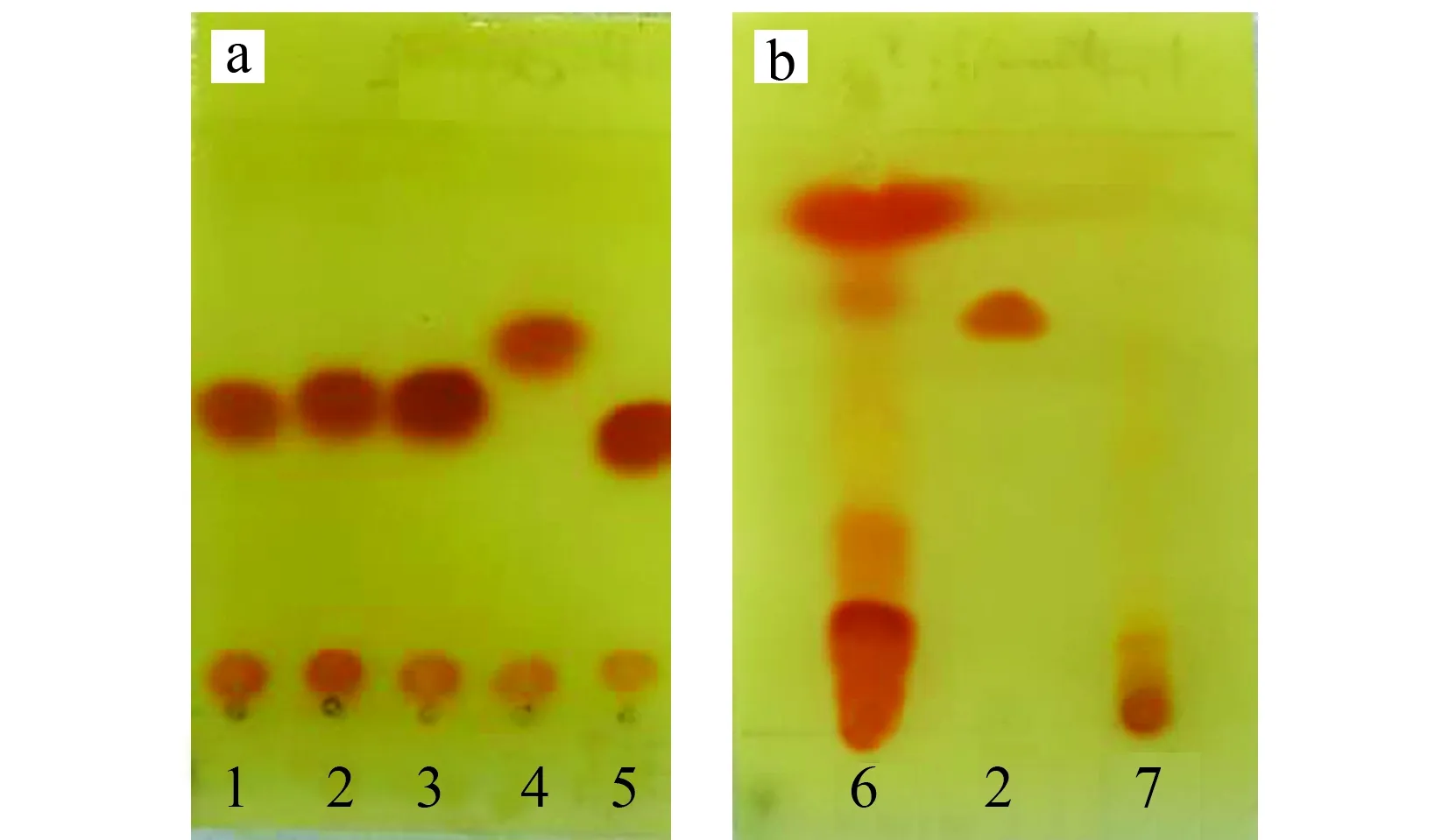
图1 标准品和样品薄层色谱图Fig.1 Thin layer chromatogram(TLC) of standard (a) and sample (b)1.alachlor;2.acetochlor;3.pretilachlor;4.butachlor;5.metolachlor;6.garlic;7.onion.
由图1b可知,大蒜成分复杂,对5种化合物测定干扰较大,在5个目标化合物附近,有较大不成型的斑点,而洋葱相对干扰较小,因此,残留测定时前处理过程尤其重要。
2.2 质谱条件的优化
配制2.0 μg/mL的目标化合物标准溶液在m/z50~550范围内进行全扫描,根据色谱图及全扫描谱图,得出各目标农药的保留时间后,采用Auto SRM模式进行质谱条件优化,得到母离子全扫描谱图,选择分子离子峰或相对丰度较高的特征碎片峰作为母离子,锁定母离子后,采用离子扫描方式进行二级质谱分析,获得子离子全扫描谱图,选择丰度较高的合理断裂碎片离子作为子离子,在Targeted模式下优化碰撞能量,选择离子丰度最高、基质干扰最小的三个离子对作为特征离子对,其中响应最高的离子对作为定量离子,最终确定的母离子、子离子和碰撞能量详见表1。
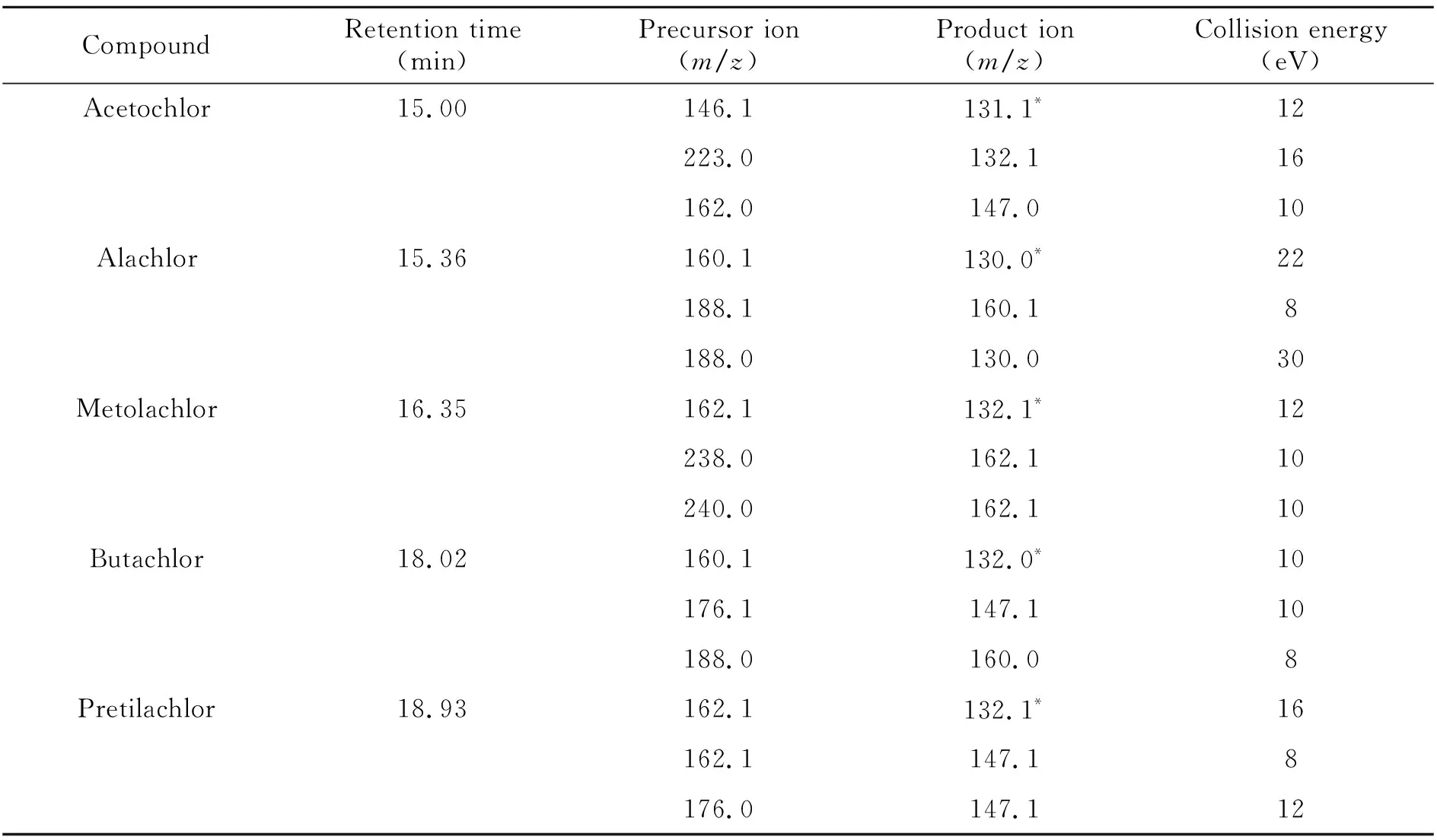
表1 目标化合物多反应监测(SRM)质谱参数
2.3 提取溶剂的优化
传统QuEChERS[18]方法采用乙腈或者乙腈-HAc溶液(99+1)为提取溶剂;正己烷提取极性较小的农药,具有较高的提取效率。本实验的5种酰胺类除草剂的极性较弱,因此,比较了乙腈、乙腈-HAc溶液(99+1)、正己烷三种溶剂的提取效率。结果表明:用正己烷和乙腈提取洋葱中目标农药时,回收率偏高,用乙腈-HAc提取时,回收率在93%~105%之间,因此,洋葱基采用乙腈-HAc为提取溶剂。而在大蒜中,用正己烷提取目标农药时,提取效率低,回收率偏低,乙腈-HAc提取时,回收率偏高,乙腈提取时,回收率在101%~105%之间,因此,大蒜采用乙腈为提取溶剂。
2.4 净化条件的选择
2.4.1 PSA用量洋葱[19]中含有葡萄糖、木糖、半乳糖等多糖,以及咖啡酸、芥子酸和阿魏酸等有机酸;大蒜[20]中含有葡萄糖、半乳糖和果糖等单糖,蔗糖、果糖和棉子糖等低聚糖,半乳聚糖、杂果聚糖和果聚糖等多聚糖,这些物质在前处理过程中的不进行净化,后续过程会产生较大的干扰。为了获得最佳的净化效果及回收率,在添加浓度为0.1 mg/kg三个平行样品每毫升提取液净化过程中加入不同量的PSA(15 mg,25 mg,35 mg,45 mg,55 mg),比较不同用量的PSA对回收率的影响。
从图2和图3可以看出:洋葱中随着PSA的增多,5种目标农药有明显的吸附作用,回收率下降,为满足回收率的要求选择25 mg/mL作为PSA的量;大蒜中随着PSA用量的增加,丙草胺的回收率升高,其余4种目标农药基本不吸附,当PSA用量为45 mg/mL时,丙草胺的回收率最低为110%,因此,大蒜基质中选择PSA的用量为45 mg/mL。
2.4.2 MWCNTs用量MWCNTs是一种良好的吸附材料,可通过π-π作用力和分子间相互作用力[21]等方式与目标物结合,可有效去除色素、疏水性物质,具有较好的净化效果。为了获得最佳的净化效果及回收率,在添加浓度为0.1 mg/kg的3个平行样品每毫升提取液净化过程中加入不同量的多壁碳纳米管(2 mg,4 mg,6 mg,8 mg,10 mg),比较不同用量的MWCNTs对净化效果及回收率的影响(图2,图3)。结果表明,洋葱中随着MWCNTs用量增加,对目标农药依旧没有明显吸附作用,回收率偏高,当添加量为2 mg/mL时,已经满足回收率要求;大蒜中回收率偏高,当用量为4 mg/mL时满足回收率要求。因此,最终确定MWCNTs的用量为洋葱选2 mg/mL,大蒜选4 mg/mL。
2.4.3 GCB用量GCB去除类胡萝卜素、叶绿素等色素化合物,洋葱基质富含矢车菊色素和飞燕草色素等花青素类色素[22],使提取液颜色较深。为了获得最佳的净化效果及回收率,在添加浓度为0.1 mg/kg 3个平行样品每毫升提取液净化过程中加入不同量的GCB(2 mg,4 mg,6 mg,8 mg,10 mg),比较不同用量的GCB对净化效果及回收率的影响。图2可以看出,GCB对异丙甲草胺的影响较大,回收率偏高,综合其他几种农药的回收率,最终确定洋葱中GCB的用量为6.0 mg/mL。
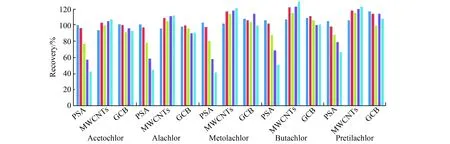
图2 不同净化材料对洋葱基质中5种农药的添加回收率影响Fig.2 Effect of different purification materials on recovery of 5 pesticides for extraction of onion
2.4.5 C18用量C18用于去除脂肪和脂类等非极性化合物。大蒜中含有中性脂质、糖脂和磷脂等脂类化合物[20],对农药残留分析造成了较大的干扰,为了获得最佳的净化效果及回收率,在添加浓度为0.1 mg/kg三个平行样品每毫升提取液净化过程中加入不同量的C18(2 mg,4 mg,6 mg,8 mg,10 mg),比较不同用量的 C18对净化效果及回收率的影响。图3可以看出:当C18用量为2 mg/mL时,5种目标农药的回收率已经满足要求,因此,最终确定大蒜中C18用量为2 mg/mL。
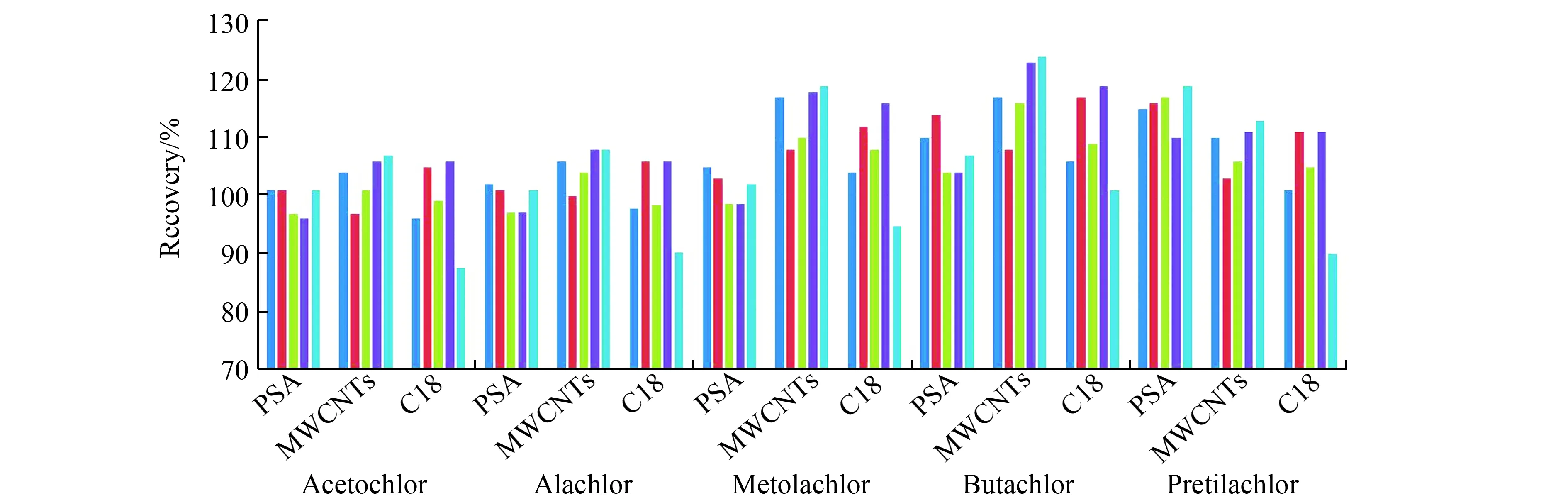
图3 大蒜基质不同净化材料对5种农药的添加回收率影响Fig.3 Effect of different purification materials on recovery of 5 pesticides for extraction of garlic
综上所述,为了使前处理方法的净化效率达到最佳,同时保证回收率、降低成本,确定洋葱每毫升提取液中加入25 mg PSA + 2 mg MWCNTs + 6 mg GCB,大蒜样每毫升提取液中加入45 mg PSA + 4 mg MWCNTs + 2 mg C18。
2.5 基质效应
分别配制相同浓度梯度的溶剂标准溶液和基质标准溶液,两者采用同一个混合标准溶液进行稀释配制,仅配制溶剂不同。溶剂标准溶液采用纯溶剂进行配制,基质标准溶液采用前处理方法制备好的空白洋葱和大蒜基质溶液进行配制,基质效应按照文献方法[17]进行计算。结果列于表2。
5种农药在优化色谱和质谱条件下的定量离子图如图4所示。
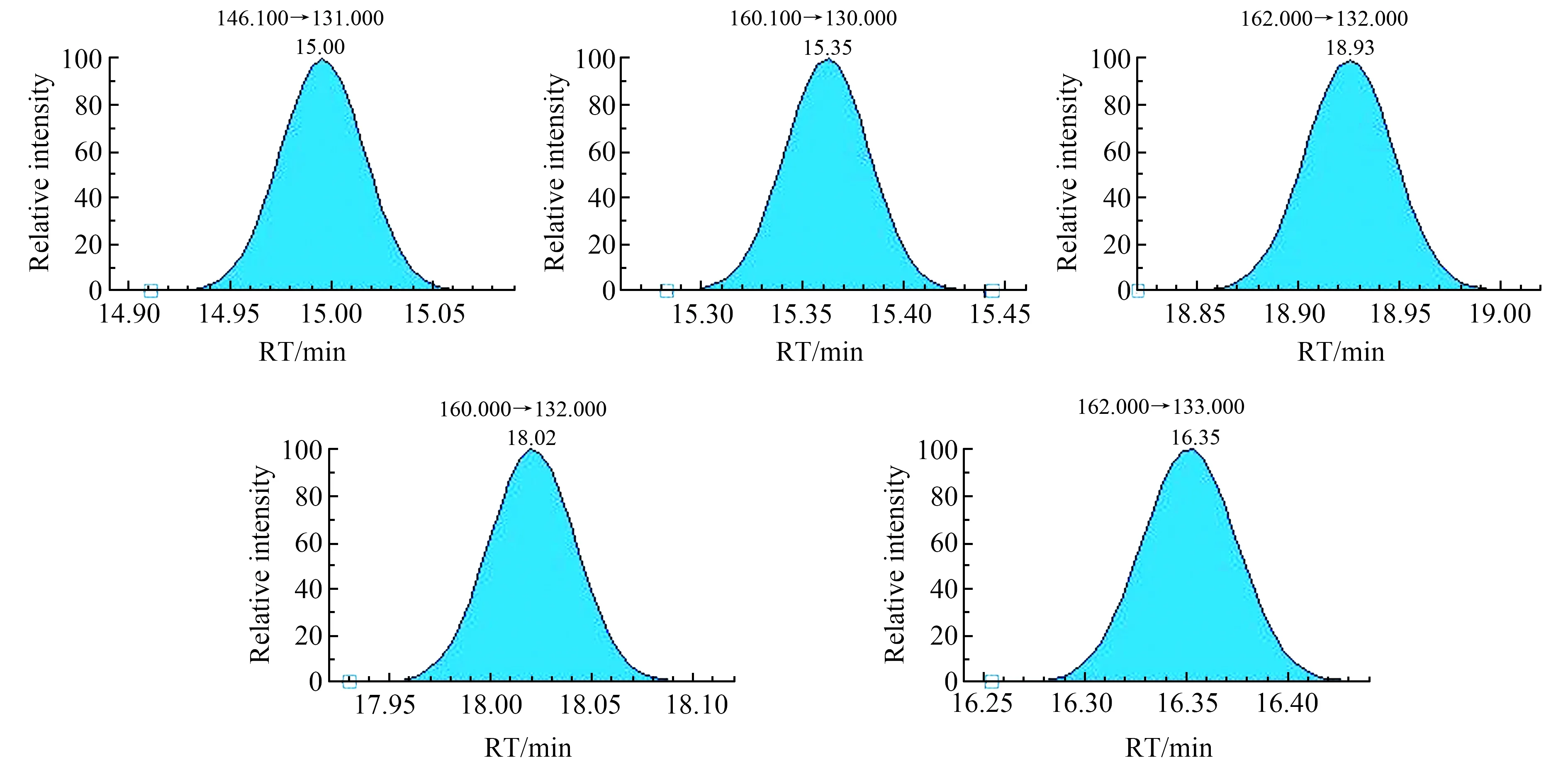
图4 5种农药定量离子Fig.4 Quantification ion of five pesticides1.acetochlor;2.alachlor;3.metolachlor;4.butachlor;5.pretilachlor.
2.6 方法的线性范围和定量限
在0.02~2.0 μg/mL线性范围内,以5种农药的质量浓度与对应的峰面积进行线性回归分析,如表2所示。以3倍信噪比(S/N=3)计算检出限(LOD),以10倍信噪比(S/N=10)计算定量限(LOQ)。5种酰胺类除草剂的线性关系良好,检出限均为0.0075 mg/kg,定量限均为0.025 mg/kg。
从表2可以看出,5种目标农药在洋葱样品中都表现出弱基质抑制效应,且基质效应不明显;在大蒜样品中表现为基质增强效应,其中乙草胺和甲草胺表现为弱基质增强效应,丙草胺、丁草胺和异丙甲草胺表现为中等基质增强效应。因此,准确定量时,需要配制基质标准溶液来进行。
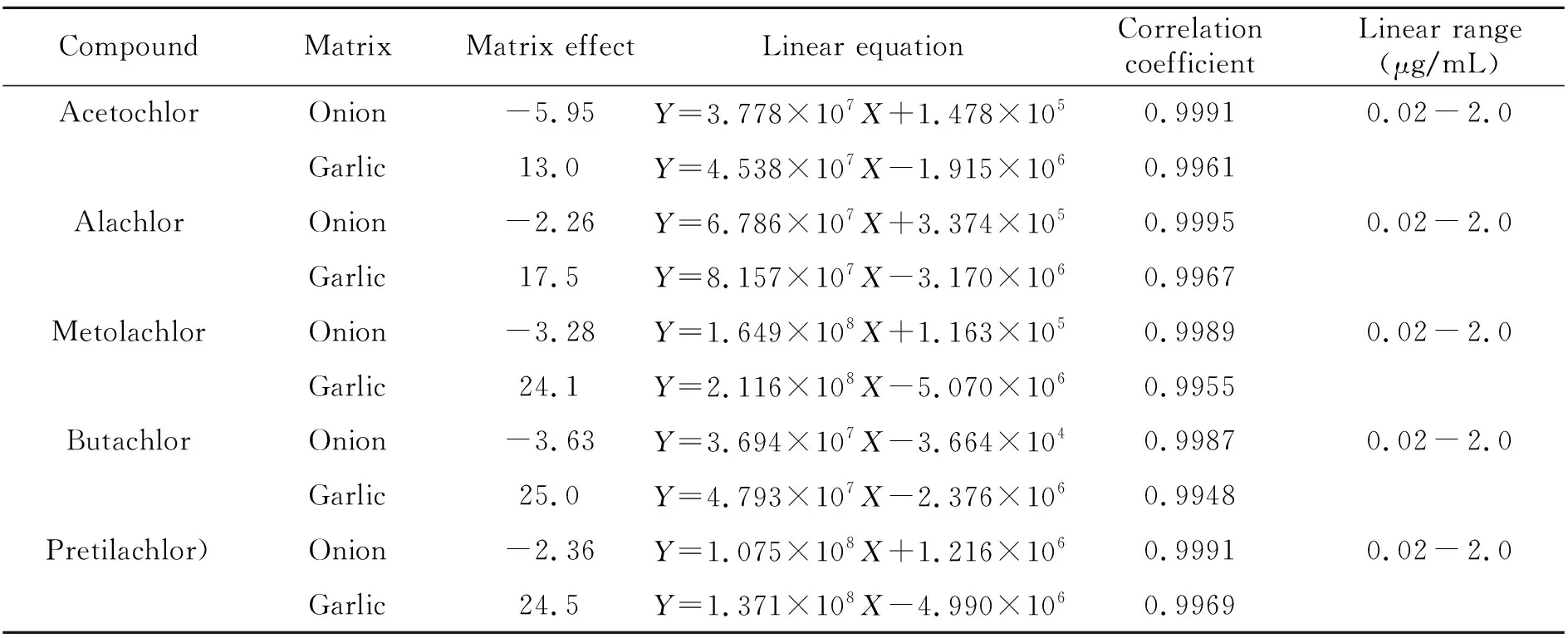
表2 5种酰胺类除草剂的基质效应、线性方程、相关系数和线性范围
2.7 方法的准确度和精密度
分别称取不含5种酰胺类除草剂残留的洋葱和大蒜样品各19份,每份10.00 g,其中1份为对照,另外18份样品分为3组,每组6份。第1组每份均加入5种酰胺类除草剂混合标准溶液,使样品中5种酰胺类除草剂的含量为0.025 mg/kg;第2组添加5种酰胺类除草剂混合标准溶液后的含量为0.1 mg/kg;第3组添加5种酰胺类除草剂混合标准溶液后的含量为0.25 mg/kg,分别将上述样品充分混匀,放置30 min。在最优前处理条件和仪器条件下,进行回收率和精密度试验,每个添加水平做6个平行样品,计算平均回收率和相对标准偏差(RSD),结果如表3所示。
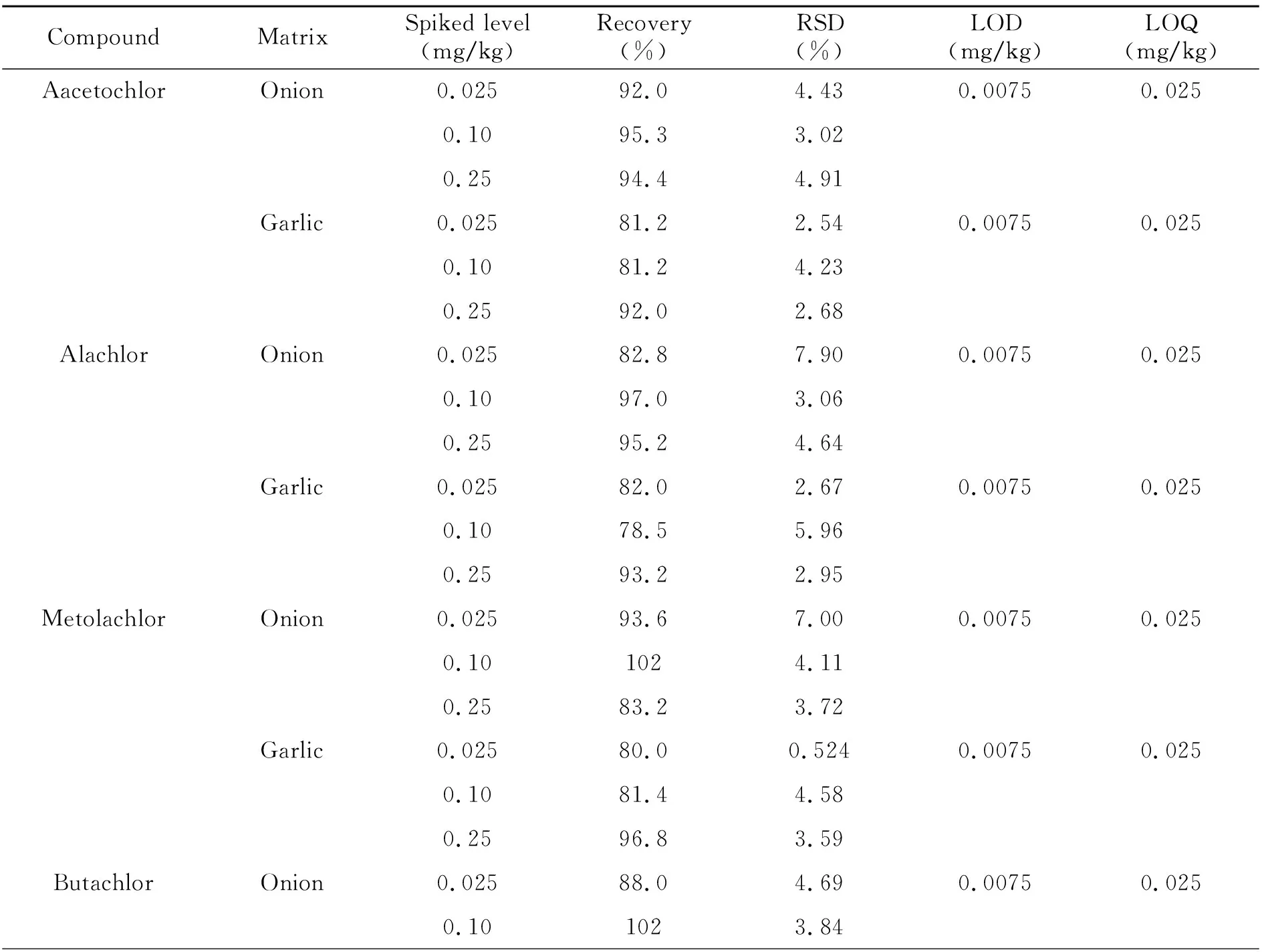
表3 5种酰胺类除草剂的回收率、精密度、检出限、定量限
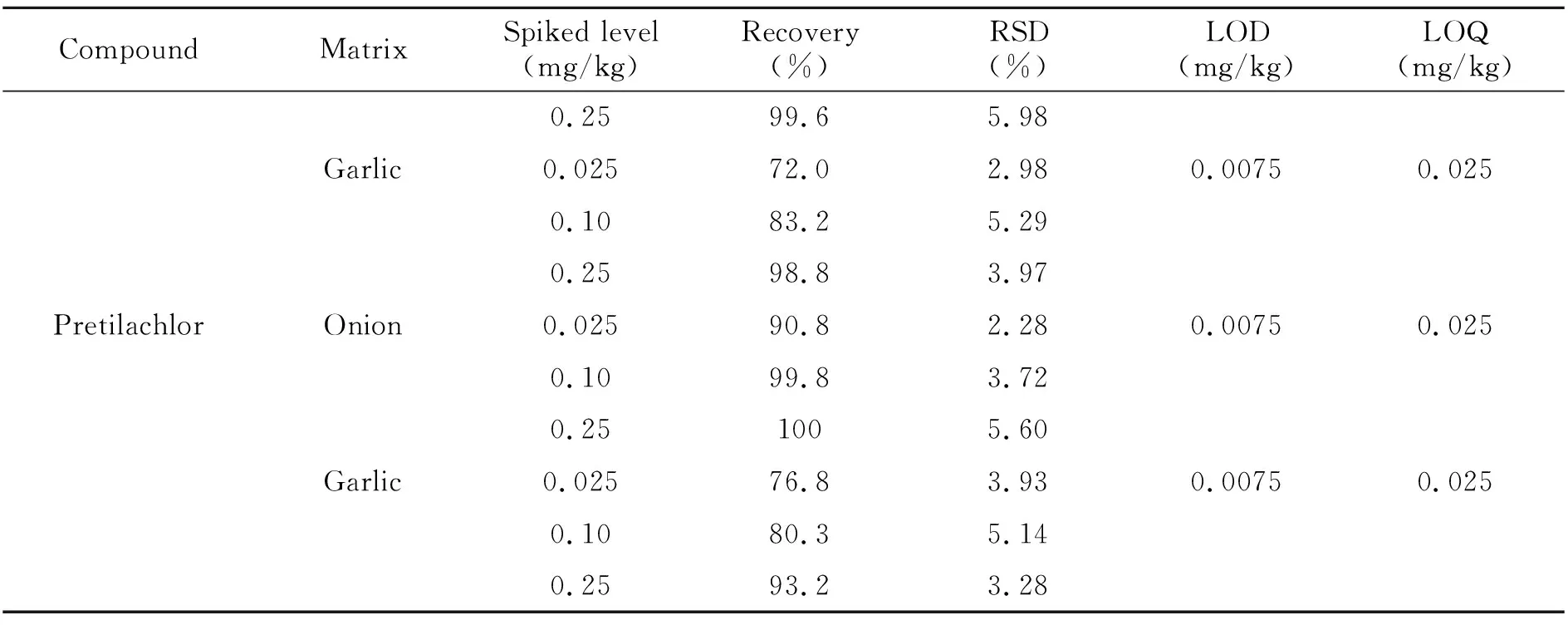
(续表3)
5种酰胺类除草剂在洋葱中的平均回收率为82.8%~102%,RSD为2.08%~7.90%,大蒜中平均回收率为72%~98.8%,RSD为0.524%~5.96%,说明该方法能达到农药残留分析的要求。
3 结论
乙草胺、甲草胺、异丙甲草胺、丁草胺和丙草胺为常用的酰胺类除草剂,本课题组前期研究土壤时发现此类农药容易检出,大蒜和洋葱为食根蔬菜,该类蔬菜根系可能从土壤中吸收本来就残留的农药。因此,该类农药在大蒜和洋葱中检测方法的开发与应用尤其重要。通过优化展开剂配比、显色条件,对5种目标农药进行薄层色谱鉴别,碘化铋钾显色改良后,洋葱和大蒜提取液对5种目标农药干扰较大,因此,洋葱和大蒜前处理很重要。采用改良QuEChERS法进行前处理,优化前处理条件、色谱条件和质谱条件,实验结果显示,5种酰胺类除草剂加标回收率结果较好,精密度和重现性满足日常检测农药残留分析要求。
