姜黄素通过AMPK/FUNDC1缓解LPS诱导的心肌细胞损伤
2022-09-30武菲菲蒋书云谢文静
杨 帆 武菲菲 苏 洁 蒋书云 谢文静 金 屏
脓毒症(sepsis)导致的循环和细胞/代谢功能障碍及随之引发的心功能不全,目前仍无有效治疗策略[1,2]。脓毒症引起的病理性损伤主要包括氧化应激、心肌细胞凋亡及线粒体功能异常等[3]。FUNDC1(FUN14domain containing 1)作为受损线粒体清除的核心调节受体之一,对心肌损伤具有重要的保护作用[4]。AMPK/FUNDC1信号通路的激活可通过改善线粒体功能障碍,进而缓解高血糖症导致的心肌损伤,且FUNDC1对于LPS诱导的脓毒症小鼠心肌组织具有显著的保护作用[5]。然而,AMPK/FUNDC1信号通路在脓毒症导致的心肌细胞损伤的病理进程中的作用机制尚未阐明。
姜黄素是姜黄根茎的重要生物活性成分,对心肌梗死等心血管疾病具有显著的保护作用[6]。Zhang等研究证实,姜黄素可通过激活AMPK并保护线粒体功能,进而缓解高糖引起的心功能损伤[7]。此外,姜黄素对脓毒症诱导的心功能不全具有明确的保护作用[8]。然而,这种保护作用是否通过保护线粒体功能及是否通过AMPK/FUNDC1信号通路,尚未明确。
本研究拟建立脂多糖(lipopolysaccharide, LPS)诱导的原代心肌细胞损伤模型,探究姜黄素对线粒体功能的调节作用,及在脓毒症诱导的心肌细胞损伤中的重要作用,并进一步明确AMPK/FUNDC1信号通路在这种调节作用中的关键机制。
对象与方法
1.实验动物:所有涉及动物实验部分均遵循美国国立卫生研究院实验动物使用指南,按照3R原则,并由中国人民解放军空军军医大学福利与伦理委员会批准(批准号:20200447)。
2.试剂:姜黄素、线粒体自噬抑制剂3-Methyladenine(3-MA)及线粒体自噬激动剂SB-203580购自美国Med Chem Express公司;LPS购自美国Sigma-Aldrich公司;JC-1检测试剂盒购自上海碧云天生物技术有限公司;CCK-8细胞活力检测试剂盒购自南京建成生物工程研究所;ELISA检测试剂盒购自美国Cloud-Clone公司;一抗购自美国Cell Signaling公司及英国Abcam公司;二抗购自北京中山金桥公司;DMEM培养基、双抗、胎牛血清购自美国Hyclone公司;GAPDH抗体购自美国Cell Signaling公司。
3.细胞培养:1~3天龄的C57BL/6J乳鼠原代细胞以Pierce原代心肌细胞分离试剂盒分离(美国Thermo Fisher Scientific公司),并转移至高糖DMEM(dulbecco′s modified eagle medium)培养基中[9]。之后,混合细胞悬液并收集非贴壁细胞,将细胞转移至含青霉素(100U/ml)和链霉素(100μg/ml)与10%胎牛血清(fetal bovine serum,FBS)的DMEM培养基中,孵育培养备用。
4.LPS细胞损伤模型建立及分组:①对照(Con)组:NMCMS以高糖DMEM培养基培养;②curcumin处理(Cur)组:NMCMS以10nmol/L的Cur处理10h[10];③LPS组:NMCMS以100ng/ml的LPS处理12h[11];④Cur保护(LPS-Cur)组:NMCMS以100ng/ml的LPS处理2h,随后加入10nmol/L的Cur共同处理10h;⑤LPS-scramble siAMPK(LPS-Scr)组:NMCMS用AMPK scramble siRNA处理36h,随后加入100ng/ml的LPS共同处理12h;⑥LPS-scramble siAMPK-Cur(LPS-Cur-Scr)组:NMCMS用AMPK scramble siRNA处理36h,再加入100ng/ml的LPS处理2h,随后加入10nmol/L的Cur共同处理10h;⑦LPS-siAMPK-Cur(LPS-siAMPK-Cur)组:NMCMS用AMPK siRNA处理36h,再加入100ng/ml的LPS处理2h,随后加入10nmol/L的Cur共同处理10h;⑧LPS-siAMPK组:NMCMS用AMPK siRNA处理36h,随后加入100ng/ml的LPS共同处理12h;⑨LPS-Cur-3-MA处理(LPS-Cur-3-MA)组:NMCMS以10nmol/L 3-MA处理60h,随后加入100ng/ml的LPS处理2h,再加入10mmol/L的Cur共同处理10h;LPS-rapamycin组:NMCMS以100nmol/L 3-MA处理60h,随后加入100ng/ml的LPS共同处理12h[12]。
5.细胞活力检测:将分离培养的NMCMS以5×103个/孔接种于96孔板中,以前述方法分别对细胞进行处理后,避光条件下向每孔中加入10μl CCK-8溶液,并于37℃水浴中孵育90min,结束后在450nm波长以分光光度计测量各孔吸光度(A)值。细胞活力=(处理组A值-空白组A值)/(对照组A值-空白组A值)。
6.线粒体膜电位(mitochondrial membrane potential,MMP):将细胞以不同方式处理后,以阳离子荧光染料JC-1对线粒体膜电位进行检测。按照操作说明将JC-1工作液加入细胞中并在37℃培养箱中避光孵育30min,随后以PBS清洗3次,每次5min。结束后采用日本Olympus荧光显微镜对各组细胞进行观察。数据以药物处理组与对照组各自的荧光强度表示。
7.NMCMS细胞线粒体分离:NMCMS线粒体按照操作说明,以线粒体分离试剂盒(英国Abcam公司)分离。以预冷的PBS缓冲液清洗NMCMS,并以1000×g离心5min,将上清液转移至新的无菌管中。以12000×g再次离心20min,收集上清液。随后以添加蛋白酶抑制剂混合物的缓冲液中清洗,最终以12000×g离心20min收集备用。
8.Western blot法检测:以上述方式处理NMCMS细胞,用预冷的PBS清洗以去除培养基残留,使用预冷的中效RIPA裂解缓冲液(美国Santa Cruz公司)处理细胞。于冰上反应15min,随后12000×g离心25min,随后加入5×loading buffer,并煮沸7min,进行蛋白定量。将提取的细胞蛋白以SDS-PAGE凝胶电泳分离并转至PVDF膜,以5g/100ml脱脂牛奶在25℃孵育1.5h,加入相应一抗在4℃孵育过夜,清洗后再加入对应二抗缓慢摇晃,反应2h,再次清洗后采用化学发光系统进行检测,之后使用Image Lab(美国Bio-Rad公司)进行蛋白定量分析。
9.ATP含量:使用ATP检测试剂盒,对分离得到的NMCMS细胞线粒体进行定量分析(上海碧云天生物技术有限公司)。将ATP标准溶液用ATP检测裂解液稀释成不同浓度梯度,绘制标准曲线。并按照每个样品100μl配置适当的ATP检测工作液,随后采用分光光度计进行检测。
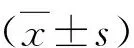
结 果
1.细胞模型评价:如图1A所示,与Con组比较,NMCMS中加入100ng/ml的LPS处理12h可显著降低心肌细胞活力至50%左右。与Con组比较,以LPS处理NMCMS 12h后可显著增加LDH活力并降低MMP的含量(图1中B、C)。同时,ROS生成也显著增加,且线粒体ATP含量显著降低(图1中D、E)。此外,对蛋白的Western blot法检测结果显示,p-AMPK及线粒体自噬标志蛋白FUNDC1的表达也显著降低(图1中F、G)。

图1 LPS处理组与对照组细胞活力、损伤标志物及ROS生成等的检测结果(n=6)A.细胞活力;B.LDH活力;C.MMP;D.ROS水平;E.ATP含量;F、G.Western blot法检测
2.Cur对NMCMS线粒体膜电位影响:如图2中A、B所示,相对于Con组,LPS处理可显著增加ROS活力并降低线粒体ATP含量,而这一改变可被Cur显著逆转。此外,定量分析显示,相对于Con组,LPS可显著降低JC-1比值,提示Δψm显著降低并线粒体损伤,而Cur可通过显著增加JC-1比值,从而改善线粒体损伤(图2中C、D)。
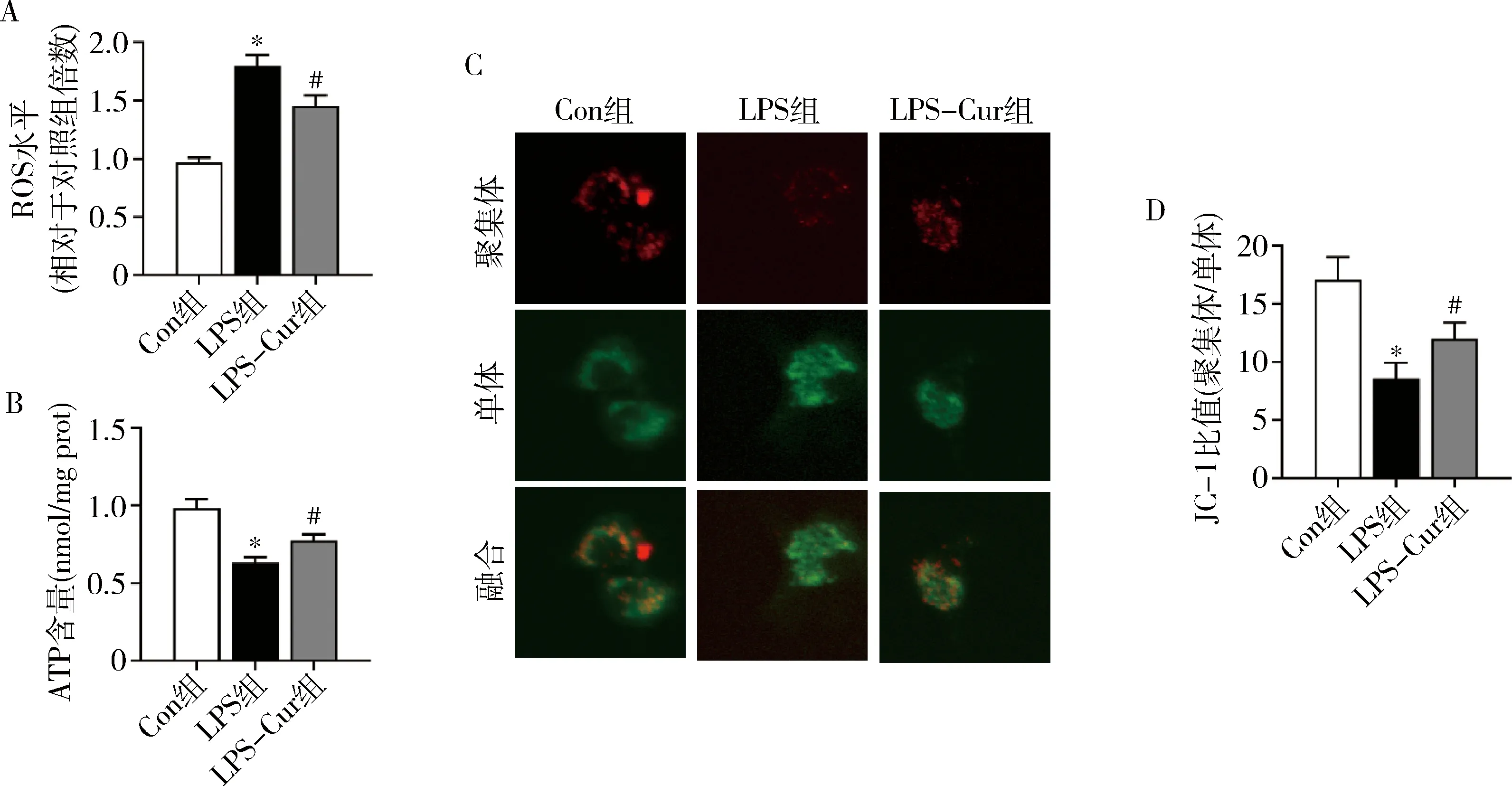
图2 Cur处理对LPS诱导的心肌细胞ROS生成、ATP含量及线粒体膜电位的影响(n=6)A.ROS水平;B. ATP含量;C、D.JC-1荧光染色及统计结果与Con组比较, *P<0.05;与LPS组比较, #P<0.05
3.Cur可缓解LPS诱导的NMCMS毒性:如图3A所示,相对于LPS处理组,培养的NMCMS中加入10nmol/L的Cur后可显著增加细胞活力,然而随着Cur浓度进一步增加,细胞活力无显著改善。对培养细胞离心后的上清液检测发现,与Con组比较,LPS处理可显著增加LDH活力并显著降低MMP含量,而Cur处理可显著减轻LPS诱导的细胞损伤(图3中B、C)。对不同处理组的细胞蛋白的进一步检测发现,Cur处理可显著缓解LPS对p-AMPK及线粒体自噬标志蛋白表达的抑制作用(图3中D、E)。
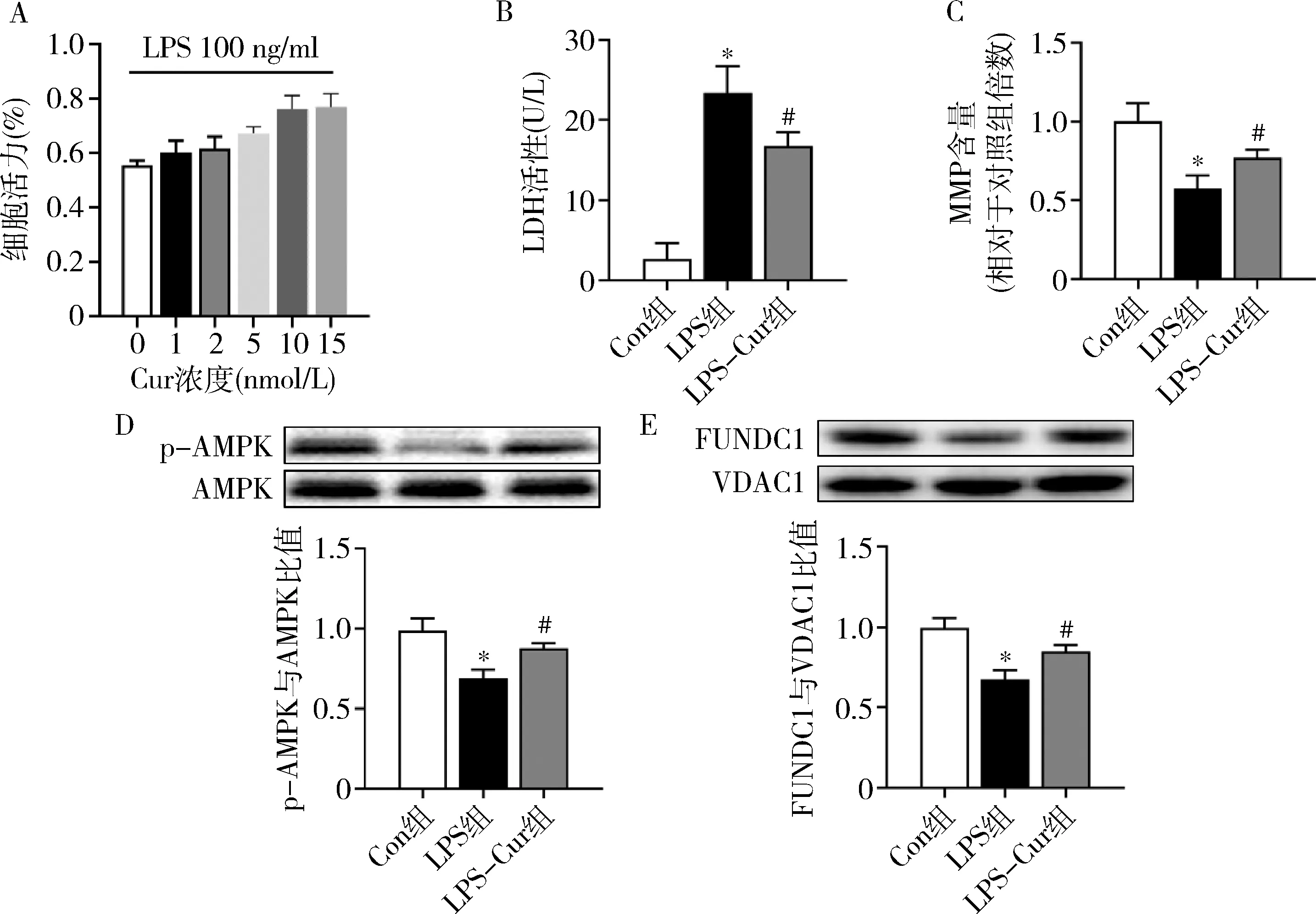
图3 Cur处理对LPS诱导的心肌细胞活力、LDH、MMP及AMPK与FUNDC1蛋白表达的影响(n=6)A.细胞活力;B.LDH活力;C.MMP;D.p-AMPK及AMPK蛋白表达;E.FUNDC1蛋白表达与Con组比较, *P<0.05;与LPS组比较, #P<0.05
4.siAMPK对Cur及LPS处理的NMCMS线粒体的影响:对Cur及LPS处理的NMCMS中加入siAMPK的结果显示,Cur可显著降低LPS损伤引起的ROS水平增加及促进ATP生成,而siAMPK处理则降低了Cur对细胞损伤的保护作用(图4中A、B)。此外,以JC-1阳离子探针检测Cur及siAMPK对LPS诱导的NMCMS毒性的影响,定量分析结果显示,加入scramble RNA后线粒体膜电位无显著改变。相对于LPS-Cur-Scr组,加入siAMPK后则显著降低JC-1比值,提示线粒体损伤加剧(图4中C、D)。
图4 Cur与siAMPK处理对心肌细胞氧化应激的影响(n=6)A.ROS水平;B.ATP含量;C.JC-1荧光染色;D.线粒体膜电位荧光染色统计结果与LPS-Scr组比较, *P<0.05;与LPS-Cur-Scr组比较, #P<0.05;与LPS-siAMPK-Cur组比较, ΔP<0.05
5.抑制AMPK的表达可降低Cur对LPS诱导的NMCMS的保护作用:如图5中A、B所示,对于LPS处理的NMCMS,与LPS-Scr组比较,Cur可显著降低LDH活性并增加MMP含量,而siAMPK可通过逆转这一趋势增加LPS诱导的细胞损伤。与LPS组比较,Cur可显著增加p-AMPK及FUNDC1蛋白的表达,而siAMPK处理后,随着p-AMPK表达量的降低,FUNDC1蛋白表达量也显著降低(图5中C、D)。提示FUNDC1可能作为重要的调节因子,参与Cur对LPS诱导的NMCMS的保护作用。

图5 Cur与siAMPK处理对LPS诱导的心肌细胞LDH、MMP及AMPK与FUNDC1蛋白表达的影响(n=6)A.LDH活力;B.MMP;C.p-AMPK及AMPK蛋白表达;D.FUNDC1蛋白表达与LPS-Scr组比较, *P<0.05;与LPS-Cur-Scr组比较, #P<0.05;与LPS-siAMPK-Cur组比较, ΔP<0.05
6.AMPK/FUNDC1信号通路对Cur抵抗LPS诱导的NMCMS损伤具有重要的调节作用:如图6中A、B所示,对于LPS处理的NMCMS,加入Cur或线粒体自噬激活剂rapamycin均可显著降低LDH活性并增加MMP含量,而加入线粒体自噬抑制剂3-MA后,这种保护作用被部分抵消。此外,Cur或rapamycin均可显著降低LPS诱导的NMCMS的ROS生成并促进ATP合成,而3-MA则可显著增加ROS生成及抑制ATP合成(图6中C、D)。对不同处理组NMCMS蛋白的进一步检测发现,Cur及rapamycin可显著改善LPS诱导的NMCMS线粒体自噬标志蛋白降解,而3-MA处理则通过降低FUNDC1蛋白表达而部分抵消Cur对细胞线粒体的保护作用,而并未改变p-AMPK的蛋白表达(图6中E、F)。提示,FUNDC1可能作为AMPK下游分子,参与调控Cur对LPS诱导的NMCMS的保护作用。

图6 Cur、3-MA及rapamycin处理对心肌细胞的影响(n=6)A.LDH活力;B.MMP;C.ROS水平;D.ATP含量;E.p-AMPK及AMPK蛋白表达;F.FUNDC1蛋白表达与LPS组比较, *P<0.05; 与LPS-Cur组比较, #P<0.05
讨 论
本研究通过离体建立LPS诱导的NMCMS损伤模型并发现,Cur可通过激活抑制LDH活力及ROS生成并增加MMP与ATP的含量,减轻线粒体损伤,保护NMCMS抵抗LPS诱导的心肌细胞毒性。其作用机制主要是通过激活AMPK/FUNDC1介导的线粒体自噬并降低ROS生成及维持线粒体膜电位实现的。本研究结果提示,Cur及AMPK/FUNDC1介导的线粒体自噬对于保护心肌细胞线粒体功能,减轻LPS诱导的心肌细胞损伤具有重要作用。
脓毒症期间的心血管系统及其功能障碍不容忽视[13]。研究表明,线粒体功能障碍,在脓毒症诱导的器官衰竭的发病机制中起着关键作用[14]。LPS可以诱导选择性的线粒体自噬过程。本研究发现,与Con组比较,LPS处理的NMCMS细胞活力显著降低,同时细胞损伤增加(LDH活性增加与MMP含量降低)与ROS水平升高及线粒体ATP生成降低。研究表明,FUNDC1依赖的线粒体自噬在通过缓解炎性反应,减轻LPS诱导的心肌细胞损伤[5,15]。本研究证实,LPS处理的NMCMS与对照组比较,p-AMPK及线粒体自噬标志蛋白FUNDC1显著激活,与既往研究结果一致[5]。
Cur是从姜黄根茎中提取的一种多酚类物质。姜黄素具有广泛的药理活性,包括抗氧化、抗炎等功效[16,17]。研究表明,Cur对心肌缺血再灌注损伤具有重要的保护作用,其主要作用机制是通过抑制ROS生成并促进ATP合成,从而减轻线粒体功能损伤,进而缓解缺血再灌注引起的心肌损伤[18]。此外,姜黄素通过调控自噬和减轻细胞凋亡来预防心肌损伤[19]。本研究证实,相对于LPS诱导的NMCMS,Cur可显著降低ROS生成并促进ATP合成,并促进AMPK的磷酸化与线粒体自噬标志蛋白FUNDC1的表达,同时通过增加JC-1的比值维持线粒体膜电位稳定,缓解LPS诱导的NMCMS损伤。
既往研究表明,AMPK/FUNDC1信号通路的激活可缓解高糖导致的心肌细胞线粒体功能障碍,且FUNDC1在LPS诱导的脓毒症小鼠心肌组织中也具有调节作用[5,20]。本研究通过对NMCMS给予siAMPK证实,Cur对LPS诱导的NMCMS损伤的保护作用可被AMPK的抑制而抵消,提示AMPK/FUNDC1信号通路可能是Cur抵抗LPS诱导的心肌细胞损伤的关键调控因子。进一步的体外研究表明,NMCMS以线粒体自噬抑制剂3-MA处理后,Cur对心肌细胞的保护作用被部分抵消,而AMPK的磷酸化未见显著改变,提示FUNDC1可能作为AMPK的下游关键分子,参与调控Cur对LPS诱导的心肌细胞损伤的保护作用。
综上所述,本研究证实,Cur可显著缓解LPS诱导的心肌细胞损伤。其潜在的保护机制是通过激活AMPK/FUNDC1信号通路,抑制ROS生成与促进ATP合成,减轻心肌细胞线粒体损伤。而抑制AMPK的磷酸化或降低FUNDC1的蛋白表达,可加剧LPS诱导的心肌细胞损伤。因此,激活AMPK/FUNDC1介导的线粒体自噬是Cur缓解LPS诱导的心肌细胞毒性的潜在治疗策略。
