颅底脊索瘤中长链非编码RNA FAM230B的促肿瘤作用及机制研究
2022-09-28田凯兵王亮马骏鹏王科张俊廷吴震
田凯兵,王亮,马骏鹏,王科,张俊廷,吴震
脊索瘤是一种起源于人胚胎残余组织的恶性肿瘤,其年发病率为(0.080~0.089)/10万,占骨肿瘤的1.8%~4.3%[1-3]。脊索瘤主要发生于颅底和骶尾部,对周围骨质有明显的破坏作用,且常包绕周围重要血管、神经和其他重要结构,导致手术全切率非常低,且部分患者会出现严重术后并发症[4-5]。尽管近年来治疗脊索瘤的手术和放疗技术明显提高,但肿瘤药物研究相对落后,而较低的手术全切率、较高的术后并发症发生率和肿瘤复发率仍困扰着患者和临床医生[6-8]。针对脊索瘤进展、侵袭等生物学行为的机制进行深入研究,有助于改进其治疗方法,对改善患者预后、延缓肿瘤复发具有重要意义。
近年来,长链非编码RNA(long non-coding RNA,lncRNA)的表观遗传、转录、翻译及翻译后水平被广泛研究,其可借助蛋白质与microRNA网络实现多种细胞功能的调控,如染色质重塑、转录及转录后调控、细胞内物质运输、细胞核亚结构形成、干细胞多能性、体细胞重编程、发育调控等[9-11]。目前,lncRNA已用于其他疾病的临床诊治,但关于颅底脊索瘤lncRNA的研究报道较少,且未能建立以lncRNA为关键点的分子调控网络,故深入研究颅底脊索瘤中lncRNA相关的调控机制对寻找新的诊治方法意义重大。本研究从细胞层面和分子层面探讨了颅底脊索瘤中lncRNA的促肿瘤作用及机制,现报道如下。
1 资料与方法
1.1 筛选lncRNA
1.1.1 材料来源 选择在首都医科大学附属北京天坛医院临床医学研究中心存放的3份脊索瘤组织样本(取自行手术治疗的原发经典型脊索瘤患者)和3份脊索组织样本(取自8~12周龄流产胎儿),样本取材前均获得家属知情同意。所有组织样本离体后立即冻存于液氮中。本研究通过首都医科大学附属北京天坛医院医学伦理委员会审核批准(批号:KYSQ 2018-098-01)。
1.1.2 lncRNA测序及分析 将3份脊索瘤组织样本和3份脊索组织样本进行lncRNA测序,由北京诺禾致源科技股份有限公司完成,采用去除核糖体RNA的方法构建链特异性文库,库检合格后进行Illumina PE150测序,采用StringTie软件对预处理后的Reads进行转录本拼接,经过转录本外显子个数、转录本外显子长度、转录本抑制注释、转录本表达量、编码潜能5个筛选步骤后获取lncRNA集。应用cuffdiff软件进行差异表达基因分析,得到差异表达转录本,以q<0.05为阈值筛选差异表达显著的lncRNA。应用NONCODE(http://www.noncode.org)和lncRNAdb(http://www.lncrnadb.org/)数据库对差异表达显著的lncRNA进行功能预测,筛选出与肿瘤发生发展关系密切的lncRNA。
1.2 细胞实验
1.2.1 细胞培养 采用笔者所在课题组自行培育的颅底脊索瘤细胞系HBC-2(专利号:ZL201210052961.8)进行细胞实验,将IMDM(美国,Thermo Fisher Scientific,21056023)和RPMI1640(美国,Thermo Fisher Scientific,A1049101)作为基础培养基(4∶1),培养基中加入1×NEAA(美国,Thermo Fisher Scientific,11130077)、1×青链霉素(美国,Thermo Fisher Scientific,15070063)和10%胎牛血清(美国,Thermo Fisher Scientific,10099),37 ℃温箱培养,约3 d传代1次。
1.2.2 细胞转染 FAM230B敲降组采用si-FAM230B进行细胞转染,对照1组采用si-FNC进行细胞转染,AC079630.2敲降组采用si-AC079630.2进行细胞转染,对照2组采用si-ANC进行细胞转染。根据本研究筛选出的两个lncRNA序列设计、构建siRNA对脊索瘤细胞系HBC-2的瞬转干扰株,引物和siRNA均由上海吉玛基因公司设计,siRNA设计如下:si-FAM230B(5′-AAGAAAAAU CAA AAU CAG GGA-3′),阴性对照si-FNC(5′-CAG AGA GGA GGA AAG GAG AUU-3′)[12];si-AC079630.2(5′-GCU AAU CAU UCU CUC UGG A -3′),阴性对照si-ANC(5′-ATC TCG TCC ATA TGA GTC T-3′)。引物设计如下:FAM230B上游引物:5′-GGG GTA CCA GCA GTT GGA CCT CAC AGT GT-3′,下游引物:5′-CGG GAT CCT GTG GGT CAT TTC TTT ATT ATT TT-3′[12];AC079630.2上游引物:5′-ACT TTG GAC AGC TGC AAC AAC -3′,下游引物:5′-ACT CAG GAT ATG GAG TTG CGA -3′;GAPDH上游引物:5′-GGA GCG AGA TCC CTC CAA AAT-3′,下游引物:5′- GGC TGT TGT CAT ACT TCT CAT GG-3′。
采用siRNA(中国,上海吉玛基因公司)进行细胞转染,转染试剂为siRNA MATETM(中国,上海吉玛基因公司,G04003),转染前24 h将生长状态良好的贴壁细胞种植于六孔板,约为6×104/孔,无抗生素培养基2 ml/孔。转染前将6 pmol siRNA加入200 μl Opti-MEM培养基(美国,Thermo Fisher Scientific,31985062),混匀后室温放置5 min。取15 μl siRNA MATETM加入上述培养基,充分混匀,室温放置10 min。将siRNA血清加入六孔板并做好标记,原条件培养48 h。
1.2.3 采用实时荧光定量PCR检测lncRNA敲降率 将转染好的细胞加入1 ml TRIzol(美国,Thermo Fisher Scientific,15596026)进行RNA提取,使用带有gDNA Erase的反转录试剂盒(日本,Takara,RR047A)进行反转录,配制溶液后置于PCR扩增仪,去除组织DNA并进行反转录。使用实时荧光定量PCR试剂盒(日本,Takara,RR820L)进行实时荧光定量PCR。靶片段在20 μl系统中扩增。反应过程如下:95 ℃ 30 s;95 ℃5 s,60 ℃ 30 s,共40个循环;95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s。计算ΔCT值及敲降率,ΔCT=目的基因CT值-对照基因CT值,敲降率=1-2-ΔCT目的基因/2-ΔCT内参基因。实验重复3次,敲降率≥50%定义为转染合格。
1.2.4 采用CCK-8法检测细胞增殖能力 应用CCK-8试剂盒(美国,Abbkine,KTC011001)检测细胞增殖能力,将细胞接种于96孔板培养,转染完成后更换含有10% CCK-8的培养基,培养箱继续培养24、48、72 h,采用酶标仪测定450 nm处的吸光度,计算细胞活性,细胞活性=(细胞OD值-培养基OD值)/(0 h细胞OD值-0 h培养基OD值)。实验重复3次。
1.2.5 采用流式细胞仪检测细胞凋亡率 应用PE Annexin V Apoptosis Detection Kit I试剂盒(美国,BD Biosciences,559763)检测细胞凋亡率。将转染完成的细胞用胰酶消化、离心(250×g)3 min,DPBS洗3次,进行细胞计数并离心(250×g)3 min,加入1×Binging Buffer并将细胞稀释为1×106个/ml,取100 μl置于流式管,分别加入5 μl PE Annexin V和5 μl 7-AAD,轻轻混匀后避光室温反应15 min,加入400 μl 1×Binging Buffer,1 h内采用流式细胞仪检测细胞凋亡率。实验重复3次。
1.3 临床研究
1.3.1 研究对象 选择2005—2014年在首都医科大学附属北京天坛医院神经外科接受手术治疗的原发颅底脊索瘤患者83例。纳入标准:(1)经病理检查证实为脊索瘤;(2)临床资料完整。排除标准:(1)合并颅内外其他危及生命的严重疾病;(2)合并其他部位肿瘤;(3)伴有认知、心理及精神障碍。
1.3.2 研究方法 收集患者的临床资料,包括性别、年龄、术前KPS评分、FAM230B水平、肿瘤体积、肿瘤分型、肿瘤分期、肿瘤分隔情况、肿瘤血供情况、肿瘤质地、肿瘤切除程度、病理分型。磁共振成像检查结果由两位具备5年以上颅底肿瘤诊断经验的放射科医生进行评估,计算肿瘤体积,肿瘤分型包括骨侵袭性肿瘤(侵犯周围骨)和非骨侵袭性肿瘤,肿瘤分期包括硬膜破坏和无硬膜破坏,肿瘤分隔情况包括瘤内无纤维分隔和瘤内有纤维分隔,肿瘤血供情况分为丰富和不丰富,肿瘤质地分为质软和质硬(质硬包括软韧不均成分的肿瘤),肿瘤切除程度包括侵袭性切除(切除程度>90%)和非侵袭性切除(切除程度≤90%)。组织学标本由至少两名有5年以上脊索瘤分析经验的病理学医师观察,根据国际癌症研究机构的脊索瘤病理分型,包括经典型、软骨样型和未分化型[13],本研究无未分化型。主要随访方式为门诊随访,不能门诊随访的患者采用电话随访,记录患者术后肿瘤进展情况。术后肿瘤进展定义为残余肿瘤再长或肿瘤复发。
1.4 lncRNA与蛋白关系的研究 应用AnnoLnc数据库(http://annolnc.cbi.pku.edu.cn/)筛选与FAM230B相互作用的蛋白。RNA pull-down实验中预先制备细胞裂解液并测定蛋白浓度,设置无探针组、实验组(应用转录自FAM230B基因的lncRNA干扰)、阳性对照组(未经处理的HBC-2细胞裂解液)和阴性对照组(应用试剂盒中不能与蛋白结合的RNA作为阴性对照),应用Pierce™磁性RNA-蛋白Pull-Down试剂盒(美国,Thermo Fisher Scientific,20164)进行磁珠与生物素标记探针结合、探针与RNA杂交、RNA与蛋白结合复合物洗脱,最后应用Western blot法检测结合蛋白表达情况。Western blot法步骤如下:应用细胞裂解液(中国,上海碧云天生物技术有限公司,P0013)裂解细胞,离心取上清液,采用BCA试剂(中国,碧云天,P0012)测定蛋白浓度,配置分离胶和浓缩胶,经过上样、电泳、湿转、封闭、一抗(英国,Abcam,ab32199/ab38449/ab8245)孵育、二抗(中国,北京全式金生物技术有限公司,HS201-01/HS101-01)孵育,最后应用immobilon Western Chemiluminescent HRP Substrote试剂盒(德国,Merckmillipore,WBKLS0500)进行显色。
1.5 统计学方法 采用SPSS 20.0统计学软件进行数据分析。符合正态分布的计量资料以(±s)表示,两组间比较采用成组t检验;原发颅底脊索瘤患者术后肿瘤进展的影响因素分析采用单因素及多因素Cox回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 lncRNA筛选结果 lncRNA测序结果显示,筛选后获取2 153个lncRNA集,包括差异表达的lncRNA 169个,其中显著高表达lncRNA 11个、显著低表达lncRNA 4个,见图1~2。功能测序结果显示,共两个lncRNA(FAM230B和ACO79630.2)与肿瘤发生发展密切相关。
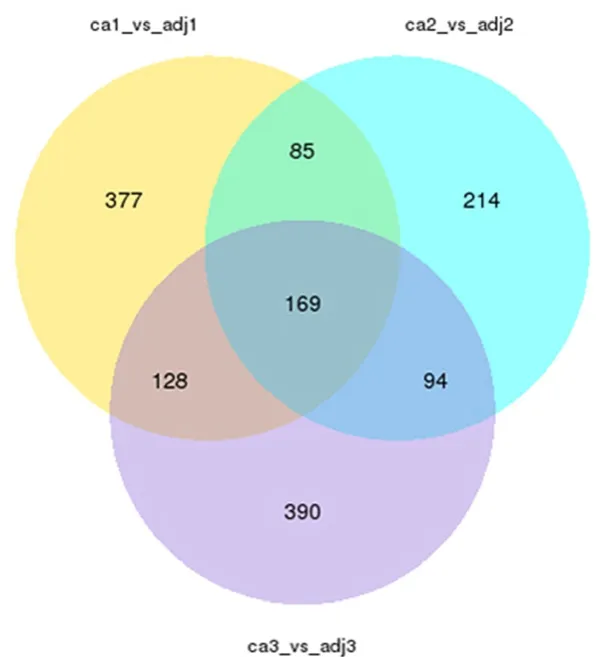
图1 差异表达基因维恩图Figure 1 Plot venn diagram of differentially expressed genes
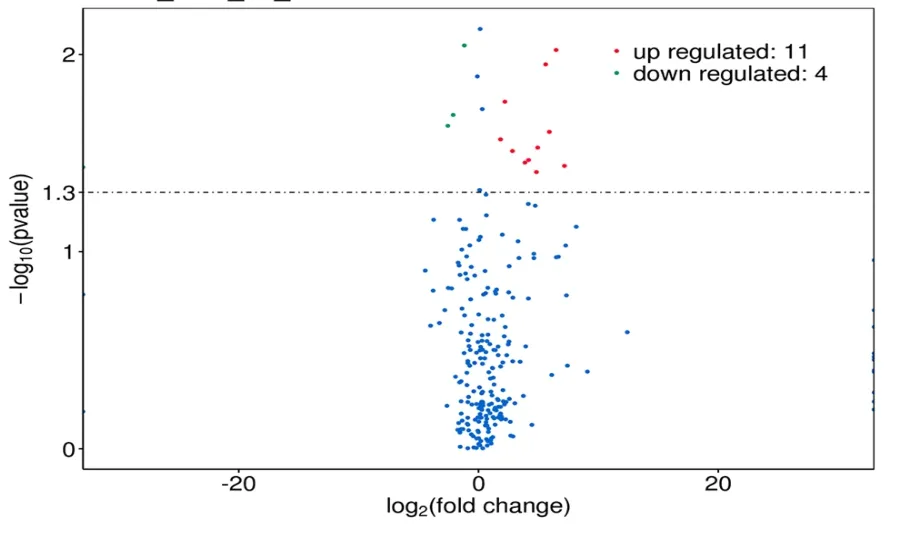
图2 火山图Figure 2 Volcano map
2.2 细胞实验结果 FAM230B敲降组FAM230B敲降率为90%,AC079630.2敲降组AC079630.2敲降率为87%。培养24、48、72 h,FAM230B敲降组细胞活性低于对照1组,差异有统计学意义(P<0.05),见表1;培养24、48、72 h,AC079630.2敲降组和对照2组细胞活性比较,差异无统计学意义(P>0.05),见表2。FAM230B敲降组细胞凋亡率为(18.74±1.06)%,高于对照1组的(4.75±0.65)%,差异有统计学意义(t=19.519,P<0.01);ACO79630.2敲降组细胞凋亡率为(5.22±0.90)%,与对照2组的(4.36±1.17)%比较,差异无统计学意义(t=1.015,P=0.367)。
表1 FAM230B敲降组和对照1组不同时间细胞活性比较(±s,n=3)Table 1 Comparison of cell activity between FAM230B knockdown group and control group 1 at different time points
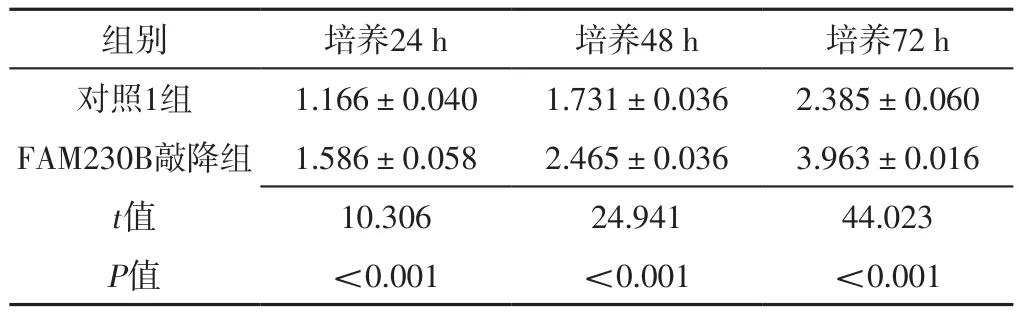
表1 FAM230B敲降组和对照1组不同时间细胞活性比较(±s,n=3)Table 1 Comparison of cell activity between FAM230B knockdown group and control group 1 at different time points
组别 培养24 h 培养48 h 培养72 h对照1组 1.166±0.040 1.731±0.036 2.385±0.060 FAM230B敲降组 1.586±0.058 2.465±0.036 3.963±0.016 t值 10.306 24.941 44.023 P值 <0.001 <0.001 <0.001
表2 AC079630.2敲降组和对照2组不同时间细胞活性比较(±s,n=3)Table 2 Comparison of cell activity between AC079630.2 knockdown group and control group 1 at different time points
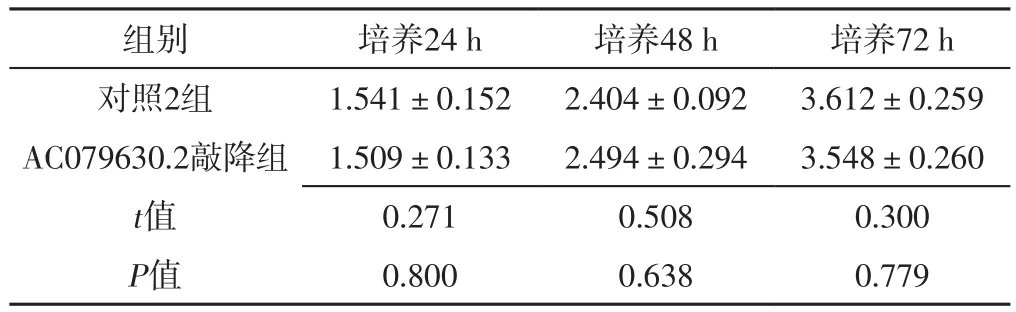
表2 AC079630.2敲降组和对照2组不同时间细胞活性比较(±s,n=3)Table 2 Comparison of cell activity between AC079630.2 knockdown group and control group 1 at different time points
组别 培养24 h 培养48 h 培养72 h对照2组 1.541±0.152 2.404±0.092 3.612±0.259 AC079630.2敲降组 1.509±0.133 2.494±0.294 3.548±0.260 t值 0.271 0.508 0.300 P值 0.800 0.638 0.779
2.3 临床研究结果
2.3.1 原发颅底脊索瘤患者临床资料及随访结果 83例患者中男40例,女43例;年龄11~62岁,平均39岁;术前KPS评分40~100分,平均80分;FAM230B水平8~18,平均13;肿瘤体积1.9~139.4 cm3,平均21.1 cm3;肿瘤分型:骨侵袭性肿瘤74例,非骨侵袭性肿瘤9例;肿瘤分期:硬膜破坏38例,无硬膜破坏45例;肿瘤分隔:瘤内有纤维分隔53例,瘤内无纤维分隔30例;肿瘤血供:丰富45例,不丰富38例;肿瘤质地:质软35例,质硬41例;肿瘤切除程度:侵袭性切除41例,非侵袭性切除42例;病理分型:经典型67例,软骨样型16例;术后肿瘤进展52例。
2.3.2 原发颅底脊索瘤患者术后肿瘤进展的影响因素分析 将临床资料作为自变量,将原发颅底脊索瘤患者术后肿瘤进展(赋值:否=0,是=1)作为因变量,进行单因素Cox回归分析,结果显示,术前KPS评分、FAM230B水平、肿瘤质地及肿瘤切除程度是原发颅底脊索瘤患者术后肿瘤进展的影响因素(P<0.05),见表3。将术前KPS评分、FAM230B水平、肿瘤质地及肿瘤切除程度作为自变量(赋值同表3),将原发颅底脊索瘤患者术后肿瘤进展(赋值:否=0,是=1)作为因变量,进行多因素Cox回归分析,结果显示,FAM230B水平、肿瘤质地和肿瘤切除程度是原发颅底脊索瘤患者术后肿瘤进展的独立影响因素(P<0.05),见表4。
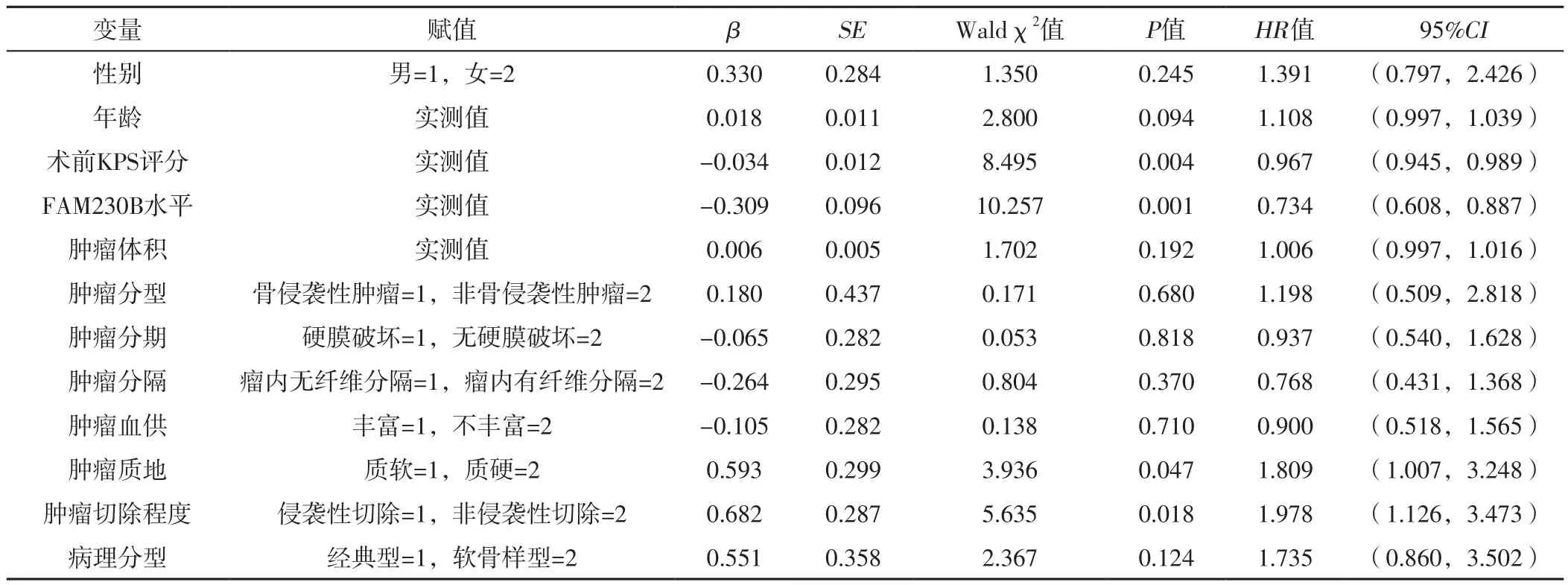
表3 原发颅底脊索瘤患者术后肿瘤进展影响因素的单因素Cox回归分析Table 3 Univariate Cox regression analysis of influencing factors of postoperative tumor progression in patients with primary skull base chordoma
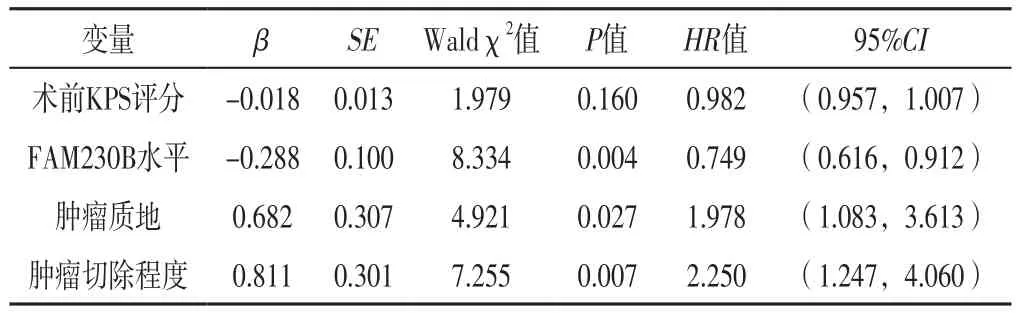
表4 原发颅底脊索瘤患者术后肿瘤进展影响因素的多因素Cox回归分析Table 4 Multivariate Cox regression analysis of influencing factors of postoperative tumor progression in patients with primary skull base chordoma
2.4 lncRNA与蛋白关系的研究结果 与FAM230B相关的PTEN蛋白得分较高(96.025 1分,P=1.14e-3)。RNA pull-down实验结果显示,FAM230B可与PTEN蛋白直接结合,见图3。Western blot法结果显示,实验组干扰前后PTEN蛋白条带无明显变化;与干扰前相比,实验组干扰后PTEN通路关键蛋白磷酸化蛋白激酶B(phosphorated protein kinase B,p-AKT)条带明显减弱,提示FAM230B干扰后细胞中p-AKT表达降低,见图4。
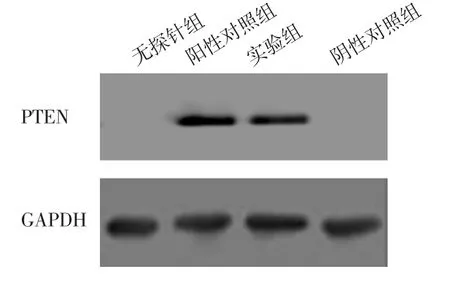
图3 RNA pull-down实验结果Figure 3 RNA pull-down results

图4 实验组干预前后p-AKT、PTEN蛋白表达的电泳图Figure 4 Electrophoretogram of p-AKT and PTEN protein expression before and after intervention in the experimental group
3 讨论
脊索瘤是一种少见的低度恶性肿瘤,好发于人体中轴骨,其中颅底脊索瘤约占所有脊索瘤的1/3[14]。脊索瘤呈浸润性生长,对周围骨质破坏严重,术后易复发,患者远期预后差,且目前尚无治疗该病的有效药物。为了明确脊索瘤发生发展的作用因子及机制,本研究着重探讨了与颅底脊索瘤发生发展相关的lncRNA。
lncRNA是一类长度为200 bp以上、不编码蛋白质的RNA分子[15],其与DNA、RNA及蛋白复合物相互作用,在转录及转录后调控中发挥着重要作用[16]。研究表明,lncRNA在多种肿瘤组织中表达异常,与肿瘤的发生发展、诊断、治疗及预后相关[17];脊索瘤组织中高表达的lncRNA在促进肿瘤细胞增殖和侵袭、抑制肿瘤细胞凋亡及肿瘤生长过程中具有明显作用[18-22],其中NONHSAT114552高表达的患者持续无瘤生存期短于NONHSAT114552低表达的患者,提示NONHSAT114552与肿瘤进展相关[20];XIST和KRT8P41高表达与患者生存率降低相关[20,22]。本研究结果证实,lncRNA FAM230B在颅底脊索瘤中具有促进肿瘤细胞增殖和抑制肿瘤细胞凋亡等作用。
lncRNA FAM230B位于22号染色体长臂,长度为3 464 bp,其在甲状腺乳头状癌中呈高表达,并可通过与miR-378-3p竞争WNT5A的3'-UTR结合位点,抑制miR-378-3p作用,促进WNT5A表达,进而促进甲状腺乳头状癌细胞转化为间质细胞[23]。一项胃癌研究结果表明,FAM230B可以竞争性地抑制miR27a-5p表达,间接促进TOP2A表达,从而促进胃癌细胞增殖、迁移和侵袭[13]。SONG等[24]研究发现,FAM230B可以促进骨肉瘤细胞增殖,其机制可能为:FAM230B通过抑制miR-203成熟,从而减弱成熟miR-203对肿瘤细胞增殖的抑制作用。CAO等[25]研究显示,FAM230B在肺腺癌组织和肺腺癌患者血浆中呈高表达,提示FAM230B高表达对肺腺癌可能具有诊断价值。另外,有研究证实,FAM230B在急性白血病和高血压引起的尿蛋白升高中发挥着重要作用[26-27]。
目前,FAM230B在颅底脊索瘤中的作用尚未见报道,细胞实验结果显示,FAM230B敲降组培养24、48、72 h细胞活力低于对照1组,细胞凋亡率高于对照1组,提示FAM230B可抑制颅底脊索瘤细胞增殖并促进颅底脊索瘤细胞凋亡,进而起到抗肿瘤作用;临床试验结果显示,FAM230B水平升高是原发颅底脊索瘤患者术后肿瘤进展的危险因素。本研究进一步进行RNA pull-down实验,结果证实FAM230B可与PTEN蛋白直接结合,并可抑制PTEN蛋白的下游蛋白p-AKT的表达。PTEN蛋白与多种肿瘤的发生发展相关,其主要通过抑制下游关键因子蛋白激酶B(protein kinase B,AKT)的磷酸化而发挥抑癌作用[28-29]。笔者所在课题组的前期研究结果显示,PTEN蛋白低表达与脊索瘤的强侵袭性明显相关[30]。另一项研究证实,PTEN蛋白表达水平与颅底脊索瘤质地相关,PTEN低表达的颅底脊索瘤患者术后无肿瘤进展期明显缩短[31]。LEE等[32]研究证实,PTEN缺乏的脊索瘤细胞增殖率升高,凋亡率降低,提示PTEN在抑制脊索瘤细胞增殖和促进脊索瘤细胞凋亡的过程中发挥了调控作用。结合本研究结果,推测颅底脊索瘤中高表达的FAM230B与PTEN蛋白结合,进而使PTEN蛋白的作用受到抑制,导致AKT磷酸化水平升高,进而促进肿瘤细胞增殖、抑制肿瘤细胞凋亡。
综上所述,lncRNA FAM230B在颅底脊索瘤组织中呈高表达,其可与PTEN蛋白结合,导致AKT磷酸化水平升高,进而发挥促进肿瘤细胞增殖、抑制肿瘤细胞凋亡的作用。
作者贡献:田凯兵、王亮、吴震进行文章的构思与设计;田凯兵、王亮、马骏鹏、王科、张俊廷、吴震进行研究的实施与可行性分析,结果分析与解释;田凯兵、王亮、马骏鹏、王科进行数据收集、整理、分析;田凯兵负责撰写、修订论文;吴震负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
