接受EGFR-TKIs治疗的EGFR突变阳性非小细胞肺癌患者预后预测列线图模型构建及验证
2022-09-28黄维佳曹健斌李逢昌李竞长张东伟何凌云李富骊伍义文
黄维佳,曹健斌,李逢昌,李竞长,张东伟,何凌云,李富骊,伍义文
肺癌是指原发于气管、支气管和肺的恶性肿瘤,在全国范围内,肺癌已成为一个重大公共卫生问题,2020年的全球癌症流行病调查显示,肺癌是全世界发病率第二和死亡率第一的恶性肿瘤[1]。肺癌按病理类型分为非小细胞肺癌(non-small-cell lung cancer,NSCLC)和小细胞肺癌,其中NSCLC是肺癌的常见类型,约占全部肺癌的80%,其5年生存率低于15%[2]。相较于传统的铂类联合化疗方案,EGFRTKIs对EGFR突变阳性患者治疗效果明显[3-4],其有效率达70%~80%,但部分患者仍对EGFR-TKIs不敏感[5-6]。临床上外周血液检测技术操作简便,可提供经济、便捷的指标以判断肿瘤预后[7]。目前国内外研究NSCLC患者预后因素大多集中在临床特征上,鲜有基于外周血指标构建风险预测模型的报道,而列线图凭借可视可读、简洁实用的优势,在医学领域得到广泛应用[8]。本研究基于血常规指标构建接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者预后预测列线图模型,并验证其预测价值,现报道如下。
1 对象与方法
1.1 研究对象 选取2018—2020年柳州市人民医院胸外科、呼吸科、肿瘤科收治的EGFR突变阳性NSCLC患者332例。纳入标准:(1)经影像学、痰涂片及病理检查确诊为NSCLC,诊断标准参考《中华医学会肺癌临床诊疗指南(2018版)》[9],且经EGFR基因检测证实EGFR突变阳性(外显子19缺失突变或外显子21 L858R点突变)患者;(2)TNM肿瘤分期为Ⅲ~Ⅳ期患者;(3)接受EGFR-TKIs一线治疗患者;(4)在EGFR-TKIs治疗前2周内行血常规检查患者。排除标准:(1)既往接受过手术、化疗、放疗、其他靶向治疗及免疫治疗者;(2)治疗前合并肺部感染、血液系统疾病者;(3)治疗前使用过激素、粒细胞集落刺激因子等可能影响血常规检查结果的药物者;(4)合并其他良、恶性肿瘤者。按照7∶3的比例将患者随机分为试验组(n=232)和验证组(n=100)。本研究经柳州市人民医院医学伦理委员会批准(批准号:GXLZ-20220173),所有患者签署知情同意书。
1.2 研究方法 通过柳州市人民医院电子病历系统收集患者的临床资料,包括性别、年龄及EGFR-TKIs治疗前2周血常规检查结果〔中性粒细胞绝对值(absolute neutrophil count,ANC)、淋巴细胞绝对值(absolute lymphocyte count,ALC)、单核细胞绝对值(absolute monocyte count,AMC)、碱性磷酸酶(alkaline phosphatase,ALP)、白蛋白(albumin,ALB)、中性粒细胞/淋巴细胞比值(neutrophilto-lymphocyte ratio,NLR)、CD4+/CD8+细胞比值、C反应蛋白(C-reactive protein,CRP)、乳酸脱氢酶(lactate dehydrogenase,LDH)、血小板/淋巴细胞比值(plateletto-lymphocyte rate,PLR)、γ干扰素(interferon-γ,IFN-γ)、白介素6(interleukin-6,IL-6)、淋巴细胞计数(lymphocyte count,LY)、纤维蛋白原(fibrinogen,FIB)、淋巴细胞/单核细胞比值(lymphocyte-to-monocyte ratio,LMR)、淋巴细胞/白细胞比值(lymphocyte-to-white blood cell rate,LWR)、中性粒细胞/白细胞比值(neutrophilto-white blood cell rate,NWR)、单核细胞/白细胞比值(monocyte-to-white blood cell rate,MWR)、单核细胞/淋巴细胞比值(monocyte-to-lymphocyte rate,MLR)、血小板计数(platelet count,PLT)、血小板/白细胞比值(platelet-towhite blood cell rate,PWR)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、WBC〕。从患者接受EGFR-TKIs一线治疗开始对其进行随访,末次随访时间为2021-12-10;随访方式为电话随访、门诊随访或住院随访;随访内容为后续治疗效果、是否复发或死亡以及死亡时间;随访频率为第1年每3个月随访1次,第2~3年每6个月随访1次。总生存期(overall survival,OS)定义为从患者接受EGFR-TKIs治疗开始至末次随访时间或死亡的时间。
1.3 统计学方法 采用SPSS 23.0统计学软件进行数据处理。不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用秩和检验;计数资料以相对数表示,组间比较采用χ2检验;采用ROC曲线分析确定血常规指标预测试验组接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者死亡的最佳截断值;采用单因素、多因素Cox回归分析探讨试验组接受EGFRTKIs治疗的EGFR突变阳性NSCLC患者死亡的影响因素;基于多因素Cox回归分析结果,采用R语言(R 4.0.3软件包)构建接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者预后预测列线图模型,采用Bootstrap抽样法重复抽样1 000次,计算一致性指数(concordance index,CI),同时采用校准曲线和ROC曲线评价该列线图模型预测接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者预后的准确性。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 两组性别、年龄、ANC、ALC、AMC、ALP、ALB、NLR、CD4+/CD8+细胞比值、CRP、LDH、PLR、IFN-γ、IL-6、LY、FIB、LMR、LWR、NWR、MWR、MLR、PLT、PWR、TNF-α、WBC、随访时间、OS比较,差异无统计学意义(P>0.05),见表1。ROC曲线分析结果显示,ANC、ALC、AMC、ALP、ALB、NLR、CD4+/CD8+细胞比值、CRP、LDH、PLR、IFN-γ、IL-6、LY、FIB、LMR、LWR、NWR、MWR、MLR、PLT、PWR、TNF-α、WBC预测试验组接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者死亡的最佳截断值分别为5.48×109/L、2.33×109/L、0.46×109/L、91.66 U/L、37.46 g/L、2.94、1.79、4.28 μg/L、201.65 U/L、154.36、50.08 ng/L、17.65 ng/L、1.11×109/L、4.55 g/L、4.07、0.26、0.72、0.074、0.32、361.30×109/L、40.68、42.05 μg/L、9.30×109/L。
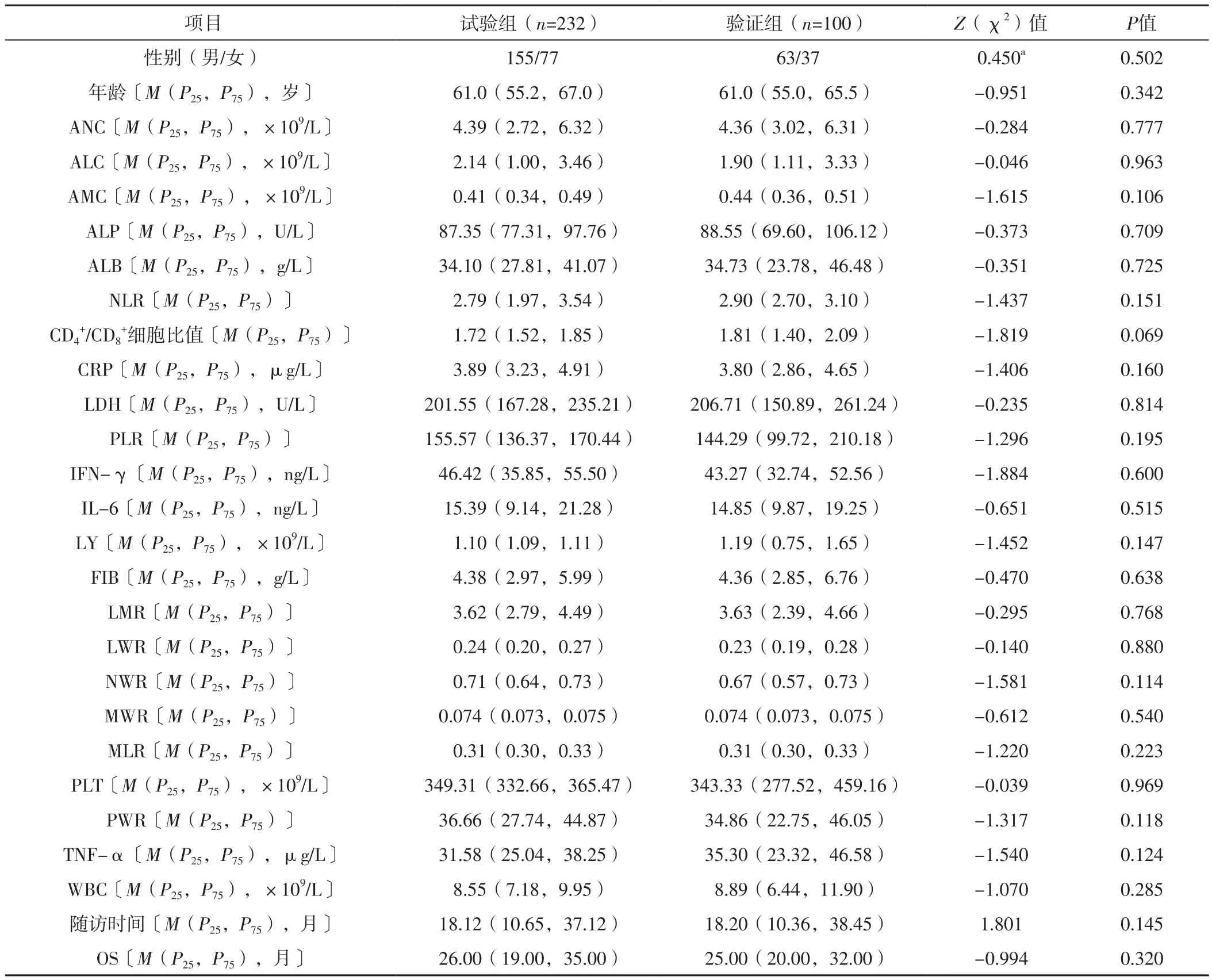
表1 两组临床资料比较Table 1 Comparison of clinical data between the two groups
2.2 接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者死亡影响因素的单因素、多因素Cox回归分析 以接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者死亡情况为因变量(赋值:死亡=1,生存=0),分别以血常规指标为自变量进行单因素Cox回归分析,结果显示,NLR、LDH、PLR、FIB是接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者死亡的影响因素(P<0.05),见表2。以接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者死亡情况为因变量(赋值:死亡=1,生存=0),上述有统计学差异的变量为自变量,进行多因素Cox回归分析,结果显示,NLR、LDH、PLR、FIB是接受EGFRTKIs治疗的EGFR突变阳性NSCLC患者死亡的独立影响因素(P<0.05),见表3。
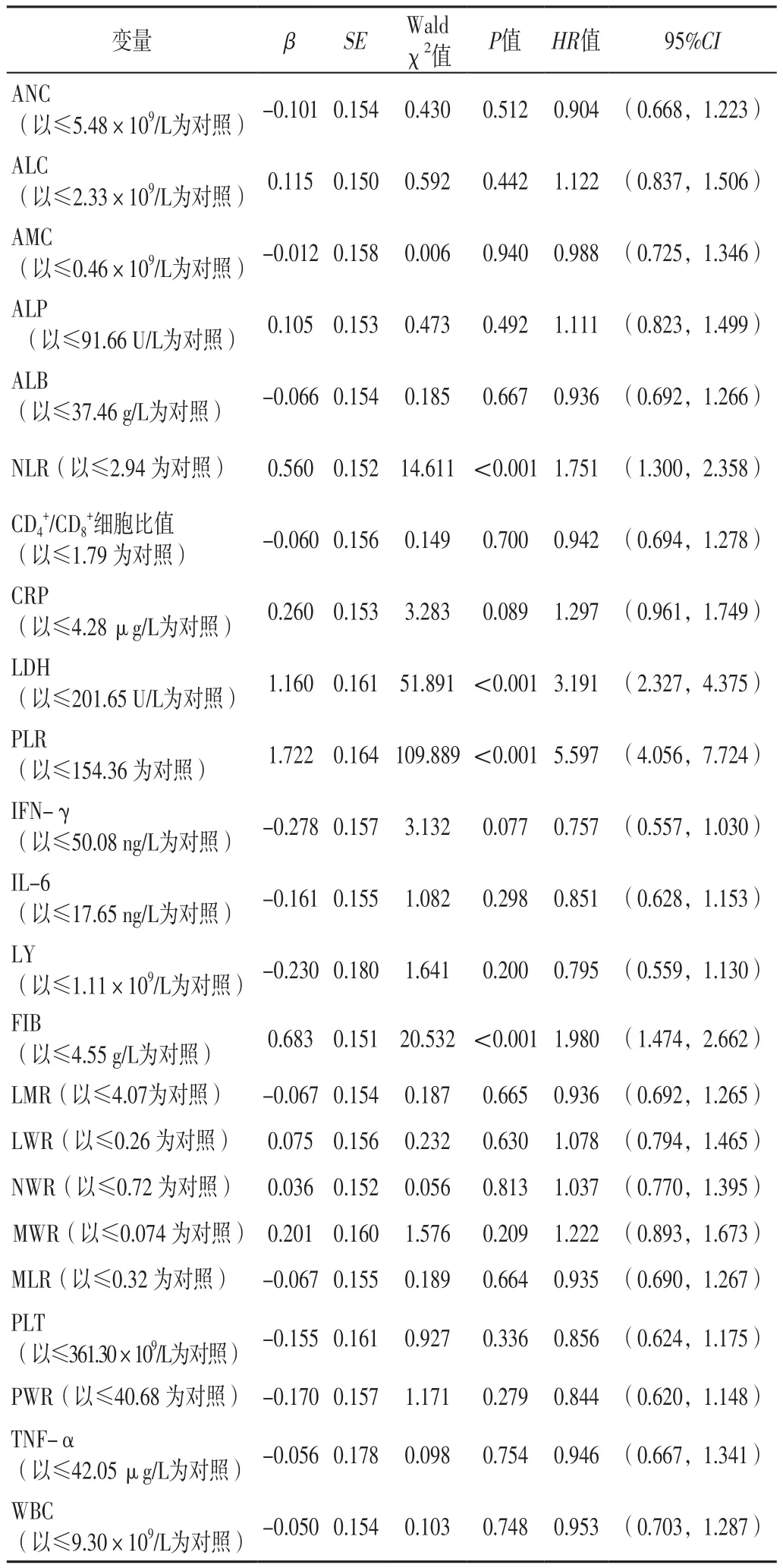
表2 接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者死亡影响因素的单因素Cox回归分析Table 2 Univariate Cox regression analysis of influencing factors of death in patients with EGFR mutation-positive NSCLC treated with EGFR-TKIs
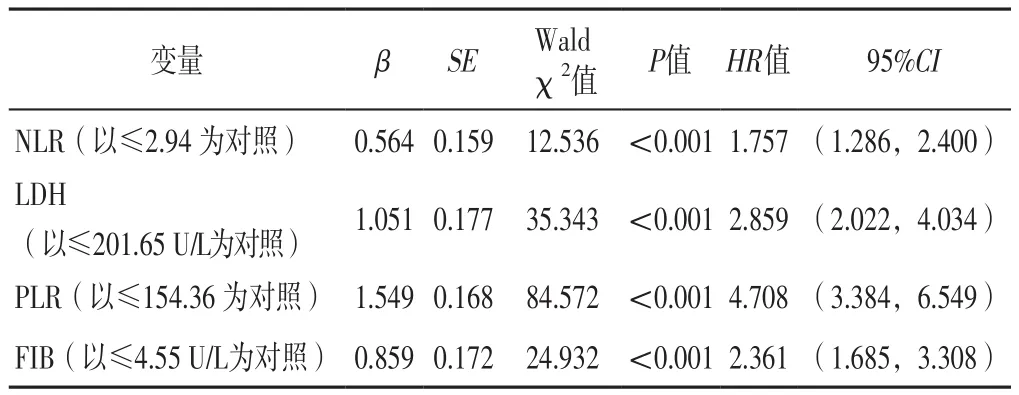
表3 接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者死亡影响因素的多因素Cox回归分析Table 3 Multivariate Cox regression analysis of influencing factors of death in patients with EGFR mutation-positive NSCLC treated with EGFR-TKIs
2.3 接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者预后预测列线图模型的构建及验证 基于多因素Cox回归分析结果,构建接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者预后预测列线图模型,见图1。该列线图模型预测试验组接受EGFRTKIs治疗的EGFR突变阳性NSCLC患者1、2、3年生存率的CI分别为0.86、0.80、0.78,预测验证组接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者1、2、3年生存率的CI分别为0.89、0.84、0.80。校准曲线分析结果显示,该列线图模型预测试验组、验证组接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者1、2、3年生存率与患者实际1、2、3年生存率基本一致,见图2~3。ROC曲线分析结果显示,该列线图模型预测试验组、验证组接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者生存情况的AUC分别为0.896〔95%CI(0.848,0.945)〕、0.833〔95%CI(0.826,0.940)〕,见图4。
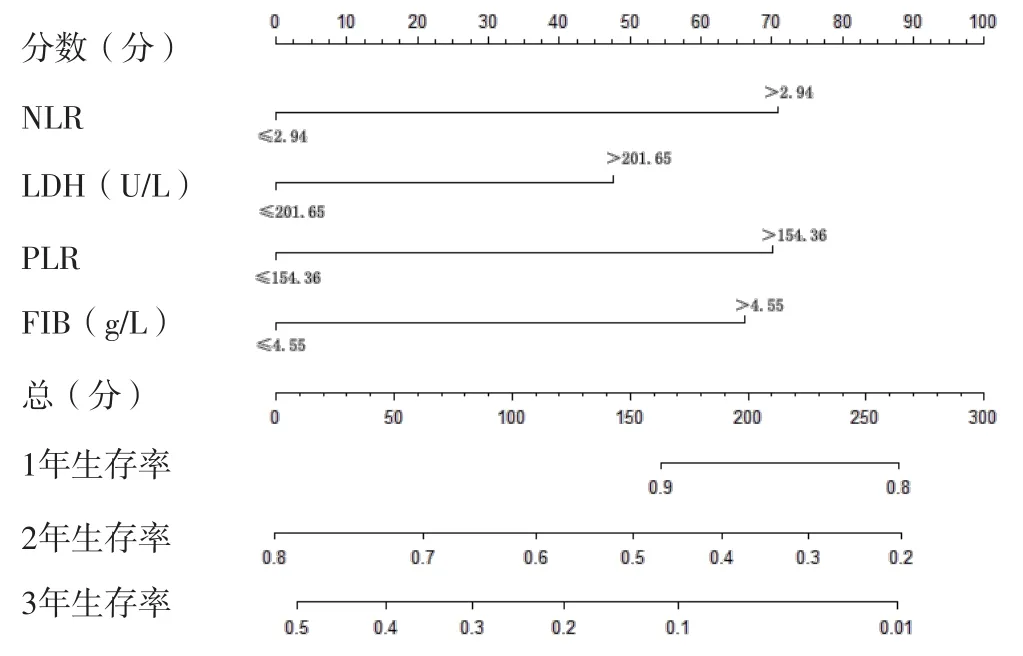
图1 接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者预后预测列线图模型Figure 1 Nomogram model for predicting prognosis of patients with EGFR mutation-positive NSCLC treated with EGFR-TKIs
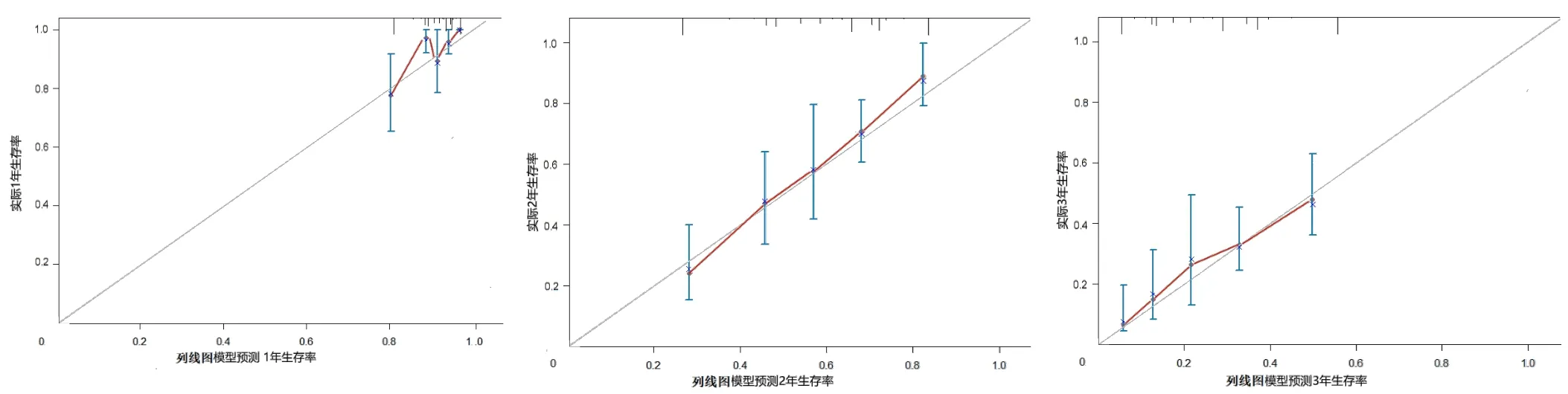
图2 列线图模型预测试验组接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者1、2、3年生存率的校准曲线Figure 2 Calibration curve of nomogram model for predicting 1-year,2-year and 3-year survival rates of patients with EGFR mutation-positive NSCLC treated with EGFR-TKIs in the experimental group

图3 列线图模型预测验证组接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者1、2、3年生存率的校准曲线Figure 3 Calibration curve of nomogram model for predicting 1-year,2-year and 3-year survival rates of patients with EGFR mutation-positive NSCLC treated with EGFR-TKIs in the validation group
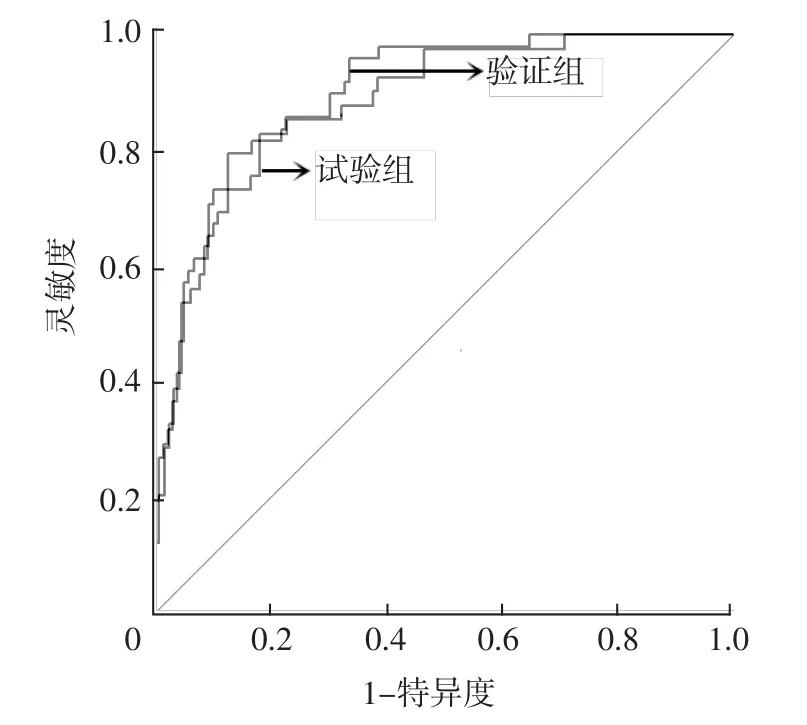
图4 列线图模型预测接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者生存情况的ROC曲线Figure 4 ROC curve of nomogram model for predicting survival of patients with EGFR mutation-positive NSCLC treated with EGFR-TKIs
3 讨论
NSCLC的恶化程度较高,患者死亡率也处于较高水平,对于NSCLC早期患者多采用手术切除联合放化疗的治疗手段。近年来随着基因检测技术的发展,以EGFR-TKIs为代表的靶向治疗逐渐成为EGFR突变阳性NSCLC患者的一线治疗方案,其在一定程度上延长了患者的OS,提高了患者生活质量和治疗依从性,但部分患者的预后仍不理想,5年生存率仅为15%[10]。寻找可以准确预测EGFR突变阳性NSCLC患者预后的临床指标,对其个性化用药方案的制定及治疗效果的评估有重要的临床价值[11]。外周血液与肿瘤有同源的基因,能有效克服肿瘤异质性,较为完整地反映原发肿瘤的基因突变状态,其检测技术为非侵入性操作且简便,是目前探索高效指标的重要方向[7]。
本研究多因素Cox回归分析结果显示,NLR、LDH、PLR、FIB是接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者死亡的影响因素,相比于低水平的NLR、LDH、PLR、FIB,高水平NLR、LDH、PLR、FIB的患者死亡风险更高。全身炎症反应与肿瘤血管生成、抑制细胞凋亡和DNA损伤有关,大量研究表明全身炎症反应加重与多种肿瘤患者预后较差明显相关[12-14]。NLR和PLR是全身炎症反应的重要标志物,中性粒细胞可通过释放细胞因子和趋化因子与肿瘤微环境相互作用,促进肿瘤细胞增殖,从而影响患者预后。而淋巴细胞在抗肿瘤免疫反应中起重要作用,NLR明显升高是炎症反应后中性粒细胞升高、淋巴细胞降低的细胞间不平衡的表现,提示免疫系统功能失调可能增加患者死亡风险[15]。SEBASTIAN等[16]回顾性分析了156例立体定向全身放射治疗6个月后NSCLC患者的临床资料,单因素Cox回归分析结果显示,治疗前患者NLR>3.6与总体生存率较差相关〔HR=2.00,95%CI(1.18,3.39),P=0.010〕。MINAMI等[17]研究结果显示,治疗前NLR<2.11的患者OS明显长于NLR≥2.11的患者,多因素分析证实治疗前较高的NLR是NSCLC患者死亡的危险因素。因此,NLR可能作为判断接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者病情进展的指标。一项包含5 524例NSCLC患者的Meta分析结果显示,较高PLR组的OS明显短于较低PLR组〔HR=1.69,95%CI(1.45,1.97),P<0.001〕,提示PLR升高与NSCLC患者的预后较差有关[18]。PLR升高主要表现为血小板相对增加和淋巴细胞相对减少,血小板水平升高可引起机体释放血管内皮生长因子,促进肿瘤血管新生,并分泌炎症因子,促进上皮间质转化及肿瘤细胞增殖和侵袭,而血小板聚集能够促进循环肿瘤细胞的黏附和包裹,增强了肿瘤细胞免疫逃逸的能力[19]。血小板与肿瘤细胞的相互作用构成了肿瘤进展的重要病理生理机制,利用阿司匹林等非甾体类抗炎药和其他抗血小板药物辅助治疗,可能会开启NSCLC治疗的新模式。TANIGUCHI等[20]研究发现,在接受纳武利尤单抗治疗的晚期NSCLC患者中,基线LDH>240 U/L的患者无进展生存期(progressionfree survival,PFS)明显短于LDH≤240 U/L的患者。LDH活性增加可导致乳酸的产生和细胞外组织液的酸化,而酸性细胞外液已被证明能够激活明胶酶活性和组织蛋白酶的产生,从而有助于增强癌细胞侵袭能力[21]。FIB是人体血浆成分中含量最高的凝血因子,其参与凝血酶的转化和凝血块的形成。此外,升高的FIB可促进血管生成,并作为细胞外基质促进肿瘤细胞转移。目前FIB已被认为是结肠癌、子宫癌、宫颈癌和乳腺癌等癌症的重要预后因素,在NSCLC的研究中也有相似的发现[22-25]。LIANG等[26]回顾性分析了456例行根治性手术切除的NSCLC患者资料,发现术前FIB≤3.77 g/L组患者5年生存率为43.5%,高于术前FIB>3.77 g/L组患者的生存率(29.0%);中位OS为48.0个月,长于术前FIB>3.77 g/L组患者的中位OS(26.0个月)。因此治疗前应检测NLR、LDH、PLR、FIB,对可能存在死亡风险的患者进行分层处理,并积极采取干预措施,调整个体化给药方案,以延长患者生存期及提高其生活质量。
相较于TNM分期预后评估体系,列线图可集成各种预测指标,可计算患者的生存率,具有较高的准确性和实用性。本研究结果显示,该列线图模型预测试验组接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者1、2、3年生存率的CI分别为0.86、0.80、0.78,预测验证组接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者1、2、3年生存率的CI分别为0.89、0.84、0.80。校准曲线分析结果显示,该列线图模型预测试验组、验证组接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者1、2、3年生存率与患者实际1、2、3年生存率基本一致。ROC曲线分析结果显示,该列线图模型预测试验组、验证组接受EGFRTKIs治疗的EGFR突变阳性NSCLC患者生存情况的AUC分别为0.896、0.833,说明该列线图具有较高的预测效能。
综上所述,NLR、LDH、PLR、FIB是接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者死亡的影响因素,本研究基于上述指标构建的列线图模型能有效预测接受EGFR-TKIs治疗的EGFR突变阳性NSCLC患者的生存率。但本研究为单中心、小样本量、回顾性研究,未来需要大样本量、多中心研究进一步验证该列线图模型的可靠性。
作者贡献:黄维佳、曹健斌进行文章的构思与设计;李竞长和张东伟进行文章的可行性分析;黄维佳、何凌云、李富骊、伍义文进行相关文献资料的收集、整理;黄维佳撰写论文;黄维佳、李逢昌等进行论文的修订、英文的修订;曹健斌负责文章质量控制及审校;黄维佳、曹健斌对文章整体负责、监督管理。
本文无利益冲突。
