术前免疫检查点抑制剂联合化疗治疗可切除Ⅲ期非小细胞肺癌的疗效及患者近期预后的影响因素分析
2022-09-28杨森谢颂平龙杏林张文涵黄杰
杨森,谢颂平,龙杏林,张文涵,黄杰
肺癌是全世界发病率居第二和死亡率居第一的恶性肿瘤[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌患者的80%~85%,早期NSCLC患者无明显症状和体征,导致确诊时约1/3的患者处于局部进展期(Ⅲ期)[2],而Ⅲ期NSCLC患者5年生存率为13%~36%[3]。对于初诊可接受手术治疗的患者,即使接受了手术治疗,5年生存率仍然较低(20%~35%)[4],表明此时已经丧失了最佳手术治疗时机。通过对Ⅲ期NSCLC患者进行新辅助免疫治疗,如化疗、放疗及靶向治疗等,然后再进行手术切除治疗可以明显改善其预后[5-8]。
免疫检查点抑制剂(immune checkpoint inhibitor,ICI)治疗黑色素瘤、霍奇金淋巴瘤、肾细胞癌等疗效确切[9],近年来其已成为Ⅲ期NSCLC患者新辅助免疫治疗的选择。常规治疗药物通常直接作用于肿瘤细胞或者通过阻断突变蛋白或生化途径而抑制和靶向破坏肿瘤细胞,ICI可特异性结合免疫检查点,如程序性死亡受体1(programmed death-1,PD-1)、程序性死亡配体1(programmed death-ligand 1,PD-L1)等,从而破坏T淋巴细胞与抗原呈递细胞之间的抑制性信号通路,解除肿瘤细胞免疫逃逸机制,进而增强内源性抗肿瘤免疫应答,对肿瘤细胞进行有效杀伤,达到抗肿瘤的效果[10]。多项研究显示,新辅助免疫治疗较新辅助化疗治疗的有效率更高,尤其是新辅助免疫治疗联合化疗方案更具有优势[11-14]。目前国内有关ICI联合化疗的研究选取的研究对象是ⅠB期~ⅢB期NSCLC患者[15-16]。ICI联合化疗在可切除Ⅲ期NSCLC患者中的疗效及安全性未检索到相关研究。本研究分析ICI联合化疗治疗可切除Ⅲ期NSCLC的疗效,并探讨患者近期预后的影响因素。
1 对象与方法
1.1 纳入与排除标准 纳入标准:(1)年龄18~70岁,性别不限;(2)病理检查确诊为NSCLC,且基因检测显示表皮生长因子受体(epidermal growth factor receptor,EGFR)/间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)阴性的ⅢA或ⅢB期患者;(3)可行手术切除治疗;(4)未发生远处转移;(5)既往未接受过放化疗、靶向药物或免疫治疗药物等相关抗肿瘤治疗;(6)美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分为0~2分[17],可以耐受新辅助免疫治疗;(7)肺功能检查结果支持预期的手术切除治疗,第1秒用力呼气容积≥1.5 L(全肺切除术患者≥2.0 L)[18-19]。排除标准:(1)存在手术禁忌证者;(2)患有自身免疫性疾病或免疫功能障碍、近期或长期使用免疫抑制药物者;(3)合并其他恶性肿瘤者;(4)合并肺纤维化、间质性肺病、尘肺病、慢性阻塞性肺疾病者;(5)肝肾功能障碍或存在严重心脑血管疾病者。
1.2 研究对象 回顾性收集2019年1月至2021年5月武汉大学人民医院收治的可切除Ⅲ期NSCLC患者45例为研究对象,其中男31例,女14例;年龄45~70岁,平均(59.8±7.8)岁;吸烟26例;病理类型:肺鳞状细胞癌24例,肺腺癌15例,其他(包括大细胞肺癌和肺腺鳞癌)6例;肿瘤分期:ⅢA期30例,ⅢB期15例;ECOG评分0~1分24例,2分21例。
1.3 资料收集 收集患者的性别、年龄、吸烟史、病理类型、肿瘤分期、ECOG评分,治疗前1周内的中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)、乳酸脱氢酶(lactate dehydrogenase,LDH)、营养预后指数(prognostic nutrition index,PNI)、PD-L1表达水平。
1.4 ICI联合化疗治疗方案 患者采用ICI联合含铂双药化疗方案。ICI为PD-1抑制剂——卡瑞利珠单抗(苏州盛迪亚生物医药有限公司生产,国药准字S20190027)200 mg,静脉滴注,第1天。化疗方案:(1)肺鳞状细胞癌:白蛋白结合型紫杉醇(江苏恒瑞医药股份有限公司生产,国药准字H20183378,260 mg/m2)+顺铂(齐鲁制药有限公司生产,国药准字H37021356,75 mg/m2)或奈达铂(先声药业有限公司生产,国药准字H20030884,75 mg/m2);紫杉醇(南京绿叶制药有限公司生产,国药准字H20030357,175 mg/m2)+顺铂(75 mg/m2)。(2)肺腺癌:培美曲塞(四川汇宇制药有限公司生产,国药准字H20173301,500 mg/m2)+奈达铂(75 mg/m2)。(3)大细胞肺癌:依托泊苷(齐鲁制药有限公司生产,国药准字H37023183,50 mg/m2)+顺铂(75 mg/m2)。(4)肺腺鳞癌:吉西他滨(南京正大天晴制药有限公司生产,国药准字H20093404,1 000 mg/m2)+顺铂(75 mg/m2)。均为静脉滴注,第1天。21 d为1个周期,每2个周期对患者进行一次疗效评估。
1.5 疗效评估、术后病理学评估及毒副作用 (1)每2个周期复查胸部CT,按照实体瘤评价标准1.1版(RECIST 1.1)[20]进行疗效评估:①完全缓解(complete response,CR):治疗后肿瘤病灶完全消失,时间至少维持1个月;②部分缓解(partial response,PR):治疗后肿瘤病灶较治疗前缩小≥30%,时间至少维持1个月;③病情稳定(stable disease,SD):治疗后肿瘤病灶较治疗前缩小<30%或增大<20%;④疾病进展(progressive disease,PD):治疗后肿瘤病灶较治疗前增大≥20%。计算客观缓解率(objective response rate,ORR)及疾病控制率(disease control rate,DCR),ORR=(CR例数+PR例数)/总例数×100%,DCR=(CR例数+PR例数+SD例数)/总例数×100%。(2)术后病理学评估:①主要病理缓解(major pathologic response,MPR):新辅助免疫治疗诱导的肿瘤消退在病理上残留肿瘤<10%;②病理完全缓解(pathologic complete response,pCR):新辅助免疫治疗诱导的肿瘤消退在病理上未见残留肿瘤[21]。本研究以MPR为可切除Ⅲ期NSCLC患者近期预后评定指标,并根据其将患者分为MPR组与非MPR组。(3)治疗结束后1个月内按美国国立癌症研究所通用毒性标准[22]评估药物毒副作用。
1.6 手术方法 手术方法采用开胸手术或电视辅助胸腔镜手术(video-assisted thoracic surgery,VATS),行标准化的肺病灶切除术与系统性纵隔淋巴结清扫术。
1.7 手术情况、术后住院时间及术后并发症 统计患者的手术方式、手术时间、手术失血量、术后引流量、术后住院时间及术后并发症发生情况。
1.8 随访 术后3个月及术后6个月进行门诊随访,随访截至2021-12-31,若患者出现NSCLC原位复发或远处复发转移,随访时间提前截止。
1.9 统计学方法 采用SPSS 26.0统计学软件进行数据处理。计数资料以相对数表示,组间比较采用χ2检验;计量资料符合正态分布以(±s)表示,两组间比较采用独立样本t检验;采用ROC曲线分析探讨NLR、PLR、LDH、PNI预测可切除Ⅲ期NSCLC患者近期预后的AUC和最佳截断值;采用多因素Logistic回归分析探讨可切除Ⅲ期NSCLC患者近期预后的影响因素。以P<0.05为差异有统计学意义。
2 结果
2.1 ICI联合化疗治疗效果及毒副作用 45例患者完成ICI联合化疗1~4个周期,其中完成1个周期2例、2个周期26例、3个周期15例、4个周期2例。CR 4例,PR 23例,SD 14例,PD 4例,ORR为60.0%(27/40),DCR为91.1%(41/45)。ICI联合化疗过程中出现反应性皮肤毛细血管增生症/皮疹31例(68.9%)、血红蛋白降低22例(48.9%)、白细胞降低19例(42.2%)、血小板降低17例(37.8%)、转氨酶异常17例(37.8%)、恶心呕吐7例(15.6%)、腹泻6例(13.3%)、便秘3例(6.7%)、心肌酶异常2例(4.4%);其中Ⅲ级及以上毒副作用4例(8.9%),包括血红蛋白降低2例、白细胞降低1例、血小板降低1例。
2.2 手术情况、术后住院时间、术后并发症、随访情况ICI联合化疗治疗过程中,因原发灶大小未变化但出现纵隔淋巴结肿大(2例)、原发灶加重并伴有新增的纵隔淋巴结肿大(2例)、突发急性脑梗死(1例),5例患者未行手术治疗,最终完成手术治疗者40例,手术切除率为88.9%,末次治疗到手术时间为22~42 d。手术方式:单肺叶切除30例,双肺叶切除5例,左全肺切除3例,袖式肺叶切除2例;其中VATS 28例,开胸手术12例(4例由VATS转为开胸手术)。手术时间161~213 min,手术出血量200~450 ml,术后引流量475~750 ml,术后住院时间3~7 d。术后并发症:轻型肺炎17例(42.5%)、心房颤动7例(17.5%)、心功能不全4例(10.0%)、肺不张3例(7.5%)、肺动脉栓塞1例(2.5%)。患者术后随访6个月,无肿瘤复发及转移。
2.3 近期预后 接受手术治疗的40例患者中,术后病理结果显示,达到MPR 22例(55.0%)(其中pCR 10例),未达到MPR 18例(45.0%)。ROC曲线分析结果显示,NLR预测可切除Ⅲ期NSCLC患者近期预后的AUC为0.838,最佳截断值为3.02;PLR预测可切除Ⅲ期NSCLC患者近期预后的AUC为0.813,最佳截断值为157.5;LDH预测可切除Ⅲ期NSCLC患者近期预后的AUC为0.761,最佳截断值为248.5 U/L;PNI预测可切除Ⅲ期NSCLC患者近期预后的AUC为0.515,无预测价值,以中位数49.0为截断值。MPR组与非MPR组性别、年龄、有吸烟史者所占比例、病理类型、肿瘤分期、PNI比较,差异无统计学意义(P>0.05);MPR组与非MPR组ECOG评分、NLR、PLR、LDH及PDL-1表达水平比较,差异有统计学意义(P<0.05),见表1。
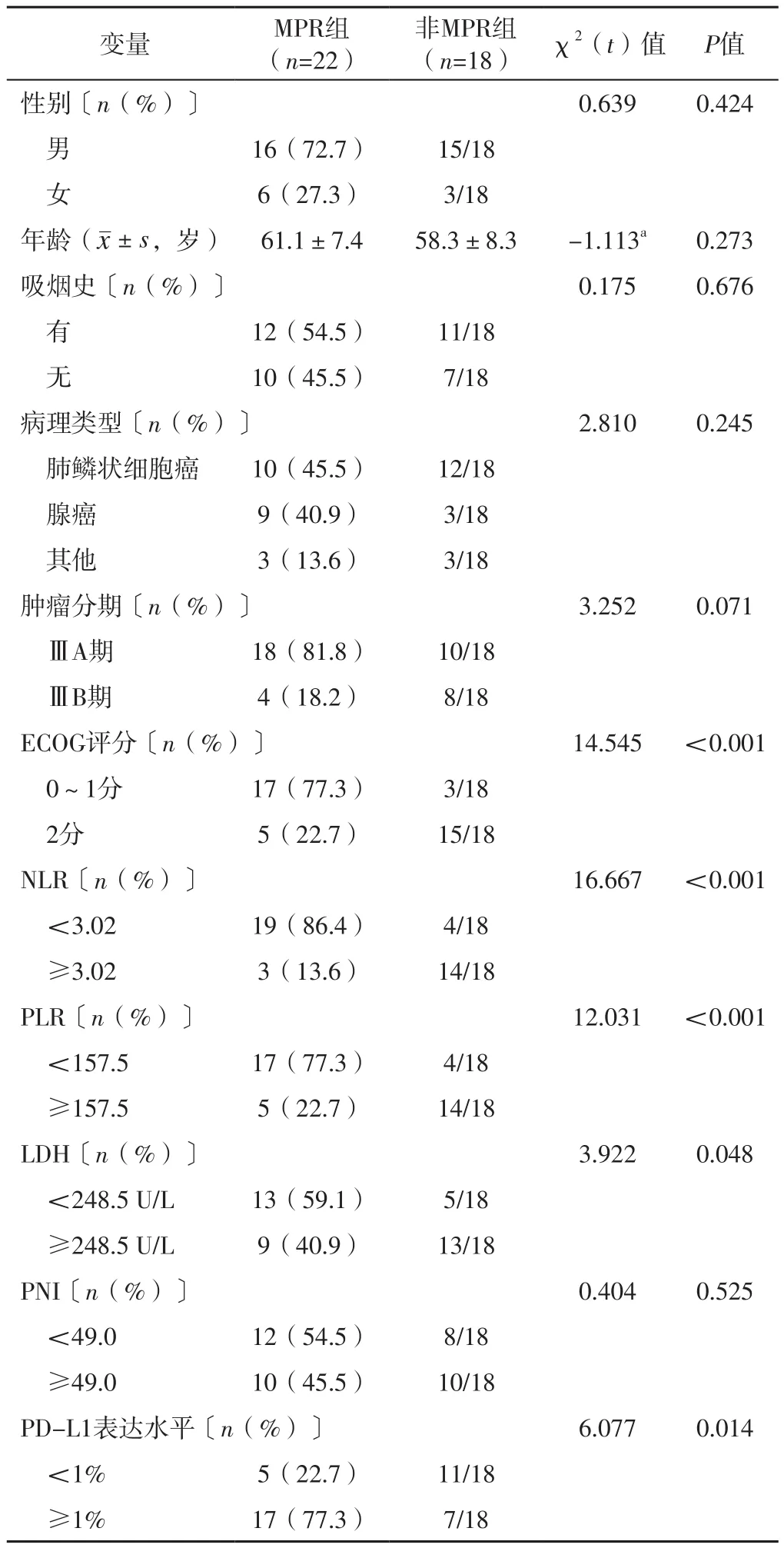
表1 MPR组与非MPR组临床资料比较Table 1 Comparison of clinical data between MPR group and non-MPR group
2.4 可切除Ⅲ期NSCLC患者近期预后影响因素分析以可切除Ⅲ期NSCLC患者近期预后为因变量(赋值:MPR=1,非MPR=0),以单因素分析差异有统计学意义的指标ECOG评分(赋值:2分=1,0~1分=0)、NLR(赋值:≥3.02=1,<3.02=0)、PLR(赋值:≥157.5=1,<157.5=0)、LDH(赋值:≥248.5 U/L=1,<248.5 U/L=0)和PDL-1表达水平(赋值:≥1%=1,<1%=0)为自变量,进行多因素Logistic回归分析,结果显示,ECOG评分、NLR是可切除Ⅲ期NSCLC患者近期预后的影响因素(P<0.05),见表2。
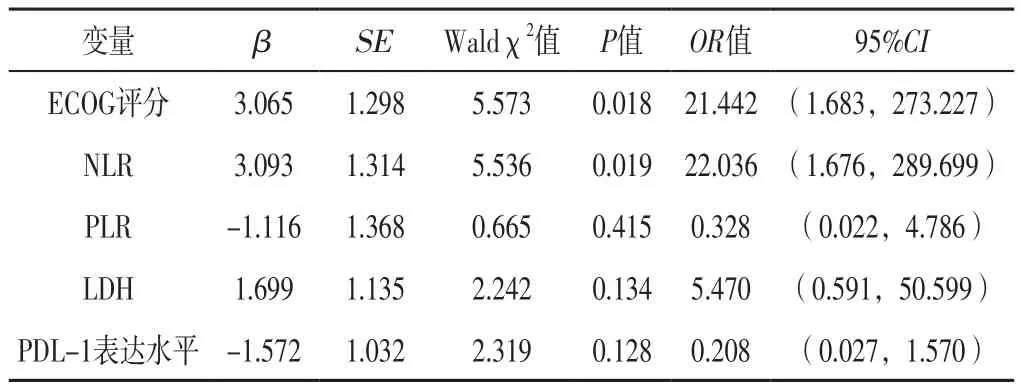
表2 可切除Ⅲ期NSCLC患者近期预后影响因素的多因素Logistic回归分析Table 2 Multivariate Logistic regression analysis of influencing factors of short-term prognosis of resectable stage Ⅲ NSCLC patients
3 讨论
对于ⅢA期NSCLC患者,手术切除原发肿瘤和区域淋巴结是最有效的局部治疗方法[23],对于部分ⅢB期患者,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南也建议进行手术治疗及术后化疗[24]。由于术后局部微残留和微转移是肺癌完全切除后复发的主要原因[25],Ⅲ期NSCLC具有系统性疾病的潜在特征,因此该类患者首选局部治疗和全身控制方法。研究显示,术前通过新辅助免疫治疗可以导致死亡肿瘤细胞释放新抗原,刺激肿瘤中新抗原特异性T细胞的启动和扩张,在术前杀灭更多的肿瘤细胞[26]。由于术前诱导产生的免疫反应可促使机体产生长期免疫记忆,ICI在新辅助免疫治疗中的作用可能优于辅助治疗,术后患者因肿瘤切除难以产生免疫介导的持续抗肿瘤效应[27],因此使用ICI作为一种新辅助免疫治疗可能优于使用其作为一种辅助治疗。同时,加入铂类诱导治疗可以增加肿瘤细胞和微环境中免疫细胞中PD-L1的表达。FOURNEL等[28]研究显示,接受新辅助免疫治疗联合顺铂治疗的NSCLC患者PD-L1染色呈阳性,其中9例(23.1%)患者的肿瘤细胞PD-L1染色由<50%转为≥50%。提示含铂类药物可以协同PD-1/PD-L1抑制剂提高临床疗效。
目前肺癌新辅助免疫治疗主要有三种方式:单免疫治疗、双免疫联合治疗和免疫治疗联合化疗[29]。2018年FORDE等[11]发表在《新英格兰医学杂志》上的CheckMate-159研究首次探讨了新辅助免疫治疗对Ⅰ期~ⅢA期NSCLC的疗效和安全性,结果显示,获得了45%的MPR率和15%的pCR率。NADIM研究[12]是首个采用纳武单抗联合紫杉醇+卡铂新辅助免疫治疗可切除ⅢA期NSCLC患者的临床研究,纳入的46例患者中41例肿瘤完全切除,肿瘤完全切除的患者中MPR率为83%,pCR率为71%,ORR为93%。本研究中患者例数和完成手术人数与NADIM研究相似,但MPR率(55.0%)、pCR率(25.0%)、ORR(60.0%)均低于NADIM研究,但与采用单免疫治疗的CheckMate-159研究[11]比较,本研究MPR率及pCR率略高。分析原因可能是因为本研究患者中存在一定比例(15/45)的ⅢB期NSCLC患者,且新辅助免疫治疗过程中因原发灶大小未变化但出现纵隔淋巴结肿大、原发灶加重并伴有新增的纵隔淋巴结肿大等原因不能接受后续手术治疗的患者有3例,均为ⅢB期,完成手术治疗的12例ⅢB期NSCLC患者中8例未达到MPR,提示免疫治疗联合化疗方案可能是此类患者新辅助免疫治疗更合理的选择。NCT02716038研究[13]采用含铂双免疫联合治疗NSCLC患者,其中77%(23/30)的患者为ⅢA期,97%(29/30)的患者新辅助免疫治疗后行手术治疗,87%(26/30)的患者行肿瘤完全切除术,57%(17/30)的患者达到MPR,本研究MPR率与之相近。
新辅助免疫治疗后患者可因严重毒副作用或因治疗无效后PD而失去最佳手术时间。目前,大多数研究中新辅助免疫治疗为2个周期,一般于新辅助免疫治疗后2~6周内实施手术[11-13,30-32]。本研究末次治疗到手术时间为22~42 d,不存在手术延迟情况。同时,新辅助免疫治疗后手术难度可能会增加,因肿瘤细胞坏死、淋巴细胞和巨噬细胞浸润、纤维组织修复等导致肺门难以解剖,这种组织学改变在肺门、纵隔淋巴结阳性患者中尤为明显[33-34]。本研究中40例完成手术治疗的患者中行VATS 28例,开胸手术12例(4例由VATS转为开胸手术)。在CheckMate-159研究[11]中,21例患者中20例完成肿瘤完全切除术,在13例行胸腔镜或机器人辅助微创手术的患者中,7例因粘连严重中转行开放性手术;患者中位手术时间为228 min,中位手术出血量为100 ml,术后中位住院时间为4 d,无手术相关死亡事件发生,术后并发症发生率为50%,包括房性心律失常(30%)、肺炎(5%)、肺栓塞(5%)、心肌梗死(5%)、肺漏气(5%)等。本研究中,手术时间较CheckMate-159研究短,手术出血量较CheckMate-159研究多。术后并发症方面,多数患者因肺部手术出现轻型肺炎,通过鼓励患者咳嗽排痰、抗生素预防感染、雾化药物干预等,出院时患者肺部炎症消退。1例肺动脉栓塞患者经抗凝及对症处理后安全出院,患者无手术相关死亡事件发生。NCT02716038研究[13]中最常见的Ⅲ~Ⅳ级毒副作用是中性粒细胞降低(50%)、转氨酶升高(14%)和血小板降低(7%),严重的毒副作用为Ⅲ级发热性中性粒细胞减少(1例)、Ⅳ级高血糖(1例)、Ⅱ级支气管肺出血(1例)。本研究中多数患者毒副作用为Ⅰ~Ⅱ级,Ⅲ级及以上毒副作用发生率相对较低,停用新辅助免疫治疗后情况好转。本研究反应性皮肤毛细血管增生症/皮疹发生率最高,均为Ⅰ~Ⅱ级,有研究表明,皮肤病学不良事件在使用新辅助免疫治疗的患者中很常见,出现反应性皮肤毛细血管增生症/皮疹与药物剂量有关,因此应慎重考虑患者的用药剂量,必要时可考虑加用抗血管生成药物以减少反应性皮肤毛细血管增生症/皮疹的发生[35]。
寻找简便、经济、高效的预测因子对于接受新辅助免疫治疗患者的预后判断是必要的。本研究结果显示,ECOG评分是可切除Ⅲ期NSCLC患者近期预后的影响因素。ECOG评分越低,患者体力状况越好,免疫功能更健全,有利于杀伤肿瘤细胞。全身炎性标志物已经逐渐成为多种肿瘤患者预后的生物标志物[36-37],中性粒细胞是癌症相关炎症的主要成分,中性粒细胞增多可以抑制淋巴细胞和自然杀伤细胞增殖,从而促进肿瘤的进展[38]。PAVAN等[39]研究显示,在接受抗PD-1/PD-L1免疫治疗的184例晚期NSCLC患者中,与基线高NLR(NLR≥3)组比较,基线低NLR(NLR<3)组患者中位无进展生存期(progression-free survival,PFS)及总生存期(overall survival,OS)更长,病理反应也更好,NLR是晚期NSCLC患者预后的预测因子。本研究结果显示,NLR预测可切除Ⅲ期NSCLC患者近期预后的AUC为0.838,NLR是可切除Ⅲ期NSCLC患者近期预后的影响因素,与PAVAN等[39]研究结果基本吻合。
纳入13项研究的Meta分析结果显示,PLR可预测NSCLC患者的OS(P<0.001);亚组分析结果显示,亚洲人群和高加索人群中PLR均可预测NSCLC患者的OS;同时对于采用手术治疗或非手术治疗的NSCLC患者,PLR亦可预测其OS[40]。PLR可能是预测NSCLC患者预后的生物标志物。本研究中PLR预测可切除Ⅲ期NSCLC患者近期预后的AUC为0.813,最佳截断值为157.5,但多因素Logistic回归分析并未发现PLR是可切除Ⅲ期NSCLC患者近期预后的独立影响因素。
本研究单因素分析结果显示,PD-L1表达水平可能与可切除Ⅲ期NSCLC患者近期预后相关;但多因素Logistic回归分析并未发现PDL-1表达水平是可切除Ⅲ期NSCLC患者近期预后的独立影响因素。PD-L1表达水平能否预测接受新辅助免疫治疗患者的预后尚存在争议[41]。PD-L1并不是一个理想的生物标志物,因为部分低PD-L1表达水平的患者对新辅助免疫治疗有反应,而另一些高PD-L1表达水平的患者对新辅助免疫治疗没有反应[42]。且PD-L1的检测方法与技术、检测时的环境条件以及PD-L1截断值的不同均可导致研究结果的不一致。因此PD-L1表达水平作为接受新辅助免疫治疗患者预后预测因子的可靠性欠佳。
综上所述,ICI联合化疗治疗可切除Ⅲ期NSCLC患者的临床疗效确切,毒副作用大部分为Ⅰ~Ⅱ级,具有一定安全性,大部分患者治疗后可进行手术治疗,术后MPR为55.0%,pCR为25.0%,ECOG评分、NLR是可切除Ⅲ期NSCLC患者近期预后的影响因素。但本研究尚存在一定局限性:本研究为回顾性研究且样本量较少,需扩大样本量、进行前瞻性研究;需联合其他生物标志物提高预测效能;由于纳入的患者中部分年龄较大,检测指标可能会受到心脑血管疾病以及代谢相关疾病的影响,今后可进行分层研究。
作者贡献:杨森进行文章的构思与设计、资料整理、论文撰写、统计学处理;黄杰进行研究的实施与可行性分析,负责文章的质量控制及审校,对文章整体负责、监督管理;杨森、龙杏林、张文涵进行资料收集;杨森、谢颂平进行论文的修订。
本文无利益冲突。
