一氧化碳中毒迟发性脑病大鼠海马组织神经元凋亡情况及机制研究
2022-09-28傅永旺张玉武艳芳
傅永旺,张玉,武艳芳
急性一氧化碳(carbon monoxide,CO)中毒后3%~30%的患者经过2~3周的“假愈期”后出现记忆力下降、精神行为异常、运动障碍及尿便障碍等一系列临床表现,称为一氧化碳中毒迟发性脑病(delayed encephalopathy after acute carbon monoxide poisoning,DEACMP)[1-2]。目前,DEACMP的发病机制尚不清楚,而促凋亡因子半胱氨酸天冬氨酸蛋白酶(cysteinyl aspartate-specific proteinase,Caspase)-3和抗凋亡因子B细胞淋巴瘤蛋白2(B cell lymphoma-2,Bcl-2)是目前发现的非常重要的凋亡因子,二者在脑缺血再灌注损伤中发挥着重要作用[3-4]。同时,CO中毒诱导的脑损伤与典型的缺血再灌注损伤极相似,但在脑缺血再灌注损伤过程中发挥重要凋亡作用的Caspase-3、细胞色素C(cytochrome C,CytC)、Bcl-2在DEACMP发病中的作用尚不清楚。本研究拟构建DEACMP大鼠模型,旨在分析其海马神经元凋亡情况及机制。
1 材料与方法
1.1 实验动物 本实验时间为2021年3月。选取6周龄雄性SD大鼠30只,SPF级,由长沙市天勤生物技术有限公司提供,许可证号:SCXK(湘)2019-0014。实验动物饲养条件:温度20~26 ℃,湿度40%~70%,所有实验按照国家实验动物饲养和使用指南进行。
1.2 主要仪器和试剂 TUNEL细胞凋亡检测试剂盒(上海碧云天生物技术有限公司,C1088),活性氧检测试剂盒(武汉伊莱瑞特生物科技股份有限公司,E-BC-K138-F),辣根酶标记山羊抗鼠IgG(H+L)(北京中杉金桥生物技术有限公司,ZB-2305),兔抗Caspase-3(江苏亲科生物研究中心有限公司,AF6311),兔抗Bcl-2(江苏亲科生物研究中心有限公司,AF6139),兔抗CytC(proteintch Group.Inc,10993-1-ap,1/500),辣根过氧化物酶标记山羊抗兔IgG(H+L)(北京中杉金桥生物技术有限公司,ZB-2301),水迷宫(上海玉研科学仪器有限公司,JLBehv-MWMG),荧光显微镜(奥林巴斯公司,CKX53),电热恒温培养箱(山东博科科学仪器有限公司,DHP-9054),SuPerMax 3100型多功能酶标仪(上海闪谱生物科技有限公司)。
1.3 实验方法
1.3.1 分组和模型制备 所有大鼠适应性饲养1周,将其随机分为对照组(n=6)和模型组(n=24),然后进行6 d Morris水迷宫实验,淘汰不合格大鼠,并随机补充。模型组大鼠于Morris水迷宫实验后第2天采用自然吸入CO中毒方法制备DEACMP模型,具体如下:在染毒箱内按照1∶5的比例通入O2和N2的混合气体,然后通入CO,当CO达到3 000 ppm后开始静态吸入CO染毒,染毒40 min后将大鼠置于空调房自然复苏。染毒后模型组正常存活16只大鼠。对照组大鼠仅进行空气暴露。
1.3.2 Morris水迷宫实验 对照组和模型组大鼠均于中毒后1 d开始进行Morris水迷宫实验,具体如下:将大鼠面向水迷宫池壁,在4个象限中点位置将其依次放入水中,自动记录大鼠巡游轨迹及爬上安全岛的过程。大鼠每次找到安全岛后让其休息30 s,然后再次放入水中进行下一次巡游。于中毒后7、14 d的相同时间点撤除水迷宫平台,让大鼠在某象限的中点面壁式入水,观察120 s内其正确穿越平台的次数,若<3次则判定为DEACMP。模型组16只大鼠中发生DEACMP 7只(DEACMP组),未发生DEACMP 9只(无DEACMP组)。
1.3.3 TUNEL法检测海马组织神经元凋亡情况 采用TUNEL法检测大鼠海马组织神经元凋亡情况,具体如下:染毒14 d后,在对照组、DEACMP组、无DEACMP组中各选取6只大鼠进行麻醉,心脏采血,打开胸腔,剪去右心耳,采用20 ml注射器抽取20 ml冰生理盐水,从左心室注入至右心耳不再流出血液为止,颅顶开口,取出大脑并置于冰上,4 ℃环境下分离大鼠双侧海马区,将其置于液氮中保存。将左侧海马组织进行冰冻切片,采用TUNEL细胞凋亡检测试剂盒染色。绿色荧光标记的为凋亡细胞核,记为TUNEL阳性细胞,在400倍荧光显微镜下观察细胞染色情况,每张切片随机选取6个图像,并计算凋亡指数,凋亡指数=TUNEL阳性细胞数/总细胞数×100%。
1.3.4 超氧化物阴离子荧光染色法检测海马组织活性氧表达情况 采用超氧化物阴离子荧光染色法检测海马组织活性氧表达情况。取各组大鼠左侧海马组织并置于灭菌离心管中,加入3 ml清理液(试剂一)浸泡15 s,采用镊子取出组织,采用无菌绵纸吸干,即刻冰冻切片(厚度6 μm)。将冰冻切片稍甩干后用免疫组化笔在组织周围画圆圈,圈内滴加活性氧染液,避光,恒温箱(37 ℃)孵育30 min。将载玻片置于PBS(pH值为7.4)中,在脱色摇床上晃动洗涤3次以充分混匀(5 min/次)。将切片稍甩干后在圈内滴加DAPI染液,避光,室温孵育3 min。将切片稍甩干后用抗荧光淬灭封片剂封片,在荧光显微镜下观察并采集图像。DAPI染染液出来的细胞核在紫外光激发下为蓝色,阳性表达为异硫氰酸呈绿色荧光。
1.3.5 Western blot法检测海马组织线粒体相关凋亡因子表达情况 采用Western blot法检测海马组织线粒体相关凋亡因子表达情况,具体如下:将右侧海马组织匀浆后提取总蛋白,于-20 ℃环境下保存。采用BCA试剂盒检测细胞上清液中蛋白质浓度,绘制标准曲线。制作SDS-PAGE胶,上样,开始跑胶,60 V电压压缩蛋白,80 V电压分离蛋白(120 min),切好含有目标条带或内参条带的胶,将海绵、滤纸、胶、膜、滤纸、海绵等依次铺好。采用遇冷的1×转膜液浸没目标胶带复合物,使用300 mA恒流转膜。使用1×TBST配置3%脱脂牛奶作为封闭液,封闭1 h。采用PVDF膜孵育一抗过夜。洗膜后采用1×TBST浸泡10 min(重复3次)。采用PVDF膜孵育二抗2 h。洗膜后用1×TBST浸泡10 min(重复3次)。采用发光液浸湿PVDF膜并置于超高灵敏度化学发光成像系统进行显影成像,检测Caspase-3、CytC、Bcl-2表达水平。
1.4 统计学方法 应用SPSS 17.0统计学软件包进行数据处理。符合正态分布的计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 DEACMP发生情况 Morris水迷宫实验结果显示,16只大鼠中发生DEACMP 7只,DEACMP发生于急性CO中毒后的7~14 d,见图1。
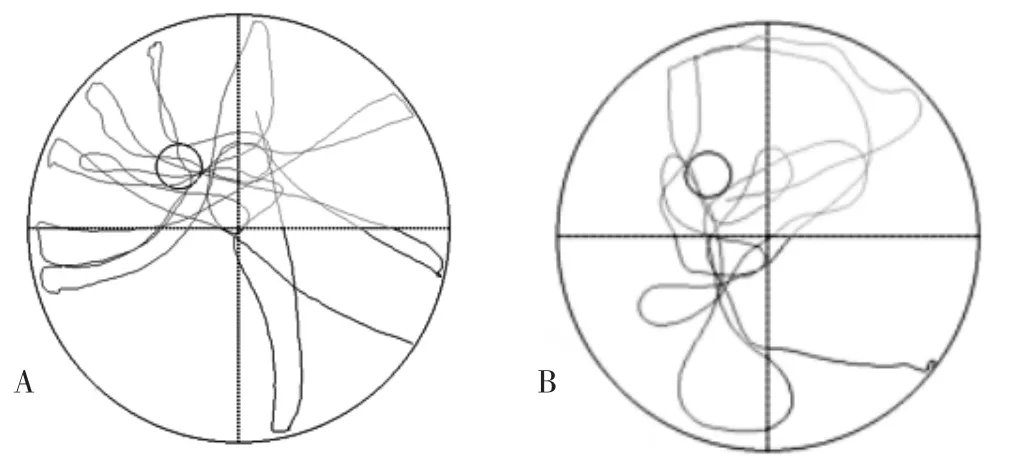
图1 对照组和DEACMP组大鼠Morris水迷宫实验结果Figure 1 Morris water maze test results of rats in control group and DEACMP group
2.2 海马组织神经元凋亡指数 对照组大鼠海马组织神经元凋亡指数为(2.95±2.00)、无DEACMP组为(3.67±3.42)、DEACMP组为(5.89±4.12)。对照组、无DEACMP组、DEACMP组大鼠海马组织神经元凋亡指数比较,差异有统计学意义(F=3.653,P=0.033)。其中DEACMP组大鼠海马组织神经元凋亡指数高于无DEACMP组和对照组,差异有统计学意义(P<0.05);无DEACMP组和对照组大鼠海马组织神经元凋亡指数比较,差异无统计学意义(P>0.05),见图2。
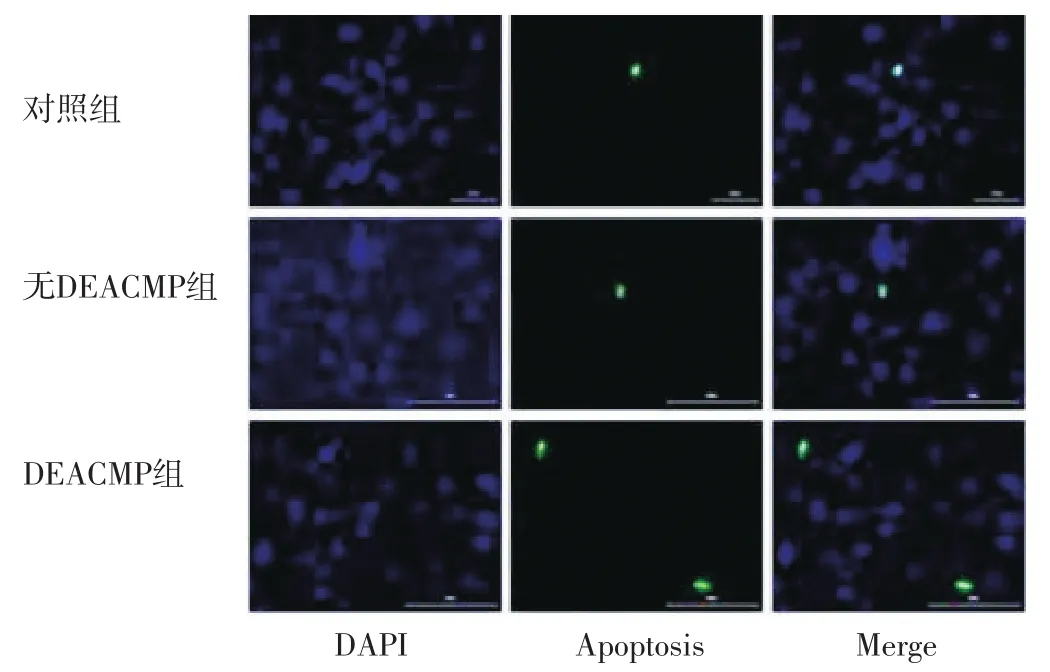
图2 对照组、无DEACMP组、DEACMP组大鼠海马组织神经元凋亡情况(TUNEL染色,×400)Figure 2 Neuronal apoptosis in hippocampus of the among the control group,no DEACMP group and DEACMP group of rats
2.3 海马组织活性氧表达情况 超氧化物阴离子荧光染色结果显示,三组大鼠海马组织均未检测到活性氧,见图3。
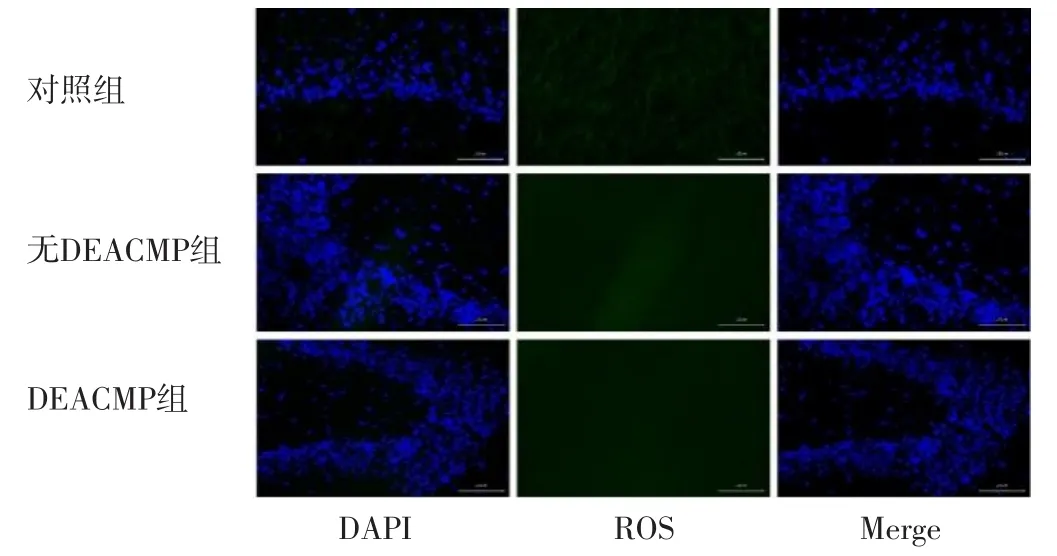
图3 对照组、无DEACMP组、DEACMP组大鼠海马组织活性氧表达情况(超氧化物阴离子荧光染色,×400)Figure 3 Expression of reactive oxygen species in hippocampus of the control group,no DEACMP group and DEACMP group of rats
2.4 海马组织线粒体相关凋亡因子表达情况 三组大鼠海马组织Caspase-3、CytC、Bcl-2表达水平比较,差异有统计学意义(P<0.05);其中DEACMP组和无DEACMP组大鼠海马组织Caspase-3、CytC表达水平高于对照组,DEACMP组大鼠海马组织Caspase-3、CytC表达水平高于无DEACMP组,差异有统计学意义(P<0.05);DEACMP组和无DEACMP组大鼠海马组织Bcl-2表达水平低于对照组,差异有统计学意义(P<0.05),见表1、图4。
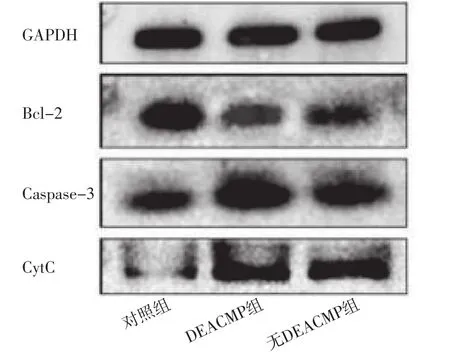
图4 对照组、无DEACMP组、DEACMP组大鼠海马组织线粒体相关凋亡因子的SDS-PAGE图Figure 4 SDS-PAGE electrophoretogram of mitochondrial related apoptosis factors in hippocampus among the control group,no DEACMP group and DEACMP group of rats
表1 对照组、无DEACMP组、DEACMP组大鼠海马组织线粒体相关凋亡因子表达情况比较(±s,n=6)Table 1 Comparison of expression of mitochondrial related apoptosis factors in hippocampus among the control group,no DEACMP group and DEACMP group of rats
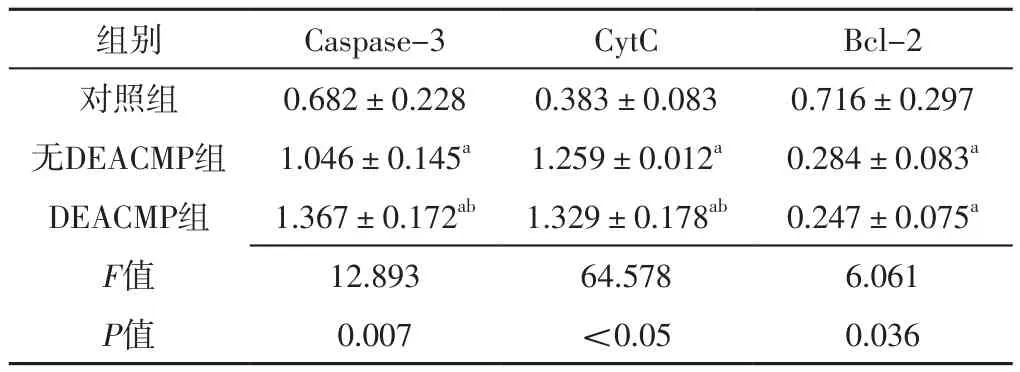
表1 对照组、无DEACMP组、DEACMP组大鼠海马组织线粒体相关凋亡因子表达情况比较(±s,n=6)Table 1 Comparison of expression of mitochondrial related apoptosis factors in hippocampus among the control group,no DEACMP group and DEACMP group of rats
注:Caspase=半胱氨酸天冬氨酸蛋白酶,CytC=细胞色素C,Bcl-2=B细胞淋巴瘤蛋白2;a表示与对照组比较,P<0.05;b表示与无DEACMP组比较,P<0.05
组别 Caspase-3 CytC Bcl-2对照组 0.682±0.228 0.383±0.083 0.716±0.297无DEACMP组 1.046±0.145a 1.259±0.012a 0.284±0.083a DEACMP组 1.367±0.172ab 1.329±0.178ab 0.247±0.075a F值 12.893 64.578 6.061 P值 0.007 <0.05 0.036
3 讨论
目前,DEACMP的发病机制尚不明确,而构建简单、可靠的DEACMP动物模型是研究其发病机制的基础。DEACMP的建模方法有腹腔注射CO中毒和自然吸入CO中毒两种方式,其中自然吸入CO中毒与患者中毒过程相似,故本研究采用自然吸入CO中毒的DEACMP造模方法。判断大鼠中毒后记忆力下降较常用的实验是Morris水迷宫实验,其结果可靠,且对动物的损伤较小。海马区与学习、记忆功能有关,其损伤后会导致记忆力下降。而在临床上DEACMP患者以认知障碍、记忆力下降为主要特征,提示可能与海马区损伤有关。本研究结果显示,DEACMP组大鼠海马组织神经元凋亡指数高于无DEACMP组和对照组,提示DEACMP的发生可能与海马组织神经元凋亡有关。
活性氧是自由基中最重要的一类活性分子。机体缺氧时,神经元能量代谢异常,脑内神经元出现大量钙内流,线粒体呼吸功能受到抑制而产生氧自由基,这种线粒体途径产生的氧自由基在神经元凋亡过程中发挥着重要作用[5-6]。线粒体(特别是损伤的线粒体)活性氧产生增加时可造成线粒体内氧化损伤,故检测活性氧可以间接推测线粒体损伤的可能。但本研究结果显示,三组大鼠海马组织均未检测到活性氧,分析其原因可能如下:由酶促抗氧化剂组成的抗氧化系统中和了额外的活性氧[7],胞质中产生的大量CytC抑制了活性氧的产生[8]。
本研究结果显示,DEACMP组和无DEACMP组大鼠海马组织Caspase-3、CytC表达水平高于对照组,DEACMP组大鼠海马组织Caspase-3、CytC表达水平高于无DEACMP组;DEACMP组和无DEACMP组大鼠海马组织Bcl-2表达水平低于对照组,提示急性CO中毒后大鼠的海马组织神经元就已经出现凋亡,且发生DEACMP的大鼠海马组织神经元凋亡更明显。有研究发现,脑缺氧时线粒体功能会发生障碍,这使胞质中的ATP含量降低、钙内流、自由基增加,促使CytC从线粒体内膜结合位点释放入细胞质,激活Caspase-9,进而激活Caspase-3,最终引起神经元凋亡[9-10]。据此,研究者推测急性CO中毒患者的主要病因为缺氧,而缺氧可导致线粒体功能障碍,可能启动线粒体途径的细胞凋亡,引起促细胞凋亡因子水平升高和抗细胞凋亡因子水平下降。无DEACMP组和对照组大鼠海马组织神经元凋亡指数比较无统计学差异,推测CO中毒后神经元凋亡过程可能是渐进性的,而未发生DEACMP的大鼠CO中毒后海马组织神经元凋亡程序可能被某种机制抑制,这是否与凋亡抑制因子有关目前尚不清楚。Bcl-2家族是目前发现的非常重要的抗凋亡相关蛋白家族,包括抗凋亡的Bcl-2亚族和促凋亡的Bax亚族。Bcl-2家族各成员之间的相互作用可控制线粒体外膜透化作用(mitochondrial membrane permeation,MOMP),且细胞凋亡的线粒体途径表现为MOMP和CytC的活化[11],进而抑制CytC的释放及Caspase的激活,从而发挥抗凋亡作用[12]。
综上所述,DEACMP大鼠存在海马组织神经元凋亡,其机制可能与Caspase-3、CytC表达水平升高及Bcl-2表达水平降低有关。但凋亡因子Caspase-3、CytC、Bcl-2参与DEACMP的具体机制仍有待进一步研究证实。
作者贡献:傅永旺进行文章的构思与设计、实施与可行性分析,负责撰写、修订论文,负责文章的质量控制及审校,并对文章整体负责、监督管理;傅永旺、张玉、武艳芳进行数据收集、整理、分析,结果分析与解释。
本文无利益冲突。
