RNA干扰SLC4A8对奶山羊乳腺上皮细胞增殖和泌乳的影响
2022-09-27吴双虎侯金星朱俊儒刘淑娟夏树立安小鹏
吴双虎,侯金星,江 悦,朱俊儒,韦 唯,刘淑娟,夏树立,韩 静,安小鹏
(1.三原县动物疫病预防控制中心,陕西 三原 713800;2.杨凌职业技术学院 动物工程分院,陕西 杨凌 712100;3.西北农林科技大学 动物科技学院,陕西 杨凌 712100;4.渭南市动物疫病预防控制中心,陕西 临渭区 714000;5.天津市农业科学院 畜牧兽医研究所,天津 300112)
泌乳性状是奶山羊产业的重要经济性状。中国是世界上奶山羊存栏数最多的国家,但奶中乳蛋白较低,影响了奶制品的质量。因此,为了满足消费者对高质量乳制品的需求,急需解析奶山羊乳蛋白合成的分子机理,以期快速提高羊乳制品的质量。
乳腺由乳腺上皮细胞和间充质细胞组成。乳腺上皮细胞具有合成、分泌乳汁的功能。泌乳是一个十分复杂的过程,与乳腺导管的正常发育、体内激素水平等多种因素密切相关。近年来研究发现,miRNA与多种细胞的免疫应答、增殖、凋亡、异化、侵袭等多种生物进程有着密不可分的联系。Zhu等研究发现,miR-8516可以通过调控斯钙素2(Stannio calcin 2,2)的表达促进乳腺上皮细胞β-酪蛋白及甘油三酯的分泌。
依赖钠的碳酸氢盐转运体(The sodium-dependent bicarbonate transporter,SLC4A8)可调节钠和碳酸氢盐的运输以交换氢化物,同介导细胞内多种信号通路并参与多种生理过程。溶质载体4(The solute carrier 4,SLC4)转运体家族由阴离子交换体(SLC4A1-3和SLC4A9)、Na偶联碳酸氢盐转运体(SLC4A4和SLC4A5)、电中性Na/碳酸氢盐共转运体(SLC4A7和SLC4A10)和电中性Na驱动的碳酸氢盐转运体(SLC4A8)组成。这些SLC4蛋白作为第二信使、脂质、结合蛋白、自动调节域等调节因子在运输CO、多种上皮细胞运输以及细胞内的调节具有广泛而重要的生理作用。碳酸氢盐是维持人体的内环境稳态主要缓冲物质之一,因此在生长发育过程中SLC4蛋白会得到广泛表达,基因发生突变时则会影响骨骼、胰腺、大脑、肾脏、心脏、甲状腺和肺等器官的生长发育和功能。
研究表明SLC4A8主要分布于大脑、心脏和睾丸。目前SLC4A8在乳腺上皮细胞中的功能作用尚不清楚。实验室前期通过对低泌乳期(产后2 d)、泌乳高峰期(产后90 d)和干奶期(产前7 d)的3只萨能奶山羊的乳腺组织进行高通量测序,根据生物信息学分析结果筛选出泌乳高峰期差异高表达的Chi-miR-8516并且已验证48为其靶基因。本试验首先在体外合成si-SLC4A8,并将其转染至奶山羊乳腺上皮细胞中,通过CCK-8,EdU试验,RT-qPCR,Western blot,ELISA检测等方法,探究si-SLC4A8对奶山羊乳腺上皮细胞增殖及泌乳功能的作用,为阐明乳腺上皮细胞功能的分子机制提供理论基础。
1 材料与方法
1.1 主要材料与试剂
本试验所用的乳腺组织采自陕西省扶风县某奶山羊养殖场,用PBS将乳腺组织冲洗3次后放入已经灭菌并加有青霉素(100 μg/mL)和链霉素(100 μg/mL)的PBS溶液中,用组织块培养法贴壁培养乳腺上皮细胞以备后续试验。
试剂和试剂盒:RNAiso Plus试剂(TAKARA)、ELISA试剂盒(TG试剂盒和β-casein试剂盒购于mlbio)、CCK-8试剂盒(ZETA)、EdU试剂盒(Beyotime)、高纯总RNA快速提取试剂盒(北京百泰克生物技术有限公司)、反转录试剂盒(Fermentas)、荧光定量试剂盒(宝生物工程大连有限公司)、LipofectamineTM2000转染试剂盒(Invitrogen)、β-actin Antibody(Beyotime)、SLC4A8 Antibody(BBI)、青霉素和链霉素(Gibco)、DMEM/F12培养基(Gibco)、Opti-MEMⅠ(Gibco)、胎牛血清(Gibco)。
1.2 细胞转染
将奶山羊乳腺上皮细胞分别培养至6孔板、12孔板、96孔板中,待细胞密度达到70%~80%时,换用F12培养液培养4 h后,将si-SLC4A8、阴性对照组NC(negative control)和si-SLC4A8+miR-8516 inhibitor分别转染进乳腺上皮细胞中。用细胞转染专用培养液OPTI-MEMI分别孵育Lipofectamine 2000及si-SLC4A8 5 min后,混合后常温孵育20 min,再将其加入细胞培养板中放置于37 ℃、5% CO恒温培养箱中。4 h后将F12培养液更换为含有10%血清细胞培养液,继续培养24 h或48 h。
si-SLC4A8序列:sense:5'-GCCCUCAGCUUACAGUGUUTT-3',antisense:5'-AACACUGUAAGCUGAGGGCTT-3'。
miR-8516 inhibitor序列:5'-GGCCUCCGUUGCCCUCAGCC-3'。引物均合成于上海吉玛制药技术有限公司。
1.3 RT-qPCR
将1.2中所述处理的12孔板中的细胞培养24 h后,用RNAiso Plus试剂按照试剂盒说明书提取各处理组和对照组细胞中的RNA。用20 μL反应体系(10 μL eaction solution,4 μL 5×Prime Script Buffer,1 μL rime Script RT Enzyme Mix I和1 μL RT Prime Mix,加灭菌水至20 μL)反转录得到cDNA,反转录程序为:37 ℃ 15min,85 ℃ 5 s,4 ℃保存。
之后进行RT-qPCR,其反应体系为:12.5 μL latinum RTS SYBR Super Mix,48基因和内参基因β-actin的实时定量引物的上游引物F、下游引物R各1 μL,1 μL cDNA模板,加灭菌水至20 μL;反应程序为:95 ℃预变性5 min,94 ℃变性15 s,退火温度为60 ℃,退火时间20 s,72 ℃延伸20 s,共进行35个循环,4 ℃保存。
48基因的实时定量引物如下:
F:5'-CCAGCAGATCACAGCCGTCATC-3';R:5'-ATCAGCAGGTCCAGGTGGTAGC-3';内参基因-的实时定量引物如下:
F:5'-GCAAGTTCCACGGCACAG-3';R:5'-GGTTCACGCCCATCACAA-3'。
试验结果以-作为内参进行处理,用2分析48 mRNA的相对表达量。
1.4 Western blot
根据1.2中所述处理6孔板中的细胞,培养48 h后提取细胞中的总蛋白。具体操作:收集细胞,弃去原培养液后用PBS清洗3遍,胰酶充分消化后1 000 r/min离心5 min,弃上清液,留细胞沉淀,向每管沉淀中加300 μL蛋白裂解液和3.0 μL的蛋白酶抑制剂,在4 ℃放置30 min,后12 000 r/min、4 ℃离心10 min,将上清液转移到1.5 mL的离心管中,加入蛋白上样液,沸水煮6~8 min获取细胞总蛋白。
进行SDS-PAGE电泳,先80 V电泳30 min,再换成120 V继续电泳至样品中溴酚蓝迁移到分离胶最下端。将蛋白转到PVDF膜,冰浴,300 mA、80 V电泳1.5 h。转膜完成后用脱脂奶粉进行封闭2 h,1×TBST缓冲液洗3次,每次10 min。接着按照1∶1 000的稀释比例进行一抗孵育,4 ℃过夜孵育或室温摇床上孵育4 h,接着用1×TBST缓冲液漂洗3次,每次10 min,按照一抗稀释的方法稀释二抗,室温摇床上孵育2 h,用1×TBST缓冲液漂洗3次后即可进行分析显影和灰度分析。
1.5 细胞活力检测(CCK-8)
根据1.2中所述处理96孔板中的细胞,24 h后依照CCK-8试剂盒中的使用说明书,在每孔中加入15 μL的CCK-8溶液,继续培养4 h后在520 nm波长下用酶标仪读取到各孔的吸光值(A),用以计算细胞的增殖率。
1.6 细胞增殖情况检测(EdU)
根据1.2中所述处理96孔板中的细胞24 h后,根据EdU试剂盒说明书,每孔加入50 μmol/L EdU培养基100 μL,培养2 h后用PBS清洗2~3次,加入50 μL细胞固定液,室温孵育15 min后去除固定液,每孔加入1×Apollo染色反应液100 μL,避光、室温、脱色摇床孵育30 min后弃染色反应液,加入100 μL渗透剂,脱色摇床孵育10 min后用100 μL甲醇清洗2~3次,再用PBS清洗2~3次;每孔加入100 μL 1×Hoechst 33342反应液,避光、室温、脱色摇床孵育30 min后弃染色反应液,PBS清洗3次;加入100 μL DAPI溶液(1 μg/μL),室温避光孵育15 min,PBS清洗3次,荧光显微镜下观察、拍照。
1.7 ELISA
根据1.2中所述处理6孔板中的细胞,24 h后收集细胞,按照ELISA试剂盒的使用说明书检测β-酪蛋白和甘油三酯在奶山羊乳腺上皮细胞中的合成量。具体实验步骤详见说明书。
1.8 数据统计与分析
试验处理得到的统计数据利用SPSS 22.0软件进行分析,并通过独立样本T检验的方法分析数据的显著性。三次重复的数据结果均用平均数±标准差(Mean ± SD)表示。差异水平用P值来显示,<0.05*表示数据差异显著,<0.01**表示数据差异极显著。
2 结果与分析
2.1 SLC4A8干扰效率检测
将si-SLC4A8和NC转染进奶山羊乳腺上皮细胞,通过RT-qPCR和Western blot法分别检测48在mRNA和蛋白水平的表达量,结果如图1A所示,si-SLC4A8转染组中48的mRNA含量较NC组极显著降低(<0.01),图1B显示,si-SLC4A8组的蛋白表达量较NC组极显著降低(<0.01),表明合成的si-SLC4A8干扰效果良好能够满足试验要求。

图1 SLC4A8干扰效率检测
2.2 si-SLC4A8对乳腺上皮细胞增殖的影响
为了研究si-SLC4A8对乳腺上皮细胞增殖的影响,将NC、si-SLC4A8、si-SLCA8+inhibitor分别转染进奶山羊乳腺上皮细胞中,按照CCK-8试剂盒说明书检测乳腺上皮细胞增殖能力。结果如图2A所示,转染si-SLC4A8组乳腺上皮细胞增殖率较NC组极显著降低(<0.01),转染si-SLC4A8+inhibitor组乳腺上皮细胞增殖率较si-SLC4A8组极显著上升(<0.01)。随后用EdU方法检测了乳腺上皮细胞增殖能力,计算EdU-阳性细胞数目在总细胞数目中的比例。结果如图2B、2C所示,与NC组相比,转染si-SLC4A8后EdU-阳性细胞比例极显著下降(<0.01),EdU结果与CCK-8结果均表明si-SLC4A8抑制乳腺上皮细胞的增殖。

图2 si-SLC4A8对乳腺上皮细胞增殖的影响
2.3 si-SLC4A8对乳腺上皮细胞甘油三酯和β-酪蛋白合成的影响
为了研究si-SLC4A8对乳腺上皮细胞中甘油三酯和β-酪蛋白合成的影响,将NC、si-SLC4A8和si-SLCA8+inhibitor转染进奶山羊乳腺上皮细胞中,用ELISA试剂盒检测甘油三酯和β-酪蛋白的含量。结果如图3A所示,si-SLC4A8转染组乳腺上皮细胞中的甘油三酯浓度较NC组极显著下降(<0.01)。如图3B所示,si-SLC4A8转染组乳腺上皮细胞中的β-酪蛋白浓度较NC组极显著下降(<0.01),si-SLCA8+inhibitor转染组的β-酪蛋白浓度较si-SLC4A8组极显著升高(<0.01)。
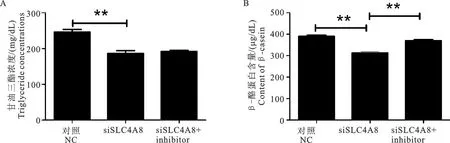
图3 si-SLC4A8对乳腺上皮细胞甘油三酯(A)和β-酪蛋白(B)合成的影响
3 讨 论
miRNAs不仅可以调节乳腺干细胞和祖细胞的增殖和分化,对乳腺导管和腺泡的正常发育也发挥着重要的调控作用,与此同时乳腺周期性分化和去分化过程中还常常伴随着乳腺上皮细胞周期性的增殖和凋亡。试验前期通过高通量测序以及生物信息学分析后发现,泌乳高峰期的萨能奶山羊乳腺组织中差异高表达的Chi-miR-8516可以通过PI3K/AKT/mTOR通路促进甘油三酯和β-酪蛋白的合成,通过Ras/MEK/ERK通路促进山羊乳腺上皮细胞(GMECs)的增殖。因此我们设计si-SLC4A8试说明48对奶山羊乳腺上皮细胞增殖及泌乳功能的作用,为阐明乳腺上皮细胞功能的分子机制提供一定的理论基础。
山羊奶以乳蛋白、乳脂、乳糖、非脂固型物为主要成分。酪蛋白是山羊奶乳蛋白的主要成分,包括κ-酪蛋白、αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白,占所有蛋白质的70%~80%。β-酪蛋白是一种两亲性磷酸蛋白,约占酪蛋白总量的30%,形成的酪蛋白胶束可以携带钙、磷等矿物质,且与人的酪蛋白相似,更易被人体消化吸收。而甘油三酯是乳脂的最大组成部分(近98%),包括大量酯化脂肪酸。而且山羊奶中短链和中链脂肪酸含量较多,这也有利于更高的消化率和更健康的脂质代谢,同时也是羊奶独特风味的来源。为研究48对于乳成分的影响,通过ELISA检测,发现干扰48后乳腺上皮细胞分泌的甘油三酯和β-酪蛋白显著下降,表明在乳腺上皮细胞中48可以促进乳腺上皮细胞的甘油三酯和β-酪蛋白的合成。通过CCK-8检测发现与NC组相比,干扰48后乳腺上皮细胞的活力显著下降,EdU试验结果表明转染si-SLC4A8后抑制细胞的增殖,表明在乳腺上皮细胞中48促进乳腺上皮细胞的增殖。目前,关于4家族基因在乳腺方面的功能研究较少,尽管在本研究中证明干扰48后能抑制奶山羊乳腺上皮细胞的增殖、乳蛋白和甘油三酯的合成,但是48对泌乳功能的调控机理仍不完善,有待进一步研究。
4 小 结
综上所述,本试验通过RNA干扰抑制48基因的表达,采用CCK-8、EdU试验分析了si-SLC4A8对乳腺上皮细胞增殖的影响,结果表明,干扰48后显著抑制乳腺上皮细胞的增殖。ELISA试验表明,干扰48基因后显著抑制乳腺上皮细胞中β-酪蛋白和甘油三酯的合成。
