暴马桑黄赤霉素合成基因GGPS的克隆及诱导表达
2022-09-26刘增才唐玉倩佟鑫宇
刘增才,唐玉倩,佟鑫宇,邹 莉
(东北林业大学 林学院,黑龙江 哈尔滨 150040)
桑黄是一类大型药用真菌的统称,隶属于刺革菌科,桑黄孔菌属。目前桑黄孔菌属在世界范围内已知种有12 个,其种类常与其生长的树木之间存在较强的专一寄生关系[1]。暴马桑黄是寄生在暴马丁香树上的桑黄,研究发现暴马桑黄中含有多种药用活性成分,如多糖、黄酮、三萜等[2],在治疗各种疾病上发挥主要药用功效。传统研究中,暴马桑黄常用于痢疾、血崩、盗汗、经闭、脾虚泄泻等疾病的治疗[1-3]。现代研究发现,暴马桑黄在保护肝脏、调节免疫、降低血糖、抗肿瘤等方面具有显著功效。Jeon 等[4]在研究暴马桑黄提取物对四氯化碳导致的大鼠肝损伤实验中发现,暴马桑黄提取物能够阻断四氯化碳引起的过氧化氢酶和超氧化物歧化酶活性降低,对肝损伤能够起到很好的保护作用。Kim 等[5]发现暴马桑黄多糖与β-葡聚糖相比,能够表现出更广泛的免疫刺激活性。不仅能够提高T淋巴细胞介导的免疫水平,还能在B 细胞上作为多克隆激活剂。并且桑黄多糖还被发现能够显著降低大鼠血糖[6]。张林芳等[7]研究结果表明,暴马桑黄总三萜能够抑制癌细胞MCF-7 的增殖,同时还能够诱导MCF-7 凋亡,在利用暴马桑黄菌丝和子实体对照实验时发现,暴马桑黄子实体对MCF-7 抑制增殖和凋亡方面表现更好。随着暴马桑黄药用特性研究不断深入,暴马桑黄在医学上的应用前景十分广阔,市场上对暴马桑黄的需求量也不断增加。目前市场上的暴马桑黄子实体多为野生资源,而人工驯化暴马桑黄子实体也正在积极探索,现在仅在实验室有小规模试验栽培,难以满足生产需要[8-10]。其主要原因是暴马桑黄生长发育机理尚不清晰,难以实现工厂化栽培。随着分子生物技术不断发展,利用基因工程定向培育优质高产的暴马桑黄菌株成为一种可靠的技术手段。
赤霉素(GA)是一类重要的生长激素,主要从植物和微生物中提取获得。研究表明,赤霉素不仅能促进植物的伸长生长[11-12],而且对细菌、真菌的生长发育也有明显促进作用[13]。赤霉素作为一类二萜化合物,是通过甲羟戊酸途径(mevalonate pathway,MVA)合成的。首先利用MVA 途径合成前体物质法呢基焦磷酸(farnesyl diphosphate,FPP),然后FPP 在第一个二萜合成关键酶牻牛儿基焦磷酸合酶(geranylgeranyl pyrophosphate synthase,GGPS)的催化下,生成牻牛儿基焦磷 酸(geranylgeranyl pyrophosphate,GGPP),GGPP 再经过一系列酶促反应最终合成赤霉素[14],代谢途径如图1所示。目前GGPS基因已经在茶树[15]、丹参[16]、雨生红球藻[17]等多种生物中被成功克隆,但在暴马桑黄中还未见GGPS基因的有关报道。
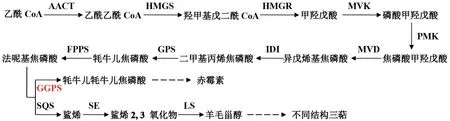
图1 赤霉素生物合成途径Fig.1 The biosynthesis pathway of GA
茉莉酸甲酯(methyl jasmonate,MeJA)常作为一种外源诱导剂,是次生代谢中重要的信号转导分子[18]。其通过调节次生代谢途径中转录因子的活性,转录因子进而影响相应关键酶基因的表达,最终决定次生代谢产物的产量。在灵芝研究中发现,MeJA 的诱导能够显著提高灵芝次生代谢产物三萜合成途径中关键酶基因的转录水平,同时上调灵芝三萜含量[19]。同样,本实验室前期研究中发现MeJA 能够促进暴马桑黄次生代谢产物三萜合成途径中关键酶基因的转录,并促进三萜含量的积累[20]。但MeJA 对次生代谢产物赤霉素含量及合成途径基因转录水平的影响还未见报道。
本试验通过PCR 扩增技术克隆得到暴马桑黄GGPS基因及其启动子序列,测序后进行生物信息学分析;随后用MeJA 诱导暴马桑黄菌丝体,并检测诱导后的暴马桑黄菌丝体中GGPS基因转录水平,赤霉素含量及菌丝体生物量的变化;最后将GGPS基因构建到原核表达载体验证其表达情况。本试验结果可为阐明暴马桑黄GGPS基因功能的研究奠定基础,同时也为培育暴马桑黄优质品种提供理论依据。
1 材料与方法
1.1 试验材料
暴马桑黄菌种DL101,大肠杆菌克隆菌株Top10,大肠杆菌表达菌株BL21(DE3)以及原核表达载体pET-32a 保存于本实验室。植物基因组DNA 提取试剂盒,植物总RNA 提取试剂盒,琼脂糖凝胶DNA 回收试剂盒均购于北京天根生化公司。质粒提取试剂盒购自于上海Omega公司。聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate polyacrylamide gel electrophoresis,SDSPAGE)试剂盒购自北京索莱宝公司。限制性内切酶EcoR Ⅰ、Hind Ⅲ,Premix Taq 酶,TB Green ™ Premix Ex Taq ™ Ⅱ(Tli RNaseH Plus)酶,pMD18-T 载体,5×In-Fusion HD 试剂盒,PrimeScript Ⅱ1st Strand cDNA Synthesis Kit 试剂盒,PrimeScript ™ RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒均购自大连Takara 公司。MeJA 购自美国Sigma 公司。其余所需药品均为国产分析纯。
1.2 试验方法
1.2.1 试验引物
利用Primer Premier 5.0 软件设计试验所需特异性引物,试验过程中用于目的基因克隆、启动子克隆、荧光定量分析及PCR 检测的引物序列见表1。

表1 引物序列†Table 1 Primer sequence
1.2.2 SbGGPS 启动子与基因克隆
分别采用植物基因组DNA 提取试剂盒与植物总RNA 提取试剂盒提取暴马桑黄总DNA 和总RNA,并将得到的总RNA 反转录成cDNA。以暴马桑黄DNA 为模板,GGPS-pro-F1和GGPSpro-R1(表1)为引物进行SbGGPS启动子PCR 扩增;另以cDNA 为模板,GGPS-F1和GGPS-R1(表1)为引物扩增SbGGPS基因。2 种扩增产物纯化回收后,分别与PMD18-T 载体过夜连接,再转入大肠杆菌Top10 感受态细胞。以M13F-47、M13R-48(表1)为引物进行菌落PCR 检测,结果呈阳性的菌液送至哈尔滨擎科生物公司进行测序。
1.2.3 生物信息学分析
得到SbGGPS启动子及基因序列后,利用Neural Network Promoter Prediction、PlantCARE 等在线软件对启动子的核心启动子区和作用元件进行预测分析;利用软件ProtParam、TMHMM、SignalP、Euk-mPLoc、SPOMA、Swiss-Model 对SbGGPS基因编码的氨基酸序列的理化特性、信号肽、跨膜区、亚细胞定位以及蛋白质结构进行预测[21]。并用MEGA5.0 软件构建系统进化树。
1.2.4 MeJA 诱导
将培养皿中培养的暴马桑黄菌丝接种到PD培养基中振荡培养10 d,然后使用匀浆仪打碎菌丝体,打碎后的均匀菌丝体作为种子菌液。吸取10 mL 种子菌液接种到250 mL PD 培养基中,在摇床中25 ℃、180 r /min 培养8 d,然后分别向摇瓶中添加无菌水、吐温-20(助剂)及不同浓度MeJA(100、150、200、250、300)处理菌丝体48 h。收集MeJA 诱导后的暴马桑黄菌丝体分为三部分:第一部分用于荧光定量分析,第二部分用于赤霉素含量测定,第三部分用于生物量测定。
1.2.5 荧光定量分析
采用植物总RNA 提取试剂盒提取MeJA 诱导后的暴马桑黄菌丝体总RNA,用Prime Script ™ RT reagent Kit with gDNA Eraser 试剂盒将总RNA 反转录成cDNA。以得到的cDNA 为模板,GGPS-F2、GGPS-R2为引物进行qRT-PCR 反应。根据得到的不同Ct 值,以α-tubulin基因为内参(表1),按照公式2-ΔΔCt计算不同浓度MeJA 诱导的暴马桑黄菌丝体中SbGGPS基因的相对转录水平[23]。
1.2.6 赤霉素含量测定
赤霉素含量测定方法及标准曲线绘制参照肖志壮等[24]。将收集到的MeJA 诱导后的暴马桑黄菌丝体分别用液氮迅速冷冻,并在研钵中研磨。称取0.5 g 研磨后的样品加入4.5 mL 70%的乙醇中溶解,5 000×g 离心10 min,将上清液用0.45 μm滤膜过滤。取0.5 mL 过滤后的样品溶液进行后续的反应,反应步骤与肖志壮等步骤相同,反应液在412 nm 波长条件下测定吸光值。
1.2.7 生物量测定
将收集到的MeJA 诱导后的暴马桑黄菌丝体置于烘箱内50℃烘干至恒重,然后用电子天平分别测定菌丝体干重。
1.2.8 SbGGPS 基因原核表达
用限制性内切酶EcoR Ⅰ和Hind Ⅲ对pET-32a 质粒进行双酶切,酶切产物用DNA 回收试剂盒纯化回收。In-Fusion HD 试剂盒将质粒酶切回收产物与SbGGPS基因片段(以GGPS-F3、GGPS-R3为引物扩增得到)进行同源重组,得到pET-32a-SbGGPS重组质粒。将重组质粒转入大肠杆菌Top10 感受态细胞中扩增并重新提取,然后用引物pET-32a-F3、pET-32a-R3(表1)对提取到的质粒进行PCR 检测,检测正确的阳性质粒转入大肠杆菌表达菌株BL21 中,SDS-PAGE 试剂盒检测蛋白表达情况。
2 结果与分析
2.1 SbGGPS 启动子及基因的克隆结果
琼脂糖凝胶电泳检测结果显示(图2),SbGGPS启动子在1 100 bp 左右出现一条特异片段,SbGGPS基因在 900 bp左右出现一条特异片段,与预测结果大小吻合。PCR 产物纯化回收后连接PMD18-T 载体并转入大肠杆菌Top10 感受态细胞,检测呈阳性的菌液送至生物公司测序,测序结果经Blast 比对,确定为SbGGPS启动子和基因序列。
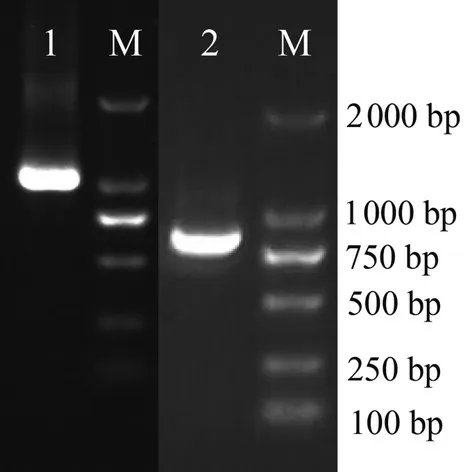
图2 PCR 产物电泳检测Fig.2 Electrophoresis detection of SbGGPS and the promoter product
2.2 生物信息学分析
2.2.1 SbGGPS 启动子分析
利用在线网站Neural Network Promoter Prediction 对SbGGPS启动子的核心启动子区进行预测。预测结果显示,得分大于0.80 的核心启动子区共有3 个,其中454~504 bp(ccggagcttgca taagcggcgcggtaccctcctgcattcgTgtataccaa)之间是核心启动子区的概率最高,达到0.99,加粗的大写字母T 为转录起始位点,说明该部位最有可能是启动子上RNA 聚合酶结合的区域,其余两处概率为0.82 和0.94。
利用在线网站PlantCARE 对SbGGPS启动子的作用元件进行预测(图3)。结果显示该启动子具有典型的启动子保守序列CAAT-box(控制转录起始的频率)和TATA-box(决定RNA 合成的起始位点),同时还有响应MeJA 的信号分子元件CGTCA-motif,响应厌氧诱导元件ARE,参与干旱诱导元件MBS。
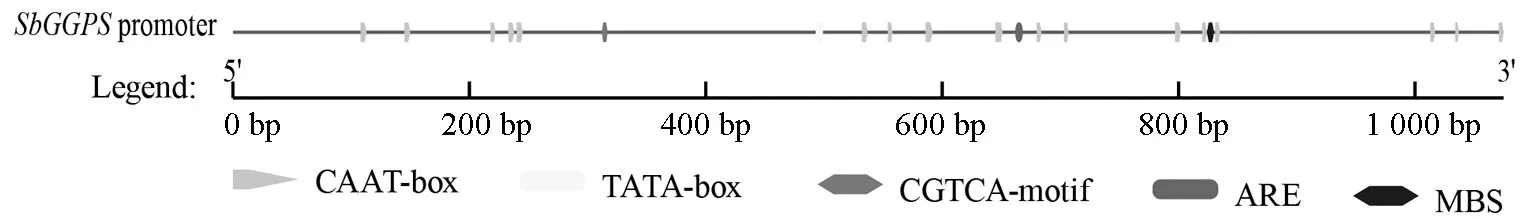
图3 SbGGPS 启动子的主要作用元件及位置Fig.3 The main cis-acting elements and positions of SbGGPS promoter
2.2.2 SbGGPS 基因及编码蛋白分析
NCBI ORF finder 显示,SbGGPS基因具有一个最大长度为945 bp 的开放阅读框,编码314 个氨基酸,具有IspA 保守结构域,是Isoprenoid_Biosyn_C1 超家族成员。ProtParam 分析结果显示,SbGGPS基因编码的蛋白质相对分子质量为35.89 kDa,不稳定系数为42.29,GRAVY 值为-0.366,表明该蛋白是不稳定的亲水性蛋白。TMHMM 预测SbGGPS 氨基酸序列(1~314 位)全部在膜外,不具有跨膜结构(图4A)。SignalP 预测SbGGPS 蛋白不存在信号肽序列(图4B)。亚细胞定位结果显示,SbGGPS 蛋白定位于细胞质。使用SOPMA 对SbGGPS 蛋白的二维结构预测分析,结果显示该序列中处于α 螺旋状态的氨基酸为58.28%,处于延伸链状态为6.69%,处于β 转角状态为5.10%,处于无规则卷曲状态为29.93%,说明蛋白质中除了含量最丰富的α 螺旋外,该蛋白多数氨基酸处于无规卷曲状态。使用Swissmodel对SbGGPS 蛋白三维结构进行预测,以疣孢青霉GGPS 蛋白三维结构图(6v0k.1.A)为模型进行构建,两者序列相似度为52.4%,结果见图4C。在NCBI 数据库中下载与暴马桑黄GGPS 具有较高同源性的氨基酸序列,采用MEGA 软件进行同源性分析并构建系统进化树(图4D)。结果表明暴马桑黄GGPS 蛋白与真菌GGPS 蛋白同源性较高,与动物(小鼠、褐家鼠)、细菌(谷氨酸棒杆菌、鲍氏不动杆菌)、植物(栀子、簸箕柳)GGPS 蛋白同源性较低,符合生物进化关系。
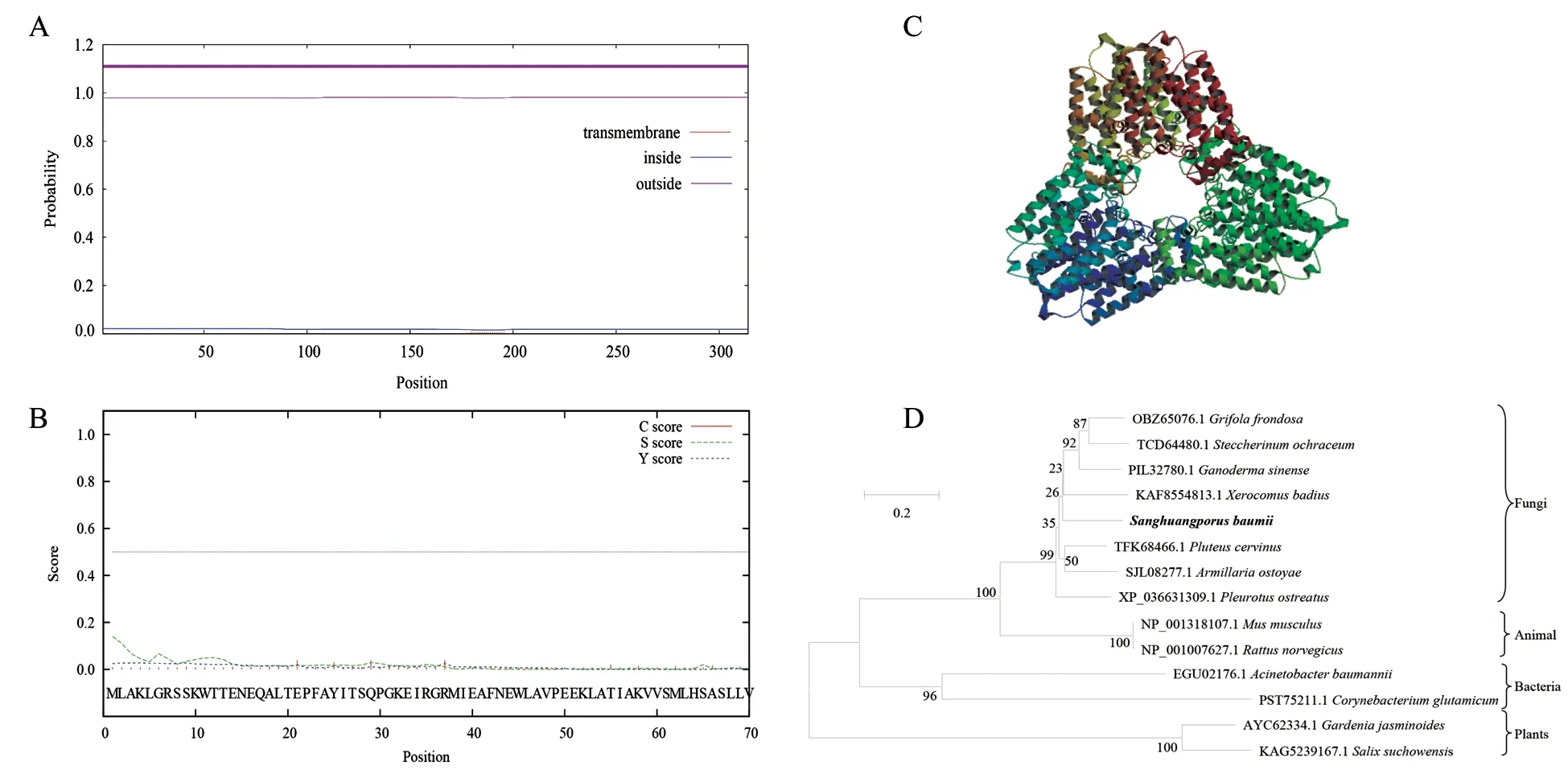
图4 SbGGPS 蛋白生物信息学分析Fig.4 Bioinformatic analysis of the SbGGPS protein
2.3 MeJA 对SbGGPS 基因转录的影响
采用qRT-PCR 技术检测经过H2O、吐温-20以及不同浓度MeJA 诱导后的暴马桑黄菌丝体SbGGPS基因转录水平变化。检测结果显示(图5),与对照组H2O 和吐温-20 相比,MeJA 处理后SbGGPS基因的转录水平明显降低;且MeJA 浓度高于100 μmol·L-1后,对SbGGPS基因转录水平的抑制作用更加显著;SbGGPS基因转录水平最低的是经过150 μmol·L-1MeJA 处理的一组,仅为对照组(H2O)的2/5 左右。
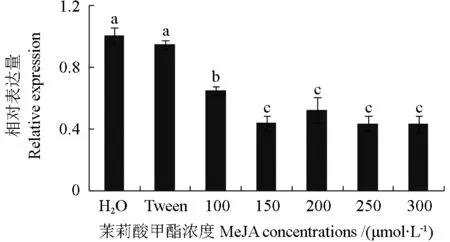
图5 不同浓度MeJA 处理下的SbGGPS 基因转录水平Fig.5 The transcript level of SbGGPS gene under different MeJAconcentrations
2.4 MeJA 对暴马桑黄菌丝赤霉素含量的影响
采用分光光度法测定经过H2O、吐温-20 以及不同浓度MeJA 诱导后的暴马桑黄菌丝体中赤霉素含量。检测结果显示(图6),经过外源物质处理后的暴马桑黄菌丝体中赤霉素含量均呈显著性下降,而MeJA 诱导后的暴马桑黄菌丝体中赤霉素含量下降趋势明显。经过250 μmol·L-1MeJA 处理的一组赤霉素含量最低(0.33 mg·g-1),仅为对照组(H2O)的2/5 左右。
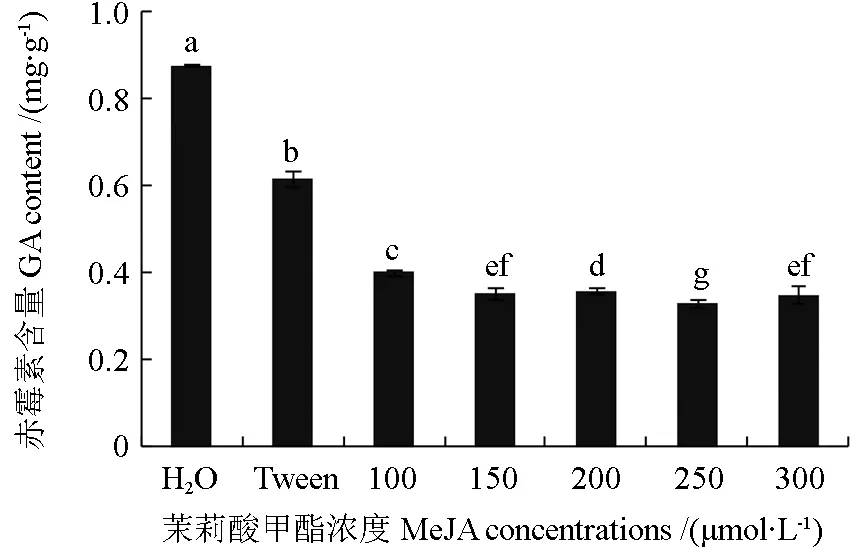
图6 不同浓度MeJA 处理下的暴马桑黄菌丝体赤霉素含量Fig.6 GA content of S.baumii mycelium under different MeJA concentrations
2.5 MeJA 对暴马桑黄菌丝体生物量的影响
分别称量经H2O、吐温-20 以及不同浓度MeJA 诱导后暴马桑黄菌丝体的生物量。由图7可以看出,MeJA 浓度的升高,使得暴马桑黄菌丝体生物量明显下降;经过300 μmol·L-1MeJA 处理的一组生物量最低(2.82 g·L-1),仅为对照组(H2O)的3/5 左右。
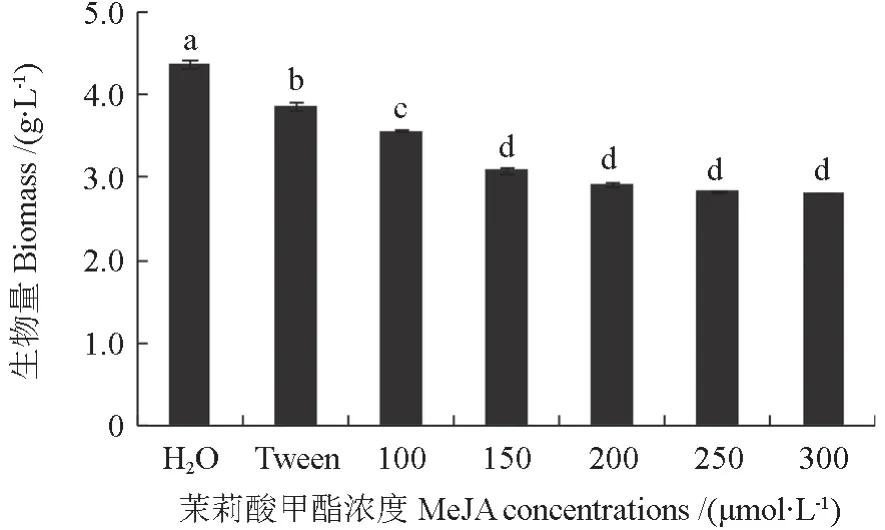
图7 不同浓度MeJA 处理下的暴马桑黄菌丝体生物量Fig.7 Biomass of S.baumii mycelium under different MeJA concentrations
2.6 相关性分析
为研究MeJA 诱导对SbGGPS基因转录水平、赤霉素含量及生物量的影响,分别对其进行Pearson 相关分析(表2)。结果显示MeJA 与SbGGPS基因转录水平、赤霉素含量及生物量均呈显著负相关,说明随着MeJA 浓度的升高,对SbGGPS基因转录水平、赤霉素含量及生物量均有显著抑制作用。随后利用Pearson 分析了MeJA 诱导下SbGGPS基因转录水平、赤霉素含量及生物量三者之间的相关性(表2),结果表明SbGGPS基因转录水平、赤霉素含量、生物量两两之间均呈显著正相关关系。说明SbGGPS基因可能在暴马桑黄菌丝生长发育过程中起着重要作用,通过调节赤霉素的合成,进而影响菌丝体生物量。
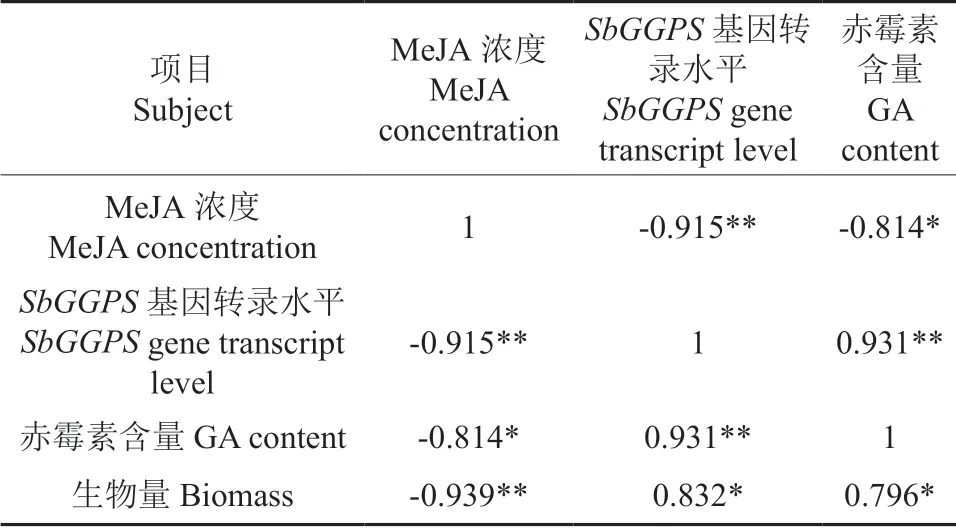
表2 Pearson 相关性分析†Table 2 Pearson correlations analysis
2.7 SbGGPS 基因原核表达
将构建成功的pET-32a-SbGGPS重组质粒转入大肠杆菌感受态细胞BL21(DE3)中,用1 mmol·L-1IPTG 诱导表达目的蛋白。SDS-PAGE结果显示,在经过2、4、6、8h 和10 h 的诱导后,转化后的菌体均表达出一条56.89 kDa 左右的蛋白条带,与预测条带大小一致(SbGGPS 蛋白35.89 kDa+标签蛋白21 kDa),而且随着诱导时间的延长目的蛋白表达量逐渐增加,且总体处于较高表达水平。
3 结论与讨论
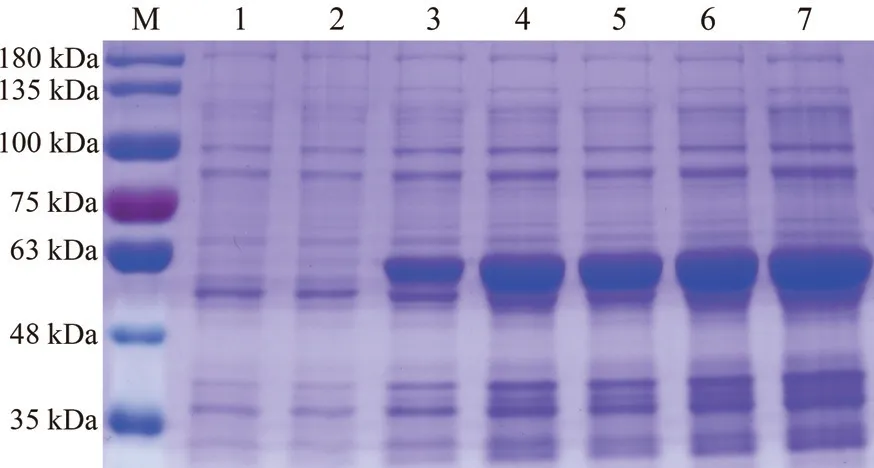
图8 SDS-PAGE 分析SbGGPS 基因诱导表达产物Fig.8 Results of the expression of SbGGPS in E.coli BL21 by SDS-PAGE analysis
3.1 讨 论
启动子是RNA 聚合酶识别、结合和开始转录的一段DNA 序列。一个高效启动子能够显著增加基因的转录水平。Johanson 等[25]研究发现使用基因自身启动子能显著增加基因自身的表达水平,并可将产物浓度提高3 倍以上。目前食药用菌遗传转化体系仍存在转化效率低的问题[26],为了提高遗传转化效率,现在食药用菌转基因研究中逐渐使用基因同源启动子,这样有利于受体细胞调控因子的识别,减少甲基化,提高转化效率[27]。通过对SbGGPS启动子分析发现,该启动子在454~504 bp 之间为核心启动区的概率达到0.99,表明克隆得到的启动子片段含有转录起始的关键区域。作用元件分析发现,SbGGPS启动子含有决定基因转录的关键顺式作用元件TATA-box和CAAT-box。为响应外界物质的诱导胁迫,启动子通常还包含多种其他作用元件,包括MeJA 的信号分子元件CGTCA-motif,响应厌氧诱导元件ARE,参与干旱诱导元件MBS 等。上述结果初步说明克隆到的SbGGPS启动子序列具有正常的调控转录功能,并且能够响应外界的诱导和胁迫。
对暴马桑黄赤霉素生物合成途径中的功能基因研究有助于利用分子手段获得优质高产的暴马桑黄菌株。本试验通过PCR 克隆获得SbGGPS基因cDNA 序列全长,序列分析显示SbGGPS基因具有完整开放阅读框,其编码的蛋白为不稳定的亲水性蛋白;同时该蛋白不具有跨越细胞器膜的结构和引导蛋白的信号肽,且定位在细胞质中,说明其既不是跨膜蛋白也不是分泌蛋白,与前人研究结果相吻合[14-15]。系统进化树构建结果显示,暴马桑黄GGPS 蛋白与褐绒盖牛肝菌、紫芝、灰树花等真菌GGPS 蛋白同源性最高,与动物(小鼠、褐家鼠)次之,与细菌(谷氨酸棒杆菌、鲍氏不动杆菌)和植物(栀子、簸箕柳)同源性较低,符合生物进化关系,这一结果在唇形科植物GGPS蛋白物种同源性研究中也被证实过[14]。
通过MeJA 诱导来增加次生代谢物的产量是研究者常用的技术手段,并且收到的效果也十分显著。Ketchum 等[28]发现MeJA 的诱导使红豆杉细胞生产次生代谢物紫杉醇的速度加快,在250 μmol·L-1MeJA 最佳浓度诱导下,紫杉醇浓度能够达到23.4 mg·L-1·d-1。Jiao 等[29]发现MeJA 诱导可以促进黄芪材料中次生代谢物三萜皂苷的生物合成,157.4 μmol·L-1MeJA 处理18.4 h 能够使三萜皂苷含量达到最大,是未处理对照的2.1 倍。同时,MeJA 诱导次生代谢物三萜产量增加在灵芝和暴马桑黄中也都被证实[19-20]。但是,本研究发现MeJA 对次生代谢物赤霉素的含量及其合成途径中的关键基因SbGGPS的表达产生明显的抑制作用,并且严重影响暴马桑黄菌丝体的生长发育,导致其生物量的减少。由此可推测MeJA 增加其他次生代谢产物的积累很可能是通过抑制赤霉素合成途径关键基因表达,导致前体底物法呢基焦磷酸更多地流向三萜或其他合成途径(图1),从而实现三萜或其他次生代谢产物的增加。结果分析中也发现SbGGPS启动子上具有MeJA 响应元件,暗示MeJA 很可能通过作用某个转录因子,转录因子进而抑制启动子上的CGTCA-motif 元件,降低SbGGPS基因的转录水平,从而影响赤霉素的产量,最后降低了暴马桑黄菌丝体的生物量,该推测还有待于进一步验证[18]。
此外,我们通过构建SbGGPS基因原核表达载体来验证其表达水平。结果表明目的蛋白诱导表达成功且目的蛋白含量明显高于杂蛋白,说明SbGGPS基因在原核系统中表达效果良好。在未来研究中,我们将构建真核表达载体,进一步证明SbGGPS基因在暴马桑黄生长发育中的作用机理。
3.2 结 论
本研究成功克隆到SbGGPS基因cDNA 全长(945 bp),其编码的蛋白质不含信号肽和跨膜结构,能够在大肠杆菌中表达。MeJA 诱导显著抑制SbGGPS基因表达,同时使赤霉素含量和生物量明显降低,很可能是SbGGPS启动子上的CGTCAmotif 元件响应MeJA 诱导的结果。试验初步证实SbGGPS基因参与暴马桑黄菌丝生长发育过程,并起着重要调节作用。
