肝移植术后早期移植物功能不全的研究进展
2022-09-23郭宏伟张丽徐钧山西医科大学第一临床医学院山西太原030000山西医科大学第一医院肝胆胰外科及肝脏移植中心山西医科大学肝病与器官移植研究所消化系疾病与器官移植山西省重点实验室山西太原030000
郭宏伟,张丽,徐钧(.山西医科大学第一临床医学院,山西 太原 030000;.山西医科大学第一医院肝胆胰外科及肝脏移植中心,山西医科大学肝病与器官移植研究所,消化系疾病与器官移植山西省重点实验室,山西 太原 030000)
肝移植是治疗急性肝功能衰竭和终末期肝病患者的最有效也是唯一有效治疗方法。早期移植物功能不全(early allograft dysfunction,EAD)是肝移植术后的常见并发症,其发生率为26.5%~35.9%[1-5],与移植物存活和移植术后受体生存有密切联系。然而,人们对于EAD 的认识仍有待深入。本文综述了EAD 的定义、诊断标准、发生机制、对受体的影响、风险因素及其防治策略,以期促进临床医师对这一并发症的认识,改善患者预后。
1 EAD 的定义
EAD 的基本定义是肝移植术后早期(1 周内)移植物功能处于边缘状态[6],绝大多数EAD 是可逆的,可无明显的症状而仅有肝脏生化检查异常,小部分EAD 可进一步发展为早期移植物无功能,导致再次移植或患者死亡。
2 EAD 的诊断标准
EAD 的诊断标准是在长期的肝移植术后早期移植物功能评估过程中发展而来的,目前临床研究中应用最为广泛的诊断标准是Olthoff 等[7]及其移植团队于2010 年提出的,满足以下3 个条件之一即可诊断为EAD:① 肝移植术后第7 天总胆红素(total bilirubin,TBiL)≥10 mg/dl(171 μmol/L);② 肝移植术后第7 天国际标准化比值(international normalized ratio,INR)≥1.6;③ 肝移植术后7 d 内丙氨酸转氨酶(alanine aminotransferase,ALT)或天冬氨酸转氨酶(aspartate aminotransferase,AST)>2 000 U/L。
本文所指EAD 定义,若无特殊说明,均为此定义。然而,Olthoff 教授提出的EAD 定义是较为简单的二分类定义,单纯地将肝移植受者分为两类,不能较好地对肝移植术后移植物功能进行连续分级。因此,一个可以准确评估肝移植术后移植物功能并预测移植预后的评分模型迫在眉睫[8]。为此,移植界已进行了多项研究并提出了数个肝移植预后模型,主要包括以下几种模型。
(1) Pareja 等[9]于2015 年提出了早期移植物功能评估模型评分(model for early allograft function score,MEAF)。
MEAF 评分=ALT 分值+INR 分值+TBiL 分值。
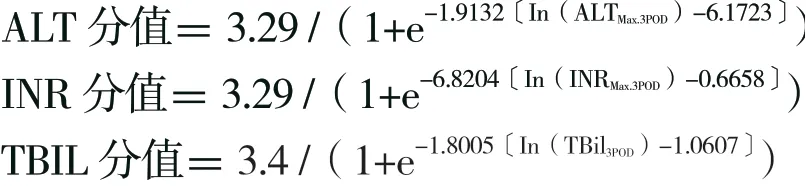
ALTMax.3POD:术后前3 d ALT 最大值,INRMax.3POD:术 后 前3 d INR 最 大 值,TBiL3POD:术 后 第3 天TBiL。
(2) Agopian 教授[6]于2017 年提出了L-GrAFT评分(liver graft assessment following transplantation risk score,L-GrAFT):L-GrAFT 分值=11.27 - 0.429 ×(AUC log AST) + 0.005 × (AUC log AST2) + 4.607 ×(early slope log AST) + 4.413 × (early slope log AST2) +0.890 × (log max INR) - 0.049 × (AUC log TBiL) +0.004 × (AUC log TBiL2) + 5.336 × (slope log TBiL) -0.046 × (AUC log PLT) - 5.249 × (slope log PLT) +13.086 × (slope log PLT2)。
AUC log AST:术后10 d AUC log AST;AUC log AST2:术后10 d AUC log AST2;early slope log AST:术后7 d log AST 斜率;early slope log AST2:术后7 d log AST2斜率;log max INR:术后10 d log max INR;AUC log TBiL: 术 后10 d AUC log TBiL;AUC log TBIL2:术后10 d AUC log TBiL2;slope log TBiL:术后10 d log TBiL 斜率;AUC log PLT:术后10 d AUC log PLT;slope log PLT:术 后10 d log PLT 斜 率;slope log PLT2:术后10 d log PLT2斜率。
(3) Avolio 等[10]于2020 年 进 行 了 一 项 包 含1 609 例移植患者的多中心队列研究后提出了EASE评分(early allograft failure simplified estimation score):EASE 评分=0.958 + (0.044 × 移植时MELD 分值) +(0.065 × PRBC) + (2.567 × 血 栓) + (0.000534 ×AUC2AST) + (-0.093 × AUC PLT) + (-7.766 × Slope PLT) + (0.735 × Slope Bilirubin) + (-0.402 ×大样本中心)。
PRBC (packed red blood cell ):包装红细胞输注数;血栓:肝血管血栓形成赋值为1;AUC2AST:术后第1、2、3、7、10 天AUC2AST;AUC PLT:术后第1、3、7、10 天AUC PLT;Slope PLT:术后第1、3、7、10 天PLT 斜率;Slope Bilirubin:术后第1、3、7、10 天胆红素斜率;大样本中心:70 例及以上为大样本,赋值为1。
新提出的MEAF 评分、L-GrAFT 评分和EASE评分可以对肝移植术后肝功能进行连续分级,但其计算公式较为复杂,可能影响其在临床工作中的应用。
截至目前,已有多项验证上述评分的相关临床研究。Jochmans 等[11]的一项包括660 例肝移植患者的研究表明,MEAF 评分和EAD 分类都是3 个月、6 个月和12 个月移植物存活率的独立预测因子,且MEAF 评分比常用的EAD 分类更能准确地预测移植物丢失。然而,一项来自Rayar 等[12]的包括785 例肝移植患者的研究发现,使用MEAF 评分评估移植物功能障碍严重程度是有效的,但MEAF 评分预测3 个月移植物存活的能力不如传统EAD 二分类标准。截止目前,移植界尚无验证L-GrAFT 评分和EASE评分预测肝移植预后准确性的相关研究。
3 EAD 的发生机制
目前认为,EAD 的潜在病理生理学机制主要与肝缺血/再灌注损伤(ischemia reperfusion injury,IRI)有关[13]。肝缺血/再灌注损伤是指肝脏经历一段时间的缺血后重新灌注时遭受的肝损伤,是肝移植过程中不可避免的事件,肝移植过程中的IRI 包括热IRI 和冷IRI 两个过程。热IRI 是指器官获取和移植过程中肝循环中断和恢复时造成的损伤,主要通过枯否细胞介导的细胞毒性物质的释放导致肝细胞损伤,冷IRI 是指器官储存过程中导致的肝脏损伤,主要导致肝窦内皮细胞的损伤和微循环的破坏[14-15]。两种形式的IRI 都包括缺血和再灌注两个阶段:缺血阶段主要表现为局部组织细胞代谢紊乱,而再灌注阶段主要表现为严重的炎症反应[16]。
肝脏缺血/再灌注损伤发生的分子机制十分复杂,目前的研究显示,与肝IRI 相关的分子通路主要有过氧化物酶体增殖物激活受体途径、核因子-κB 途径、磷脂酰肌醇-3-激酶/蛋白激酶B途径和p38 丝裂原激活蛋白激酶途径[13]。
4 EAD 对受体的影响
已有多项研究证实,EAD 与肝移植术后早期的不良移植结果相关。一项来自Hudcova 等[2]于2017 年发表的包含239 例肝移植患者的回顾性队列研究表明:EAD 不仅与肝移植术后1 年移植物丢失显著相关,而且与机械通气时间>2 d、麻醉后监护室/外科重症监护室(post-anesthesia care unit,PACU / surgical intensive care unit,SICU)住院时间>2 d、肾功能衰竭显著相关。迄今为止关于EAD 最大的单中心队列研究是来自梅奥诊所Lee 等[1]于2016 年发表的包含1 950 例肝移植的回顾性队列研究,该研究表明,发生EAD 的患者1、3 年和5 年移植物存活率和和患者生存率都明显低于未发生EAD 的患者,并且EAD 患者的平均住院时间显著延长。因此,EAD 可作为肝移植术后的早期预后指标,可用来预测移植物和患者生存率,以促进对该类患者及早实施针对性的防治策略,以及更好地优化供体-受体匹配。
研究发现,EAD 不仅与肝移植术后移植物丢失和患者生存有关,而且对其他脏器也有显著影响。2015 年,梅奥诊所Wadei 等[17]的研究表明EAD 与肝移植术后新发急性肾损伤(acute kidney injury,AKI)和术后1 年内发生终末期肾病的高风险相关,EAD 是AKI 需要肾脏替代治疗的独立预测因子。此外,术后第7 天胆红素>10 mg/dl 的受者发生肝移植术后AKI 的风险最高,这表明肾脏损伤不仅与肝缺血/再灌注损伤过程中肝脏枯否细胞释放的炎性细胞因子引发的全身炎症反应相关,也与EAD 引起的高胆红素血症导致的肾小管功能障碍有关。该团队的后续研究表明[18-19],对于肝移植术前接受肾脏替代治疗的患者,EAD 是肝移植术后肾功能不恢复(30 d 内)的预测因素。因此,预防EAD 发生或减轻其影响的治疗措施可能有助于改善肝移植后肾功能恢复和患者生存率。研究表明[20],肝移植术后肺部损伤与肝缺血/再灌注过程中枯否细胞释放的炎性细胞因子引发的全身炎症反应有关。然而,肝移植术后肺部损伤与EAD 的内在联系尚不清楚。目前,关于EAD 对肝外脏器的影响的研究主要集中于肾脏损伤,EAD 对肺脏以及其余脏器的影响仍有待进一步的研究。
5 EAD 发生的危险因素
研究表明,EAD 是肝移植术后的多因素并发症,移植界已进行了一些初始研究来寻找可控的危险因素。
5.1 供体因素:一项来自Hoyer 等[21]的包含678 例肝移植患者的研究认为,肝移植术后早期移植物功能主要取决于供体因素,而肝移植术后长期移植物功能及患者的远期存活主要是经受体因素驱动。
5.1.1 供体年龄:一直以来,移植界普遍认为高龄供体意味着更差的移植物质量,高龄供体的器官多发生退行性变、再生能力较差,更容易遭受缺血/再灌注损伤。中国心脏死亡捐献器官评估与应用专家共识2014 版将50 岁作为肝移植供体筛选的年龄界限,而将50 ~65 岁作为边缘性供肝筛选的年龄界限[22]。然而最近的研究表明[23],当排除脂肪变性、血钠水平等其他影响供肝质量的危险因素后,供体年龄并不会影响移植肝功能。
5.1.2 供肝脂肪变性:研究表明,相较于正常供肝,脂肪变性供肝对缺血/再灌注损伤的耐受性更差,并且缺血/再灌注损伤的特点也与正常供肝不同[24]。肝细胞内的脂滴使肝细胞胀大,一方面导致肝血窦狭窄,导致局部微循环障碍。另一方面在器官冷保存时易发生脂肪固结,再灌注时引起肝细胞崩解坏死。Hoyer 等[21]的研究证实,供肝活检大泡脂肪变性是EAD 的预测因子。目前普遍认为,轻度脂肪变性供肝(<30%)是安全的,中度脂肪变性供肝(30%~60%)与肝移植术后EAD 显著相关,应谨慎使用,而重度脂肪变性供肝(>60%)应予丢弃[25]。
5.1.3 冷、热缺血时间:众所周知,冷、热缺血时间是肝移植术后EAD 最重要的危险因素,但具体的冷、热缺血时间标准依然众说纷纭。中国心脏死亡捐献器官评估与应用专家共识2014 版将冷、热缺血时间标准定为[22]:热缺血时间<20 min、冷缺血时间<8 h,将热缺血时间20 ~30 min、冷缺血时间8 ~15 h 定义为边缘性供肝,不建议使用热缺血时间超过30 min、冷缺血时间超过15 h 的供肝。来自Paterno 等[26]的包含2 107 例DCD 肝移植的研究认为DCD 肝移植热缺血时间的安全阈值为40 min。而来自2020 年国际肝移植协会的共识意见则认为DCD 肝移植热缺血时间的安全阈值为30 min,当存在其他危险因素(如供体年龄>45 岁)时,此阈值应降低为20 min[27]。
5.1.4 心脏死亡捐献供肝(DCD 供肝):随着我国DCD 供肝的广泛开展,目前已成为供肝获取的重要来源。相较于DBD 供肝,DCD 供肝意味着较长的热缺血时间,这可能导致更差的移植预后。来自梅奥中心的研究表明DCD 供肝是肝移植术后EAD发生的高危因素[1]。
5.1.5 供体高钠血症:肝移植术前供体血清钠浓度对肝移植术后移植物功能的影响目前尚无明确定论。既往的研究表明供体高钠血症 (≥155 mmol/L)与肝移植术后EAD 相关[28],然而最近的多项研究表明供体高钠血症并不会对肝移植术后移植物功能产生负面影响[29-31],因此,供体高钠血症对肝移植术后的影响仍需进一步的研究来明确。
5.1.6 其他:近期浙江大学进行了一项关于移植前供肝肝内蛋白表达谱对肝移植术后EAD 的影响的临床研究表明同种异体移植物重量和肝内血管内 皮 生 长 因 子(vascular endothelial growth factor,VEGF)高表达是肝移植术后EAD 的危险因素[32]。这可能与较大的移植物接受较小的门静脉血流导致肝内微循环灌注不足有关,而VEGF 高表达则可能意味着供肝存在较严重的缺血/再灌注损伤。
5.2 受体因素
5.2.1 终 末 期 肝 病 模 型(model for end-stage liver disease,MELD)评分:受体术前疾病的种类及其严重程度对肝移植术后EAD 的发生起着重要作用。MELD 评分可以比较准确的评估受体术前疾病的严重程度,来自Olthoff 等[7]的研究也表明,较高的MELD 评分是肝移植术后EAD 发生的危险因素(MELD 评分每增加10 分,EAD 的发生率增加约44%)。
5.2.2 合并恶性肿瘤:来自梅奥诊所的一项研究发现[33],以肝癌作为第二诊断的患者发生EAD 的风险显著增加,但两者之间的内在联系仍不清楚。
5.3 手术因素:肝移植术后EAD 的手术相关危险因素包括手术时间、术中输注红细胞数量等[1,10]。较长的手术时间和更多的输血量意味着手术过程更加复杂以及术前疾病更严重,如广泛的侧枝循环形成、门静脉血栓、门静脉海绵样变等。来自Lee 等[1]的研究表明,手术时间和术中输注红细胞数量是肝移植术后EAD 发生的独立危险因素,发生EAD组与未发生EAD 组的平均手术时间分别为4.3 h 和4.8 h,平均输注红细胞数量为10.0单位和13.1单位。
6 EAD 的预防策略
由于EAD 的发生机制主要是IRI 以及不同程度的排斥反应,所以目前针对EAD 的预防策略主要集中于减轻IRI 和优化供受体匹配。
6.1缩短冷、热缺血时间:已有多项研究表明[21],较短的冷、热缺血时间意味着更好的移植物质量以及较低的EAD 发生率,因此,缩短冷、热缺血时间可以预防EAD 的发生。例如合理分配器官,尽可能避免远距离运输以及提高运输效率以缩短冷缺血时间,优化器官获取的手术过程以缩短热缺血时间也可以有效地预防EAD。
6.2器官保存液的选择及改良:自1987 年现世以来,UW 液已成为供体肝脏保存液的金标准。除UW 液之外,临床当中常用的器官保存液还包括HTK 液、CS 液、IGL-1 液等。然而,关于各种器官保存液的优缺点及其选择仍未形成统一的认识。最近的一项研究表明HTK 液、CS 液、IGL-1 液在器官保存方面具有与UW 液相同的安全性和有效性[34]。然而也有研究表明HTK 液在减少移植物损伤方面不如UW 液和IGL-1 液,并且与更高的术后EAD 发生率相关[35]。由此可见,各种器官保存液的适用条件仍需进一步的随机对照研究来证明。
虽然现有的器官保存液已经能够在很大程度上延长器官冷储存的时间,但是冷储存过程中带来的损伤仍是影响移植预后的重要原因。因此,移植界仍在致力于改良器官保存液以减轻发生在冷储存过程中的损伤。Kniepeiss 等[36]的最新报道显示,传统的HTK 液-Custodiol®已经改进为Custodiol-N版本;体外研究已经证明Custodiol-N 溶液在减轻供肝冷保存损伤方面优于Custodiol®溶液。后续的Ⅲ期临床移植试验正在进行,其结果尚未公布。
6.3机械灌注(machine perfusion,MP):与静态冷储存相比,MP 可以冲洗肝内的无氧代谢产物等有害物质,提供细胞代谢所需的能量及营养物质,并能实时监测器官功能的变化。MP 的出现推动了高风险供体的应用,目前MP 主要包括以下几种类型:低温机械灌注、亚低温机械灌注、常温机械灌注、低温氧合机械灌注、受控氧合复温等。作为目前移植界器官保存领域的研究热点,已有大量关于MP 技术的优势及缺点的研究。并且,中山大学何晓顺教授团队于2017 年首次将常温机械灌注技术运用于临床,实现了无缺血肝移植[37]。该研究的成功意味着IRI 可以得到完全的避免,供体器官可以获得最大限度的利用。
6.4优化供受体匹配:肝移植供受体匹配主要包括ABO 血型匹配、大小匹配、性别匹配、种族匹配等方面。目前的研究表明,ABO 血型不相容肝移植(ABOi-LT)患者术后生存率显著低于ABO血型相容肝移植患者,因此,ABOi-LT 应谨慎应用于临床以降低术后EAD 的发生风险[38]。有研究表明移植物重量是肝移植术后EAD 的危险因素,将移植物大小匹配作为供受体匹配的一部分有望降低术后EAD 的发生风险[32]。
7 展 望
随着肝移植成功率越来越高,越来越多的患者选择了接受肝移植治疗。EAD 作为肝移植术后的常见并发症,也是患者预后不良的重要原因。因此,了解EAD 的发病机制及危险因素、改良EAD 的诊断标准、运用机械灌注等技术预防EAD 的发生对于提高肝移植患者的长期生存具有重要的临床意义。机械灌注作为一种更优的器官保存技术,表现出了良好的应用前景,但其应用指征、灌注参数以及灌注液的选择仍未形成统一认识,尚需大量研究进行探索。
