过表达微小RNA-877-5p通过靶向叉头框转录因子M1调控胃癌细胞活力和凋亡
2022-09-22张荣姚春和
张荣,姚春和
胃癌的诊断和治疗当前有了很大改善,但手术切除后肿瘤转移频繁和肿瘤复发率仍然较高,晚期胃癌病人的预后较差[1-2]。因此,阐明胃癌发生发展的分子机制,寻找新的生物标志物,开发靶向治疗手段势在必行。微小RNA(microRNA,miRNA,miR)是内源性非编码RNA(长度约为22 nt),通过降解靶mRNA或阻断其翻译,转录后调节基因表达,并作为癌基因或抑癌基因发挥作用[3]。越来越多的证据表明,miRNA参与肿瘤包括胃癌的发生发展过程[4]。研究表明,miR-877-5p在胶质瘤和肝癌组织、细胞中低表达[5],且过表达miR-877-5p可抑制肝癌细胞的增殖、迁移和侵袭[6]。但miR-877-5p在胃癌细胞中的表达,以及对胃癌细胞增殖和凋亡的影响和机制,目前还尚未可知。因此,本研究自2020年1—7月通过评估miR-877-5p在胃癌细胞生长和凋亡中的作用,旨在阐明其潜在机制。
1 资料与方法
1.1 一般资料胃癌细胞株HGC-27、SUN-1、AGS和正常胃黏膜上皮细胞株GES-1购自美国典型培养物保藏中心(ATCC)。RPMI-1640培养基、胎牛血清购自美国Gibco公司;miR-877-5p模拟物/抑制物、模拟物阴性对照(miR-NC)/抑制物阴性对照(anti-miRNC)、FOXM1小干扰RNA(si-FOXM1)、小干扰RNA阴性对照si-NC、FOXM1过表达载体(pcDNAFOXM1)、阴性对照pcDNA购自武汉淼灵生物科技有限公司;实时定量基因扩增荧光检测(qPCR)试剂盒购自美国ThermoFisher公司;胰酶、MTT、RIPA裂解液购自美国Sigma公司;抗FOXM1、细胞周期蛋白D1(cyclinD1)、细胞周期依赖性激酶抑制因子p21与p27、B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)、Bcl-2相关X蛋白(bcl-2 associated X protein,Bax)、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved cysteinyl aspartate specific proteinase 3,cleaved-caspase 3)蛋白抗体购自美国Cellular Signaling Technology公司;辣根过氧化物酶标记的Ⅱ抗购自北京中杉金桥生物技术有限公司;ECL发光检测试剂盒、双萤光素酶报告基因检测试剂盒、Annexin V-FITC细胞凋亡检测试剂盒购自上海碧云天生物技术研究所。酶标仪购自德国Eppendorf公司,BD FACSCalibur流式细胞仪购自美国Beckman公司。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 方法
1.2.1 细胞培养与脂质体转染HGC-27、SUN-1、AGS和GES-1细胞用含10%胎牛血清的RPMI-1640培养基,置于恒温培养箱中(37℃、5%二氧化碳)培养。观察细胞达到80%融合度的生长状态时,加入胰酶,消化并接种传代。
胃癌HGC-27细胞转染时,将生长状态良好的HGC-27细胞接种于6孔板,细胞密度为1×105个/毫升。利用Lipofectamine 2000试剂,在融合度大于70%的HGC-27细胞中转染miR-877-5p模拟物、miR-NC,si-FOXM1、si-NC,共转染miR-877-5p模拟物和pcDNA-FOXM1、共转染miR-877-5p和FOXM1过表达载体阴性对照(pcDNA),分别记为miR-877-5p组、miR-NC组、si-FOXM1组、si-NC组、miR-877-5p+pcDNA-FOXM1组和miR-877-5p+pcDNA组。培养48 h,收集细胞用于后续指标检测。
1.2.2 qPCR检 测miR-877-5p和FOXM1 mRNA表达TRIzol试剂提取HGC-27、SUN-1、AGS和GES-1细胞总的RNA,并逆转录为互补核糖核酸(cDNA),以cDNA为模板,U6为参照,进行qPCR反应。miR-877-5p的正向引物序列为5'-GGGGACACGGGCAAAGACT-3',反向引物序列为5'-GAGGACACACGTCTGAGGGTC-3';FOXM1的 正向 引 物序列 为5'-GGAGGAAATGCCACACTTAGCG-3',反 向引物序列为5'-TAGGACTTCTTGGGTCTTGGGGTG-3'。收集反应结束后得到的Ct值,根据2-ΔΔCt方法计算miRNA和mRNA的表达。
1.2.3 蛋白质印迹法检测蛋白的表达HGC-27细胞总蛋白的提取通过RIPA裂解液进行,吸取蛋白样品进行10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,之后用5%脱脂奶粉常温封闭PVDF膜1 h,加入1∶1 000稀释的抗FOXM1、CyclinD1、p21、p27、Bcl-2、Bax、cleaved-caspase3Ⅰ抗,同时加入抗甘油醛-3-磷酸脱氢酶(GAPDH)Ⅰ抗作内参,并于4℃孵育12 h。PVDF膜用1∶5 000稀释的Ⅱ抗孵育,1 h后加入ELC化学发光液显色、显影,分析蛋白条带灰度值。
1.2.4 MTT法检测细胞活力 收集HGC-27细胞5×104个/毫升,接种于96孔板,分别连续培养24 h、48 h、72 h,将100 μL MTT溶液(浓度为5 mg/mL)加至每孔中,37℃孵育,4 h后去上清,将200 μL二甲基亚砜(dimethyl sulphoxide,DMSO)加至每孔中,置37℃摇床振荡充分溶解结晶,10 min后置酶标仪读取各孔细胞吸光度值(OD值),检测波长λ=490 nm。
1.2.5 流式细胞术检测细胞凋亡 细胞凋亡的检测参照annexin V-FITC细胞凋亡检测试剂盒步骤进行。调整HGC-27细胞密度为1×106个/毫升,在195 μL annexin V-FITC结合液中重悬,将其转移至EP管,之后依次加入5 μL annexin V-FITC和10 μL PI染色液,分别轻轻混匀,在黑暗中静置20 min,上流式细胞仪进行HGC-27细胞凋亡情况评估。
1.2.6 双荧光素酶活性检测 利用TargetScan(http://www.targetscan.org/)在 线 工 具 预 测 发 现FOXM1的3’非编码 区(3’untranslated region,3’UTR)中含有miR-877-5p假定的结合位点,推测FOXM1可能是miR-877-5p的靶基因。使用位点突变技术构建突变的FOXM1 3’UTR,利用PCR技术扩增野生型FOXM1 3’UTR和突变型FOXM1 3’UTR序列,将扩增序列与含有萤火虫荧光素酶基因的质粒重组,鉴定出正确的质粒命名为野生型FOXM1(WT-FOXM1)和 突 变 型FOXM1(MUTFOXM1),将其与miR-877-5p模拟物或miR-NC共转染入HGC-27细胞,48 h后遵循双萤光素酶报告基因检测试剂盒的步骤,测定双荧光素酶活性。
1.3 统计学方法每个独立实验均重复6次。采用SPSS 22.0软件进行数据的整理与分析,并表示为。两组间数据比较用t检验,多组数据间比较用单因素方差分析,组间多重比较用SNK-q检验,当P<0.05时,差异有统计学意义。
2 结果
2.1 miR-877-5p和FOXM1在胃癌细胞和正常胃黏膜上皮细胞中的表达qPCR检测miR-877-5p表达,结果显示,与正常胃黏膜上皮细胞GES-1比较,miR-877-5p表达量在胃癌细胞HGC-27、SUN-1、AGS中明显减少(P<0.05),选择差异最显著的HGC-27细胞进行后续实验。qPCR和Western blotting分别检测FOXM1 mRNA和FOXM1的蛋白表达,发现与GES-1组比较,FOXM1 mRNA和FOXM1的蛋白表达量在HGC-27、SUN-1、AGS细胞中显著增加(P<0.05)。见表1,图1。
表1 miR-877-5p和FOXM1在胃癌细胞和正常胃黏膜上皮细胞中的表达/
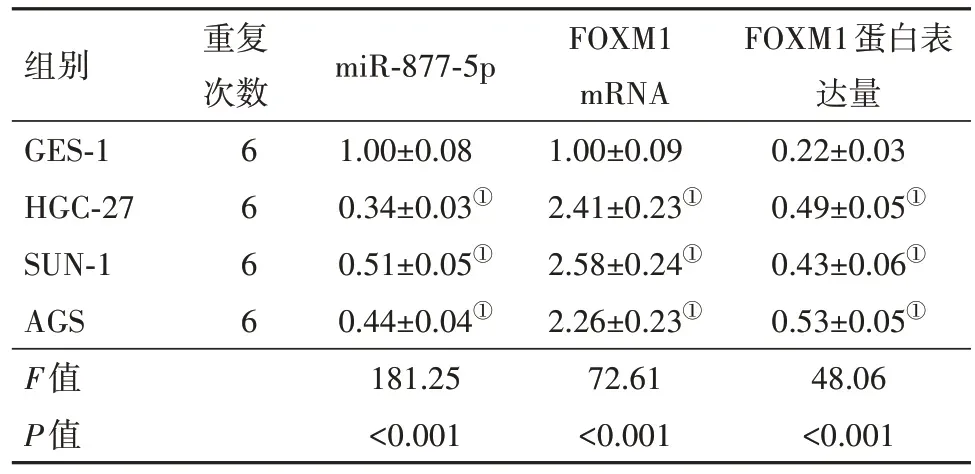
表1 miR-877-5p和FOXM1在胃癌细胞和正常胃黏膜上皮细胞中的表达/
注:①与GES-1组比较,P<0.05。
组别GES-1 HGC-27 SUN-1 AGS F值P值重复次数6 6 66 miR-877-5p 1.00±0.08 0.34±0.03①0.51±0.05①0.44±0.04①181.25<0.001 FOXM1 mRNA 1.00±0.09 2.41±0.23①2.58±0.24①2.26±0.23①72.61<0.001 FOXM1蛋白表达量0.22±0.03 0.49±0.05①0.43±0.06①0.53±0.05①48.06<0.001

图1 miR-877-5p和FOXM1在胃癌细胞和正常胃黏膜上皮细胞中的表达
2.2 miR-877-5p过表达对胃癌HGC-27细胞活力的影响在HGC-27细胞转染miR-877-5p模拟物,发现miR-877-5p表达量远远高于miR-NC组(P<0.05)。MTT检测结果显示,miR-877-5p过表达明显降低48 h(P<0.05)、72 h(P<0.05)的细胞活力,对24 h的细胞活力无显著影响。Western blotting检测结果表明,相比于miR-NC组,miR-877-5p过表达显著减少cyclinD1的表达量,提高p21、p27的蛋白水平(P<0.05)。见表2,图2。
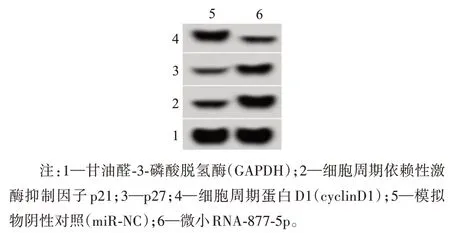
图2 miR-877-5p过表达对胃癌HGC-27细胞活力的影响
表2 miR-877-5p过表达对胃癌HGC-27细胞活力的影响/

表2 miR-877-5p过表达对胃癌HGC-27细胞活力的影响/
注:OD为吸光度,cyclinD1为细胞周期蛋白D1,p21、p27均为细胞周期依赖性激酶抑制因子。
组别miR-NC miR-877-5p t值P值重复次数66 miR-877-5p 1.00±0.09 2.14±0.21 12.22<0.001 OD值24 h 0.36±0.03 0.33±0.03 1.73 0.114 48 h 0.64±0.06 0.42±0.04 7.47<0.001 72 h 1.02±0.09 0.56±0.05 10.94<0.001 cyclinD1 0.69±0.06 0.31±0.03 13.88<0.001 p21 0.24±0.03 0.59±0.05 14.70<0.001 p27 0.34±0.03 0.73±0.07 15.54 0.000
2.3 miR-877-5p过表达对胃癌HGC-27细胞凋亡的影响与miR-NC组比较,miR-877-5p过表达明显增加HGC-27细胞凋亡率(P<0.05),降低Bcl-2蛋白水平,而提高Bax、cleaved-caspase 3的蛋白水平(P<0.05)。见表3,图3。
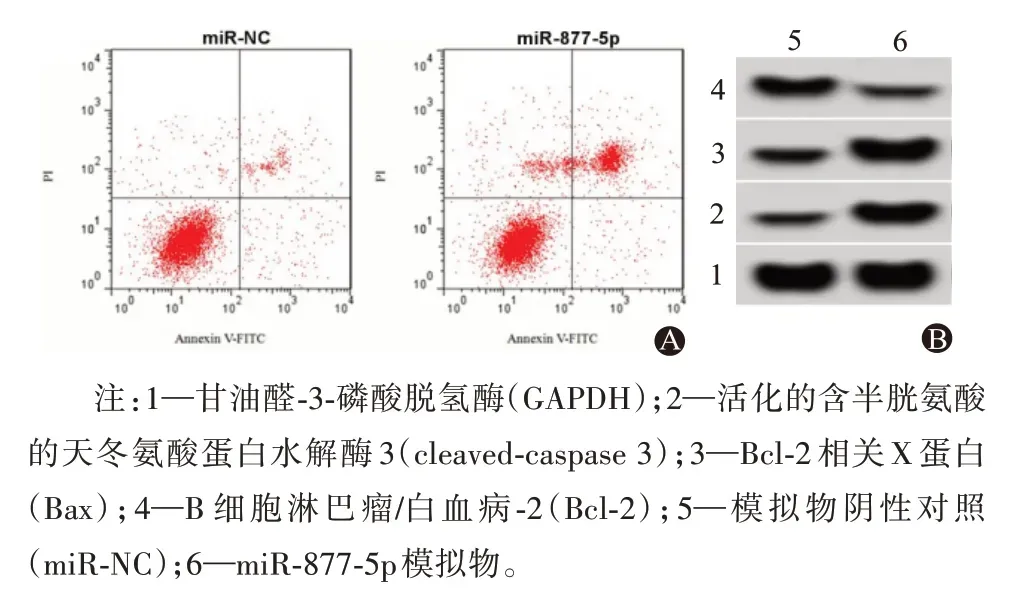
图3 miR-877-5p过表达对胃癌HGC-27细胞凋亡及凋亡相关蛋白表达的影响:A为细胞凋亡流式图;B为miR-877-5p过表达对胃癌HGC-27细胞凋亡相关蛋白表达的影响
表3 miR-877-5p过表达对胃癌HGC-27细胞凋亡的影响/
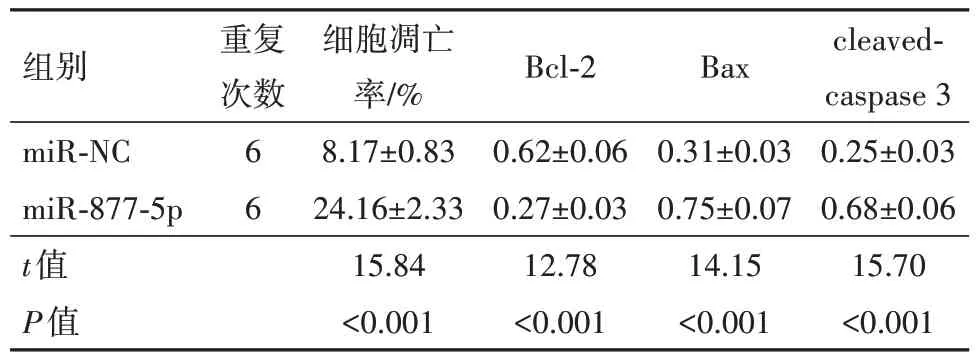
表3 miR-877-5p过表达对胃癌HGC-27细胞凋亡的影响/
注:Bcl-2为B细胞淋巴瘤/白血病-2,Bax为Bcl-2相关X蛋白,cleaved-caspase 3为活化的含半胱氨酸的天冬氨酸蛋白水解酶3。
组别miR-NC miR-877-5p t值P值重复次数6 6细胞凋亡率/%8.17±0.83 24.16±2.33 15.84<0.001 Bcl-2 0.62±0.06 0.27±0.03 12.78<0.001 Bax 0.31±0.03 0.75±0.07 14.15<0.001 cleavedcaspase 3 0.25±0.03 0.68±0.06 15.70<0.001
2.4 抑制FOXM1表达对胃癌HGC-27细胞增殖和凋亡的影响将si-FOXM1转染入HGC-27细胞,FOXM1蛋白表达量明显减少(P<0.05),证明成功构建敲减FOXM1表达的细胞。与si-NC组比较,敲减FOXM1的表达显著降低48 h(P<0.05)、72 h(P<0.05)的细胞活力,对24 h的细胞活力无明显影响,增加细胞凋亡率(P<0.05),减少cyclinD1、Bcl-2蛋白表达量,提高p21、Bax蛋白水平(P<0.05)。见表4,图4。
表4 抑制FOXM1表达对胃癌HGC-27细胞增殖和凋亡的影响/
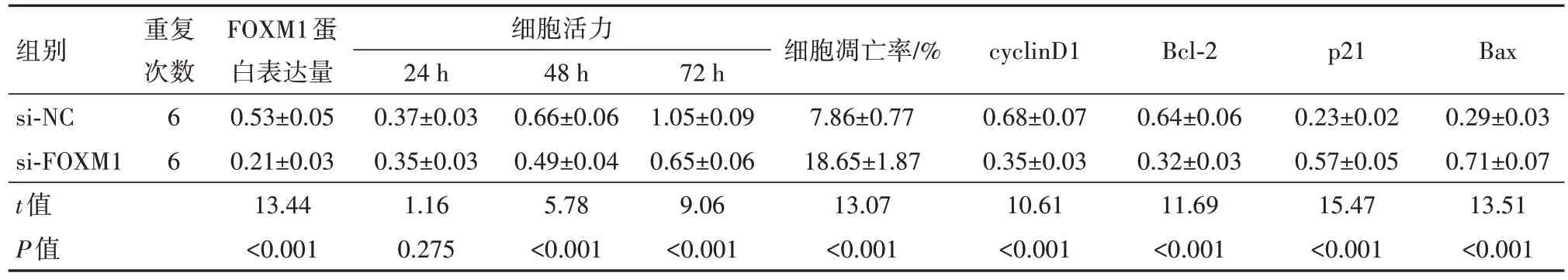
表4 抑制FOXM1表达对胃癌HGC-27细胞增殖和凋亡的影响/
注:cyclinD1为细胞周期蛋白D1,Bcl-2为B细胞淋巴瘤/白血病-2,p21为细胞周期依赖性激酶抑制因子,Bax为Bcl-2相关X蛋白。
组别si-NC si-FOXM1 t值P值重复次数66 FOXM1蛋白表达量0.53±0.05 0.21±0.03 13.44<0.001细胞活力24 h 0.37±0.03 0.35±0.03 1.16 0.275 48 h 0.66±0.06 0.49±0.04 5.78<0.001 72 h 1.05±0.09 0.65±0.06 9.06<0.001细胞凋亡率/%7.86±0.77 18.65±1.87 13.07<0.001 cyclinD1 0.68±0.07 0.35±0.03 10.61<0.001 Bcl-2 0.64±0.06 0.32±0.03 11.69<0.001 p21 0.23±0.02 0.57±0.05 15.47<0.001 Bax 0.29±0.03 0.71±0.07 13.51<0.001
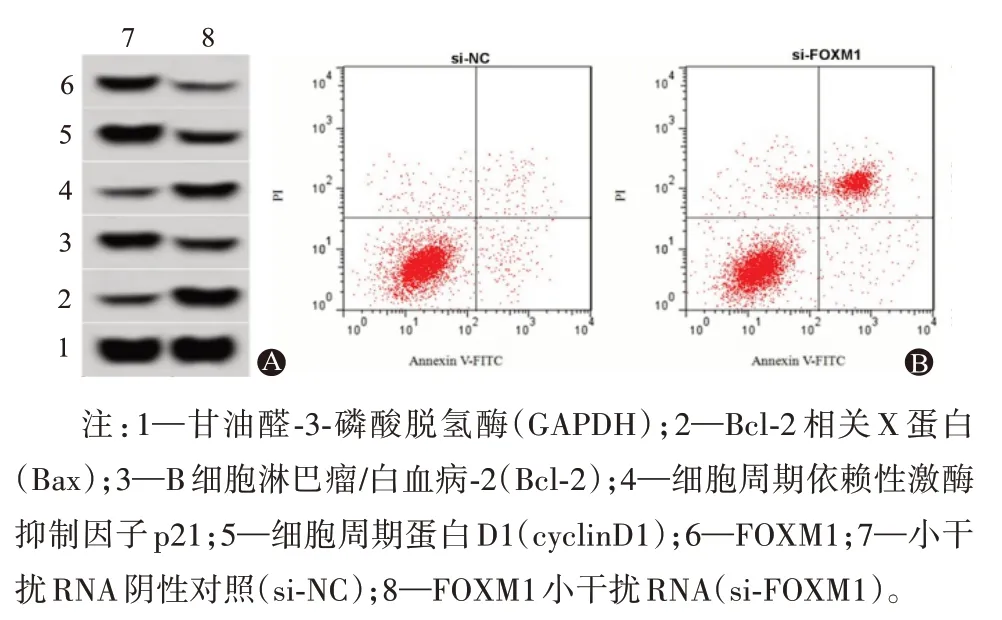
图4 抑制FOXM1表达对胃癌HGC-27细胞活力和凋亡的影响:A为免疫印迹图;B为敲减FOXM1的表达对胃癌HGC-27细胞凋亡的影响
2.5 miR-877-5p靶向调控FOXM1的表达生物信息学预测出miR-877-5p与FOXM1的3’UTR部分碱基可形成互补配对(图5A)。双荧光素酶报告实验显示,miR-877-5p明显抑制WT-FOXM1荧光素酶活性(P<0.05),而MUT-FOXM1荧光素酶活性无显著差异。相较于miR-NC组,miR-877-5p明显减少FOXM1蛋白表达量(P<0.05)。相比于anti-miR-NC组,anti-miR-877-5p显著提高FOXM1蛋白水平(P<0.05)。见表5,图5。

图5 miR-877-5p靶向调控FOXM1表达:A为FOXM1的序列中含有与miR-877-5p互补的核苷酸序列;B为miR-877-5p调控FOXM1蛋白的表达
表5 miR-877-5p靶向调控FOXM1的表达/

表5 miR-877-5p靶向调控FOXM1的表达/
组别miR-NC miR-877-5p t值P值重复次数6 6 WT-FOXM1酶活性1.01±0.09 0.36±0.04 16.17<0.001 MUT-FOXM1酶活性0.98±0.08 1.02±0.09 0.81 0.435 FOXM1蛋白表达量0.52±0.05 0.23±0.03 12.18<0.001
2.6 FOXM1过表达逆转miR-877-5p过表达对胃癌HGC-27细胞活力和凋亡的作用与miR-NC组比较,miR-877-5p过表达明显减少FOXM1蛋白表达量(P<0.05),显著影响48 h、72 h的细胞活力、细胞凋亡率、cyclinD1、p21(P<0.05)、Bcl-2、Bax蛋白水平(P<0.05)。与miR-877-5p+pcDNA组比较,miR-877-5p和pcDNA-FOXM1共转染入HGC-27细胞,明显升高FOXM1的蛋白水平(P<0.05),提高48 h、72 h的细胞活力(P<0.05),减少细胞凋亡率,以及增加cyclinD1(P<0.05)、Bcl-2蛋白表达量并降低p21、Bax蛋白水平(P<0.05)。见表6~8;图6。

图6 FOXM1过表达逆转录miR-877-5p过表达对胃癌HGC-27细胞活力和凋亡的作用:A为免疫印迹图;B为FOXM1过表达逆转录miR-877-5p过表达对胃癌HGC-27细胞凋亡的作用
表6 FOXM1过表达逆转miR-877-5p过表达对胃癌HGC-27细胞增殖和凋亡的作用/
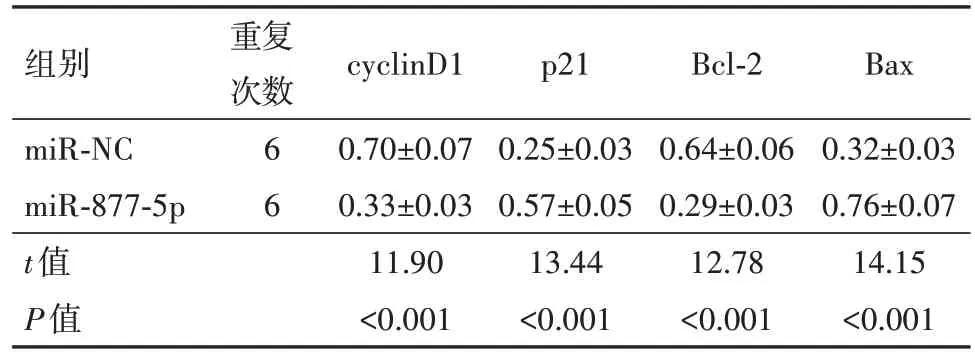
表6 FOXM1过表达逆转miR-877-5p过表达对胃癌HGC-27细胞增殖和凋亡的作用/
注:cyclinD1为细胞周期蛋白D1,Bcl-2为B细胞淋巴瘤/白血病-2,p21为细胞周期依赖性激酶抑制因子,Bax为Bcl-2相关X蛋白。
组别miR-NC miR-877-5p t值P值重复次数6 6 cyclinD1 0.70±0.07 0.33±0.03 11.90<0.001 p21 0.25±0.03 0.57±0.05 13.44<0.001 Bcl-2 0.64±0.06 0.29±0.03 12.78<0.001 Bax 0.32±0.03 0.76±0.07 14.15<0.001
3 讨论
miRNA是一类高度保守的非编码小RNA,通过结合靶mRNA的3’UTR,导致其降解或翻译抑制[7]。大量资料显示,miRNA参与细胞增殖、细胞周期、凋亡、转移等多种生物学过程,已成为癌症发生和进展的关键调节因子[8-9]。最近,已经确定了多种miRNA参与胃癌进展和转移[10],表明miRNA可作为有效地诊断和预后分子生物标记物,并且可以成为胃癌有效治疗靶点[11-12],因此,寻找参与胃癌发展的新miRNA有助于改善病人预后。在此项研究中,发现miR-877-5p在胃癌细胞HGC-27、SUN-1、AGS中的表达明显低于正常胃黏膜上皮细胞GES-1,miR-877-5p过表达显著抑制HGC-27细胞的活力,并促进其凋亡。这些结果表明miR-877-5p在抑制胃癌进展中起关键作用。既往研究表明,miR-877表达在非小细胞肺癌(NSCLC)组织和细胞系中表达下调,miR-877低表达与NSCLC病人TNM分期和远处转移显著相关;功能实验证明,miR-877表达的恢复限制了NSCLC细胞的增殖和侵袭[13]。miR-877-5p在肝细胞癌中表达上调[14]。本研究结果与这些报道相同,表明miR-877-5p可能是诊断和治疗患有这些特定恶性肿瘤类型的病人的有效靶标。
FOXM1是一个叉头盒(Fox)转录因子超家族一员,广泛表达于增殖细胞和癌细胞中[15]。根据报道,FOXM1经常在癌症中过度表达,影响肝癌等肿瘤进展[16-17]。FOXM1在胃癌细胞中的表达高于胃黏膜上皮细胞,在胃癌的转移过程中发挥了重要的促进作用[18]。FOXM1基因表达下调可显著降低多株宫颈癌细胞侵袭和迁移能力[19]。FOXM1在膀胱癌组织中存在过度表达,干扰其表达可抑制膀胱癌细胞的增殖、迁移和侵袭,促进细胞凋亡[20]。下调FOXM1表达可使食管癌细胞周期阻滞,促进细胞凋亡,抑制细胞增殖[21]。本研究中,FOXM1的mRNA和蛋白在HGC-27、SUN-1、AGS细胞明显上调,抑制其表达显著抑制HGC-27细胞增殖并诱导凋亡,与前述研究相符。
表7 HGC-27细胞中FOXM1的表达及其细胞增殖和凋亡变化/
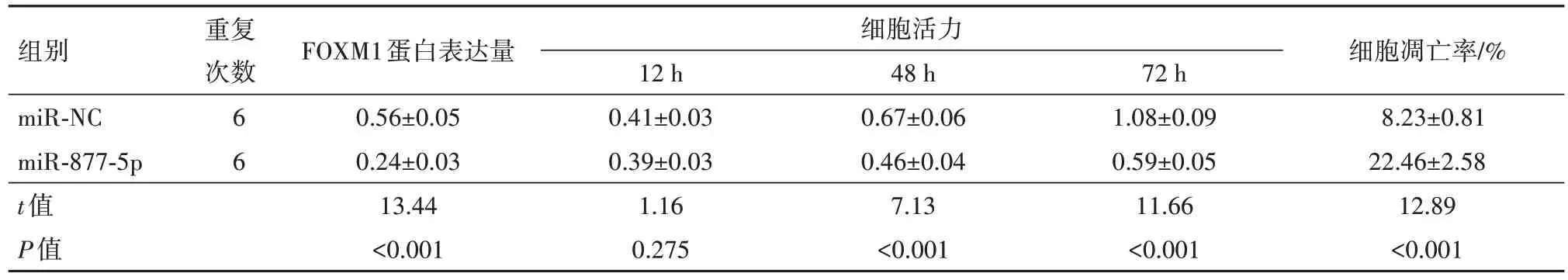
表7 HGC-27细胞中FOXM1的表达及其细胞增殖和凋亡变化/
组别miR-NC miR-877-5p t值P值重复次数66 FOXM1蛋白表达量0.56±0.05 0.24±0.03 13.44<0.001细胞活力12 h 0.41±0.03 0.39±0.03 1.16 0.275 48 h 0.67±0.06 0.46±0.04 7.13<0.001 72 h 1.08±0.09 0.59±0.05 11.66<0.001细胞凋亡率/%8.23±0.81 22.46±2.58 12.89<0.001
表8 FOXM1过表达逆转miR-877-5p过表达对胃癌HGC-27细胞增殖和凋亡的作用/
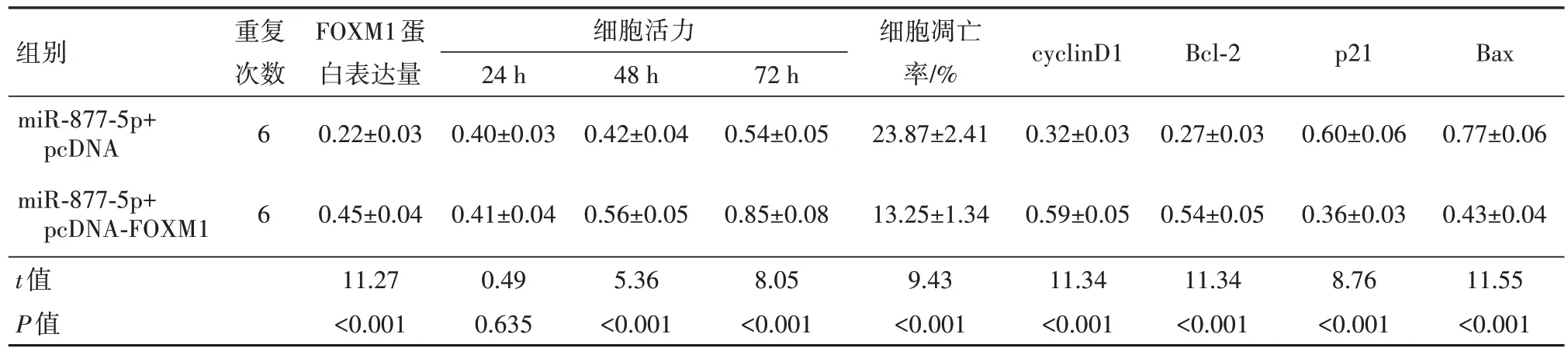
表8 FOXM1过表达逆转miR-877-5p过表达对胃癌HGC-27细胞增殖和凋亡的作用/
注:cyclinD1为细胞周期蛋白D1,Bcl-2为B细胞淋巴瘤/白血病-2,p21为细胞周期依赖性激酶抑制因子,Bax为Bcl-2相关X蛋白。
组别miR-877-5p+pcDNA miR-877-5p+pcDNA-FOXM1 t值P值重复次数6 6 FOXM1蛋白表达量0.22±0.03 0.45±0.04 11.27<0.001细胞活力24 h 0.40±0.03 0.41±0.04 0.49 0.635 48 h 0.42±0.04 0.56±0.05 5.36<0.001 72 h 0.54±0.05 0.85±0.08 8.05<0.001细胞凋亡率/%23.87±2.41 13.25±1.34 9.43<0.001 cyclinD1 0.32±0.03 0.59±0.05 11.34<0.001 Bcl-2 0.27±0.03 0.54±0.05 11.34<0.001 p21 0.60±0.06 0.36±0.03 8.76<0.001 Bax 0.77±0.06 0.43±0.04 11.55<0.001
miRNA通过直接调节其靶基因的表达参与几乎所有关键细胞过程的调节。本研究探索了miR-877-5p在胃癌进展中发挥抑制作用的机制。生物信息学分析用于鉴定miR-877-5p的可能靶标,并且在miR-877-5p和FOXM1的3’UTR之间观察到互补位点。荧光素酶报告基因实验和Western blotting分析显示miR-877-5p可以直接靶向FOXM1的3’UTR,上调或下调miR-877-5p明显调控FOXM1表达。此外,FOXM1在胃癌细胞中表达上调,与miR-877-5p表达相反。最后,miR-877-5p和pcDNAFOXM1共转染,发现FOXM1过表达逆转了miR-877-5p过表达在胃癌细胞中的肿瘤抑制作用。这些结果为FOXM1是胃癌细胞中miR-877-5p的直接靶基因提供了证据。因此,使用基于miR-877-5p的靶向治疗来敲减FOXM1的表达可能是胃癌病人中一种有价值的治疗方法。
总之,miR-877-5p在胃癌细胞中表达下调,miR-877通过抑制FOXMl表达,抑制胃癌细胞活力并诱导其凋亡,表现出抗肿瘤特性。这些发现为胃癌发生和发展的机制提供了新的见解和潜在治疗靶点。
