颈动脉粥样硬化与急性Stanford A型主动脉夹层术后并发症的相关性分析
2022-09-22苗素琴金微微余娜张琼王刚
苗素琴,金微微,余娜,张琼,王刚
急性Stanford A型主动脉夹层在心血管外科中属于最危急的重症,且病理复杂,目前为止,只有及时确诊并进行手术才是挽救生命的有效方法[1]。由于其病理特征,术后容易出现中枢神经系统并发症,且危害巨大,通常分为是永久性神经系统功能障碍(PND)和短暂性神经系统功能障碍(TND)两种,但无疑都增加了病人的病残率、致死率,极大地影响其手术预后及生活质量[2]。有研究显示,合并颈动脉粥样硬化病人在接受心脏外科手术后,中枢神经系统并发症发生率较无此症状的同类病人明显增高[3]。因此猜测,颈动脉粥样硬化是导致急性Stanford A型主动脉夹层病人术后出现PND、TND的高危因子[4]。对此,本研究回顾性分析中国人民解放军东部战区总医院80例同类病人,旨在探讨颈动脉粥样硬化与PND、TND发生的相关性。
1 资料与方法
1.1 一般资料回顾性分析2019年2月至2020年2月中国人民解放军东部战区总医院收治的急性Stanford A型主动脉夹层病人80例,其中合并颈动脉粥样硬化40例为观察组,无颈动脉粥样硬化40例为对照组。纳入标准:①行孙氏手术治疗;②年龄≥18岁;③无恶性肿瘤。排除标准:①合并肝、肾系统重症疾病;②有心血管手术史;③术前合并中枢神经系统疾病;④重度贫血;⑤术后1个月内死亡;⑥伴有结缔组织疾病。病人或其近亲属知情同意,本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 方法
1.2.1 测量方法 采用GE Vivid E9心血管彩色多普勒超声诊断仪,于术前1 d内测量病人颈动脉内中膜厚度(IMT),频率10~15 MHz。嘱病人行仰卧位,纵切面二维扫描颈总动脉干、颈内动脉及颈动脉分叉处、距分叉处远近端1 cm分叉处IMT。根据《颈动脉外科学》所述标准,IMT<1.3 mm且≥0.9 mm为颈动脉内中膜增厚,IMT≥1.3 mm为斑块。IMT≥0.9 mm为观察组,IMT<0.9 mm为对照组。
1.2.2 手术方式 所有病人一经确诊急性Stanford A型主动脉夹层立即行孙氏手术(急诊手术在病人入院后24 h内进行)。静吸复合麻醉,病人行仰卧位,上胸垫高伸展颈部,游离右侧腋动脉,选取正中位置开胸,游离头臂血管,建立体外循环。降温至心跳停开始主动脉近端处理,鼻温降至20℃时暂停近端操作,转向主动脉弓与降主动脉处理,同时通过右侧腋动脉行选择性动脉脑灌注,流量6~10 mL·kg-1·min-1。随后剖开主动脉弓,横断3支头臂血管,缝合关闭左锁骨下近端动脉。将支架型人工血管(直径24~28 mm)植入降主动脉真空腔,选择适合的四分支人工血管,吻合降主动脉,全周连续缝合,灌注恢复下半身循环。将头臂血管分支吻合左颈动脉,连续缝合后排气开放复温,恢复心脏循环,随后完成主动近端吻合。心脏电击复跳,鼻温至37.5℃撤离体外循环。进行常规中和操作与术后止血,检查头臂血管后关胸。
1.3 诊断标准(1)急性Stanford A型主动脉夹层:病人发病2周内,夹层累及升主动脉。(2)永久性神经系统功能障碍(PND):经神经内科医师会诊且由CT/MRT影像学检查确诊,多为出血或栓塞导致的脑卒中。(3)短暂性神经系统功能障碍(TND):多表现为手术后产生的意识混乱、谵妄和苏醒延迟现象,经脑部CT/MRT影像学检查显示非阳性,且经治疗后中枢神经系统可恢复正常。两组均在术后1个月内统计PND、TND发生例数,对已经出院的病人则采用电话随访方式或门诊复诊期间收集资料。
1.4 统计学方法采用SPSS 22.0进行统计学分析。计数资料采用例(%)表示,组间比较以χ2检验;计量资料采用表示,两组定量数据比较采用t检验的方法,P<0.05被认为差异有统计学意义。
2 结果
2.1 基线特征共80例急性Stanford A型主动脉夹层病人接受孙氏手术。两组一般资料对比差异无统计学意义(P>0.05)。见表1。两组术中资料对比差异无统计学意义(P>0.05)。见表2。
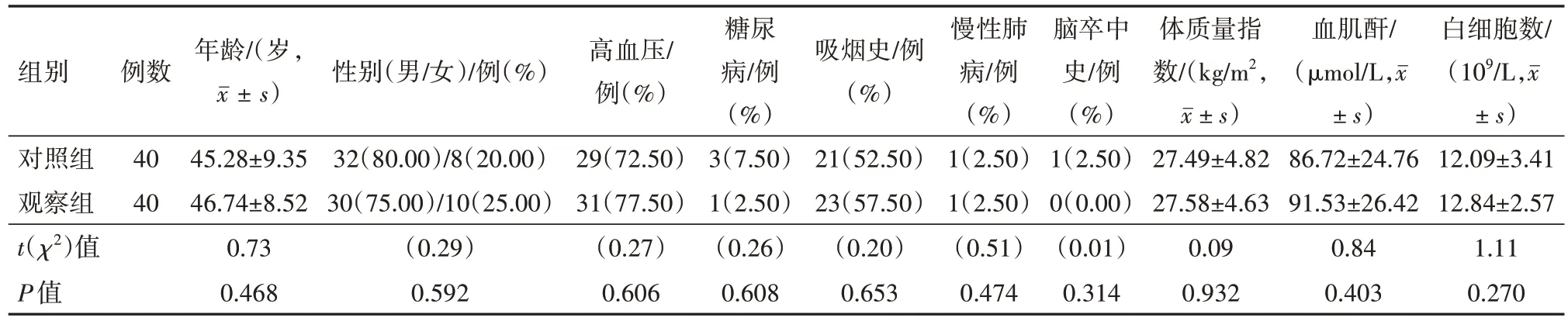
表1 两组急性Stanford A型主动脉夹层病人80例一般资料比较
2.2 预后情况观察组共23例(57.50%)术后出现中枢神经系统疾病,PND发生率为17.50%(9/40),TND发 生 率 为30.00%(14/40)。 对 照 组 共4例(10.00%)术后出现中枢神经系统疾病,PND发生率为5.00%(2/40),TND发生率为5.00%(2/40)。观察组术后1个月内PND、TND发生率均高于对照组(χ2=5.17,P=0.023;χ2=11.25,P<0.001)。见表3。
2.3 颈动脉粥样硬化与术后出现PND、TND相关性分析采用Kaplan-Mei法描述两组术后PND、TND发生率。观察组术后1个月内PND、TND发生率曲线较对照组呈明显上升趋势(χ2=4.11,P=0.035;χ2=7.17,P<0.001)。
2.4 颈动脉粥样硬化病人年龄、血肌酐水平及深低温停循环时间与术后出现PND、TND相关性分析调整年龄、术前血肌酐水平及深低温停循环时间后,采用Cox比例风险模型计算术后PND、TND发生风险。与对照组相比,观察组伴有颈动脉粥样硬化者术后发生PND及TND的风险性均显著上升,其HR95%CI分别为5.16(1.04,25.64)及3.73(1.12,12.47),差异有统计学意义(P<0.05)。见表3。
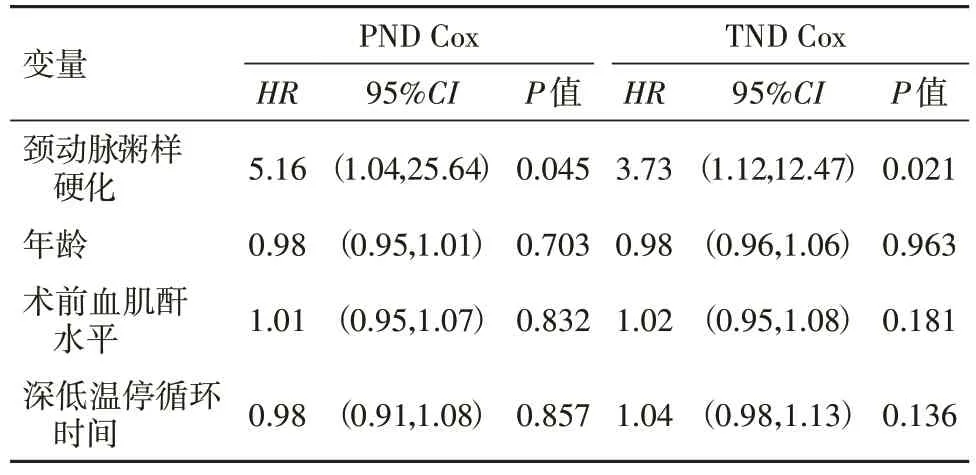
表3 术后PND Cox与TND Cox多因素回归分析
3 讨论
尽管孙氏手术的推广使得治疗技术取得明显进步,但对于急性Stanford A型主动脉夹层累及主动脉弓部的病人,仍然需要在深低温停循环及选择性脑灌注条件下进行弓部的血管重建,很难避免对中枢神经系统造成损伤,因此相关并发症是此类手术常见的后遗症[5-6]。临床上通常将主动脉手术术后新发神经系统疾病分为PND、TND两种[7]。其中PND更为严重,表现为脑栓塞及脑出血,且尽管治疗后却难以恢复如初,对病人日常生活造成不利影响[8]。TND虽严重程度不如PND,但相比而言发生率较高,表现为术后一过神经功能障碍,属于短暂且轻微的脑损伤,主要与低流量关注等因素导致的脑缺血性损伤相关,一般经治疗后短期内可恢复正常[9]。
有研究显示,伴有颈动脉粥样硬化的病人在接受心脏外科手术后,中枢神经系统并发症发生率较无此症状的同类病人明显增高,但其研究对象多接受冠状动脉旁路移植手术,对于急性Stanford A型主动脉夹层病人的相关报道尚为数不多[10-11]。在本研究中,观察组术后1个月内PND、TND发生率均高于对照组(P<0.05),与文献研究结果基本一致。另外,经Kaplan-Mei法描述分析后,观察组术后1个月内PND、TND发生率曲线较对照组呈明显上升趋势(P<0.05),Cox多因素分析显示,观察组PND、TND发生风险高于对照组(P<0.05)。猜测原因可能是颈动脉粥样硬化能大致反映主要血管的总体发展趋势,动脉粥样硬化由于血流循环会造成全身性的改变,因此会影响术中、术后脑血流灌注,极大提高栓塞风险,最终引发TND甚至是PND[12]。病人动脉粥样硬化后,继而动脉内膜出现增厚,形成斑块从而导致血管狭窄[13]。此类病变发展历程中最先累及的是动脉内中膜,随着血管壁增厚、弹性降低,血管腔狭窄,血流动力学将发生显著变化,极易导致脑血流低灌注,这为PND、TND此类并发症创造了先决条件[14-15]。在动脉粥样硬化的早期阶段,IMT增厚成为高频超声检查检测全身动脉周粥样硬化的切入点[16]。相比于其他检测方式,这种方法无创且操作简单,可重复性强,对急需手术的急性A型主动脉夹层病人具有重要意义[17]。以往文献报道[18-19],A型夹层术后PND、TND发生的影响因子包括病人年龄、脑卒中史、术前血肌酐水平及深低温停循环时间等。尽管本研究中两组基线资料无明显差异,但调整这些因子后经Cox风险模型分析显示,观察组PND、TND发生风险显著高于对照组(P<0.05),与文献结论基本一致。由于本研究中两组例数较少且均采取孙氏手术,加之平均深停时间短,可能是导致基线资料未出现明显差异的原因[20-21]。另外,由于研究中只有1例病人合并脑卒中史,因此未将此因子纳入Cox分析。
综上所述,合并颈动脉粥样硬化的急性Stanford A型主动脉夹层病人术后PND、TND发生风险较大,而术前经超声评估或利于协助制定治疗方案并改善预后。
