浮游虫黄藻生长及碱性磷酸酶对不同磷酸盐浓度的响应
2022-09-22王云龙欧阳珑玲
李 月,王云龙,欧阳珑玲
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院东海水产研究所,农业农村部东海渔业资源开发利用重点实验室,上海 200090)
虫黄藻(Symbiodinium sp.)是构成珊瑚礁生态系统所必需的共生甲藻。在共生体中,虫黄藻为珊瑚提供氧气及合成有机物等,而珊瑚虫代谢产生的CO2、硝酸盐和磷酸盐等则为虫黄藻所用,以维持其生长[1]。珊瑚礁在营养贫乏的浅水中形成,与其他水生系统相比,磷的浓度相对较低,其溶解无机磷(dissolved inorganic phosphorus,DIP)的浓度在0.05~0.50μmol·L-1[2-3]。国内外学者就不同磷酸盐浓度对造礁珊瑚-虫黄藻共生体中虫黄藻的影响开展了较多研究。结果表明,磷酸盐限制可引起共生虫黄藻光合效率降低,增加珊瑚对热和光胁迫的敏感度而导致其白化[4];共生虫黄藻的光合效率可随磷酸盐含量的升高而增加,同时珊瑚的钙化速率也随之加快,但在高磷酸盐初始浓度影响下,共生虫黄藻的光合作用效率随着磷浓度的升高反而受到抑制[5]。
实际上,除与宿主共生外,虫黄藻也可在珊瑚礁生活的海域外营浮游生活,且这类虫黄藻可作为潜在的磷源储备库,对珊瑚礁的构建有着重要的生态学意义[6]。由于外部输入和内部周转情况不同,不同海域中磷的含量差异较大。根据《中国渔业生态环境状况公报》,近十年我国海域活性磷酸盐浓度最低为0.012μmol·L-1,最高达12.97μmol·L-1。活性磷酸盐水平在同一海域不同时期变化也较大,如赤潮发生后磷酸盐浓度可降至最低。由此可见,浮游虫黄藻处在磷酸盐不断变化的自然环境中。但由于目前仅见光照和代谢抑制剂对浮游虫黄藻吸收磷酸盐影响的研究[7],不同磷酸盐浓度对浮游虫黄藻的影响尚不可知。虽然有学者就不同磷源和磷酸盐浓度对从珊瑚中分离后单独培养的虫黄藻的生长影响进行了较为细致的研究[8-10],但离体培养与营浮游生活的虫黄藻对不同磷酸盐浓度的响应可能存在差异[7]。因此,研究浮游虫黄藻细胞对不同磷酸盐浓度的响应,以及长时间处于低磷酸盐环境中藻细胞的生长特性,可进一步帮助揭示虫黄藻的生理生态特性,并为保护珊瑚礁生态系统提供理论依据。
鉴于此,本研究以从东海海域分离出的浮游虫黄藻为实验材料,研究短期内4个初始磷酸盐浓度对该藻生长的影响,同时以高磷酸盐初始浓度为培养条件对该虫黄藻进行长期培养,研究藻细胞的生长特性,同时探究光合作用效率及碱性磷酸酶活性(alkaline phosphatase activity,APA)与磷酸盐之间的响应联系。
1 材料与方法
1.1 藻种来源及培养
虫黄藻ECSFRI081109藻株由中国水产科学研究院东海水产研究所提供。该藻从舟山海域海水样品中分离纯化而得,通过扫描电镜及ITS基因扩增和测序而确定其为虫黄藻E系群的一种。
配置盐度为28的人工海水,经0.45μm滤膜过滤后高压蒸汽灭菌(121℃、20 min),并在超净工作台中配置f/2培养基,保证藻细胞无菌培养。将接种后的虫黄藻放置于光照培养箱中,培养温度为20℃,光照强度为4 000 lx,光暗比为12 h∶12 h。所有培养液每天8∶00和18∶00点手动摇匀两次。
1.2 实验设计
为了解不同磷酸盐浓度对营浮游生活的虫黄藻的影响,以及当藻细胞长时间处于低磷酸盐环境中是否能维持生长,分别设计短期培养实验和长期培养实验。
1.2.1 短期培养实验
本实验设置4个磷酸二氢钠初始浓度试验组。其中,基于实验室培养所用f/2培养基设置最高浓度为35.00μmol·L-1,基于近年来我国东海区海域中磷酸盐浓度低值平均值和高值平均值设置浓度分别为0.15、10.00μmol·L-1,并增设20.00μmol·L-1试验组。
将达到指数生长期的藻液经8 000×g离心收集后用不含磷的无菌人工海水洗涤,然后再离心收集并分别转接至200 mL磷酸盐初始浓度为0.15、10.00、20.00、35.00μmol·L-1的f/2培养基中培养,每个处理组设置3个重复。藻细胞初始密度为30×106个·L-1,培养条件与前面一致。实验过程中不再添加任何营养物质。于第0、1、2、4、7天取样测定细胞浓度、磷酸盐浓度、APA。
1.2.2 长期培养实验
将达到指数生长期的藻细胞经8 000×g离心收集后用不含磷的无菌人工海水洗涤,然后再离心收集转接至200 mL磷酸盐浓度为35.00 μmol·L-1的f/2培养基中培养,时长55 d。藻细胞初始密度约为5×106个·L-1,设置3个重复。实验过程中不再添加任何营养物质。每隔5 d测定细胞浓度、磷酸盐浓度、APA、光合作用参数。
1.3 比生长速率及叶绿素荧光参数测定
取0.9 mL藻液加入0.1 mL鲁戈氏液固定,使用光学显微镜(BX43,Olympus,Japan),取0.1 mL样品置于浮游植物计数框计数。虫黄藻比生长速率(μ)按式(1)计算。
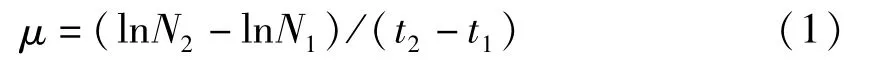
式(1)中,μ为连续培养时间内的比生长速率,N1及N2分别为培养时间t1和t2时的虫黄藻细胞密度。
使用浮游植物荧光分析仪(PHYTO-PAMED,Walz,Effeltrich,Germany)测定叶绿素a含量和实际光化学量子效率(Fq′/Fm′),参数测定时光化学设置参见SHEN等[11]。
1.4 磷酸盐浓度及APA检测
磷酸盐浓度采用磷钼蓝显色法用分光光度计进行检测[12]。APA测定参照OU等[13]测定方法。
1.5 数据处理
磷酸盐初始浓度以实际测量值为准(图1)。数据以3次重复的标准差(means±SD)表示。数据经正态化分布(Shapiro-Wilk)和方差齐性检验(Levene),通过单因素方差分析(one-way ANOVA),采用Tukey HSD事后多重比较法检验数据之间的差异(P<0.05)。所有数据使用Excel 2010和PASW Statistics 19.0软件进行分析,绘图使用OriginPro 2018 v9.5.0。
2 结果与分析
2.1 短期培养下不同磷酸盐浓度对虫黄藻生长及APA的影响
对培养基中磷酸盐浓度进行检测发现,当初始浓度为35.00μmol·L-1时,磷酸盐浓度在培养初期(0~2 d)即呈下降趋势,且第2天后下降幅度显著增加(图1-A)。当初始浓度为10.00、20.00μmol·L-1时,在第0~2天磷酸盐浓度降低不显著,第2天后开始显著下降。当磷酸盐初始浓度为0.15μmol·L-1时,尽管起始浓度较低,但磷酸盐浓度在1 d后下降至0.05μmol·L-1,随后无显著变化(P>0.05)。
培养过程中,4个试验组中藻细胞的APA变化趋势存在差异(图1-B),主要为低磷酸盐初始浓度(0.15μmol·L-1)的试验组与其他3组变化趋势不同。磷酸盐初始浓度为10.00、20.00、35.00μmol·L-1的试验组APA均呈总体下降趋势,不同的是前两个试验组APA在接种后第1天出现了一定程度的降低,随后上升,第2天后开始趋于稳定。而磷酸盐初始浓度为0.15μmol·L-1的试验组藻细胞中APA前期显著上升,第2天达最大后缓慢下降,至第4天趋于稳定。整个培养过程中,磷酸盐初始浓度为10.00、20.00、35.00μmol·L-1的试验组中藻细胞的APA显著低于浓度0.15μmol·L-1的试验组(P<0.05),表明其与环境中无机磷浓度呈负相关[14]。由此可见,低无机磷条件可诱导碱性磷酸酶(alkaline phosphatase,AP)活性增强。
由图1-C可知,接种后到2 d时,各试验组藻细胞密度增长缓慢或呈下降趋势,表现出了至少两天的生长迟滞期,这与其他甲藻相似[15-16]。之后,除磷酸盐初始浓度为0.15μmol·L-1的试验组外,其他试验组藻细胞在2 d后的生长趋势较一致,即细胞密度在培养后期仍呈现增长的趋势。培养至第7天,藻细胞密度因磷酸盐初始浓度不同而出现差异,具体表现为:磷酸盐初始浓度为35.00μmol·L-1时,藻细胞密度最高,且显著高于其他组(P<0.05);初始浓度为10.00 μmol·L-1和20.00μmol·L-1时,藻细胞密度次之,且两组间无显著差异(P>0.05);磷酸盐初始浓度为0.15μmol·L-1时,藻细胞密度最低,仅为最高试验组细胞密度的1/3。

图1 不同磷酸盐初始浓度处理下培养基中磷酸盐浓度(A)和虫黄藻细胞APA(B)藻细胞密度(C)的变化Fig.1 Effects of different initial concentrations of phosphate treatment on the phosphate concentration in the medium(A),APA of alga(B)and cell density of Symbiodinium sp.(C)
2.2 长期培养下不同高磷酸盐初始浓度对虫黄藻生长的影响
当磷酸盐初始浓度为35.00μmol·L-1时,培养基中细胞浓度开始迅速增加,第20天达最高,为2.34×108个·L-1,此后出现波动式下降(图2-A)。而比生长速率在培养前5 d处于较高水平,之后有所下降,20 d后比生长速率常出现负值,与生长变化相符(图2-B)。藻细胞叶绿素a含量在前15 d呈指数上升,第15天达最大值,为3 034.27μg·L-1,随后开始下降,第40天后基本保持稳定,为807.71~873.23μg·L-1(图2-C)。对藻细胞的Fq′/Fm′分析结果显示,Fq′/Fm′在培养前5 d升高,随后显著下降,第25天后变化趋势出现改变,呈波动下降状态(图2-D)。
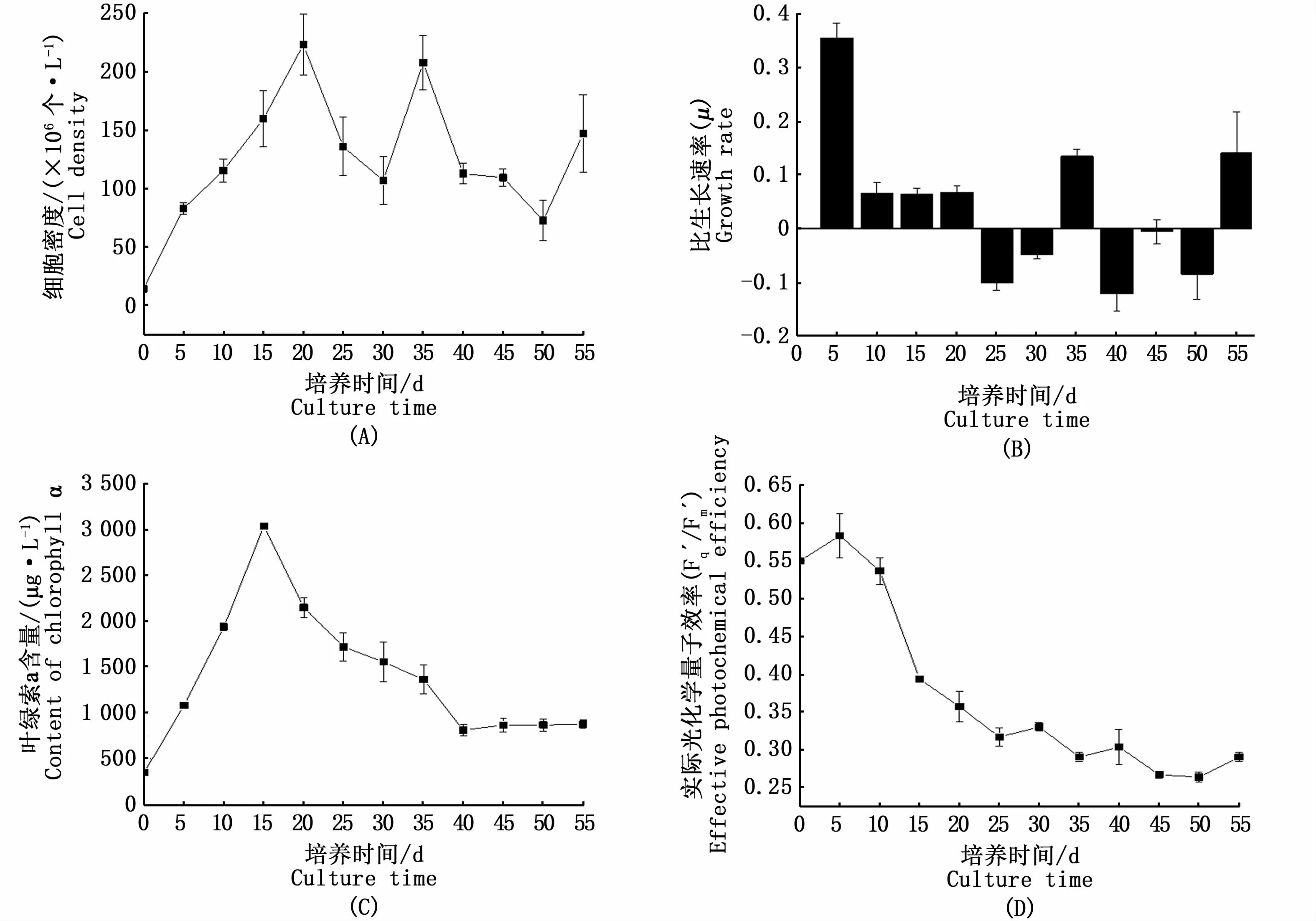
图2 不同高磷酸盐初始浓度长期培养下虫黄藻细胞生长及光合作用特征变化情况Fig.2 Changes of cell growth and photosynthetic characteristics of Symbiodinium sp.cultured with long-term high initial phosphate concentration
2.3 长期培养下培养基中磷酸盐浓度及藻细胞APA的变化
长期培养实验开始时,培养基中磷酸盐浓度迅速下降,第5天时降到0.04μmol·L-1,随后一直处于较低水平,并呈现出小幅波动,为0.04~0.53μmol·L-1(图3-A)。藻细胞APA在培养前期维持在较低的水平,第20天显著增加,至第30天时APA增加到最大,随后呈现下降-上升的波动趋势(图3-B)。分析发现20~55 d时藻细胞APA与数量的变化趋势相反,推测藻细胞数量下降后的再次上升是由于藻细胞衰亡释放有机磷为AP提供底物,使得藻细胞重新获得无机磷而得以增殖。
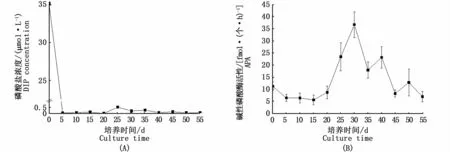
图3 不同高磷酸盐初始浓度长期培养下培养基中磷酸盐浓度(A)和藻细胞APA(B)的变化Fig.3 Changes of DIP in the culture media of Symbiodinium sp.(A)and APA of microalgal cells(B)with long-term high initial phosphate concentration
3 讨论
磷作为藻类生长所必须的营养物质,在合成核苷酸、磷脂以及通过磷酸化调控蛋白质的功能中起重要作用,是浮游植物生长的重要营养元素之一[17]。浮游虫黄藻的细胞数量在高磷酸盐初始浓度(35.00μmol·L-1)下显著高于其他组,表明营养水平的提高促进了该藻的生长。然而,对共生虫黄藻的研究表明,单独增加磷酸盐浓度对共生体中虫黄藻的密度无影响[18];或在高磷酸盐初始浓度(30.00μmol·L-1)环境下,共生体中虫黄藻密度会随着磷酸盐浓度的提高而降低[5]。导致浮游虫黄藻和共生虫黄藻存在差异的原因可能是共生虫黄藻生活的直接环境是共生体膜泡结构,营养盐为虫黄藻吸收利用需穿过两层膜,因此藻细胞可利用的磷酸盐浓度较低,且宿主有能力限制共生虫黄藻对磷酸盐的吸收[8,19]。LIU等[9]比 较 了 高 磷 酸 盐 初 始 浓 度(36.00μmol·L-1)和无磷酸盐(<0.01μmol·L-1)培养条件下离体虫黄藻(Symbiodinium voratum)的生长特征,本研究与其结果一致,即藻细胞数量与环境中的磷酸盐浓度呈正相关关系,表明共生虫黄藻在离开宿主后对磷酸盐的吸收能力与浮游虫黄藻相似。
在高磷酸盐初始浓度的长期培养过程中,随着培养基中磷酸盐的迅速消耗,浮游虫黄藻细胞Fq′/Fm′显著下降并伴随着比生长速率下降,这是由于磷酸盐缺乏会破坏藻类类囊体膜,从而降低细胞的光合效率影响藻类的生长[20]。藻细胞的密度比叶绿素a出现5 d的滞后下降趋势,表明在磷酸盐大量消耗后藻细胞呈现出衰败态势,虽然细胞数量增加但逐渐衰老的细胞中叶绿素a含量较正常生长细胞偏低[21]。此外,藻类的生长与N/P值密切相关,水体中N/P值过高会形成的磷限制状态[19]。长期培养实验中后期(20 d以后),培养基中N/P均值为340①中国水产科学研究院东海水产研究所未发表数据,说明浮游虫黄藻处于磷限制的生长环境中[22]。此时藻细胞虽呈现出下降-上升的波动生长趋势,但藻细胞数量上升时的比生长速率约为10~20 d的2倍,表明该藻与其他甲藻一样具有耐低磷特性[23]。
虽然DIP是藻类吸收磷的首选形式,但当DIP受到限制时,细胞也可利用溶解有机磷(dissolved organic phosphorus,DOP)和颗粒有机磷(particulate organic phosphorus,POP)[2,24]。碱性磷酸酶能水解DOP释放DIP,被认为是藻类最常见的DOP利用机制[14],其活性与环境中无机磷浓度呈负相关[25]。当磷酸盐初始浓度为0.15 μmol·L-1时,浮游虫黄藻APA显著高于其他3个试验组。研究表明,藻类AP的表达受环境调控,一般认为当外界DIP浓度为0.05~3.70 μmol·L-1时可诱导APA增强[26]。在长期培养实验中,当培养基中磷酸盐浓度下降至0.04 μmol·L-1后,浮游虫黄藻细胞APA并未立即升高(图3),这是由于藻细胞APA还受细胞内磷含量的调控。在环境磷酸盐丰富的情况下,甲藻具有过量摄取磷并储存于细胞内部的能力,当受到磷限制影响时藻细胞会启用自身磷库维持生长[27]。此外,该表现与短期培养实验中低磷酸盐初始浓度组(0.15μmol·L-1)的不同,可推测短期培养接种时细胞磷库状态处于较低水平。当然,这需要后续实验加以证实。值得注意的是,在短期和长期培养实验中AP活性的增强并未引起培养基中DIP浓度升高,可能是因为AP水解与DIP的吸收是同时进行的,这与东海原甲藻(Prorocentrum donghaiense)对有机磷的利用形式相似,而与米氏凯伦藻(Karenia mikimotoi)相反[28-29]。目前,关于甲藻对磷的利用机制的研究颇多,但不同种类间具有较大差异[23]。浮游虫黄藻是对珊瑚礁系统具有重要生态意义的种类,其对磷的利用途径及在分子层面的机理解析将是今后需要重点研究的方向。
